программа по химии. химия 8 класс. Протокол 6 6 мая 2021 Согласовано Зам директора по увр
 Скачать 119.78 Kb. Скачать 119.78 Kb.
|
|
8 класс Контрольная работа №1 по теме «Первоначальные химические понятия» Вариант I 1. Приведите примеры двух физических и двух химических явлений. Отметьте признаки химических реакций. 2. Определите валентность химических элементов по формулам их соединений: Сr2О3, Р2О5, Fе2O3, Na2O, ZnI2. 3. Вычислите массовую долю кислорода в железной окалине Fе3О4. 4. Расставьте коэффициенты в схемах химических реакций и укажите тип каждой реакции: а) Сu + О2 → СuО б) А1(OН)3 → Al2O3 + Н2О в) MgО + Н2 → Н2О + Mg Вариант II 1. Составьте план разделения смеси, состоящей из железных, медных и древесных опилок. 2. Напишите формулы соединений, используя таблицу Д. И. Менделеева для определения валентности элементов: VII IV МnО, SnO, BaCl, NaS, Li F 3. Вычислите массовую долю водорода в молекуле метана СН4. 4. Расставьте коэффициенты в схемах химических реакций и укажите тип каждой реакции: а) Na + S → Na2S б) Fе(ОН)3 → Fе2O3 + Н2О в) Zn + НСl → ZnСl2 + Н2 Контрольная работа №2 по теме «Кислород. Водород. Вода. Растворы» Вариант 1. 1. Нарисуйте схему прибора, с помощью которого можно получить кислород в лаборатории и собрать его методом вытеснения воды. 2. Перечислите области применения водорода. На каких физических или химических свойствах основано это применение? 3. Допишите уравнения химических реакций, укажите, какими из них можно воспользоваться для получения водорода. Назовите тип каждой реакции. а) CuО + Н2 → … + Cu б) Al + НСl → AlСl3 + … в) Zn + … → ZnSO4 + Н2 4. Допишите уравнения реакций, характеризующих химические свойства водорода: эл. ток а) Н2 + О2 → б) Н2 + СuО → Укажите, окисляется или восстанавливается водород в этих реакциях. 5. Для засолки огурцов приготовили 5 кг 6 %-ного раствора поваренной соли. Вычислите, какие массы соли и воды потребовались для приготовления этого раствора. Вариант II 1. Нарисуйте схему прибора, с помощью которого можно получить водород в лаборатории и собрать его методом вытеснения воздуха. 2. Под номерами 1- 5 даны важнейшие области применения кислорода. Буквами А- Е обозначены свойства кислорода, лежащие в основе его применения. Приведите в соответствие области применения и свойства кислорода. Применение кислорода 1. В технике для резки и сварки металлов. 2. В медицине для облегчения дыхания больных. 3. В металлургии (кислородное дутьё). 4. В химической промышленности для получения новых веществ. 5. В химических лабораториях для проведения реакций. Свойства кислорода А. Поддерживает дыхание. Б. Реагирует со многими простыми и сложными веществами, образуя оксиды. В. В реакциях с кислородом создаются высокие температуры. Реакции экзотермичны. Г. Ускоряет процесс горения и окисления веществ. Д. Бесцветный газ, тяжелее воздуха. Е. Газ, плохо растворимый в воде, сжижается под давлением. 3. Допишите уравнения химических реакций. Назовите полученные вещества. а) ... + О2 → СuО б) Fе + O2 → ... в) S + ... → SО2 г) СuS + ... → SО2 + ... 4. Допишите уравнения реакций, характеризующих химические свойства водорода: а) ... + ... → Н2О б) WO3 + ... → W + ... Укажите, окисляется или восстанавливается водород в этих реакциях. 5. 200 г 15 %-ного раствора сахара упарили наполовину. Какой стала после этого массовая доля сахара в растворе? Контрольная работа № 3 по теме «Основные классы неорганических соединений» Вариант 1. А-1. Формулы только кислот приведены в ряду 1) НС1, NаС1, НNO3 3) Са(ОН)2, Н3РО4, Са3(РО4)2 2) Н2SO3, Н2SO4, Н2S 4) Na2O , NаNО3, НNО3 А-2. Формулы только щелочей приведены в ряду 1) Fe(ОН)2, КОН, Ва(ОН)2 3) КОН, NаОН, LiОН 2) NаОН, Са(ОН)2, Сu(ОН)2 4) Fе(ОН)3, Сu(ОН)2, NаОН А-3. Оксид, который реагирует с гидроксидом натрия, образуя соль, - это 1) Fе2O3 2) К2О 3) SО3 4) ВаО А-4. Взаимодействие оксида с водой относится к реакциям 1) соединения 2) обмена 3) разложения4) замещения А-5. Взаимодействие гидроксида меди (II) с азотной кислотой относится к реакциям 1) соединения 2) разложения 3) замещения 4) обмена А-6. Индикатор фенолфталеин в щелочной среде становится 1) бесцветным 2) малиновым 3) красным 4) жёлтым А-7. Свойство, которое является общим для нерастворимых оснований и щелочей, — этo 1) взаимодействие с кислотными оксидами 2) взаимодействие с кислотами 3) взаимодействие с солями 4) разложение А-8. Оксид, который реагирует и с гидроксидом калия, и с соляной кислотой, — это 1) Nа2О 2) ZnО 3) МgО 4) К2О В-1. Даны формулы веществ: FеО, К2О, СО2, МgO, СгО, СrO3, SО2, Р2О5. Выпишите формулы только основных оксидов. В-2. Установите соответствие между химической формулой вещества и классом неорганических соединений, к которому оно принадлежит. А. кислоты Б. щёлочи В. Оксиды Г. нерастворимые основания 1) МgО 2) Н3РO4 3) А1(ОН)3 4) NаОН В-3. Установите соответствие между исходными веществами и продуктами химических реакций. 1) НgО + НNО3 2 ) А1 + Н2SО4 3) Nа2O + СO2 4) К2О + Н3РО4 А. А12(SO4)3 + Н2 Б. К3РО4 + Н2О В. Hg(NO3)2 + Н2О Г. Nа2СO3 + Н20 В-4. Вставьте в схемы химических реакций недостающие формулы веществ. 1) ... + ... → Мg(NО3)2 + Н2О 2) ... + ... → МgС12 + Н2 3) ... + ... → К3РО4 + Н2O 4) ... + ... → Ма2S + Н2O В-5. Допишите уравнения химических реакций. 1) LiОН + SO3 → 2) NаОН + Р2О5 → 3) Са(ОН)2 + СО2 → 4) Ва(ОН)2 + SO2 → С-1. Даны вещества: соляная кислота, гидроксид кальция, вода, оксид фосфора (V), оксид магния. С какими из перечисленных веществ может взаимодействовать: а) гидроксид натрия; б) гидроксид железа (III)? Напишите уравнения соответствующих реакций. Укажите тип каждой реакции. С-2. Как отмыть пробирку от остатков нерастворимого в воде основания? С-3. Составьте уравнения химических реакций, соответствующих схеме Р → X→ Н3Р04 ↓ Nа3РО4 Вариант II А-1. Формулы только солей приведены в ряду 1) К2СO3, Н2СO3, КОН 3) Н2S, Ва(NО3)2, ВаС12 2) А1С13, А1(NО3)3, А12S3 4) Сu(ОН)2, СuSО4, СиS А-2. Формулы только бескислородных кислот приведены в ряду 1) НС1, НNO3, Н2S 3) Н3Р04, Н2С03, Н28 2) Н2SO3, Н2S, НNО2 4) Н2S, НF, НС1 А-3. Оксид, который реагирует с кислотой, образуя соль, — это 1) Р2О5 2) СuО 3) S02 4) СО2 А-4. Получение оксида металла при нагревании гидроксида металла относится к реакциям 1) соединения 2) обмена 3) разложения 4) замещения А-5. Химическая реакция, уравнение которой К2О + 2НNО3 = 2КNО3 + Н2О, относится к реакциям 1) разложения 2) соединения 3) обмена 4) замещения А-6. Индикатор лакмус в щелочной среде становится 1) фиолетовым. 2) красным 3) синим 4) бесцветным А-7. В каком ряду все основания, формулы которых приведены, разлагаются при нагревании? 1) NаОН, Сг(ОН)2, Са(ОН)2 2) Fе(ОН)3, Сu(ОН)2, Fе(ОН)2 3) Ва(ОН)2, Мg (ОН)2, КОН 4) КОН, LiОН, А1(ОН)3 А-8. Гидроксид, который взаимодействует и с гидроксидом натрия, и с серной кислотой, - это 1) Сu(ОН)2 2) КОН 3) Zn(ОН)2 4) Са(ОН)2 В-1. Даны формулы веществ: СО2, Nа2О, СаО, МnО, Мn2О7, С12О7, Li2О, Р2О5. Выпишите формулы только кислотных оксидов. В-2. Установите соответствие между химической формулой вещества и его названием. 1) FеС13 2) Сu(NО3)2 3) А12(SО4)3 4) К2СО3 А. нитрат меди (II) Б. карбонат калия В. хлорид железа (III) Г. нитрит меди (II) Д. сульфат алюминия В-3. Установите соответствие между исходными веществами (веществом) и продуктами химических реакций. 1) NаОН + СО2 2) NaOH + H2SO4 3) Fе(ОН)2 + HCl 4) Fе(ОН)2 A. FeO + H2O Б. Nа2СО3 + H2O B. Ма2SО4 + H2O Г. FеС12 + H2O В-4. Вставьте в схемы уравнений химических реакций недостающие формулы веществ. 1) ... + КОН → Fе(ОН)3 + ... 2) ... + HCl → MgCl2 + … 3) НNО3 + КОН → ... + H2O 4) ... + ... → ВаSО4 + NaCl В-5. Допишите уравнения химических реакций, протекающих при нагревании. 1) Мg(ОН)2 → 2) А1(ОН)3 → 3) Fе(ОН)3 → 4) Сu(ОН)2 → С-1. С какими из перечисленных веществ: вода, оксид углерода (IV), азотная кислота, гидроксид кальция, поваренная соль — может вступать в реакцию: а) оксид кальция: б) оксид фосфора (V); в) оксид кремния (IV)? Запишите уравнения возможных химических реакций. С-2. В трёх склянках без этикеток находятся оксиды: в одной - оксид кальция, в другой - оксид меди (II), в третьей - оксид фосфора (V). Как их можно распознать? С-3. Составьте уравнения химических реакций, соответствующих схеме Са → X→ Са(ОН)2 ↓ Са(NO3)2 Контрольная работа №4 по теме «Периодический закон Д.И. Менделеева. Строение атома. Строение вещества». Вариант 1. 1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 5; б) 2, 8, 6; в) 2, 8, 8; г) 2, 8, 5. 2. Расположите: а) в порядке ослабления металлических свойств химические элементы Nа, Li, Сu, RЬ, К; б) в порядке усиления неметаллических свойств химические элементы Al, Si, С1, Р, S. 3. Определите по формулам степени окисления атомов в бинарных соединениях. Назовите вещества. Подчеркните наиболее электроотрицательный химический элемент. А1С13, НF, NН3, СаВг2, NО2, IF7 4. Запишите формулу сероводорода. Определите вид химической связи. Составьте схему её образования. Поясните, какую кристаллическую решётку имеет карбид кремния (SiС), если известно, что это вещество используют как абразивный материал. 5. Расставьте коэффициенты в уравнениях методом электронного баланса: а) Cl2 + NaOH 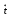 NaCl + NaClO3 + H2O; NaCl + NaClO3 + H2O;б) HCl + Mg → MgCl2 + H2. 6. Какой объем водорода выделиться при взаимодействии 54 г алюминия с серной кислотой? Вариант II 1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 8, 2; б) 2, 8, 7; в) 2, 8, 8; г) 2, 8, 8, 2. 2. Расположите: а) в порядке усиления металлических свойств химические элементы Ва, Sr, Мg, Са, Ве; б) в порядке ослабления неметаллических свойств химические элементы F, В, К, О, С. 3. Составьте формулы веществ. Проставьте степени окисления над знаками химических элементов в каждой формуле. Подчеркните наиболее электроотрицательный химический элемент. а) нитрид кальция б) оксид марганца (VII) в) карбид кремния 4. Запишите формулу оксида лития. Определите вид химической связи. Составьте схему её образования. Назовите вид этой химической связи. Поясните, какую кристаллическую решётку имеет йод, если известно, что это вещество легко возгоняется. 5. Расставьте коэффициенты в уравнениях методом электронного баланса: а) KClO3 → KCl + O2; б) NaBr + Cl2 → NaCl + Br2. 6. Какая масса цинка прореагирует с соляной кислотой, для получения 11,2 л водорода? Практическая работа № 1. Правила безопасной работы с оборудованием и веществами. Строение пламени. Перед выполнением практических работ еще раз ознакомьтесь с правилами техники безопасности (см. §2). 1. Приемы обращения с лабораторным штативом. Устройство лабораторного штатива показано на рисунке 4 учебника, Штатив служит для закрепления приборов при выполнении опытов. При закреплении в штативе пробирка должна быть зажата в лапке так, чтобы она не выпадала и вместе с тем чтобы ее можно было передвигать. Крепко зажатая пробирка может лопнуть. Пробирку зажимают не на середине, а около отверстия. Для того чтобы вынуть пробирку из штатива, нужно ослабить винт. При закреплении на штативе стакана его ставят на специальную сетку, помещенную на кольцо штатива. Фарфоровую чашку помещают на кольцо штатива без сетки. 2. Приемы обращения со спиртовкой. О правилах и приемах обращения со спиртовкой и электронагревателем смотрите текст на с. 12 учебника. 3. Изучение строения пламени. При внимательном рассмотрении пламени можно различить три его зоны (рис. 6 учебника). В нижней его части 3 происходит смешивание образующихся газов с воздухом. Если быстро внести в эту часть пламени головку спички и подержать ее некоторое время, то спичка загорается не сразу. Следовательно, в этой части пламени температура невысокая. Если в нижнюю часть пламени внести стеклянную трубочку и к ее отверстию приблизить зажженную спичку, то появляется пламя. Это доказывает, что в нижней части пламени имеются несгоревшие газы. Средняя часть пламени (2) является самой яркой. Это объясняется тем, что здесь под влиянием относительно высокой температуры происходит разложение углеродсодержащих продуктов и окисляющиеся частицы угля сильно накаляются и излучают свет. Во внешней части пламени (1) происходит полное сгорание газов с образованием оксида углерода (IV) СО2 и воды Н2О. Вследствие этого пламя в этой части несветящееся. , Практическая работа №2. Очистка загрязнённой поваренной соли. 1. Растворение загрязненной поваренной соли (смесь соли с песком). В стакан с загрязненной солью налейте примерно 20 мл воды. Чтобы ускорить растворение, содержимое стакана перемешайте стеклянной палочкой (осторожно, не касаясь стенок стакана). Если при этом соль не растворится, добавляйте понемногу воду до тех пор, пока соль не растворится. 2. Очистка полученного раствора при помощи фильтрования. Для изготовления фильтра листок фильтровальной бумаги шириной в два раза больше диаметра воронки дважды сложите пополам, примерьте к воронке и отрежьте по дуге, так чтобы край бумаги был на 0,5 см ниже края воронки (рис. 13 учебника). Раскрытый фильтр поместите в воронку и смочите водой, расправьте его, чтобы он плотно примыкал к воронке. Воронку вставьте в кольцо штатива. Конец ее должен касаться внутренней стенки стакана, в котором собирается отфильтрованный раствор. Мутный раствор налейте на фильтр по стеклянной палочке (см. рис. 10 учебника). В стакан стечет прозрачный фильтрат. 3. Выпаривание раствора. Полученный фильтрат вылейте в фарфоровую чашку и поставьте ее на кольцо штатива (см. рис. 11 учебника). Нагревайте в пламени, периодически перемешивая фильтрат до полного испарения воды. Полученную соль сравните с исходной. Практическая работа №3. Получение водорода и исследование его свойств. 1. Получение водорода и его собирание методом вытеснения воды. Последовательность действий: В пробирку поместите 1–2 гранулы цинка, прилейте около 3 мл раствора соляной кислоты; накройте пробирку воронкой широкой частью вниз, на носик воронки наденьте чистую пробирку. Подожгите спиртовку. Поднесите пробирку с полученным водородом к пламени спиртовки для обнаружения водорода. 2. Горение водорода. Практическая работа №4. Получение и свойства кислорода. 1. Получение и собирание кислорода, а) Соберите прибор, как показано на рисунке 25 (с. 73 учебника), и проверьте его на герметичность. В пробирку насыпьте примерно на 1/4 ее объема перманганата калия и у отверстия пробирки положите рыхлый комочек ваты (стекловаты). Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива, так чтобы конец газоотводной трубки почти доходил до дна стакана или цилиндра, в котором будет собираться кислород. Сначала обогрейте всю пробирку. Затем постепенно передвигайте пламя от ее дна в сторону пробки. Полноту заполнения стакана (цилиндра) кислородом проверяйте тлеющей лучинкой. Как только сосуд наполнится кислородом, закройте его картоном или стеклянной пластинкой. б) Соберите прибор, как показано на рисунке 26 (с. 74 учебника), и проверьте его на герметичность. В сосуд с водой опрокиньте пробирку с водой (или цилиндр, закрытый стеклянной пластинкой). Затем пробирку (цилиндр) с водой наденьте на конец газоотводной трубки и нагревайте пробирку с перманганатом калия. Когда сосуд заполнится кислородом, закройте его под водой стеклянной пластинкой. Собранный кислород сохраните для следующих опытов. 2. Горение в кислороде угля и серы. а) Положите в железную ложечку кусочек древесного угля и раскалите его в пламени. Затем ложечку с тлеющим углем внесите в сосуд с кислородом и наблюдайте за происходящим. Запишите уравнение реакции горения угля. Практическая работа №5. Приготовление растворов солей с определенной массовой долей растворённого вещества. 1. Получите от учителя задание; вычислите, сколько соли и воды потребуется для приготовления указанного раствора с заданной массовой долей вещества. 2. Отвесьте на весах соль (вспомните из курса физики правила взвешивания) и поместите ее в колбу. 3. Отмерьте требуемый объем дистиллированной воды (вспомните правила измерения объема жидкостей) и вылейте ее в колбу с солью. Содержимое колбы перемешайте до полного растворения соли. Практическая работа №6. Решение экспериментальных задач по теме «Важнейшие классы неорганических соединений». Задача 1. Опытным путем докажите, что соли реагируют с кислотами. Задача 2. Осуществите практически следующие превращения: сульфата меди (II) → гидроксид меди (II) → хлорид меди (II). |
