30 патфиз пищеварение студфайл. Протокол 7 от 31. 08. 201 3 Зав кафедрой патофизиологии, к м. н доцент Т. С. Угольник
 Скачать 1.72 Mb. Скачать 1.72 Mb.
|
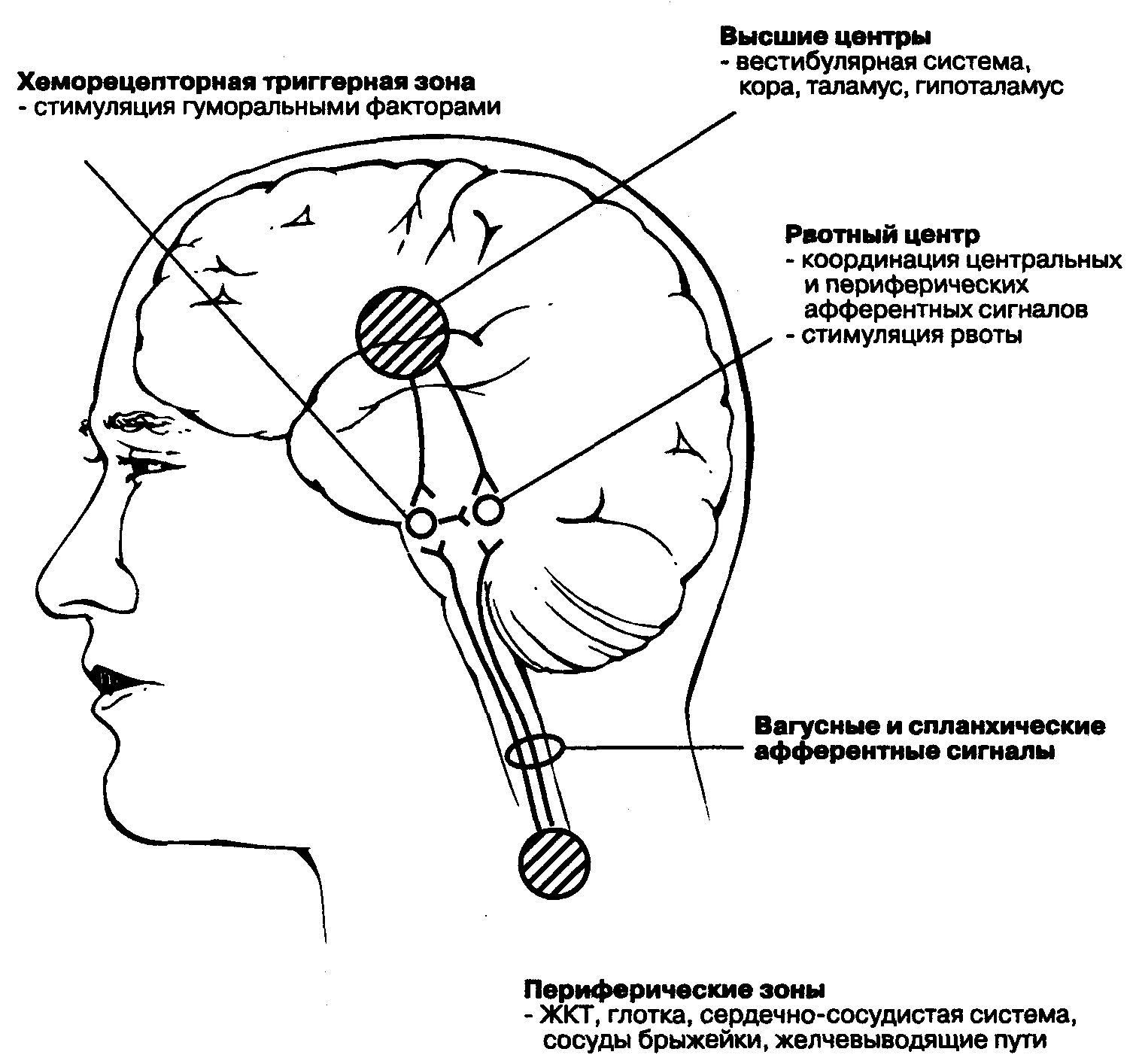
Нарушение двигательной функции пищеводаДисфункции пищевода характеризуются затруднением движения пищи по пищеводу, её прохождения в желудок и забросом содержимого желудка в пищевод (рефлюкс). Наиболее часто дисфункции пищевода развиваются на уровнях верхнего и нижнего его сфинктеров.Верхний пищеводный сфинктер и тело пищеводаПричины: – нейрогенные расстройства регуляции моторики пищевода (при энцефалитах, дистрофических и деструктивных изменениях нейронов блуждающего нерва и интрамуральных пищеводных сплетений; при психических расстройствах, в условиях патологического стресса). При этом вагусные влияния усиливают перистальтику пищевода, а интрамуральные сплетения могут как активировать (через холинергические мускариновые m2-рецепторы), так и тормозить (через никотиновые и мускариновые m1-рецепторы) сокращение продольных и циркулярных слоёв мышц пищевода. – гуморальные нарушения регуляции тонуса и перистальтики пищевода, заключающиеся в избыточных эффектах вазоактивного интестинального полипептида (VIP) и оксида азота. – склеротические изменения в стенке пищевода (после химических или термических ожогов, при дерматомиозите или генерализованной склеродермии, после заживления язв и обширных эрозий). – спазм стенки пищевода (локальный или диффузный эзофагоспазм при невротических состояниях или проглатывании большого куска твёрдой пищи). Последствия: Ахалазия — состояние, проявляющееся длительным спазмом гладкомышечных клеток (ГМК) стенки тела пищевода, его нижнего сфинктера, утратой перистальтики и недостаточным расслаблением сфинктера. Диффузный спазм пищевода характеризуется сокращением ГМК всех отделов стенки пищевода при сохранении нормального тонуса (в отличие от ахалазии) нижнего пищеводного сфинктера. Нижняя часть пищевода и нижний сфинктер пищеводаПричины: – нарушение холинергической иннервации стенки пищевода (при энцефалитах или невритах с поражением тел нейронов и нервных стволов блуждающего нерва и интрамуральных сплетений). – снижение или усиление эффектов БАВ, регулирующих тонус мышц пищевода (повышающих тонус: мотилина, гастрина, вещества P и др.; снижающих тонус: серотонина, секретина, VIP, соматостатина, дофамина, оксида азота). Последствия: Ахалазия кардиального отдела пищевода — состояние, характеризующееся нарушением расслабления нижнего сфинктера пищевода во время процесса глотания. Проявления: пищеводная дисфагия (замедление движения пищи по пищеводу после её проглатывания и задержка её эвакуации в желудок), ощущение тяжести и болей в грудной клетке, снижение массы тела (вследствие нарушения поступления пищи в желудок и кишечник). Гастро-эзофагальный рефлюкс — заброс содержимого желудка в пищевод. Частое повторение и длительное сохранение рефлюкса обозначают как гастро-эзофагальный рефлюксный синдром (или болезнь). Нарушения пищеварения в желудкеВ основе нарушений пищеварения в желудке находятся парциальные, а чаще сочетанные расстройства секреторной, моторной, всасывательной, барьерной и защитной функций желудка.В желудочной секреции различают две фазы: сложнорефлекторную и нейрохимическую. В каждую из этих фаз выделяется примерно одинаковое количество желудочного сока, и моторика желудка является равномерной. 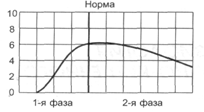 В условиях патологии различают 5 типов желудочной секреции и моторики: Возбудимый тип характеризуется быстрым и интенсивным нарастанием секреции в первую фазу, ее длительным продолжением и относительно медленным спадом во вторую фазу. 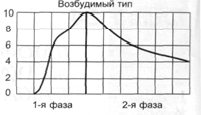 Однако соотношение интенсивности секреции между фазами остается нормальным. Моторика желудка характеризуется гиперкинезом. Тормозной тип — секреция и моторика желудка снижены в обе фазы. 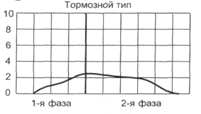 Астенический тип — в первую фазу происходит быстрое нарастание секреции и наблюдается бурная моторика, но этот процесс длится недолго. Во вторую фазу наблюдается быстрый спад секреции и гипокинезия желудка. 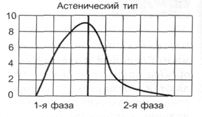 Инертный тип — в первую фазу секреция нарастает медленно, но затем долго держится на высоком уровне и медленно угасает. Аналогично ведет себя и моторика. 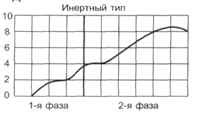 Хаотический тип характеризуется отсутствием каких-либо закономерностей динамики секреции и моторики желудка. 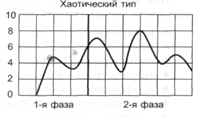 Нарушение секреторной функции желудка Нарушение секреторной функции желудка включает в себя изменения количества желудочного сока, кислотности, образования пепсина и слизи. Соляная кислота и пепсин необходимы для химической обработки пищи. Стимуляторы желудочной секреции: ацетилхолин, гастрин, гистамин, простагландины (PgF2а), энкефалин, бомбезин, инсулин, глюкокортикоиды, СТГ, ТТГ, пролактин. Ингибиторы желудочной секреции: снижение рН в антральном отделе желудка менее 3, секретин, холецистокинин-панкреозимин, гастроингибирующий полипептид (ГИП), кальцитонин, нейротензин, вазоактивный интестинальный полипептид (ВИП), субстанция Р, соматостатин, простагландины (PgА1, PgЕ2), эстрогены, минералокортикоиды. 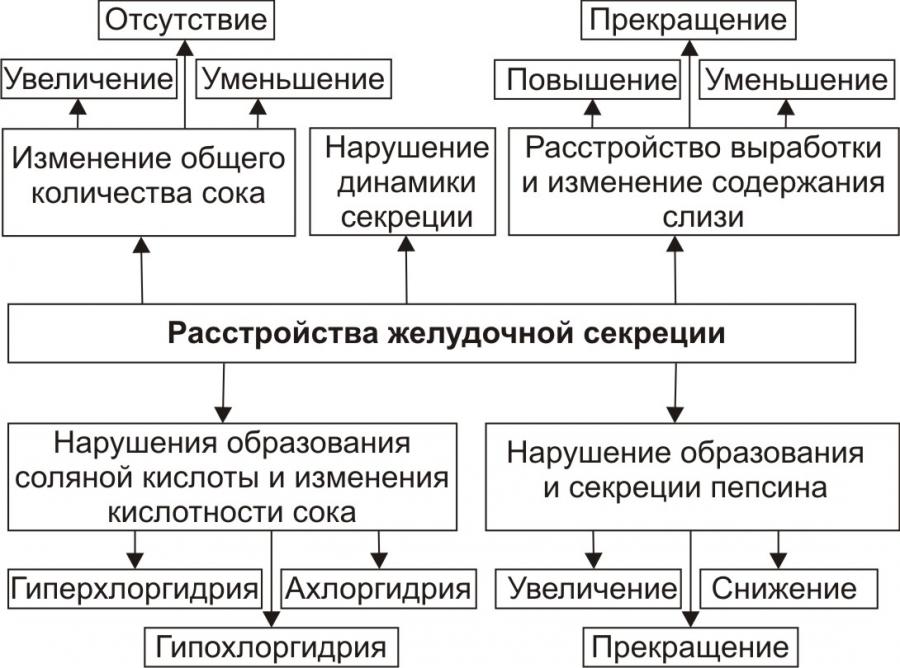 Рис. 5. — Типовые расстройства секреторной функции желудка (по П.Ф. Литвицкому, 2002) К расстройствам желудочной секреции относятся гиперсекреция, гипосекреция и ахилия.Гиперсекреция — увеличение количества желудочного сока, повышение его кислотности и переваривающей способностиПричины: генетически детерминированное увеличение массы секреторных клеток желудка, активация влияний блуждающего нерва при невротических состояниях или конституциональной ваготонии, повышение синтеза и/или эффектов гастрина, гипертрофия и/или гиперплазия энтерохромаффинных (энтероэндокринных) клеток при гипертрофическом гастрите, перерастяжение антрального отдела желудка, действие некоторых ЛС (ацетилсалициловой кислоты или кортикостероидов).Последствия: замедление эвакуации пищевой массы из желудка, эрозии и изъязвления слизистой оболочки желудка, сопровождающийся изжогой гастро-эзофагальный рефлюкс, нарушения пищеварения в кишечнике.Гипосекреция — уменьшение объёма желудочного сока, снижение его кислотности и расщепляющей эффективности.Причины: уменьшение массы секреторных клеток при гипо- и атрофической форме хронического гастрита или распадающейся опухоли желудка, снижение эффектов блуждающего нерва при неврозах или конституциональной симпатикотонии, снижение образования гастрина, дефицит в организме белков и витаминов, действие ЛС, снижающих или устраняющих эффекты блуждающего нерва (блокаторов холинорецепторов или активаторов холинэстераз).Ахилия — состояние, характеризующееся практически полным отсутствием желудочной секреции в результате значительного снижения или прекращения секреторной функции желудка.Нарушения моторики желудкаВ норме движения желудка выражаются в виде перистальтики — волнообразного сокращения стенки желудка, которое продвигает пищу от кардиального к пилорическому отделу, и перистолы — тонического напряжения мускулатуры, которое способствует размельчению пищи. При патологических состояниях перистальтика желудка может быть усиленной (гипертонус) либо ослабленной (гипотонус, атония) (рис. 6) 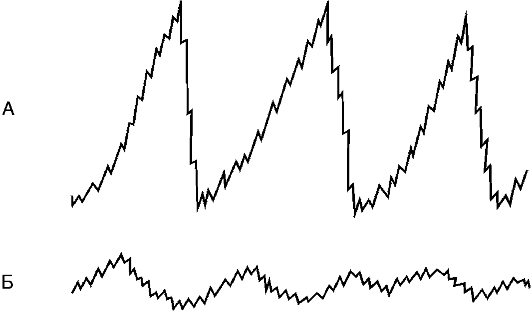 Рис. 6. — Гастрограмма: А – гипертонус желудка; Б – гипотонус желудка (по В.В. Новицкому и соавт., 2009) 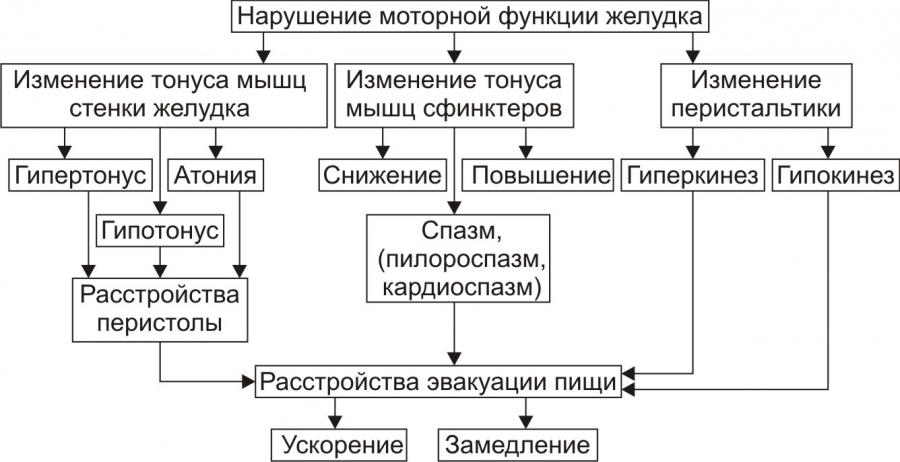 Рис. 7. — Типовые расстройства моторной функции желудка и её последствия (по П.Ф. Литвицкому, 2002) Последствия: в результате нарушений моторики желудка возможно развитие синдрома раннего насыщения, изжоги, тошноты, рвоты и демпинг-синдрома.Синдром раннего (быстрого) насыщения — результат снижения тонуса и моторики антрального отдела желудка. Приём небольшого количества пищи вызывает чувство тяжести и переполнения желудка, что создаёт субъективные ощущения насыщения.Изжога — ощущение жжения в области нижней части пищевода (результат снижения тонуса кардиального сфинктера желудка, нижнего сфинктера пищевода и заброса в него кислого желудочного содержимого).Тошнота — неприятное, безболезненное субъективное ощущение, предшествующее рвоте, возникающее при подпороговом возбуждении рвотного центра.Рвота — непроизвольный рефлекторный акт, характеризующийся выбросом содержимого желудка (иногда и кишечника) наружу через пищевод, глотку и полость рта. |
| Название | Основная локализация | Механизм действия | Роль в патологии |
| Гастрин | Антральный отдел желудка | Стимуляция секреции кислоты в желудке и ферментов в поджелудочной железе, сокращение НПС, освобождение кальцитонина | Повышен уровень при ахлоргидрии, пернициозной анемии, ваготомии; опосредует синдром Золлингера-Эллисона |
| Холецистокинин | Тонкая кишка | Стимуляция сокращения желчного пузыря и секреции ферментов поджелудочной железой, трофическое действие на поджелудочную железу, торможение аппетита | Повышен уровень при недостаточности поджелудочной железы, снижен при целиакии |
| Секретин | Тонкая кишка | Стимуляция секреции гидрокарбоната поджелудочной железой, торможение секреции кислоты в желудке, расслабление НПС | Снижен уровень при целиакии |
| Гастроингибирующий пептид (ГИП) | Тонкая кишка | Торможение секреции кислоты и моторики желудка, стимуляция секреции инсулина | Снижен уровень при целиакии, предполагают участие в патогенезе ожирения |
| Вазоактивный интестинальный пептид (ВИП) | Тонкая кишка | Снижает тонус сосудов, активирует панкреатическую и кишечную секрецию | Опосредует синдром Вернера-Морисона |
| Энтероглюкагон | Тонкая и толстая кишка | Трофическое влияние на слизистую оболочку кишечника | Повышен уровень при удалении или повреждении слизистой оболочки |
| Мотилин | Тонкая кишка | Стимуляция моторики желудка, кишечника | Повышен уровень при диарее |
| Нейротензин | Тонкая кишка | Стимуляция секреции в тонкой кишке, гипотензия, угнетение секреции кислоты в желудке и инсулина | Повышен уровень при мальабсорбции |
| Соматостатин | Гипоталамус, поджелудочная железа, желудок | Торможение желудочной и панкреатической секреции, выработки СТГ, гастрина, ГИП, инсулина, глюкагона | Опосредует синдром соматостатиномы (диспепсия + сахарный диабет + холелитиаз) |
| Панкреатический полипептид | Поджелудочная железа | Торможение секреции ферментов поджелудочной железой и сокращение желчного пузыря, моторики желудка и кишечника | Снижен уровень при недостаточности поджелудочной железы, повышен при диарее |
| Опиоидные пептиды (эндорфины) | Мозг, кишечник, желудок | Торможение желудочной секреции, активация моторики кишечника, расслабление НПС, стимуляция аппетита | Снижен уровень при ожирении, повышен при голодании, участвует в патогенезе «синдрома раздраженной кишки» |
Нарушение полостного и пристеночного пищеварения
Нарушение всасывания в кишечнике
Основные причины: недостаточное полостное и мембранное пищеварение, ускорение эвакуации кишечного содержимого, атрофия ворсинок слизистой оболочки кишечника, избыточное содержание экссудата на поверхности слизистой оболочки, резекция большого фрагмента тонкого кишечника, расстройства крово- и лимфообращения в стенке кишечника.
Синдром мальабсорбции — синдром недостаточности всасывания.
Формы:
Первичная:
– генетически детерминированные или врожденные ферментопатии тонкой кишки
– патология абсорбирующего эпителия тонкой кишки (целиакия, тропическая спру)
Вторичная:
– поражения отдельных структур или всей стенки тонкой кишки, возникающие как следствие других заболеваний
Этиология первичного (наследственного) синдрома: генетически обусловленные ферментопатии, отсутствие внутриклеточных переносчиков (дисахаров, триптофана — болезнь Хартнупа).
Этиология вторичного (приобретенного) синдрома: энтериты; энтеропатии; опухоли тонкой кишки; резекция более 1 метра кишечника; отравления; алиментарная недостаточность питания; действие ионизирующего излучения; системные заболевания (амилоидоз, склеродермия, недостаточность кровообращения, эндокринопатия).
Острый синдром развивается в результате воспаления и усиления пассажа химуса по ЖКТ, хронический синдром — как результат дистрофических и атрофических процессов слизистой тонкого кишечника.
Причины нарушения пристеночного пищеварения
1) нарушения структуры ворсинок и микроворсинок, уменьшение их числа на единицу поверхности (А.М. Уголев). Это характерный признак хронических заболеваний тонкой кишки, где морфологическим субстрактом являются воспалительные, дистрофические и склеротические изменения слизистой оболочки. Развитие атрофических изменений слизистой тонкой кишки, преимущественно ворсинок, отмечается при дизентерии, холере;
2) изменение ферментного слоя кишечной поверхности в результате генетической или приобретенной недостаточности ферментов, участвующих в пристеночном пищеварении. Первичная недостаточность пристеночного пищеварения, как правило, развивается у детей в раннем возрасте при расширении пищевого рациона с включением в него новых продуктов, содержащих непереносимый дисахарид. Приобретенная недостаточность чаще является следствием заболеваний тонкой кишки — хронического энтерита, а также вирусного гепатита и других инфекций;
3) расстройства кишечной перистальтики, что приводит к нарушению переноса пищевых веществ из полости кишки на поверхность энтероцитов, например хронические энтериты, болезни Уиппла, болезни Крона и другие заболевания тонкой кишки;
4) недостаточность полостного пищеварения, когда малорасщепленные крупные молекулы не проходят в щеточную кайму эпителия ворсинок.
Синдром мальдигестии — синдром недостаточности пищеварения (переваривания).
Причины:
1. Нарушение полостного пищеварения (диспепсия) при снижении секреторной функции желудка, поджелудочной железы, печени, нарушении моторики ЖКТ, дисбактериозе, алиментарных нарушениях.
2. Нарушение мембранного пищеварения при воспалительных, аутоиммунных, дистрофических и склеротических процессах в тонком кишечнике, сопровождающихся уменьшением количества микроворсинок, повреждением их структуры и нарушением их функции, нарушением синтеза или транслокации кишечных и панкреатических ферментов, адсорбированных на мембранах микроворсинок.
Формы:
1. Желудочная: связана с атрофическим гастритом, стенозом привратника, раком желудка.
2. Кишечная: связана с хроническим воспалительным процессом в тонкой кишке.
3. Панкреатическая: связана с внешнесекреторной недостаточностью поджелудочной железы.
Нарушения моторики кишечника
Моторная деятельность тонкой кишки обеспечивает перемешивание пищевого содержимого с пищеварительными секретами, продвижение химуса и повышение внутрикишечного давления, способствующего фильтрации некоторых компонентов в кровь и лимфу.
Расстройства двигательной функции кишечника проявляются в ускорении или замедлении перистальтики и чередовании этих процессов, а также в нарушении ритмической сегментации, происходящей за счет преимущественно циркулярного слоя мышц и маятникообразных сокращений, обеспечивающих взаимодействие продольного и циркулярного слоев мышц.
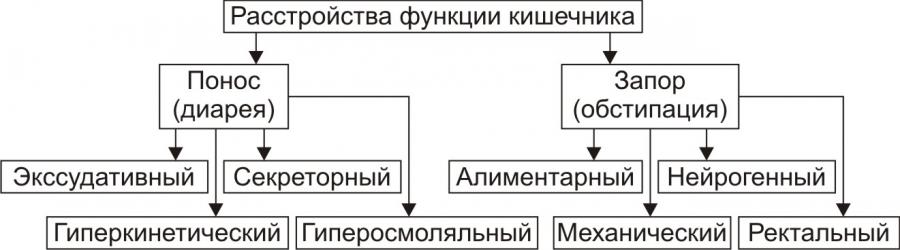
Рис. 11. — Типовые формы нарушения моторной функции кишечника и их разновидности
(по П.Ф. Литвицкому, 2002)
Понос (диарея, от гр. diarrheo — истекаю) — учащенный (более 2–3 раз в сутки) стул жидкой или кашицеобразной консистенции, сочетающийся с усилением моторики кишечника.
Основные виды и механизмы возникновения
Экссудативный: результат избыточного образования воспалительного экссудата слизистой оболочкой кишечника (при инфекционных и неинфекционных энтеритах и колитах).
Секреторный: следствие чрезмерной секреции жидкости в просвет кишечника (при холере, вирусных энтероколитах).
Гиперосмоляльный: результат значительной гиперосмоляльности кишечного содержимого (напр., при нарушении всасывания компонентов кишечного химуса при мальабсорбции или передозировке солевых слабительных).
Гиперкинетический: следствие гиперсекреции и повышенной перистальтики кишечника (напр., при энтероколитах, синдроме раздражённой кишки.
Последствия: гипогидратация организма, вплоть до эксикоза (крайняя степень гипогидратации организма); гиповолемия и нередко — артериальная гипотензия, нарушения электролитного баланса и КЩР (различного характера и выраженности в зависимости от основного заболевания).
Запор (обстипация) — длительная задержка стула или затруднение опорожнения кишечника (до 3 сут и более). Наблюдается у 25–30% людей в возрасте после 70 лет.
Основные виды и механизмы возникновения
Алиментарный (малообъёмный): является результатом малого объёма кишечного содержимого (при хроническом недоедании, малом потреблении жидкости, недостатке овощей и фруктов в пище, употреблении легкоусвояемой пищи). Малый объём кишечного содержимого и экскрементов недостаточен для активации рефлекторного процесса дефекации.
Нейрогенный (спастический и атонический запоры):
– спастический запор: чрезмерное повышение вагальных нейрогенных влияний на стенку кишечника может привести к спазму её мускулатуры. Это замедляет эвакуацию пищи и опорожнение кишечника.
– атонический запор: снижение нейроэффекторных воздействий на мускулатуру кишечника вызывает его гипотонию и задержку стула.
Ректальный: является следствием патологических процессов в прямой кишке (трещины или парапроктита), сопровождающихся болью. Это подавляет рефлекс дефекации.
Механический: результат механической задержки эвакуации кишечного содержимого (опухолью, рубцом).
Кишечная непроходимость — нарушение проходимости кишечника вследствие механического препятствия или нарушение его функций. Кишечная непроходимость может быть врожденной и приобретенной.
Виды по патогенезу
Механическая — обусловлена механическим закрытием просвета кишки опухолью, каловыми камнями, гельминтами, инородными телами или сдавление кишок извне опухолью, рубцом.
– обтурационная механическая непроходимость (просвет кишки закрыт, но кровообращение в кишечной стенке первоначально не нарушено)
– странгуляционная механическая непроходимость (сдавливается кишечная стенка и резко страдает ее кровоснабжение)
Динамическая — возникает при спазме или параличе кишечной мускулатуры.
Тромбоэмболическая — возникает в результате нарушения кровообращения в кишечной стенке при тромбозе или параличе сосудов.
В участке непроходимости развиваются застойная гиперемия, паралич сосудов, отек, воспаление и некроз. Под влиянием болевых импульсов и сосудистых расстройств резко снижается всасывание в кишечнике, однако секреция кишечного сока продолжается. Содержимое кишечника растягивает его отделы, расположенные выше места непроходимости, раздражает рецепторы и вызывает упорную рвоту. В результате развивается обезвоживание организма, наступает сгущение крови. В крови падает содержание хлоридов, которые вместе с водой переходят в брюшную полость, увеличивается содержание аммиака, мочевины, индикана и других продуктов гниения, усиленно образующихся в кишечнике и всасывающихся в кровь. Развивается тяжелая кишечная аутоинтоксикация.