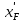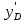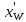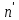курсовая. Расчетнографическая работа расчет ректификационной колонны для разделения бинарной смеси бензол толуол
 Скачать 0.78 Mb. Скачать 0.78 Mb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение Высшего образования «Уфимский государственный нефтяной технический университет» Кафедра “Нефтехимии и химической технологии” РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА «РАСЧЕТ РЕКТИФИКАЦИОННОЙ КОЛОННЫ ДЛЯ РАЗДЕЛЕНИЯ БИНАРНОЙ СМЕСИ БЕНЗОЛ – ТОЛУОЛ» По дисциплине “Процессы и аппараты химической технологии” Выполнил: Студент группы БТГ-18-01 Ахметов М.А Принял: Доцент кафедры НХТ Климкин М.А Уфа, 2020 СОДЕРЖАНИЕВВЕДЕНИЕ 2 1 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 5 2 ИСХОДНЫЕ ДАННЫЕ 7 3 РАСЧЕТНАЯ ЧАСТЬ 7 3.1 ПОСТРОЕНИЕ ЗАВИСИМОСТИ ДАВЛЕНИЯ НАСЫЩЕННЫХ ПАРОВ ОТ ТЕМПЕРАТУРЫ, КРИВЫХ ИЗОБАР ПАРА, ЖИДКОСТИ И ЭНТАЛЬПИЙНОЙ ДИАГРАММЫ 8 3.2. РАСЧЕТ ОДНОКРАТНОГО ИСПАРЕНИЯ 14 3.3. РАСЧЕТ МАТЕРИАЛЬНОГО БАЛАНСА РЕКТИФИКАЦИОННОЙ КОЛОННЫ (РК) 23 3.4. РАСЧЕТ ТЕПЛОВОГО БАЛАНСА РЕКТИФИКАЦИОННОЙ КОЛОННЫ 29 3.5. РАСЧЕТ РЕЖИМА ПОЛНОГО ОРОШЕНИЯ 32 3.6. РАСЧЕТ ЧИСЛА ТЕОРЕТИЧЕСКИХ ТАРЕЛОК НА Х-Н И КОМБИНИРОВАННОЙ ДИАГРАММЕ 34 3.6.1. Расчет числа теоретических тарелок на х-у диаграмме 34 3.6.2. Расчет числа теоретических тарелок на комбинированной диаграмме 36 3.7. РАСЧЕТ ПРОФИЛЯ КОНЦЕНТРАЦИЙ И НАГРУЗОК ПО ВЫСОТЕ КОЛОННЫ 40 3.7.1. Расчет флегмового и парового чисел колонны 40 3.8. РАСЧЕТ ФАКТИЧЕСКОГО ЧИСЛА ТАРЕЛОК 46 3.9. РАСЧЕТ ДИАМЕТРА РЕКТИФИКАЦИОННОЙ КОЛОННЫ (РК) 48 3.10. РАСЧЕТ ВЫСОТЫ РЕКТИФИКАЦИОННОЙ КОЛОННЫ 51 3.11. РАСЧЕТ КОНДЕНСАТОРА-ХОЛОДИЛЬНИКА 52 3.11.1. Расчет поверхности конденсатора-холодильника 52 3.11.2. Расчет расхода воды 53 3.12. РАСЧЕТ КИПЯТИЛЬНИКА 54 3.12.1 Расчет поверхности кипятильника 54 3.12.1. Расчет расхода пара 55 3.13. РАСЕЧТ ДИАМЕТРОВ ШТУЦЕРОВ РЕКТИФИКАЦИОННОЙ КОЛОННЫ 55 ВВЕДЕНИЕ При проведении процессов ОИ и ОК получают пар, более богатый НКК, а жидкость более богатую ВКК, чем исходная система. Однако достаточно хорошая степень разделения таким образом не достигается. Для получения продуктов с любой желаемой концентрацией компонентов и с высокими выходами служит процесс ректификации, заключающийся в многократно повторяющемся контактировании неравновесных паровой и жидкой фаз. Образованные в результате контакта паровая и жидкая фазы будут отличаться по составу от вступивших в контакт встречных неравновесных потоков паровой и жидкой фаз. В итоге такого контакта пар обогатится низкокипящим компонентом, а жидкость – высококипящим. Если исходные пары и жидкость находились при одинаковом давлении, то для обеспечения этих условий требуется, чтобы температура вступающей в контакт жидкости была ниже температуры паров. После контактирования температуры пара и жидкости выравниваются, так как система стремится к состоянию равновесия. Производя многократное контактирование неравновесных потоков паровой и жидкой фаз, направляя после каждой ступени пары на смешение с жидкостью, а жидкость на контакт с парами, более бедными НКК, можно изменить составы фаз желаемым образом. Подобное контактирование фаз по схеме противотока в целом по аппарату осуществляется в специальных аппаратах – ректификационных колоннах, заполненных различными контактными устройствами: тарелками, насадками ит.д. Таким образом, процесс ректификации есть диффузионный процесс разделения жидких смесей, компоненты которых различаются по температурам кипения, осуществляемый путем противоточного контактирования неравновесных паров и жидкости. Расчет ректификационной колонны сводится к определению ее основных геометрических размеров – диаметра и высоты. Оба параметра определяются гидродинамическим режимом работы колонны, который, в свою очередь, зависит от скоростей и физических свойств взаимодействующих фаз, а также от типа контактного устройств. 1 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Ректификация (от по позднелат. rectificatio - выпрямление, исправление), разделение жидких смесей на практически чистые компоненты, отличающиеся температурами кипения, путем многократных испарения жидкости и конденсации паров. В этом основное отличие ректификации от дистилляции, при которой в результате однократного цикла частичного испарения-конденсации достигается лишь предварительное (грубое) разделение жидких смесей. Для ректификации обычно используют колонные аппараты, называемые ректификационными колоннами, в которых осуществляется многократный контакт между потоками паровой и жидкой фаз. Движущая сила ректификации – разность между фактическими (рабочими) и равновесными концентрациями компонентов в паровой фазе, отвечающими данному составу жидкой фазы. Парожидкостная система стремится к достижению равновесного состояния, в результате чего пар при контакте с жидкостью обогащается легколетучими (низкокипящими) компонентами (НКК), а жидкость - труднолетучими (высококипящими) компонентами (ВКК). Поскольку жидкость и пар движутся, как правило, противотоком (пар – вверх, жидкость – вниз), и при достаточно большой высоте колонны, в ее верхней части можно получить практически чистый целевой компонент. Ректификацию можно осуществлять непрерывно или периодически. Для непрерывной ректификации применяют колонны, состоящие из двух ступеней: верхняя – укрепляющая (в ней пар укрепляется, т.е. обогащается НКК) и нижней – отгонная (где происходит исчерпывание жидкой смеси, т. е. извлечение НКК и обогащение ее ВКК). При периодической ректификации в колонне производится только укрепление пара. Различают ректификации бинарных (двухкомпонентных) и многокомпонентных смесей. Рассмотрим сущность процесса ректификации на примере разделения двухкомпонентной смеси при наличии теоретических тарелок. На каждую, например, n-ую тарелку с вышележащей тарелки стекает жидкость в количестве gn1, при температуре tn1 и нижерасположенной тарелки поднимаются пары в количестве Gn1, при температуре tn1. При теоретическом контакте на n-ой тарелке система достигает состояния равновесия, при этом пары Gn и жидкость gn будут иметь одинаковую температуру tn. Для осуществления процесса ректификации температурный режим в колонне должен быть таким, чтобы температура убывала в направлении движения потока паров (возрастала в направлении движения потока жидкости), т. е. tn1 tn tn1. При контакте фаз в результате массообменных процессов температура паровой фазы снизится, часть паров конденсируется и концентрация НКК в них возрастёт, а температура жидкой фазы увеличится, часть её испарится, и концентрация НКК в ней уменьшится. Изменение состава паров и жидкости удобно проследить по изобарным температурным кривым. На n-й теоретической тарелке в результате контакта концентрация НКК в паровой фазе увеличилась на величину yn yn1, а в жидкой фазе уменьшилась на величину x+1n xn , тем самым концентрация ВКК в жидкости увеличилась. При ректификации массообмен протекает в обоих направлениях. Если теплота испарения и теплоёмкости разделяемых компонентов различаются незначительно, то массы парового и жидкостного потоков по высоте аппарата изменяются мало. Очевидно, что при многократном повторении таких противоточных контактов на верху аппарата можно получить пары, обогащенные в любой степени НКК y 1,0, а снизу отбирать жидкость, обогащенную ВКК x 0 . Подобное контактирование осуществляется до тех пор, пока пар на верху колонны не приобретает заданного состава по НКК yD, а жидкость внизу колонны не достигнет состава xw. Подобное контактирование фаз по схеме противотока в целом по аппарату осуществляется в ректификационных колоннах, заполненных различными контактными устройствами: тарелками, насадками и т.п. 2 ИСХОДНЫЕ ДАННЫЕ Расчёт ректификационной колонны для разделения бинарной смеси бензол-толуол Таблица 1 - Исходные данные
Бензол– НКК, т.е. более легколетучий компонент. Толуол – ВКК, т.е. менее легколетучий компонент. 3 РАСЧЕТНАЯ ЧАСТЬ 3.1 ПОСТРОЕНИЕ ЗАВИСИМОСТИ ДАВЛЕНИЯ НАСЫЩЕННЫХ ПАРОВ ОТ ТЕМПЕРАТУРЫ, КРИВЫХ ИЗОБАР ПАРА, ЖИДКОСТИ И ЭНТАЛЬПИЙНОЙ ДИАГРАММЫ Зависимость между температурой t и давлением насыщенных паров компонента Pi описывается эмпирическим уравнением Антуана: 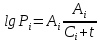 (1) (1) 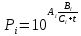 (1*) (1*)где Аi, Вi, Сi – эмпирические величины, постоянные для каждого компонента.
Для определения температур кипения бензола (низкокипящего компонента) tкип Б и толуола (высококипящего компонента) tкип Т, т.е. крайних точек изобарных температурных кривых, при заданном рабочем давлении уравнение Антуана нам надо решить относительно температуры t. Для этого вместо давления насыщенных паров компонента Рi в уравнение подставим давление в середине колонны π, т.е.: 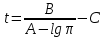 (2) (2)Температура кипения бензола 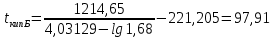 Температура кипения толуола 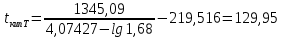 Таким образом, в данной бинарной системе низкокипящим компонентом является бензол, высококипящим – толуол. Далее в пределах рассчитанных температур кипения компонентов зададимся пятью температурами. Температуры будут меняться со следующим шагом: 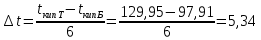 градусов градусовt1=97,910 ºС t2=103,25 ºС t3=108,59 ºС t4=113,93 ºС t5=119,27 ºС t6=124,61 ºС t7=129,95 ºС Давления насыщенных паров компонентов РБ и РТ найдем по уравнению (1): При температуре t1 =97,91 ºС  ат, ат, 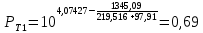 ат атПри температуре t2 =103,25 ºС 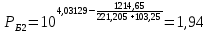 ат, ат, 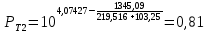 ат атПри температуре t3 =108,59 ºС 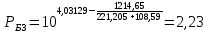 ат, ат, 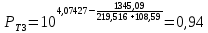 ат атПри температуре t4 = 113,93ºС 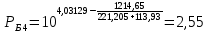 ат, ат, 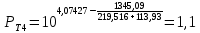 ат атПри температуре t5 = 119,27ºС 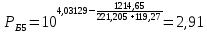 ат , ат , 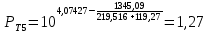 ат атПри температуре t6 = 124,61ºС 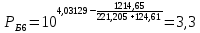 ат, ат, 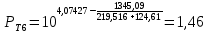 ат атПри температуре t7 =129,95 ºС 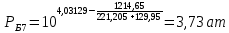 , , 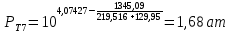 Полученные результаты приведены в таблице 2. По полученным данным строим график зависимости давления насыщенных компонентов от температуры. Определим мольные доли бензола в кипящей жидкой фазе 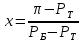 (3) (3)в равновесной паровой фазе 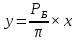 (4) (4)При температуре t1 =97,91ºС 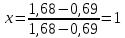 ; ; 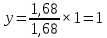 При температуре t2 =103,25ºС 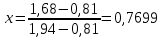 ; ; 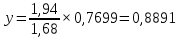 При температуре t3=108,59 ºС 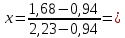 0,5736; 0,5736; 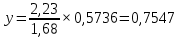 При температуре t4=113,93 ºС 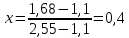 ; ; 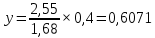 При температуре t5=119,27 ºС 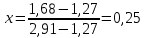 ; ; 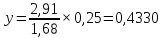 При температуре t6=124,61 ºС 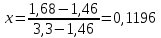 ; ; 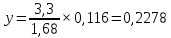 При температуре t7=129,95 ºС 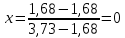 ; ; 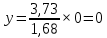 По полученным данным строим изобару и X-Y диаграмму. Полученные результаты приведены в таблице 2. Таблица 2 – Результаты расчета равновесных концентраций
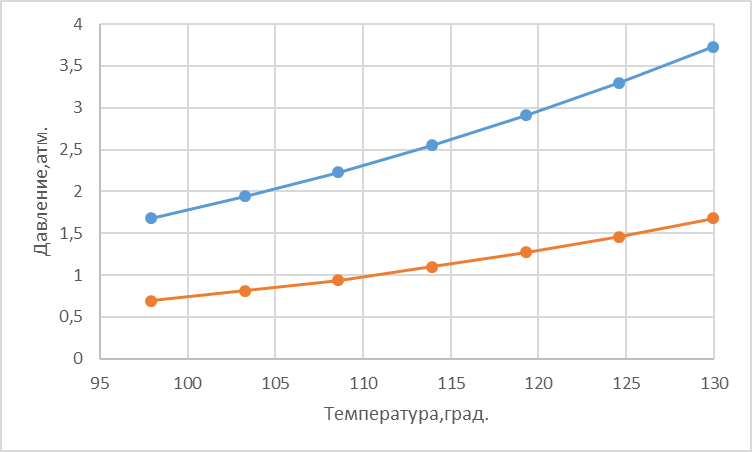 Рисунок 1 – Зависимость давления насыщенных паров от температуры 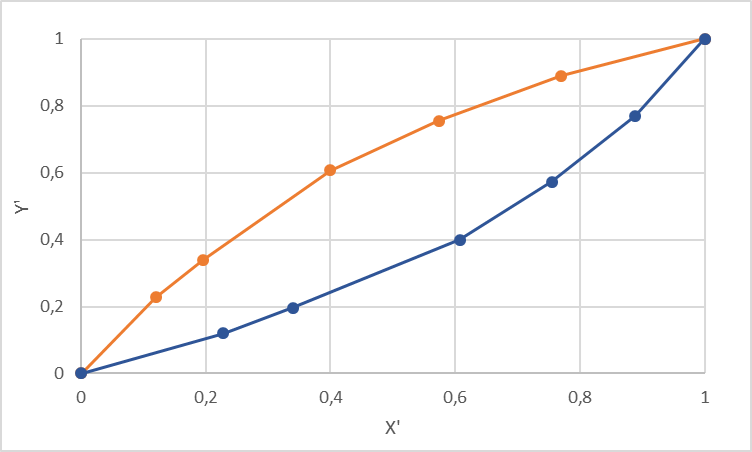 Рисунок 2 – X'-Y' диаграмма 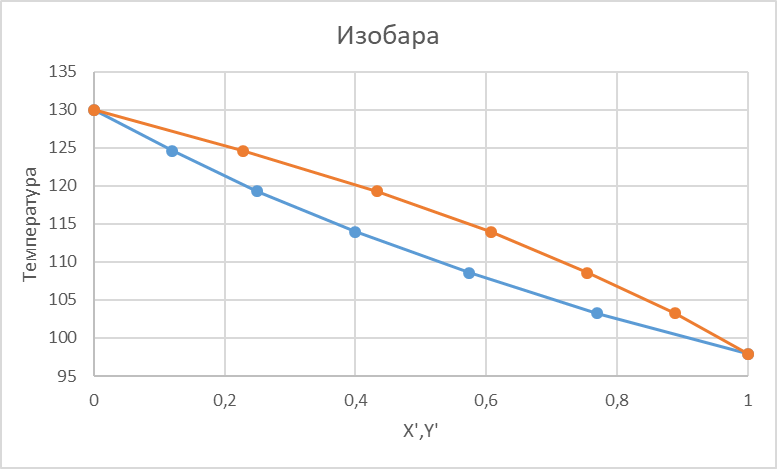 Рисунок 3 - Изобара 3.2. РАСЧЕТ ОДНОКРАТНОГО ИСПАРЕНИЯ Рассмотрим процесс однократного испарения (ИО) двухкомпонентной смеси. 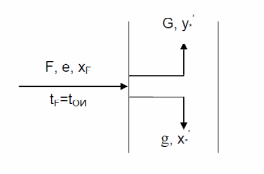 Рисунок 4 – Схема однократного испарения Материальный баланс процесса однократного испарения может быть представлен уравнениями: общее: 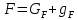 , (6) , (6)для низкокипящего компонента: 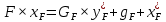 , (7) , (7)где 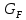 и и 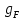 – расходы пары и жидкости; – расходы пары и жидкости;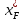 и и 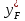 - мольные доли низкокипящего компонента в равновесных жидкой и паровой фазах, полученных в результате однократного испарения сырья на входе в колонну. - мольные доли низкокипящего компонента в равновесных жидкой и паровой фазах, полученных в результате однократного испарения сырья на входе в колонну.Отношение массы образовавшихся паров G к массе исходной смеси F называется массовой долей отгона и обозначается через е. Отношение G' к F' есть мольная доля отгона, обозначаемая через е'. Совместное решение уравнений (6) и (7) дает уравнение материального баланса ОИ в мольных единицах: 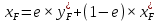 , (8) , (8)Если в уравнении (8) 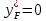 , то , то 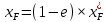 , откуда , откуда 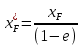 (9) (9) 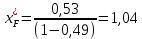 Отложим на x'-у'-диаграмме точку А по величине          0,62 0,44 F N А 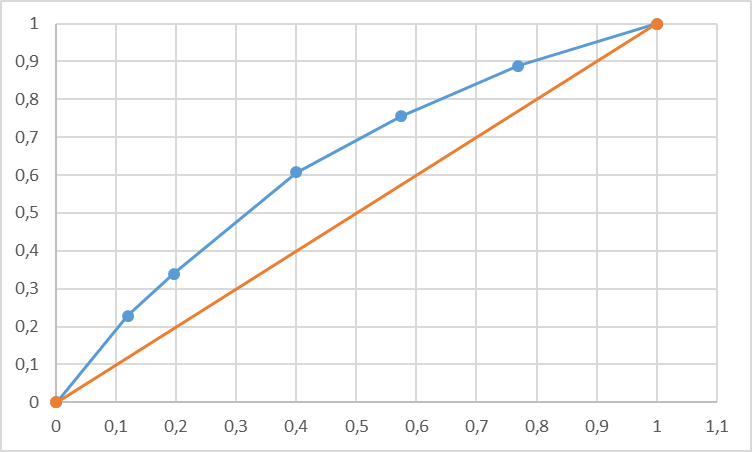 Строим линию ОИ, проходящую через точку А и точку N, координаты которой x' F=0,53 и y' F=0,53, то есть лежит на диагонали. Получаем точку F, то есть состав после ОИ: x’*F=0,44 и y’*F=0,62. Проверим, правильно ли мы нашли x`*,y`* . Для чего по формуле (8) найдем е, подставив полученные координаты и сравним полученную долю отгона с долей отгона данной в задании 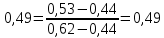 Имеем 0,49=0,49 x’*F, y’*F найдены верно. Отложив на изобаре мольные доли x’*F и y’*F на линии жидкости получим расход жидкости gF, на линии пара – расход пара GF. Нода gF GF должна быть параллельна оси абсцисс. Точка F находится на ноде, причем ее абсцисса соответствует величине x`F=0,53 . По ноде определим температуру сырья tF=114 °С.      114 0С 0,44 0,53 0,62  Таким образом, в результате ОИ мы рассчитали состав равновесных фаз сырья, поступающего в колонну, и определили температуру сырья. Построение энтальпийной диаграммы Величины энтальпии для различных веществ в жидком и газообразном состоянии могут быть взяты из справочника или рассчитаны по эмпирическим зависимостям от температуры t и плотности 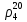 вещества. вещества. 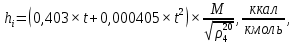 (10) (10)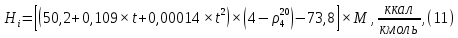 где hi и Hi – энтальпии компонентов соответственно в жидкой и паровой фазах; М – молекулярная масса. t1 = 97,91 ºС 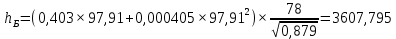 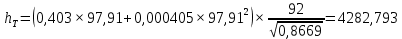 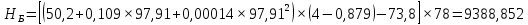 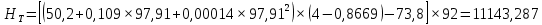 t2 = 103,25 ºС 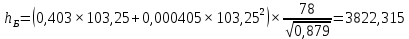 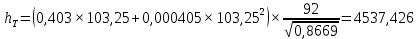 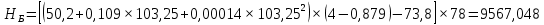 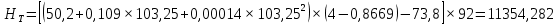 t3 = 108,59 ºС 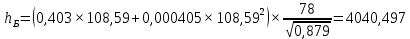 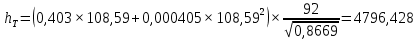 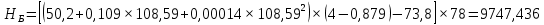 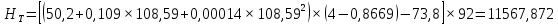 t4 = 113,93ºС 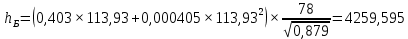 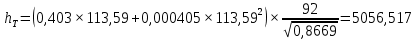 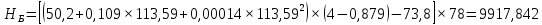 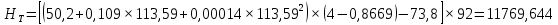 t5 = 119,27ºС 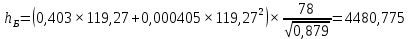 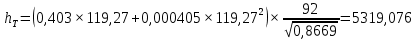 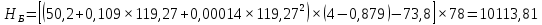 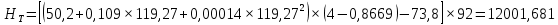 t6 = 124,61 ºС 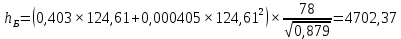 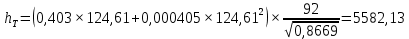 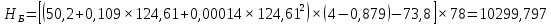 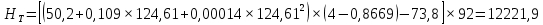 t7 = 129,95 ºС 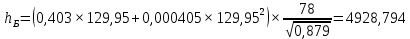 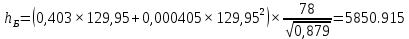 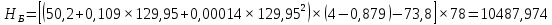 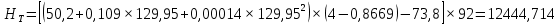 Результаты расчета энтальпий приведены в таблице 3. Энтальпийная диаграмма в координатах «содержание низкокипящего компонента в жидкой и паровой фазах – энтальпия жидкой и паровой фаз» включает линию (кривую) энтальпии кипящей жидкости и линию энтальпии равновесных паров. Отрезки линий, соединяющих точки энтальпий равновесных фаз, называются конодами. Крайние коноды соответствуют чистым компонентам, они занимают вертикальное положение, остальные коноды располагаются под разными углами к оси абсцисс. Энтальпии жидкой и паровой фаз рассчитываются по закону аддитивности: Для жидкой фазы 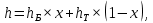 (12) (12)Для насыщенных паров 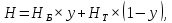 (13) (13)t1=97,91 ºС 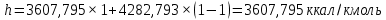 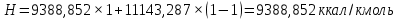 t2=103,25 ºС 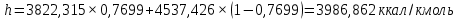 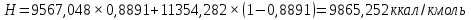 t3=108,59 ºС 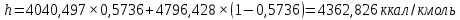 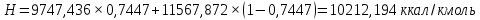 t4=113,93 ºС 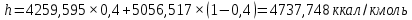 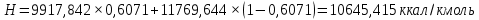 t5=119,27 ºС 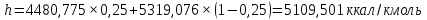 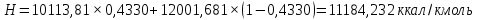 t6=124,61 ºС 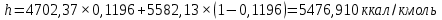 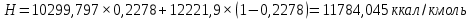 t7=129,95 ºС 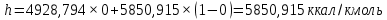 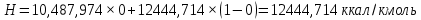 Таблица 3 – Результаты расчета энтальпий в жидкой и паровой фазах
Из результатов расчета видно, что с ростом температуры растут значения энтальпий каждого из компонентов и смеси как в жидкой, так и в паровой фазах. По данным таблицы 3 строим энтальпийную диаграмму. 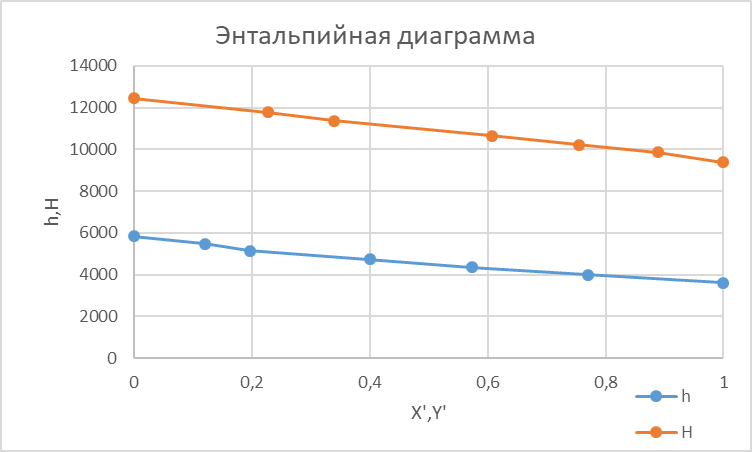 Результаты расчета ОИ перенесем на энтальпийную диаграмму. Перенесем координаты XW и YD на энтальпийную диаграмму и получим координаты hW и HD.                 hF=7150 hw=5890 HD=9500 G F g 0,44 0,53 0,62 YD=0,97 Xw=0,037  Энтальпия остатка hw=5890 ккал/кмоль Энтальпия дистиллята HD=9500 ккал/кмоль Энтальпия сырья hF=7150 ккал/кмоль. 3.3. РАСЧЕТ МАТЕРИАЛЬНОГО БАЛАНСА РЕКТИФИКАЦИОННОЙ КОЛОННЫ (РК) 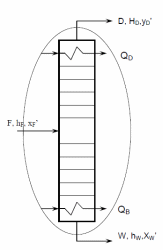 Материальный баланс в целом для ректификационной колонны: 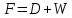 (14) (14)Материальный баланс по низкокипящему компоненту 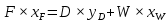 (15) (15)Материальный баланс по высококипящему компоненту 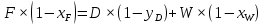 (16) (16)где F, D, W – расходы сырья, дистиллята и остатка; 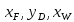 – мольные доли низкокипящего компонента в сырье, дистилляте и остатке. – мольные доли низкокипящего компонента в сырье, дистилляте и остатке.Материальный баланс составим в мольных и массовых единицах. По условию задания имеем производительность колонны, т.е. расход сырья, F=18,5 т/час. Средняя молекулярная масса дистиллята: 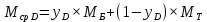 (17) (17)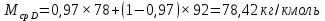 Средняя молекулярная масса остатка: 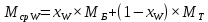 (18) (18)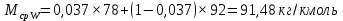 Переведем расход сырья в мольные единицы, для чего по закону аддитивности рассчитаем среднюю молекулярную массу: 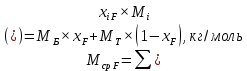 (19) (19)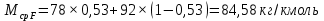 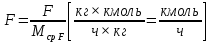 (20) (20)Где 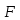 – расход сырья, кмоль/ч, – расход сырья, кмоль/ч,F – расход сырья, кг/ч, 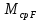 – средняя молекулярная масса сырья. – средняя молекулярная масса сырья.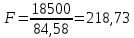 кмоль/ч кмоль/чРассчитаем расход дистиллята и остатка по правилу рычага 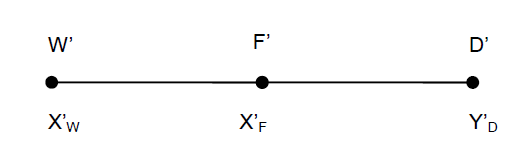 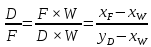 (21) (21)Из уравнения (21) выразим 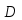 : :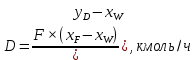 (22) (22)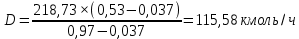 Аналогично рассчитаем выход остатка: 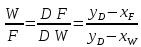 (22) (22)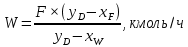 (23) (23)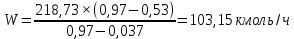 Таким образом, расход дистиллята и остатка по сырью: 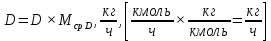 (24) (24)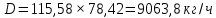 , ,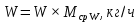 (25) (25)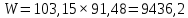 кг/ч кг/чПроверка по уравнению (14) 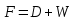 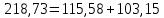 – верно. – верно.Рассчитаем материальный баланс по каждому компоненту: Сколько бензола в кмоль/ч в исходной смеси: 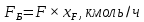 (26) (26)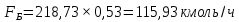 Проведем мольные единицы в массовые. Найдем содержание бензола в исходной смеси в кг/ч: 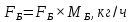 (27) (27)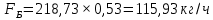 Аналогичным образом рассчитаем мольную и массовую долю для толуола 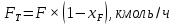 (28) (28)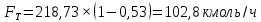 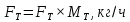 (29) (29)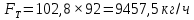 Далее рассчитаем, сколько бензола будет в дистилляте: 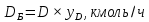 (30) (30)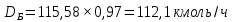 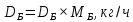 (31) (31)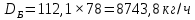 Сколько толуола будет в дистилляте: 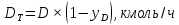 (32) (32)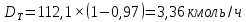 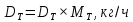 (33) (33)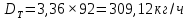 Сколько будет бензола в остатке: 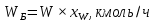 (34) (34)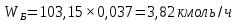 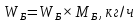 (35) (35)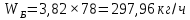 Сколько будет толуола в остатке: 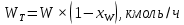 (36) (36)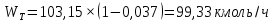 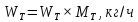 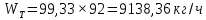 Таблица 4 – Материальный баланс ректификационной колонны
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||