Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
7.1.Основные ферменты, используемые в генной инженерии7.1.1.Рестриктазы и ДНК-метилазыСреди ферментов, используемых в генной инженерии для клонирования, большое значение имеют эндонуклеазы рестрикции – рестриктазы. Эти ферменты, впервые открытые как часть системы рестрикции–модификации ДНК у бактерий, специфически гидролизуют молекулы двухцепочечных ДНК при наличии в них определенных последовательностей нуклеотидов, называемых сайтами рестрикции. В то же время метилазы используют для ограничения числа сайтов рестрикции и получения более крупных фрагментов ДНК с помощью рестриктаз. Классификация рестриктаз. По механизму действия и молекулярной структуре различают три типа рестриктаз. Ферменты рестрикции типа I представляют собой сложные мультимерные комплексы, построенные из трех субъединиц с молекулярной массой до 300 кДа, которые обладают рестриктазной, ДНК-метилазной и АТРазной активностями. Рестриктазы типа I для проявления своей активности требуют присутствия ATP, S-аденозилметионина и ионов Mg2+, они не распознают специфические последовательности нуклеотидов и в силу этого не находят широкого применения в генной инженерии. Рестриктазы типа II узнают специфические последовательности нуклеотидов в точке расщепления ДНК или непосредственной близости от нее, требуют для проявления активности наличия в реакционной смеси ATP и ионов Mg2+ и чаще всего используются при молекулярном клонировании. Ферменты типа III также активны только в присутствии ATP и ионов Mg2+ и не проявляют абсолютной зависимости от S-аденозилметионина. 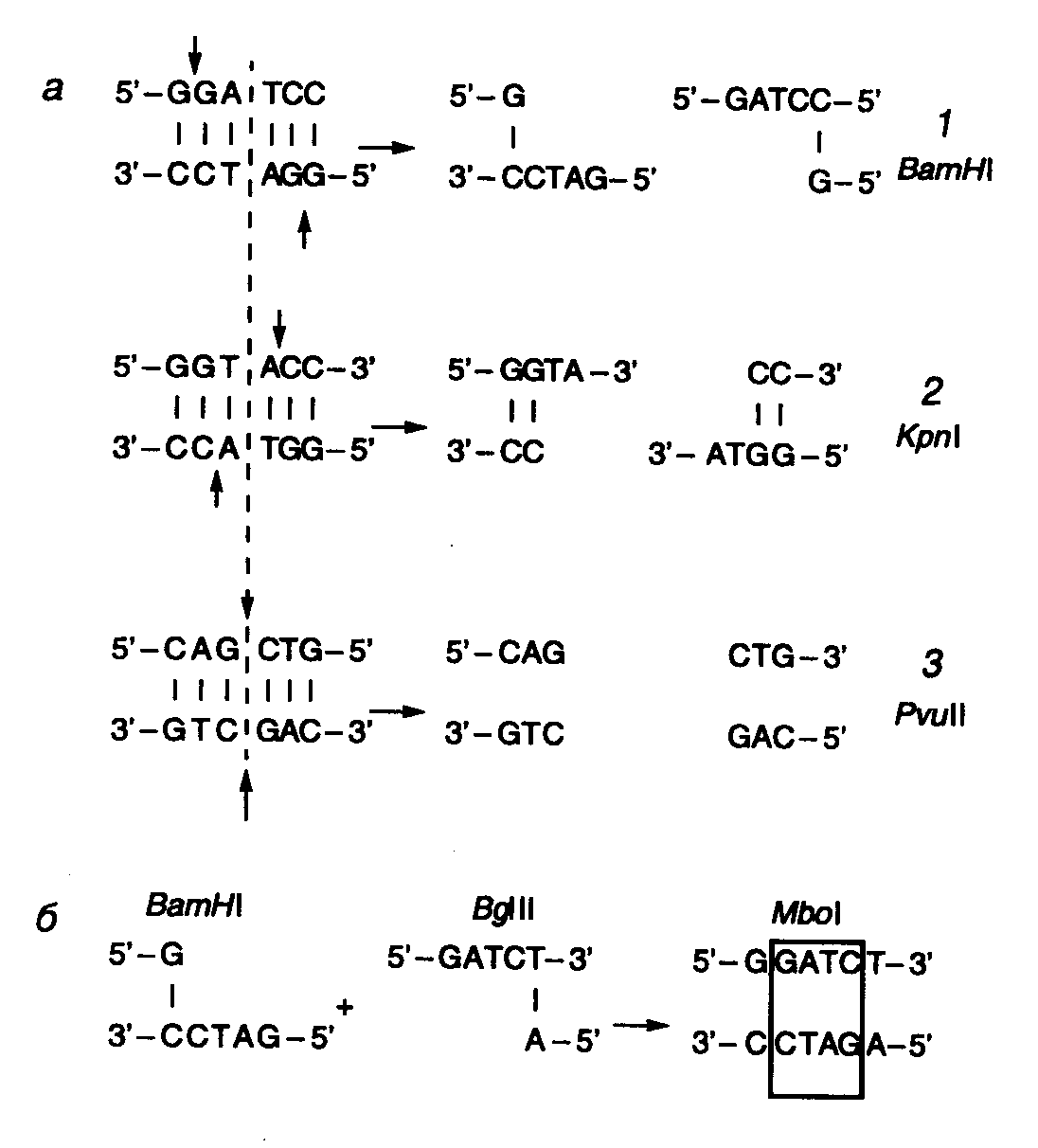 Рис. II.1. Формы разрывов двухцепочечных ДНК, образующихся под действием рестриктаз а – 5’-выступающие (1), 3’-выступающие "липкие" (2) и "тупые" (3) концы ДНК, образующиеся под действием рестриктаз BamHI, KpnI и PvuII соответственно. Стрелками обозначены места разрывов цепей ДНК, пунктирной линией – ось симметрии сайтов рестрикции; б – лигирование с потерей сайта рестрикции Названия рестриктаз складываются из первых букв видовых названий бактерий, в которых они обнаружены, например Eco – E. coli. В том случае, когда различные по специфичности действия рестриктазы присутствуют в клетках разных штаммов одного вида бактерий, в название рестриктазы вводят дополнительную букву, например рестриктазы Hinc и Hind выделены из бактериальных клеток Haemophilus influenzae, штаммы с и d. Цифры, следующие за буквенными обозначениями, отражают последовательность открытия соответствующих рестриктаз в клетках бактерий одного вида, например HaeI, HaeII и HaeIII из H. aegipticus. Рестриктазы типа II – основной инструмент генной инженерии. Большинство рестриктаз типа II специфически узнают на ДНК тетра- и гексануклеотидные последовательности, а по крайней мере три из них – октануклеотиды. Чем короче олигонуклеотидная последовательность сайта рестрикции, узнаваемого рестриктазой, тем чаще он встречается в случайной последовательности нуклеотидов, в которой каждый из четырех нуклеотидов представлен с одинаковой частотой (50% А–Т-пар и 50% G–С-пар). Так, случайная тетрануклеотидная последовательность встречается в среднем через каждые 256 п.о. (44), а гексануклеотидная – через каждые 4096 п.о. (46). Однако в природных ДНК распределение нуклеотидов может заметно отличаться от случайного. Например, для эукариотических ДНК характерна низкая частота встречаемости динуклеотида CpG и соответственно сайтов рестрикции, содержащих эти динуклеотиды (рестриктазы HhaI, HpaII, TaqI, ThaI, AvaI, HaeII, HindII, SalI, SmaI, XhoI, XmaI). Существенное отклонение частоты встречаемости сайтов рестрикции от ожидаемого при случайном их распределении вдоль ДНК свойственно и хромосомам термофильных бактерий, которым, напротив, свойственно (хотя и не во всех случаях) обогащение по G–С-парам. Для большинства сайтов, узнаваемых рестриктазами типа II, характерно наличие в них симметрии второго порядка, т.е. узнаваемые ими последовательности представляют собой палиндромы, например у рестриктазы EcoRI – 5’-GAATTC-3’. Это означает, что нуклеотиды, расположенные в каждой из цепей на равном расстоянии от оси симметрии, комплементарны друг другу. Если точки расщепления противоположных цепей ДНК смещены друг относительно друга в сайте рестрикции, то образующиеся в результате рестрикции концы ДНК содержат выступающие одноцепочечные участки. Поскольку такие участки комплементарны сами себе и друг другу и могут между собой взаимодействовать, их часто называют "липкими" концами. В "липких" концах выступающим одноцепочечным участком может быть как 5’-, так и 3’-конец (рис. II.1,а). Формальным признаком образования 5’- или 3’-выступающих "липких" концов в сайтах рестрикции является расположение точки расщепления цепей ДНК в последовательности, используемой для обозначения сайта рестрикции, слева или справа от оси симметрии соответственно. У некоторых рестриктаз точки расщепления обеих цепей ДНК расположены непосредственно друг под другом в сайте рестрикции. В этом случае после расщепления ДНК "липких" концов не образуется, а получаются так называемые "тупые" концы, в которых нет выступающих одноцепочечных участков ДНК (см. рис. II.1,а). Имеется одно принципиальное функциональное различие между 5’- и 3’-выступающими "липкими" концами – последние невозможно пометить путем их достройки ДНК-полимеразой. Эту особенность следует иметь в виду при выборе рестриктаз для получения рестрикционных фрагментов ДНК, которые предполагается использовать в качестве зондов. При конструировании рекомбинантных молекул полезно помнить, что, хотя рестриктазы BamHI, BclI, BglII и XhoII узнают разные сайты рестрикции, они образуют одни и те же "липкие" концы, GATC. То же характерно и для группы рестриктаз SalGI, XhoI и AvaI (NCGA). При лигировании (см. ниже) фрагментов ДНК, образованных рестриктазами одной из таких групп, происходит их объединение, но при этом исходные сайты рестрикции теряются, так как в результате образуется новая непрерывная последовательность нуклеотидов (см. рис. II.1,б). Сайты рестрикции для некоторых рестриктаз II типа не являются симметричными. Например, рестриктаза HgaI узнает асимметричную последовательность 5’-GACGC-3’, а одноцепочечные разрывы вносит в противоположные цепи ДНК, отступя вправо на 5 и 10 нуклеотидов соответственно: 5’-GACGC(N)5 3’-CTGCG(N)5(N)5 Последовательности нуклеотидов образующихся "липких" концов являются уникальными для каждого такого сайта рестрикции. Вследствие этого рестрикционные фрагменты ДНК, образовавшиеся под действием данной рестриктазы, в смеси соединяются друг с другом лишь в строго определенной исходной последовательности, которая задается уникальными последовательностями нуклеотидов в "липких" концах рестрикционных фрагментов ДНК. Например, при расщеплении этой рестриктазой репликативной формы ДНК фага X174 образуется 14 фрагментов, которые in vitro объединяются в правильную последовательность с образованием инфекционной X174-ДНК. Универсальные рестриктазы для одноцепочечных ДНК. На основе рестриктаз, узнающих асимметричные последовательности нуклеотидов, разработана система, позволяющая расщеплять молекулы одноцепочечной ДНК в любой заданной точке. С этой целью синтезируется олигонуклеотид, 5’-концевая часть которого содержит сайт, узнаваемый такой рестриктазой, а последовательность нуклеотидов 3’-концевой части комплементарна участку ДНК, в который необходимо внести эндонуклеазный разрыв. В результате гибридизации олигонуклеотида с одноцепочечной ДНК образуется структура, изображенная на рис. II.2. При этом фермент взаимодействует с сайтом узнавания (участок I), а разрывы вносятся по местам, обозначенным стрелками. Таким образом, положение места эндонуклеазного расщепления будет целиком зависеть от последовательности нуклеотидов участка II синтетического олигонуклеотида, комплементарного ДНК-субстрату. 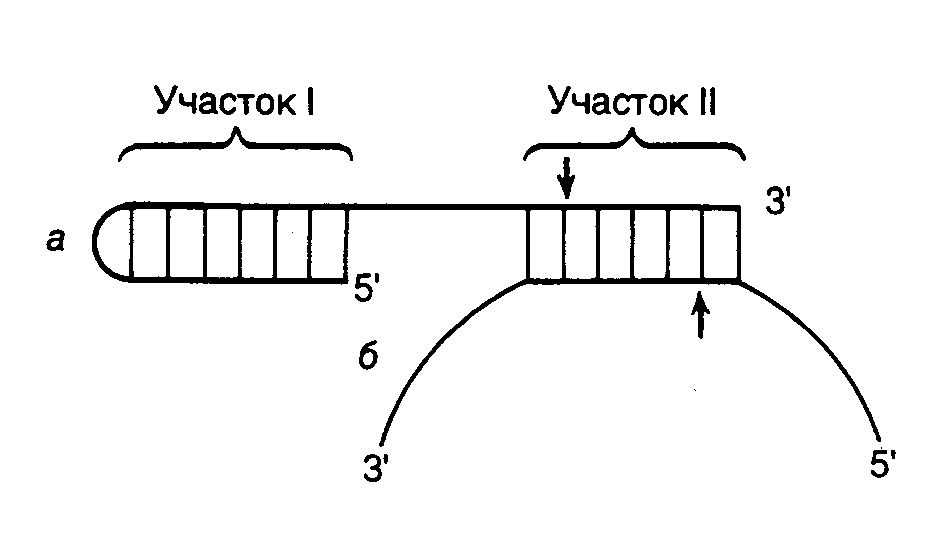 Рис. II.2. Расщепление одноцепочечной ДНК универсальной рестриктазой а – синтетический олигонуклеотид; б – одноцепочечная ДНК. После образования шпильки и гибридизации с одноцепочечной ДНК-мишенью олигонуклеотид образует сайт связывания рестриктазы (участок I) и сайт расщепления ДНК-ДНК-гибрида (участок II). Стрелки указывают места эндонуклеазного расщепления ДНК и олигонуклеотида Изошизомеры. В клетках разных видов бактерий могут содержаться рестриктазы, узнающие одни и те же сайты рестрикции. Такие рестриктазы называют изошизомерами. Изошизомеры некоторых рестриктаз с успехом используются для обнаружения метилированных участков ДНК в геноме. Так, рестриктазы HhaI и HpaII расщепляют неметилированные последовательности GCGC и CCGG соответственно и утрачивают способность к расщеплению, если хотя бы один из остатков цитозина в этих сайтах метилирован. В то же время фермент MspI (изошизомер HpaII) расщепляет последовательность CCGG независимо от того, метилированы или неметилированы остатки цитозина в таком сайте. N-Метилирование остатков аденозина в ДНК можно обнаружить с помощью изошизомеров Sau3A (расщепляет как метилированные, так и неметилированные последовательности GATC), DpnI (расщепляет только метилированные последовательности GMeATC) и MboI (расщепляет только неметилированные последовательности). Изменение специфичности действия рестриктаз в неоптимальных условиях. Рестриктазы являются высокоспецифическими ферментами. Однако для поддержания этой специфичности in vitro необходимо соблюдать в реакционной смеси оптимальные условия для действия ферментов. При нарушении таких условий у некоторых рестриктаз начинает проявляться вторичная (так называемая штриховая) активность. Так, рестриктаза EcoRI расщепляет последовательность GAATTC при pH 7,3, 100 мМ NaCl в присутствии 5 мМ MgСl2, однако при изменении значений pH, понижении концентрации NaCl или замене ионов Mg2+ на Mn2+, а также в присутствии органических растворителей у фермента появляется тенденция к расщеплению более короткой последовательности AATT (так называемая активность EcoRI). К рестриктазам, обладающим подобными свойствами, относятся также BamHI, BstI, BsuI, DdeI, HhaI, PstI, SalI, SstI, XbaI. Действие рестриктаз на необычные субстраты. Помимо двухцепочечных ДНК многие рестриктазы способны использовать ДНК-РНК-гибриды в качестве субстрата. Это относится, в частности, к рестриктазам EcoRI, HindII, SalI, MspI, HhaI, AluI, TaqI и HaeIII. Некоторые рестриктазы, например HaeIII, HhaI и SfaI, способны расщеплять одноцепочечную ДНК фага X174, хотя и со значительно меньшей скоростью, чем соответствующую двухцепочечную RF-форму. Такая способность была продемонстрирована для некоторых других рестриктаз, а также ДНК-субстратов. Остается неясным, узнают ли эти рестриктазы истинные одноцепочечные сайты или же последовательности нуклеотидов, заключенные в элементы вторичной структуры. С развитием метода полимеразной цепной реакции (ПЦР) (см. ниже) часто возникает необходимость расщепления рестриктазами амплифицированных олигонуклеотидов недалеко от их концов, т.е. в условиях, когда сайт рестрикции фланкирован с одного из своих концов одним или несколькими нуклеотидами. В этом случае установлена четкая зависимость способности определенных рестриктаз расщеплять сайты рестрикции от количества фланкирующих сайт нуклеотидов. Данное свойство рестриктаз объясняют, в частности тем, что на самих концах двухцепочечной молекулы ДНК происходит локальное плавление двойной спирали ДНК с образованием коротких одноцепочечных участков, захватывающих сайт узнавания рестриктазами. Частично избежать локальное плавление можно понижением температуры реакционной смеси во время проведения рестрикции таких олигонуклеотидов. Поскольку эти данные имеют большое значение для практической генной инженерии, они суммированы в табл. II.1. Таблица II.1 Эффективность расщепления коротких последовательностей ДНК некоторыми распространенными рестриктазами
Таблица II.1 (окончание)
ДНК-метилазы. Большинство штаммов E. coli содержит два типа ферментов, метилирующих ДНК: dam- и dcm-метилазы. Первая осуществляет перенос метильных групп в N-положение аденина в последовательности GATC. В таком случае многие рестриктазы (например BclI, MboI или ClaI), в состав сайтов рестрикции которых входит данная метилированная последовательность, перестают расщеплять ДНК по этим сайтам. Аналогичное действие на некоторые рестриктазы, например EcoRII, оказывает и dcm-метилаза, осуществляющая метилирование остатков цитозина по положению С5 в последовательностях CMeCAGG и CMeCTGG. Для того чтобы избежать нежелательного влияния этих метилаз на клонируемые ДНК, в качестве хозяев используют мутантные штаммы E. coli: dam- и dcm-. ДНК-метилазы бактериальных систем рестрикции и модификации применяют для блокирования in vitro соответствующих сайтов рестрикции на исследуемых фрагментах ДНК с целью получения под действием гомологичных рестриктаз фрагментов больших размеров. 7.1.2.ДНК- и РНК-лигазыСоздание фосфодиэфирных связей в одноцепочечных разрывах двухцепочечной ДНК с помощью ДНК-лигаз является наряду с рестрикцией одним из важнейших этапов получения рекомбинантных ДНК in vitro. Наибольшее применение в генно-инженерных исследованиях находит ДНК-лигаза бактериофага Т4. Реакция лигирования протекает в два этапа (рис. II.3). Вначале образуется промежуточный комплекс фермент–АМР (этап 1), после чего остаток АМР переносится на 5’-фосфатную группу концевого нуклеотида в точке разрыва ДНК (этап 2). Образовавшаяся фосфодиэфирная связь гидролизуется во время нуклеофильной атаки 3’-ОН группы соседнего нуклеотида, что приводит к образованию новой фосфодиэфирной связи, восстанавливающей целостность сахаро-фосфатного остова ДНК. Т4-ДНК-лигаза осуществляет соединение фрагментов двухцепочечной ДНК, обладающих комплементарными "липкими" или "тупыми" концами. Как следует из механизма реакции, необходимым условием протекания лигирования является наличие 5’-концевого фосфата и 3'-концевого гидроксила в точках разрыва цепей ДНК. При этом эффективность соединения фрагментов ДНК по "тупым" концам Т4-ДНК-лигазой возрастает в присутствии Т4-РНК-лигазы, которая осуществляет ковалентное соединение 5’-фосфорилированных концов одноцепочечных ДНК или РНК с 3’-ОН группами одноцепочечных нуклеиновых кислот. 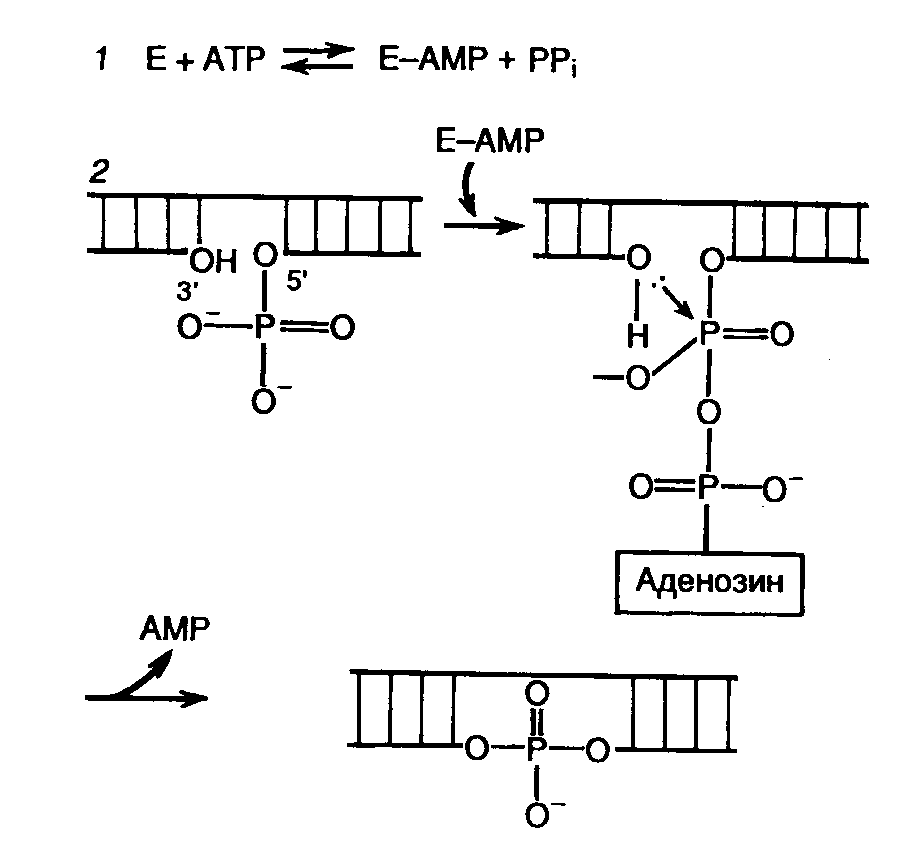 Рис. II.3. Механизм лигирования ДНК Т4-ДНК-лигазой 1 – образование промежуточного комплекса фермент Е–AMP; 2 – образование фосфодиэфирной связи 7.1.3.Ферменты матричного синтеза ДНК и РНКК ферментам матричного синтеза нуклеиновых кислот относятся многочисленные ДНК- и РНК-зависимые ДНК- и РНК-полимеразы, осуществляющие зависимый от матричных ДНК или РНК синтез нуклеиновых кислот. Эти ферменты обычно используются в генной инженерии для получения двухцепочечных молекул ДНК из одноцепочечных, а также для обратной транскрипции, т.е. синтеза двухцепочечных ДНК, комплементарных мРНК, которые называют комплементарными ДНК (кДНК). ДНК-зависимые ДНК-полимеразы. Среди ДНК-зависимых ДНК-полимераз наибольшее применение в генной инженерии находят ДНК-полимераза I E. coli и ее большой фрагмент (фрагмент Кленова), Т4-ДНК-полимераза и в последнее время термостабильные ДНК-полимеразы, особенно ДНК-полимераза Thermus aquaticus (Taq-полимераза). Все эти ферменты в присутствии ионов Mg2+ из четырех дезоксирибонуклеозидтрифосфатов (dATP, dCTP, dGTP и TTP) осуществляют синтез ДНК, комплементарной матричной ДНК, и для функционирования требуют наличия затравки на одноцепочечной матричной ДНК, т.е. олиго- или полидезоксирибонуклеотида со свободным 3’-ОН-концом, комплементарного матричной ДНК. ДНК-полимераза I E. coli состоит из одной полипептидной цепи с молекулярной массой около 109 кДа и обладает тремя активностями: полимеризующей в направлении 5’3’, 5’3’-экзонуклеазной и 3’5’-экзонуклеазной. Большой фрагмент ДНК-полимеразы I E. coli (фрагмент Кленова) является частью полипептидной цепи ДНК-полимеразы I с молекулярной массой около 76 кДа, у которой отсутствует домен, соответствующий 5’3’-экзонуклеазе. Как ДНК-полимераза I, так и ее фрагмент используются для введения радиоактивно меченных дезоксирибонуклеотидов в синтезируемые цепи ДНК путем ник-трансляции, т.е. перемещения одноцепочечного разрыва вдоль молекулы двухцепочечной ДНК, в котором 3’-ОН-конец используется в качестве затравки для ферментов. При этом ДНК-полимераза I прокладывает себе путь с помощью 5’3’-экзонуклеазы, а фрагмент Кленова вытесняет цепь ДНК с 5’-конца. Кроме того, фрагмент Кленова используют для синтеза второй цепи кДНК, секвенирования ДНК по методу Сенгера, заполнения 5’-выступающих "липких" концов ДНК с образованием "тупых" концов, введения концевой радиоактивной метки, а также для удаления 3’-выступающих концов рестрикционных фрагментов ДНК 3’5’-экзонуклеазой этого фермента. Как и ДНК-полимераза I E. coli, Т4-ДНК-полимераза обладает 3’5’- (но не 5’3’-) экзонуклеазной активностью, которая у последней, по крайней мере, в 200 раз выше. Это позволяет использовать Т4-ДНК-полимеразу, в частности, для введения радиоактивной метки путем реакции обмена немеченного 3’-концевого нуклеотида на меченный радиоактивным изотопом. Полимеразная цепная реакция (ПЦР). Термостабильная Taq-полимераза в настоящее время широко используется для проведения полимеразной цепной реакции (ПЦР), а ее модифицированный аналог – и для секвенирования ДНК по методу Сенгера. Сущность ПЦР заключается в следующем (рис. II.4). Реакционная смесь обычно содержит исследуемую ДНК, dATP, dCTP, dGTP и TTP, Taq-полимеразу и два синтетических олигодезоксирибонуклеотидных праймера длиной 15–30 нуклеотидов, комплементарных участкам противоположных цепей ДНК, фланкирующих исследуемый участок ДНК-матрицы. ПЦР начинается с кратковременного (1–2 мин) прогревания реакционной смеси при 95o, в процессе которого происходит плавление цепей матричной ДНК и инактивация примесных белков, которые могут присутствовать в реакционной смеси, если используется недостаточно очищенная матричная ДНК, например из клинических образцов. Далее реакционную смесь охлаждают до температуры отжига праймеров с матричной ДНК (37–65o). В результате праймеры связываются с комплементарными им местами на матрице и с этого момента начинают служить затравками для синтеза Taq-полимеразой новых цепей ДНК, комплементарных каждой из цепей денатурированной матричной ДНК. Для проведения синтеза ДНК в оптимальных для Taq-полимеразы условиях температуру реакционной смеси поднимают до 72o и при такой температуре проводят элонгацию цепей вновь синтезирующейся ДНК в течение 0,5–2 мин. По окончании стадии синтеза ДНК заканчивается первый цикл ПЦР, после чего проводятся такие же второй, третий и т.д. в автоматическом режиме. По окончании третьего цикла уже образуется дискретный продукт ПЦР – фрагмент двухцепочечной ДНК, содержащий на своих 5’-концах последовательности нуклеотидов праймеров. Количество продукта ПЦР в реакционной смеси после завершения каждого цикла удваивается и, следовательно, по мере прохождения реакции экспоненциально возрастает, достигая нескольких микрограммов в реакционной смеси объемом 25–50 мкл. По окончании ПЦР содержимое реакционной смеси анализируют электрофорезом в агарозном геле в присутствии бромистого этидия, где продукт реакции выявляется в УФ-свете. Продукт ПЦР можно выделить из агарозного геля в чистом виде и работать с ним, как с обычным фрагментом двухцепочечной ДНК, т.е. гидролизовать рестриктазами, клонировать в плазмидных векторах по "липким" и "тупым" концам, секвенировать или использовать в качестве зондов при гибридизации. С помощью ПЦР можно амплифицировать in vitro сегменты ДНК длиной от 0,1 до 5–7 т.п.о. и более, а для получения положительного результата достаточно присутствия в реакционной смеси одной–двух копий амплифицируемой последовательности нуклеотидов (например геномной ДНК, содержащейся в одной–двух соматических клетках). При этом не возникает необходимости в тщательной очистке матрицы, так как большинство попадающих в реакционную смесь белков и ферментов инактивируется в первых же циклах ПЦР и не оказывает влияния на протекание реакции при высоких температурах. Благодаря таким особенностям, как простота постановки, высокая чувствительность и воспроизводимость, ПЦР в последнее время получила широкое распространение в фундаментальных и прикладных исследованиях по молекулярной биологии и генетике. Возможность амплификации любого сегмента ДНК, последовательность нуклеотидов которого известна, и получение его по завершении ПЦР в гомогенном виде и препаративном количестве делают ПЦР альтернативным методом молекулярного клонирования коротких фрагментов ДНК. При этом не возникает необходимости в применении тех сложных методических приемов, которые используют в генной инженерии при обычном клонировании. 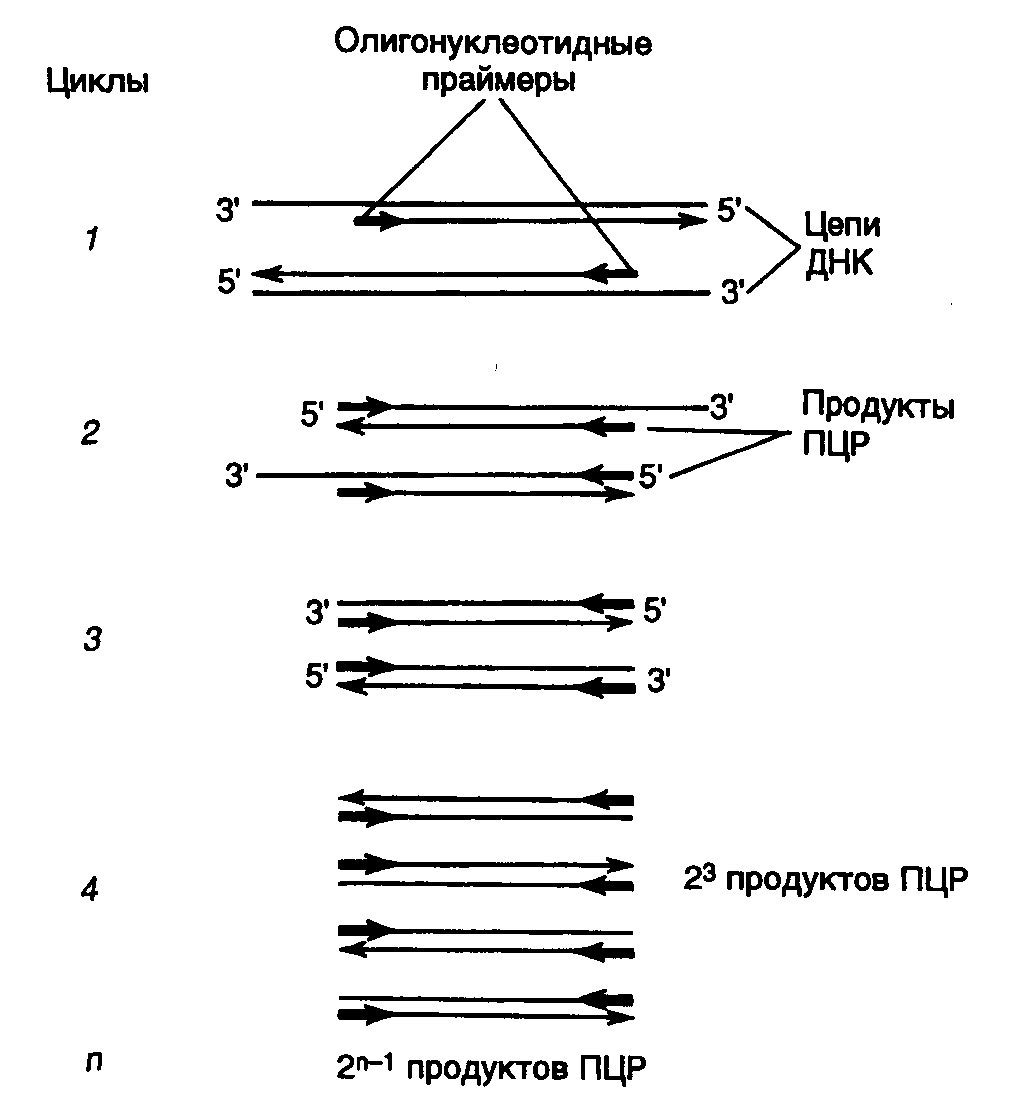 Рис. II.4. Полимеразная цепная реакция (ПЦР) Поскольку специфичность ПЦР зависит главным образом от соответствия последовательности нуклеотидов праймеров первичной структуре амплифицируемых фрагментов ДНК, эта специфичность приближается к абсолютной при повышении длины праймеров до 17–20 нуклеотидов. Такая высокая специфичность и чувствительность позволяют использовать ПЦР для ДНК-диагностики инфекционных и наследственных заболеваний человека, а также вирусоносительства в тех случаях, когда вирусом в латентной форме заражены лишь отдельные соматические клетки, например в случае вируса иммунодефицита человека (ВИЧ) (см. главу 11). Разработка метода ПЦР во многом расширила методические возможности молекулярной генетики, и в частности генной инженерии, причем настолько, что это кардинально изменило и усилило исследовательский потенциал многих ее направлений. Точность амплификации ДНК термостабильными ДНК-полимеразами является особенно критическим параметром в том случае, если продукты ПЦР используются далее для конструирования экспрессирующихся генов. Необходимость в уменьшении частоты мутаций стимулирует поиски новых термостабильных ДНК-полимераз, амплифицирующих ДНК с большей точностью. В табл. II.2 приведены результаты испытаний точности синтеза ДНК различными коммерческими ДНК-полимеразами. Относительно высокая точность синтеза ДНК in vitro ДНК-полимеразами Pfu и Vent обусловлена наличием у них 3’-5’-экзонуклеазной корректирующей активности. Частота ошибочно включенных нуклеотидов в результате одновременного функционирования двух разных ДНК-полимераз в смесях, применяемых для амплификации длинных сегментов ДНК (long PCR), оказывается ниже, чем при использовании Taq-полимеразы, но выше, чем для очищенной ДНК-полимеразы Pfu. При проведении аллель-специфической ПЦР (см. раздел 11.1) необходимо учитывать способность Taq-полимеразы инициировать синтез ДНК на праймерах, 3’-концевой нуклеотид которых некомплементарен матричной ДНК. При исследовании этого вопроса оказалось, что не все пары Таблица II.2 Частота ошибок при синтезе ДНК, осуществляемом термостабильными ДНК-полимеразами in vitro при проведении ПЦР в оптимальных условиях
ошибочно спаренных нуклеотидов праймера и ДНК-матрицы одинаково эффективно предотвращают синтез ДНК Taq-полимеразой. По способности направлять синтез ДНК все такие пары 3’-концевого нуклеотида праймера и соответствующего нуклеотида матричной ДНК располагаются в следующий ряд: C–C, A–G, G–A, G–G < A–A < T–C, C–T, T–T << A–C, C–A << G–T, T–G (данные фирмы "Cetus"). При этом наименее благоприятными для продолжения синтеза ДНК являются пары нуклеотидов пурин–пурин и пиримидин–пиримидин. РНК-зависимые ДНК-полимеразы (обратные транскриптазы, ревертазы). Обратные транскриптазы способны осуществлять синтез ДНК на матрице РНК, полимеризуя четыре дезоксирибонуклеозидтрифосфата, как это имеет место в случае ДНК-зависимых ДНК-полимераз. Обратные транскриптазы, так же как и ДНК-полимеразы функционируют только при наличии затравки. Широко используемая в генной инженерии обратная транскриптаза вируса миелобластоза птиц помимо полимеризующей активности обладает 5’3’- и 3’5’-экзорибонуклеазными активностями и расщепляет РНК в ДНК-РНК-гибридах по процессивному механизму. Обратные транскриптазы находят применение в синтезе двухцепочечных ДНК, комплементарных РНК (особенно мРНК), для последующего ее клонирования в плазмидных векторах при получении библиотек (клонотек) кДНК (см. раздел 7.3). Обратные транскриптазы, подобно ДНК-полимеразам, могут быть использованы для введения радиоактивной или флуоресцентной метки в ДНК-зонды в составе соответствующим образом меченных дезоксирибонуклеозидтрифосфатов. Недавно способность синтезировать ДНК на матрице РНК в определенных условиях была продемонстрирована для термостабильной ДНК-полимеразы Thermus thermophilus. Это позволяет использовать ее для прямого обнаружения специфических РНК в биологических образцах методом ПЦР. Современные модификации такого подхода дают возможность в одной реакционной смеси (и пробирке) синтезировать в реакции обратной транскрипции небольшое число копий амплифицируемого фрагмента ДНК на матрице РНК, которые сразу же используются тем же ферментом в качестве матрицы в обычной ПЦР (one tube PCR). 7.1.4.Другие ферментыСреди других многочисленных ферментов, используемых в генной инженерии, прежде всего следует упомянуть полинуклеотидкиназы, которые осуществляют перенос -фосфатных групп ATP на 5’-OH группы ДНК или РНК. Полинуклеотидкиназа бактериофага Т4 широко используется для введения радиоактивной метки в ДНК или РНК с целью получения радиоактивно меченных зондов или секвенирования нуклеиновых кислот. Терминальная трансфераза из тимуса теленка (терминальная дезоксирибонуклеотидилтрансфераза), осуществляющая последовательное присоединение дезоксирибонуклеозидмонофосфатов из пула дезоксирибонуклеозидтрифосфатов к 3’-OH-группам молекул ДНК, используется для введения радиоактивной метки в составе меченых нуклеотидов в 3’-концы ДНК, а также присоединения к 3’-концам фрагментов ДНК (особенно кДНК) протяженных гомополимерных последовательностей нуклеотидов (коннекторов) для последующего их клонирования. Щелочные фосфатазы бактерий (BAP) и кишечника теленка (CIAP) катализируют удаление 5’-фосфатных групп ДНК или РНК, а также расщепление макроэргических связей рибо- и дезоксирибонуклеозидтрифосфатов. Их используют при подготовке фрагментов нуклеиновых кислот к введению 5’-концевой радиоактивной метки 32Р, а также для предотвращения лигирования векторных молекул ДНК самих на себя. Как уже упоминалось выше, ДНК-лигаза способна образовывать фосфодиэфирные связи в одноцепочечных разрывах лишь при наличии в них 5'-концевого фосфата. Удаление 5'-концевых фосфатных групп молекул вектора, лианеризованных с помощью одной рестриктазы во время его подготовки для клонирования соответствующего фрагмента ДНК, предотвращает образование кольцевых молекул вектора (без вставки), а также его олигомеров во время лигирования с клонируемой последовательностью. Необходимые для лигирования со вставкой фосфатные группы содержатся в самих клонируемых фрагментах ДНК, а остающиеся в результате неполного лигирования два одноцепочечных разрыва репарируются in vivo после введения вектора со вставкой в бактериальные клетки. В заключение следует рассмотреть некоторые нуклеазы, часто используемые в генной инженерии. Нуклеазы – это гидролитические ферменты, расщепляющие нуклеиновые кислоты. По механизму расщепления субстратов нуклеазы разделяют на экзо- и эндонуклеазы. Экзонуклеазы осуществляют последовательное отщепление моно- или небольших олигонуклеотидов с концов молекул ДНК или РНК, тогда как эндонуклеазы вносят в молекулы нуклеиновых кислот внутренние разрывы. В частности, к эндонуклеазам относятся многочисленные рестриктазы, рассмотренные выше. Некоторые нуклеазы обладают более широкой специфичностью и могут гидролизовать как РНК, так и ДНК, а также одновременно проявлять эндо- и экзонуклеазную активности. Нуклеаза Bal31 из Alteramonias aspejiana последовательно отщепляет отдельные моно- и олигонуклеотиды с 5’- и 3’-концов двухцепочечных ДНК, укорачивая обе цепи ДНК приблизительно с равной скоростью. При этом нуклеаза Bal31 гидролизует и одноцепочечные ДНК. Экзонуклеаза IIIE. coli катализирует последовательное отщепление 5’-нуклеотидов из двухцепочечных ДНК в направлении 3’5’. Фермент обладает эндонуклеазной активностью по отношению к апуринизированной ДНК, активностью РНКазы H (гидролиз РНК в РНК-ДНК-гибридах) и 3’-фосфатазной активностью. Экзонуклеаза фага катализирует последовательное отщепление 5’-мононуклеотидов в двухцепочечных ДНК при наличии в них 5’-концевых фосфатных групп. Ее используют для получения одноцепочечных молекул ДНК с целью их последующего секвенирования. Нуклеаза S1 из Aspergillus orizae специфически расщепляет одноцепочечные молекулы ДНК с образованием 5’-фосфорилированных моно- и олигонуклеотидов. Те же свойства присущи и нуклеазе золотистой фасоли (mung bean). Панкреатическая_рибонуклеаза_A'>Панкреатическая рибонуклеаза A (РНКаза A) обладает активностью эндорибонуклеазы, специфически расщепляющей фосфодиэфирные связи, образованные пиримидиновыми нуклеотидами. Продуктами гидролиза являются 3’-фосфорилированные пиримидиновые мононуклеотиды и олигонуклеотиды, содержащие концевые пиримидин-3’-монофосфаты. ПанкреатическаядезоксирибонуклеазаI (ДНКаза I) представляет собой эндонуклеазу, гидролизующую как одно-, так и двухцепочечную ДНК с образованием сложной смеси моно- и олигонуклеотидов, содержащих 5’-фосфатные группы. В присутствии ионов Mg2+ ДНКаза I независимо атакует каждую цепь ДНК, при этом места разрывов располагаются статистически вдоль молекулы, а в присутствии ионов Mn2+ расщепляет обе цепи ДНК приблизительно напротив друг друга. Рассмотренные ферменты не исчерпывают всего списка белков, используемых в генной инженерии. Особенности применения многих из этих ферментов для решения конкретных генно-инженерных задач будут не раз обсуждаться при дальнейшем изложении принципов генной инженерии. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
