|
|
Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
Во всех предыдущих рассуждениях речь шла о глобальной защите функционально значимых участков гипотетического генома от спонтанных и индуцируемых мутаций некодирующими последовательностями нуклеотидов. При этом для простоты рассуждений предполагалось, что распределение нуклеотидов геномной ДНК и самих мутагенов в интерфазном ядре гомогенно. В реальном геноме эукариот распределение последовательностей нуклеотидов геномной ДНК в интерфазном ядре далеко не однородно. Достаточно вспомнить, что геном эукариот всегда представлен несколькими хромосомами (в частности диплоидный геном человека заключен в 46 хромосомах), ДНК каждой пары из которых обладает уникальными первичной и пространственной структурами. ДНК индивидуальных хромосом в интерфазном ядре компартментализована, а плотность упаковки ДНК в различных участках индивидуальных интерфазных хромосом неравномерна.
В этом отношении наиболее изучена и показательна хромомерная организация гигантских политенных хромосом, образующихся в клетках некоторых типов животных и растений. Для таких хромосом в интерфазном ядре характерны различные уровни компактизации хроматина вдоль хроматид, что морфологически проявляется в формировании визуально обнаруживаемых, поперечно расположенных дисков и междисков. В этих хромосомах выделяют три уровня компактизации ДНК. Дискам (неактивным районам политенных хромосом) свойственен максимальный 100–380-кратный уровень компактизации хроматина по отношению к свободной ДНК. С началом транскрипции, т.е. при переходе участков интерфазных хромосом в активное состояние, уровень компактизации понижается до 40-кратного, и ДНК декомпактизуется еще сильнее в условиях максимальной транскрипции, когда молекулы РНК-полимеразы движутся вдоль ДНК одна за другой на небольшом расстоянии друг от друга, как это имеет место, например в кольцах Бальбиани. Уровень упаковки ДНК в хроматине метафазных хромосом самый высокий: исходная длина ДНК в этом случае уменьшается в 6000–7000 раз.
Следует подчеркнуть, что компактизация ДНК вдоль хроматид в интерфазных политенных хромосомах высоко упорядочена в индивидуальных хромосомах генома и обладает абсолютной видовой специфичностью. Это позволяет использовать рисунок поперечной исчерченности индивидуальных политенных хромосом для их идентификации и физического картирования генов. В настоящее время установлено, что некоторые большие гены Drosophila (например ген dunce, кодирующий фосфодиэстеразу циклического АМР, а также гены E74 и Shaker) локализованы в нескольких дисках и междисках и, следовательно, неравномерно компактизованы по своей длине. Различные уровни упаковки ДНК наблюдают в разных районах одних и тех же политенных хромосом, и для этих уровней, по-видимому, характерны более тонкие градации, чем те, которые выявляются при визуальных наблюдениях в виде поперечной исчерченности политенных хромосом.
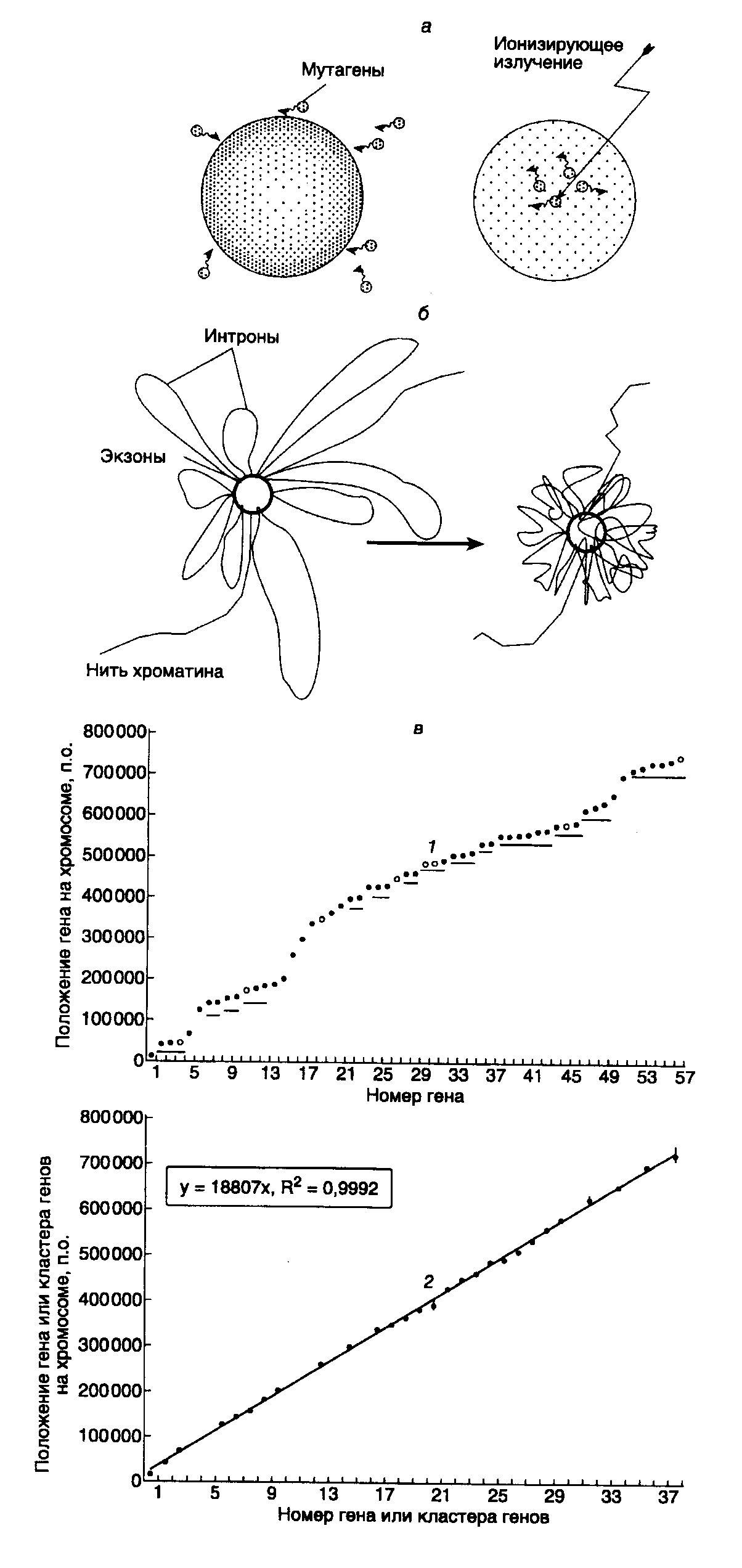
Рис. I.64. Способы проникновения мутагенов в отдельные микрокомпартменты ядра (а), возможная роль интронов в дифференциальной защите генов (б) и расположение летальных генов на хромосоме 2 дрожжей (в)
а – мутагены, образующиеся вне микрокомпартмента, содержащего ДНК (слева) и внутри него (справа); б – гипотетический ген в виде "розетки" с интронами в виде петель, окружающих объединенные экзоны. Слева – структура гена с расправленными петлями, справа – их гипотетическая реальная пространственная структура, образующая защитную оболочку вокруг экзонов; в – расположение известных жизненно важных генов на хромосоме 2 без предварительной обработки исходных данных (1), а также после обработки с учетом кластеров и гипотетических летальных генов (2). Гены, расстояние между которыми <10 т.п.о., объединяли в кластеры (подчеркнуты), которые на графике 2 изображали в виде отдельных точек с доверительными интервалами, лежащими между первым и последним нуклеотидами кластера. По мере необходимости вводили гипотетические гены (пропуски между точками на графике 2). Указаны коэффициент детерминированности R2, описывающий точность аппроксимации полученных данных к линейной функции, и ее уравнение
У большинства хромосом соматических клеток эукариот не происходит политенизации ДНК, и соответствующая часть геномной ДНК заключена в одной хроматиде. Тем не менее, несмотря на то что в интерфазных ядрах большинства соматических клеток визуально не выявляется четкая хромомерная структура индивидуальных хромосом, нет основания полагать, что их хроматиды организованы принципиально иначе, чем в политенных хромосомах. Действительно, у всех метафазных хромосом соматических клеток животных после их гистохимической окраски выявляется высокоспецифичная поперечная исчерченность (бэндинг), и этот рисунок может быть следствием компактизации высокоупорядоченных хромомерных структур, исходно присутствующих в интерфазных хромосомах. Если такое предположение верно, то у любых интерфазных хромосом соматических клеток эукариот расположение хромомеров вдоль хроматид, а, следовательно, и уровни компактизации ДНК видоспецифичны и являются постоянной характеристикой индивидуальных хромосом и биологических видов в целом.
Рассматривая индивидуальную интерфазную хромосому как потенциальную мишень для мутагенов, можно заключить, что защищенность генетической информации ее индивидуальных локусов от их действия будет прямо пропорциональна уровням компактизации заключенной в них ДНК, т.е. концентрации последовательностей нуклеотидов на единицу ядерного объема, занимаемого этими участками генома. Рассмотрим подробнее процессы, которые могут происходить в микрокомпартментах (отдельных хромомерах) хромосом при их контакте с химическими внутриядерными мутагенами (рис. I.64,а). Как и в случае целых ядер эукариотических клеток, химические мутагены поступают в микрокомпартменты двумя различными путями: образуясь непосредственно внутри них, например под действием ионизирующего излучения, и путем радиальной диффузии через поверхность микрокомпартментов (индивидуальных хромомеров). В первом случае частота мутаций, возникающих на участке заключенной в микрокомпартмент хромосомной ДНК в результате контактов с образующимися здесь же химическими мутагенами, будет обратно пропорциональна концентрации этой ДНК в микрокомпартменте, т.е. уровню ее компактизации в хромомере. Действительно, в продуктивных (приводящих к мутациям) взаимодействиях нуклеотидов ДНК с мутагенами участвует доля нуклеотидов ДНК, пропорциональная количеству нуклеотидов, контактирующих c мутагенами. Эта доля уменьшается при увеличении концентрации нуклеотидов-акцепторов мутагенов в микрокомпартменте. При условии взаимодействия всех k мутагенов с K нуклеотидами рассматриваемого микрокомпартмента (с последующим образованием аддуктов нуклеотид-мутаген и мутаций) частота мутаций F на данном участке ДНК будет равна:
F = 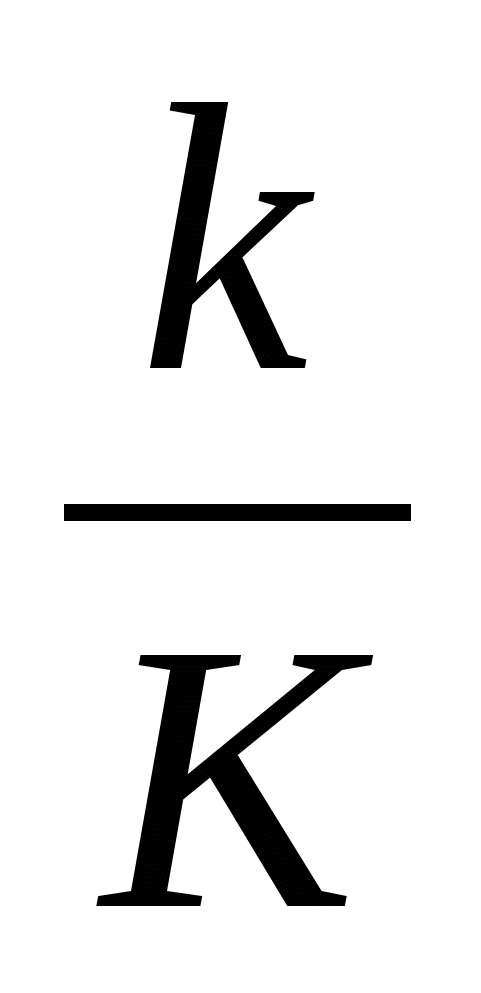 . .
В более общем виде это выражение можно записать, как:
F = 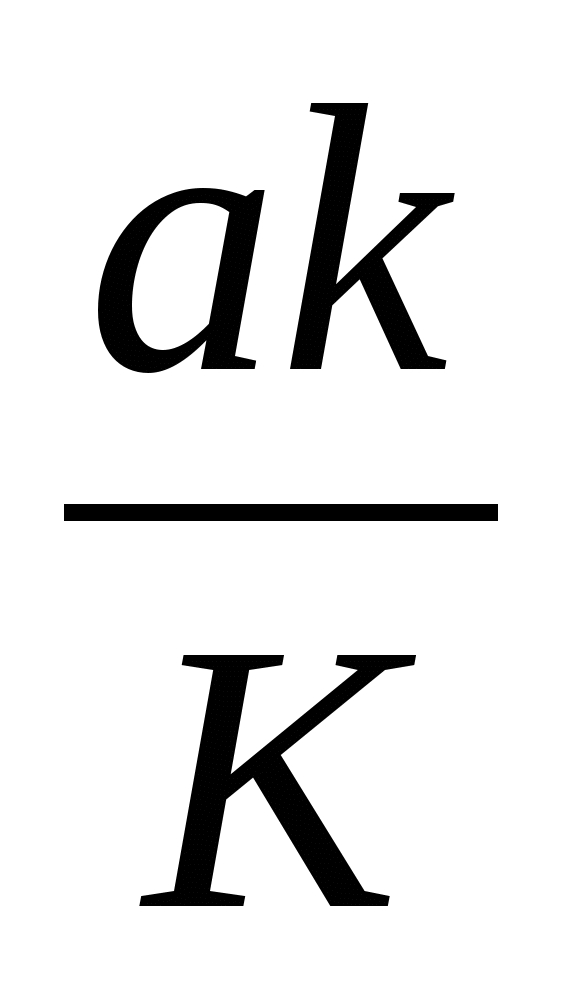 , (4), , (4),
где a – коэффициент эффективности взаимодействия мутагенов с нуклеотидами-акцепторами (0 < a 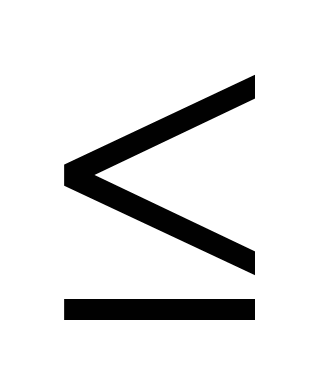 1). Если количество нуклеотидов и молекул мутагенов в индивидуальном микрокомпартменте выразить через их концентрации в нем (соответственно C и c), то выражение (4) примет вид: 1). Если количество нуклеотидов и молекул мутагенов в индивидуальном микрокомпартменте выразить через их концентрации в нем (соответственно C и c), то выражение (4) примет вид:
F = 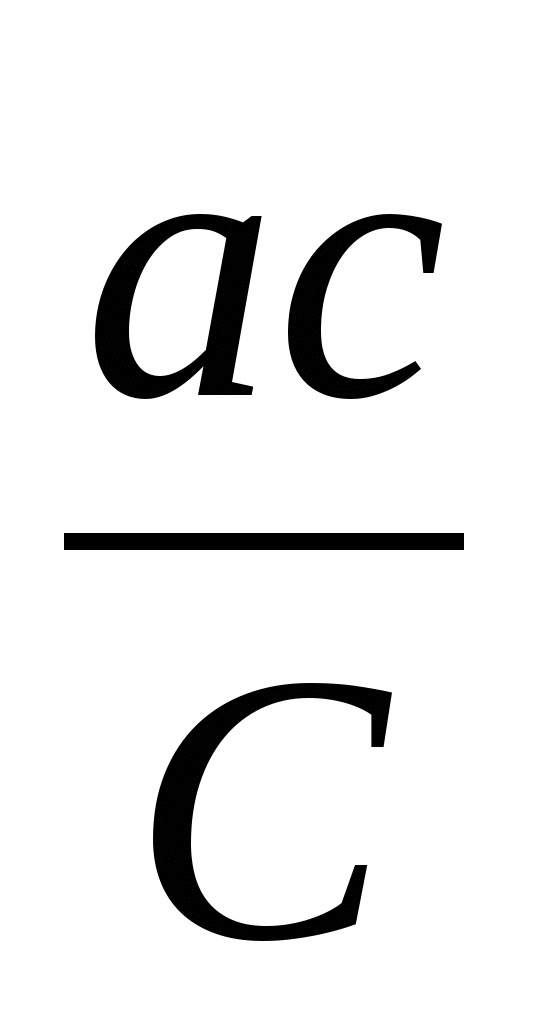 , ,
поскольку по определению k = cV, а K = CV (V – объем микрокомпартмента, занимаемого индивидуальным хромомером).
Если предположить, что стационарная концентрация мутагенов, образующихся внутри интерфазного ядра эукариотических клеток, одинакова во всех его частях, то частота мутаций, вызываемых такими агентами в индивидуальных хромомерах эукариотических хромосом, будет обратно пропорциональна концентрации нуклеотидов ДНК этих хромомеров в соответствующих микрокомпартментах, т.е. обратно пропорциональна плотности упаковки ДНК в хромомере. Следовательно, локальная плотность упаковки цепей ДНК в интерфазном ядре эукариотических клеток может быть важным фактором, определяющим частоту мутаций в соответствующих генетических локусах. При этом необходимо учитывать, что белки являются неотъемлемой частью хроматина эукариотических клеток, и они также могут оказывать влияние на частоту мутаций в индивидуальных хромомерах, затрудняя доступ мутагенов к нуклеотидам ДНК.
Судьба мутагенов, поступающих в ядро эукариотической клетки из цитоплазмы в результате радиальной диффузии, складывается иначе (см. рис. I.64,а, слева). По-видимому, значительная их часть взаимодействует с нуклеотидами ДНК, расположенной на периферии ядра или внутриядерных хромомеров, и степень защиты как ядра в целом, так и его отдельных микрокомпартментов прямо зависит от плотности такой защитной оболочки. Вторым фактором, регулирующим глубину проникновения мутагенов в ядро и его микрокомпартменты, является реакционноспособность самих мутагенов. Данный параметр, ранее обозначенный как коэффициент эффективности взаимодействия мутагенов с нуклеотидами a (уравнение (4)), определяет время жизни мутагена в ядре, т.е. как скоро молекула мутагена прореагирует с потенциальными нуклеотидами-акцепторами, которые мутаген встречает в процессе диффузии внутри ядра. Третьим фактором, от которого зависит эффективность защиты кодирующих жизненно важных последовательностей нуклеотидов генома от мутаций, вызываемых такими мутагенами, является пространственное расположение самих внутриядерных последовательностей. Очевидно, что вероятность встречи с мутагенами и взаимодействия с ними больше у нуклеотидов последовательностей, локализованных на периферии ядра или хроматиновых доменов – хромомеров. С учетом этого фактора можно полагать, что максимальная защита имела бы место в том случае, если бы мутагены первыми встречали избыточные некодирующие последовательности, мутации в которых нейтральны в отношении влияния на жизнеспособность клеток многоклеточного эукариотического организма.
В последнее время появляется все больше экспериментальных данных, свидетельствующих о высокоупорядоченном распределении специфических последовательностей нуклеотидов в интерфазных ядрах эукариот. Одна группа данных такого рода, связанных с упорядоченной конденсацией нитей ДНК вдоль хроматид индивидуальных интерфазных хромосом, была уже обсуждена выше. Помимо этого, активно рассматривается модель петельно-доменной организации генов в эукариотических хромосомах. Неслучайное распределение MAR- и SAR-последовательностей в геномной ДНК эукариот и их ассоциация с белками ядерного матрикса (скэффолда) в интерфазе клеточного цикла, по-видимому, весьма специфически контролируют пространственное расположение протяженных участков интерфазных хромосом в ядрах. Кроме того, на более низком (хромомерном) уровне компактизации интерфазных хромосом также обнаружены специфические способы укладки ДНК в виде больших и малых петель, вероятно, относящихся к хромомерам и "розеткам" соответственно (см. рис. I.64,б). Не исключена возможность, что в соответствии с моделью Н.А. Резника и соавторов (1991 г.) образование розеток из ДНП-петель специфически отражает интрон-экзонную структуру конкретных генов. Если такая модель соответствует действительности, то петли интронов генов, заключенных в розетки, могут создавать специфическую защитную оболочку, предохраняющую экзоны генов от контакта с мутагенами. В этой связи соотношение суммарных размеров интронов и экзонов индивидуальных генов может оказаться существенным параметром, характеризующим уровень защищенности функционально значимых участков генов от химического мутагенеза. Чем больше отношение суммарной длины интронов к суммарной длине экзонов в конкретном гене, тем более плотную защитную оболочку интроны могли бы сформировать вокруг компактизованных экзонов. Такое соотношение может указывать на уровень защищенности конкретных генов (или даже их частей) от химических мутагенов.
Описанные выше структурные особенности организации генетического материала позволяют предполагать разную и генетически детерминированную доступность индивидуальных участков интерфазных хромосом для химических мутагенов. Имеются, по крайней мере, три группы экспериментальных данных, указывающих на то, что различные участки одного и того же генома спонтанно изменяются с помощью мутаций с разной скоростью. Прежде всего, это прямые экспериментальные указания на неодинаковую мутабильность как различных генов одного и того же генотипа, так и одного и того же гена в генотипах разных биологических видов.
При другом подходе к исследованию этой проблемы путем компьютерного анализа баз данных последовательностей нуклеотидов было установлено, что степень эволюционной дивергированности конкретных участков генома у разных видов млекопитающих непостоянна и может изменяться от локуса к локусу. Скорость накопления замен нуклеотидов в конкретных локусах приблизительно одинакова как для кодирующих последовательностей нуклеотидов генов (экзонов), так и для соседствующих с ними некодирующих последовательностей, казалось бы, не подверженных давлению отбора. Этот, на первый взгляд, странный результат вполне естественно объясняется в рамках предлагаемой модели дифференциальной защиты различных хромосомных локусов от спонтанных мутаций как следствие упорядоченного гетерогенного распределения геномной ДНК внутри интерфазных ядер. Действительно, рядом расположенные последовательности должны быть одинаково защищены от мутагенов независимо от их функциональной нагрузки. Такой механизм защиты конкретных генетических локусов от спонтанных и индуцированных мутаций мог бы приводить к мозаичной эволюции генома, предполагаемой в модели Б.Ф.Купа.
Наличие в геноме филогенетически консервативных последовательностей нуклеотидов, как правило, принято объяснять жестким давлением отбора на эти последовательности в процессе эволюции. Например, к числу наиболее консервативных из известных белков относятся гистоны H3 и H4, у которых одна замена на 100 аминокислотных остатков, по-видимому, эволюционно фиксируется в полипептидной цепи не чаще чем в несколько сотен миллионов лет. На противоположном полюсе находятся иммуноглобулины и фибринопептиды, у которых такие мутационные изменения фиксируются в геноме в сотни раз быстрее. В соответствии с традиционной точкой зрения медленно и быстро эволюционирующие белки различаются по содержанию в них функционально значимых сайтов, изменение которых под действием мутаций несовместимо с жизнью. Можно предполагать, однако, что селективная консервативность их генов обеспечивается и структурными особенностями соответствующих локусов генома конкретных видов организмов. Функционирование такого механизма предотвращало бы тяжелые последствия в виде летальных исходов, которыми приходится расплачиваться организмам и соматическим клеткам за мутации в соответствующих локусах, если бы те возникали с такой же частотой, что и в функционально незначимых частях генома. Подобный механизм мог бы быть эффективным в селективной защите от мутаций генетических локусов, содержащих множественные копии генов, так как избыточность генетической информации создает особенно благоприятную почву для дивергенции гомологичных последовательностей. Действительно, дупликации генов и их последующая дивергенция рассматриваются в настоящее время как ключевые механизмы эволюционного процесса.
Еще одна группа данных, свидетельствующих в пользу модели дифференциальной защиты отдельных генетических локусов от спонтанных мутаций, была получена при анализе скоростей образования мутаций в трансгенах, интегрированных в различные участки генома организма-хозяина. Значительную вариабельность в скоростях мутирования локусов мини- и микросателлитов, обнаруженную в геноме млекопитающих и проявляющуюся в различиях уровней их внутрипопуляционного полиморфизма, также частично можно объяснить с помощью обсуждаемой модели.
Таким образом, видоспецифическое пространственное расположение ДНК отдельных генетических локусов интерфазных хромосом создает материальную основу для их дифференциальной чувствительности по отношению к химическим мутагенам экзогенного и эндогенного происхождения. Избирательная доступность индивидуальных нуклеотидов ДНК таких локусов может детерминировать относительную частоту спонтанных мутаций в отдельных локусах геномной ДНК эукариот. Все это может иметь большое значение для онтогенетического и филогенетического развития биологических видов.
5.3.4.Высокоупорядоченное расположение летальных генов на хромосомах
Если гипотеза о наличии внутри ядер генетически детерминированных, пространственно упорядоченных участков геномной ДНК является верной, то это влечет за собой важное следствие. В этом случае в процессе эволюционных преобразований геномов их участки, максимально защищенные от действия химических мутагенов, в результате транслокаций и других хромосомных перестроек могли быть заняты генами, функциональная целостность которых особенно важна для выживания клеток или организмов. Такими генами являются, прежде всего, жизненно важные (летальные) гены, инактивация которых под действием мутаций приводит к гибели клеток. Действительно, организмы, у которых критические гены максимально защищены от действия мутагенов, должны были бы обладать эволюционным преимуществом перед организмами, геном которых не обладает этими свойствами, и в первую очередь сохраняться естественным отбором. Если это так, то летальные гены маркируют в геноме современных организмов участки, максимально благоприятные для их целостности, т.е. наиболее защищенные от действия мутагенов, наиболее доступные для белков системы репарации и т.п. В этой связи можно предполагать, что линейное расположение жизненно важных генов вдоль ДНК отражает особенности пространственной организации ДНК в ядрах эукариот на высшем уровне.
Используя эти рассуждения в качестве рабочей гипотезы, мы исследовали расположение жизненно важных генов на всех 16 хромосомах дрожжей Saccharomyces cerevisiae, первичная структура которых в настоящее время полностью определена. Для этого объекта точно известно положение на хромосомах многих жизненно важных генов. В ходе исследований было установлено, что на всех хромосомах дрожжей имеются участки, в которых известные на момент исследования летальные гены (или их кластеры) расположены периодически (на равном расстоянии друг от друга). В качестве примера рассмотрим положение жизненно важных генов на одной из хромосом.
Хромосома 2 является одной из пяти наиболее крупных хромосом дрожжей, длина которой составляет
813 т.п.о. Хромосома содержит 429 открытых рамок считывания (ОРС), среди которых ко времени проведения анализа 57 были определены как жизненно важные гены, 193 – как нелетальные, а указанные свойства остальных 179 ОРС в настоящее время неизвестны. Следовательно, количество известных нежизненно важных генов хромосомы 2 приблизительно в 3 раза превышает число известных жизненно важных, и это соотношение к настоящему времени соблюдается у всех хромосом дрожжей.
Летальные гены расположены на хромосоме неравномерно. Имеются места их скопления, особенно ярко выраженные в центральной части хромосомы, а также участки, в которых они встречаются не так часто (см. рис. I.64,в,1). Даже без предварительной обработки данных можно было видеть дискретность расположения летальных генов и их кластеров, в которые объединяли гены, если расстояние между ними было меньше 10 т.п.о. (подчеркнуты на рисунке). После представления каждой группы генов отдельного кластера в виде одной точки (с доверительными интервалами, расположенными между началами и концами кластеров) и введения в график нескольких свободных мест для гипотетических, пока неизвестных генов (или их кластеров) периодический характер распределения кластеров летальных генов на хромосоме 2 становится очевидным (см. рис. I.64,в,2). Видно, что места предпочтительного расположения летальных генов или их кластеров расположены на хромосоме 2 периодически. При этом период расположения генов или их кластеров (повторяющееся равное расстояние между следующими друг за другом генами) численно равен выраженному в парах оснований угловому коэффициенту линейной функции, которая описывает последовательность координат генов на графиках.
Таким образом, после минимальных преобразований исходных данных, потребовавших введения в общей сложности девяти гипотетических генов или их кластеров (места, в которых отсутствуют точки на графике), а также выделения 14 групп кластеров генов, последовательность координат летальных генов и их кластеров удовлетворительно описывается линейной функцией с угловым коэффициентом 18 807 (R2 = 0,9992). Это указывает на периодический характер расположения летальных генов вдоль всей хромосомы 2 с периодом
18,8 т.п.о.
Разработанная нами методика анализа летальных генов, кратко рассмотренная на примере хромосомы 2, была использована для исследования остальных хромосом S. cerevisiae. Оказалось, что на каждой из исследованных хромосом можно выделить участки с периодическим расположением летальных генов. По характеру распределения жизненно важных генов исследованные хромосомы разделяются на две группы. В одной из них (хромосомы 1, 2, 5–7, 9, 11, 12 и 16) летальные гены (и их кластеры) образуют непрерывную последовательность и распределены равномерно по всей длине хромосом. При этом у семи из девяти хромосом этой группы периоды расположения генов очень близки и лежат в пределах 22,0–25,8 т.п.о.
Ко второй группе относятся хромосомы, на которых летальные гены образуют несколько участков с разной периодичностью. Для относящихся к этой группе хромосом 2, 10 и 14 характерны два участка периодически расположенных летальных генов. При этом участки хромосомы 3, обладающие очень близкими периодами, локализованы симметрично относительно центра хромосомы, в окрестностях которого летальные гены пока не обнаружены. Равные по своим размерам хромосомы 10 и 14 обладают похожим строением в отношении анализируемого признака: за участком с меньшей периодичностью следует область хромосомы, на которой расстояние между летальными генами или их кластерами больше.
На хромосомах 4, 8 и 13 можно выделить по три области с периодически расположенными летальными генами, структура которых очень похожа. В этом случае области с меньшими периодами фланкируют участки хромосом, на которых расстояния между периодически расположенными летальными генами больше. Интересно, что на хромосоме 8 близкие по периодичности концевые участки (периоды 22,3 и 23,7 т.п.о.) расположены симметрично относительно центральной области хромосомы, для которой характерен приблизительно вдвое больший период чередования жизненно важных генов (40,9 т.п.о.). Не исключено, что по мере открытия новых летальных генов в центральной части этой хромосомы все три участка сольются в единую область, периодичность расположения летальных генов в которой будет близка таковой в отмеченных концевых участках (22–23 т.п.о.).
Для крупной хромосомы 15 характерно наличие пяти участков с периодически расположенными летальными генами. И на этот раз периоды участков 1, 3 и 5 очень близки (20,5; 23,0 и 23,9 т.п.о. соответственно). В то же время расстояния между периодически расположенными жизненно важными генами этой хромосомы на участке 2 приблизительно вдвое больше (46,2 т.п.о.).
Несмотря на то что точные числовые значения периодов в расположении летальных генов различаются как между хромосомами, так и между конкретными участками индивидуальных хромосом дрожжей, складывается впечатление об универсальном характере расположения анализируемых летальных генов. Действительно, среди 29 обнаруженных участков с периодическим расположением летальных генов на 16 исследованных хромосомах у 17 из них значения периодов лежат в пределах 19,7–25,8 т.п.о., а из оставшихся 12, по крайней мере, три значения могут рассматриваться как кратные им, т.е. они подтверждают ту же структурную закономерность. Обнаруженная периодичность в расположении жизненно важных генов хромосом дрожжей может указывать на наличие в интерфазных ядрах дрожжей периодически повторяющихся пространственных структур хроматина высокого порядка, что может создавать особые биохимические условия для находящихся в них генов, например иметь отношение к защите жизненно важных генов от мутаций, как физически, так и обеспечивая эффективное функционирование ферментов системы репарации.
Периодичность расположения жизненно важных генов на хромосомах дрожжей как возможное отражение пространственной структуры хроматина. Существование информационных макромолекул, особенно таких гигантских, как молекулы ДНК, полностью зависит от их упорядоченной пространственной структуры. Последовательные циклы компактизации и декомпактизации хроматина сопровождают каждое деление эукариотических клеток и являются одним из самых универсальных и распространенных генетических процессов в живой природе. Точность и эффективность этого процесса очень высоки. Если исходная пространственная структура хроматина в интерфазных ядрах еще во многом остается непонятной, то структура метафазных хромосом, выявляемая на цитогенетическом уровне, является консервативным видоспецифическим признаком. Последние модели строения метафазных хромосом указывают на наличие у них центрального остова, включающего в себя тандемно повторяющиеся MAR/SAR-последовательности, и упорядоченных боковых петель хроматина. Трудно представить себе, чтобы имеющиеся связи между участками хроматина, сближенными в метафазных хромосомах, полностью утрачивались при его декомпактизации в интерфазе клеточного цикла, поскольку это должно было бы затруднять и замедлять его циклически повторяющуюся сборку в начале каждого митоза. Одним из указаний на сохранение таких связей является наличие в интерфазных ядрах особых хромосомных зон, занимаемых индивидуальными декомпактизованными хромосомами, которые не перемешиваются друг с другом.
Основа пространственной упорядоченности ДНК в составе хроматина заложена в ее первичной структуре. Как известно, монотонно следующие друг за другом четыре азотистых основания ДНК образуют правильную двойную спираль, шаг которой в случае B-формы ДНК составляет 10,5 нуклеотидов на виток двойной спирали. Именно такая монотонная организация молекулы ДНК в конечном итоге дает возможность формироваться на ней, как на матрице и прямом участнике процесса, периодически повторяющихся нуклеосом. На этом первом уровне пространственной организации хроматина так называемые коровые частицы нуклеосом (тетрамер гистонов H3/H4, фланкированный димерами гистонов H2A/H2B, с закрученным вокруг них участком ДНК длиной в 146 п.о.) разделены участками линкерной ДНК длиной
50 п.о. Особенности пространственной структуры хроматина на более высоких уровнях (соленоид и петельно-доменный уровни компактизации хроматина) до конца не ясны и по-прежнему остаются предметом дискуссий. Имеющиеся экспериментальные данные указывают на существование периодически повторяющихся пространственных структур и на высших уровнях упаковки интерфазного хроматина.
Ограниченная инкубация нативного хроматина животных и растений с нуклеазами позволяет обнаруживать с помощью электрофореза в импульсном электрическом поле образование дискретных фрагментов ДНК двух классов: крупных, длиной
300 т.п.о. и более коротких –
50 т.п.о. Использование топоизомеразы для расщепления ДНК в основаниях петель, ассоциированных с ядерным матриксом, приводит к накоплению фрагментов ДНК приблизительно того же размера. Наконец, деградация ДНК на ранних стадиях апоптоза начинается с образования аналогичных по размерам фрагментов геномной ДНК. К сожалению, соответствующие данные относительно пространственной организации хроматина дрожжей мне неизвестны. Помимо выше отмеченных факторов материальной основной формирования периодически организованных пространственных структур хроматина могут быть и повторяющиеся последовательности нуклеотидов, в большом количестве встречающиеся в геноме высших эукариот.
Обнаруженное в ходе нашего исследования периодическое распределение летальных генов вдоль всех 16 хромосом дрожжей по-своему указывает на наличие возможной связи между пространственной структурой их хроматина и функциональной значимостью генетического материала, включенного в соответствующие последовательности. Как уже отмечалось выше, значения большинства периодов между летальными генами и/или их кластерами лежат в пределах 20–26 т.п.о., что представляет собой величину того же порядка, что и размеры фрагментов ДНК, образующихся при ограниченном нуклеазном гидролизе нативного хроматина. На мой взгляд, жизненно важные гены дрожжей маркируют места хромосом, наиболее безопасные для их существования. Поскольку наибольшую опасность для клетки представляют мутации, инактивирующие их летальные гены, места их расположения могут быть в большей степени защищены от действия химических мутагенов, с которыми организм в избытке сталкивается в процессе своей жизнедеятельности. Такую защиту для последовательностей нуклеотидов могли бы обеспечивать, например внутренние части хроматиновых глобул. Действительно, уже сам факт наличия у нативного хроматина упорядоченно расположенных участков ДНК, в большей или меньшей степени защищенных от действия нуклеаз (что и дает возможность образования характерных дискретных фрагментов ДНК), однозначно указывает на существование в хроматине последовательностей нуклеотидов, по-разному защищенных от действия мутагенов. В соответствии с вышеизложенным мы предполагаем наличие вдоль хромосом дрожжей периодически повторяющихся мест с большей или меньшей защищенностью от действия мутагенов. В зависимости от тонкой пространственной структуры хроматина в этих участках уровни защищенности последовательностей нуклеотидов от мутагенов могут варьировать от участка к участку и приводить к генетической детерминированности скоростей спонтанного мутагенеза в конкретных генетических локусах.
Возможное биологическое значение обнаруженной периодичности расположения летальных генов на хромосомах дрожжей. Хроматин всех эукариот построен в общих чертах одинаково, поэтому обнаруженные у дрожжей особенности его строения и вытекающие из этого следствия хотелось бы рассмотреть применительно и к геному высших эукариот. В этой связи необходимо обратить внимание на четыре момента развиваемой концепции, которые могут иметь общебиологическое значение.
Значительно большее разнообразие последовательностей нуклеотидов различных типов, присутствующих в геноме высших эукариот, по сравнению с геномом дрожжей, создает условия для формирования более разнообразных и богатых в функциональном отношении пространственных структур хроматина в интерфазных ядрах. Наличие же таких структур, в свою очередь, предполагает существование у высших эукариот и более тонкого контроля скоростей спонтанного мутагенеза в конкретных генетических локусах по обсуждаемому механизму. Такая разная генетическая детерминированность темпов мутационных изменений генетических локусов у биологических видов могла бы контролировать направление их возможных эволюционных преобразований и историческое развитие таксонов.
Наличие в интерфазных ядрах эукариот участков ДНК, максимально защищенных от действия мутагенов, предполагает существование в них и генетических локусов с минимальным уровнем защиты. Из этого следует, что делеции или вставки в окрестностях защищенных локусов могут сдвигать генетические локусы в менее благоприятное, с точки зрения защиты, положение на хромосоме. Для менее защищенных локусов могут возникать обратные ситуации. Следовательно, делеции или вставки, а также природный геномный полиморфизм (в частности обнаруживаемый по длинам рестрикционных фрагментов ДНК) могут быть причиной (и новым механизмом) возникновения локального мутаторного фенотипа в соматических клетках высших организмов. Известно, что мутаторный фенотип часто предшествует малигнизации клеток и сопровождает рост опухолей. Если предполагаемый нами механизм функционирует, то возникновение делеции или вставки по соседству с критическим локусом (протоонкогеном или антионкогеном), контролирующим развитие заболевания, должно переводить мутантный организм в группу риска с повышенной вероятностью изменения этого локуса под действием мутаций. Другим примером могла бы быть лейденская мутация в факторе V системы свертывания крови, ассоциированная с развитием тромбозов, которая чрезвычайно широко распространена в европейской популяции и не встречается у ориенталов. Это и другие подобные явления можно объяснить неблагоприятным пространственным расположением соответствующего генетического локуса в интерфазном ядре у индивидуумов европейской популяции, принадлежащих к группе риска, которое делает локус легко доступным для химических мутагенов или препятствует функционированию ферментов системы репарации.
Исходя из всего вышеизложенного, можно полагать, что "избыточные" последовательности генома эукариот обеспечивают необходимую пространственную структуру хроматина в интерфазных ядрах, создавая оптимальные условия для генов с точки зрения их экспрессии и защиты от мутационных изменений, что является жизненно важным фактором существования эукариот.
Интроны в генах эукариот могут обеспечивать специфическое пространственное расположение экзонов в интерфазных ядрах, оптимальное с точки зрения их защиты от мутаций и эффективности экспрессии генов. Например, делеционное удаление интронов из гена может приводить к тому, что его 5'-концевая регуляторная часть в процессе упаковки ДНК в хроматин попадет внутрь хроматиновой глобулы и станет недоступной РНК-полимеразам, факторам транскрипции и другим регуляторным белкам. В такой ситуации наиболее важными для гена становятся длины его интронов, а не их первичная структура.
5.3.5.Возможный смысл парадокса С
У организмов, находящихся на примерно одинаковых ступенях эволюционного развития, часто наблюдаются значительные вариации в размерах геномов (см. главу 1). Например, у некоторых видов рыб, относящихся к разным отрядам и подклассам, размеры геномов заметно различаются. Наименьшие геномы характерны для некоторых неродственных видов костистых рыб. В частности, у малоротой корюшки, меченосца или камбалы размер генома приблизительно в 5 раз меньше генома млекопитающих. В то же время у двоякодышащих рыб (одни из немногих выживших представителей кистеперых рыб, которые морфологически практически не изменились за миллионы лет своего существования) размер генома, по крайней мере, в 35 раз превышает размер генома плацентарных млекопитающих. Ввиду большого морфологического и физиологического сходства этих видов рыб можно предположить, что различия в размерах их геномов, главным образом, определяются относительным содержанием в них избыточных последовательностей нуклеотидов.
Развивая концепцию о стабилизирующем влиянии избыточных последовательностей нуклеотидов ДНК на генетическую информацию, заключенную в геноме многоклеточных организмов, можно предполагать, что различия в размерах геномов у близких видов многоклеточных организмов отражают существенные особенности в функционировании их генетического аппарата и его внутриклеточного окружения. У организмов с высоким содержанием избыточной ДНК могут менее эффективно функционировать ферменты репаративной системы, что, в свою очередь, усиливает (имитирует) экзогенное и эндогенное мутагенные воздействия. Действительно, эффективность функционирования систем эксцизионной репарации, по-видимому, существенно различается даже в клетках разных видов млекопитающих. Кроме того, у таких организмов могло бы быть более высоким внутриядерное содержание эндогенных мутагенов в силу видовых особенностей их метаболизма. В связи с этим весьма вероятно, что гигантский размер геномов двоякодышащих рыб и амфибий отражает одну или несколько таких особенностей функционирования их генетического аппарата и его внутриклеточного окружения. Эволюционное включение в их геном большого количества защитных избыточных последовательностей нуклеотидов могло значительно стабилизировать геном и, по-видимому, позволило этим организмам пройти морфологически неизменными через миллионы лет своего существования. С другой стороны, малый размер генома других видов может сочетаться с более эффективно работающими системами репликации и репарации, а также способствовать ускоренному видообразованию.
Таким образом, повышение точности функционирования систем репликации и репарации ДНК, с одной стороны, и увеличение размера генома за счет включения в него некодирующих последовательностей нуклеотидов, с другой, могут приводить к одному и тому же эволюционному последствию: увеличению информационной стабильности генома. Поэтому размер генома современных эукариот эволюционно оптимизирован в отношении максимально допустимой частоты мутаций, совместимых с жизнеспособностью конкретных биологических видов. Сохранение видоспецифических соотношений между кодирующими и некодирующими последовательностями генома эукариот может быть следствием естественного отбора, отсекающего крайние варианты, у которых или слишком мало, или чрезмерный избыток некодирующих последовательностей.
Эволюционное увеличение размера генома понижает требования таких видов к точности функционирования систем репарации геномной ДНК. В результате снижение давления отбора на эти ферментативные системы могло способствовать накоплению в них мутаций, уменьшающих точность функционирования таких систем. Следовательно, суммарный размер генома эукариотического организма отражает не только потребность организма в определенном количестве генетической информации для обеспечения соответствующего уровня сложности его биологической организации, но и особенности жизнедеятельности организма, связанные с интенсивностью экзогенных и эндогенных мутагенных воздействий.
Подводя итоги вышесказанному, необходимо еще раз отметить, что, по крайней мере, две особенности строения генома эукариот могут оказывать влияние на частоту мутаций, возникающих в нем в процессе репликации под действием экзогенных и эндогенных мутагенов. Во-первых, включение избыточных последовательностей нуклеотидов приводит к глобальной защите всех функционально значимых последовательностей генома от эндогенных и экзогенных мутагенов. Избыточные последовательности нуклеотидов генома эукариот весьма существенно стабилизируют геном, что, возможно, является необходимым и достаточным условием для эволюционного появления многоклеточности. Во-вторых, внутриядерная компартментализация последовательностей нуклеотидов геномной ДНК, при которой происходит специфическая упаковка нитей хроматина в индивидуальных компартментах, занимаемых хромомерами и более крупными блоками последовательностей нуклеотидов, должна также сопровождаться изменением частоты мутаций в конкретных генетических локусах пропорционально локальной внутриядерной концентрации ДНК и пространственному расположению отдельных генетических локусов друг относительно друга.
Эволюционно сложившиеся отношения между суммарными длинами экзонов и интронов в индивидуальных генах, а также уровни упаковки и пространственное расположение ДНК в отдельных генетических локусах могли бы указывать на тот максимально допустимый темп мутационных изменений экзонов, который совместим с жизнеспособностью организмов в онтогенезе. С другой стороны, эти соотношения были бы своеобразной генетической программой, предопределяющей и филогенетическое развитие видов. Действительно, селективная видоспецифическая защита отдельных генетических локусов от спонтанного и индуцированного мутагенеза должна сопровождаться преимущественным образованием мутаций в локусах, наименее защищенных некодирующими последовательностями нуклеотидов, на фоне которых и разворачиваются основные события, связанные с естественным отбором. При этом уровни защищенности отдельных генетических локусов определяют различные темпы изменений этих локусов в филогенезе разных таксономических групп организмов. Частоты спонтанных мутаций в индивидуальных генах ограничиваются достаточно узкими рамками, определяемыми пространственной структурой как самих генов, так и более протяженных генетических локусов, включающих в себя некодирующие последовательности нуклеотидов. Такие ограничения могут быть преодолены при более мощных мутагенных воздействиях, однако соотношение частот мутаций, возникающих в разных частях генов, в основном, должно сохраняться, в том числе из-за разной доступности этих частей химическим мутагенам.
Все вышеперечисленные причины могут в конечном счете определять дискретный популяционный полиморфизм и направление изменчивости фенотипов индивидуальных биологических видов, наблюдаемые в природе. В этих терминах можно было бы объяснить закон гомологических рядов Н.И. Вавилова, в соответствии с которым у родственных видов, родов и даже семейств организмов наблюдаются сходные ряды фенотипической изменчивости. Действительно, данное явление вполне естественно объясняется общностью генотипов таких таксономических групп и общностью пространственной структуры их геномов, определяющей мутабильность отдельных генетических локусов и направление эволюционных преобразований этих генов и признаков. Такая генетически детерминированная изменчивость генотипов индивидуальных биологических видов и может дать гомологические ряды фенотипических признаков родственных организмов, которые формируются направленно изменяющимися генотипами. В то же время для образования признаков, выводящих организмы из их таксономических групп, требуются более радикальные преобразования генотипов, чем точковые мутации, которые бы открывали новые участки генома для интенсивного спонтанного мутагенеза. Направленная изменчивость генотипов, определяемая пространственной структурой и составом интерфазных хромосом, должна допускать в больших популяциях одновременное образование одних и тех же мутантных фенотипических признаков у большого числа особей и ускорять процесс видообразования.
Не исключено, что еще большее, чем интроны, отношение к генетической программе филогенетического развития имеют крупные блоки повторяющихся последовательностей индивидуальных хромосом, которые окружают и в разной степени защищают от мутационных изменений участки генома, наиболее важные для видообразования и сохранения вида как такового. Анализ и картирование этих блоков в геноме многоклеточных организмов могут способствовать выявлению новых функционально значимых участков генома и их экспериментальному исследованию. Не менее интересные результаты может принести и анализ интрон-экзонной структуры известных генов, а также фланкирующих генов избыточных последовательностей по уровню защищенности индивидуальных генов от мутаций. Такой анализ может по-новому осветить генетическую значимость уже известных участков генома. С использованием аналогичного подхода могут быть выявлены новые жизненно важные гены, которые организм особенно бережно укрывает от мутаций избыточными последовательностями нуклеотидов.
Организовав геном эукариот таким изящным (но не безупречным) образом, природа сама указывает на его слабые места и возможные пути дальнейшего совершенствования. Уязвимость современного генома в отношении неблагоприятных экологических факторов (в первую очередь, антропогенных) может быть связана с тем, что в доисторические времена, когда происходила адаптивная эволюция организмов, экологическая обстановка была существенно благоприятнее. Крупные геномы гораздо более чувствительны как мишени для ионизирующих излучений, а этот фактор в те времена мог не иметь большого значения, и эволюционирующим организмам не нужно было к нему приспосабливаться. Уязвимость такого сложноорганизованного генома, как геном эукариот, заключается еще и в том, что его мутационные изменения, нарушающие пространственную организацию укладки ДНК в интерфазных ядрах, могут быть причиной возникновения мутаторного фенотипа мутантных соматических клеток. Этот фенотип, в свою очередь, может вызывать тяжелые патологические изменения организма, включая онкологические, аутоиммунные и другие тяжелые заболевания. С другой стороны, введение генно-инженерными методами генетически нейтральных последовательностей нуклеотидов, изменяющих доступность для мутагенов особенно важных генетических локусов генома, могло бы повысить устойчивость организма к мутагенным воздействиям, тем самым оградив его от многих патологий и увеличив продолжительность жизни. Такой генно-инженерный подход мог бы стать одним из элементов превентивной генотерапии.
С учетом всего сказанного вряд ли можно считать избыточные последовательности нуклеотидов эукариот "эгоистичными" геномными паразитами, как это часто обсуждается в современной литературе. Избыточные последовательности нуклеотидов в геноме, количество и локализация которых, по-видимому, строго сбалансированы по отношению к функционально значимым последовательностям в процессе эволюции, ведут себя вполне "альтруистично", принимая удар мутагенов на себя и специфически защищая жизненно важные участки ДНК от мутаций. Их "самоотверженное" "альтруистичное" поведение способствует сохранению хрупкой стабильности генома эукариот на приемлемом уровне и дает возможность многоклеточным организмам существовать в виде гигантских клонов высококооперированных соматических клеток, а также, вероятно, перспективу и вектор их филогенетического развития.
|
|
|
 Скачать 5.83 Mb.
Скачать 5.83 Mb.
