Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
5.2.Репарация ДНКБольшая группа молекулярно-генетических явлений, известная в настоящее время под общим названием "репарация повреждений ДНК", была осознана как отдельный и очень важный биологический феномен лишь в конце 1950-х годов. По мнению Ф. Сталя такая задержка в развитии этого направления исследований была связана с широко распространенным мнением о том, что гены, как чрезвычайно тонко и точно организованные биологические структуры, должны быть хорошо защищены от самой возможности биохимических повреждений, например путем упаковки в высокоэффективную защитную оболочку. В то время невозможно было представить себе ген в виде нестабильной макромолекулы, структура которой динамически изменяется на протяжении жизненного цикла организма, непрерывно отклоняясь от своего начального состояния и возвращаясь к исходной структуре в результате координированного функционирования большого числа ферментных систем. 5.2.1.Основные механизмы репарации поврежденной ДНК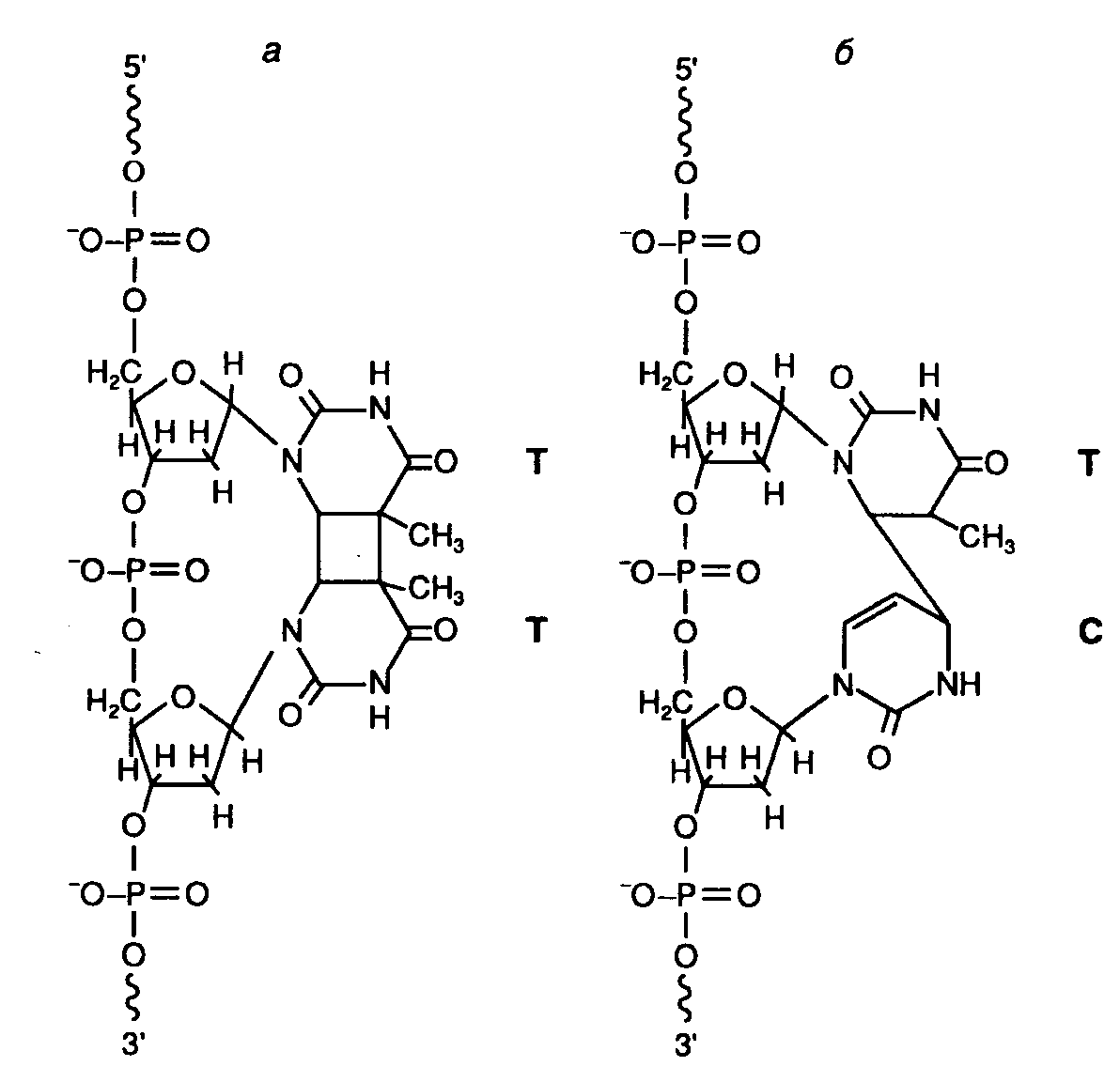 Рис. I.56. Участок ДНК с основными повреждениями, вызываемыми УФ-светом а – тиминовый димер циклобутанового типа; б – пиримидиновый димер, соединенный 6–4 связью. С – цитозин; Т – тимин Как уже упоминалось выше, имеются два типа нарушений структуры ДНК, которые в конечном итоге приводят к мутациям. Это, во-первых, включение нормальных нуклеотидов в аномальное окружение из последовательностей нуклеотидов, приводящих к образованию неправильно спаренных оснований и петель разных размеров. Во-вторых, появление повреждений ДНК в виде аномальных нуклеотидов в правильных последовательностях ДНК. В этом случае речь идет о различных химических модификациях нуклеотидов, включая их разрушение и образование поперечных сшивок. Помимо того, что повреждения ДНК часто являются причиной мутаций, они еще могут приводить к задержке и полному блокированию репликации и транскрипции. При исследовании механизмов репарации ДНК первые важные результаты были получены на клетках, облученных УФ-светом с длинами волн 240–280 нм. УФ-облучение клеток часто сопровождается их гибелью, образованием мутаций и злокачественной трансформацией, что вызвано в первую очередь повреждениями их ДНК. Среди первичных повреждений такого рода наиболее часто встречаются биспиримидиновые фотопродукты: пиримидиновые димеры циклобутанового типа, соединенные связью 6–4 (рис. I.56). Как про-, так и эукариоты имеют несколько ферментных систем, которые разделяют пиримидиновые димеры или восстанавливают исходную структуру азотистых оснований. К таким репаративным системам относится, прежде всего, система эксцизионной репарации ДНК, осуществляющая вырезание поврежденных нуклеотидов (nucleotide excision repair – NER) или азотистых оснований (base excision repair – BER). Система ферментативной фотореактивации ДНК (photoreactivation – PHR), основным компонентом которой является ДНК-фотолиаза, разделяет пиримидиновые димеры, превращая их в нормальные пиримидиновые основания. Кроме того, поврежденные УФ-светом молекулы ДНК могут репарироваться с участием систем рекомбинации и в процессе пострепликативного синтеза ДНК. Действие многих вышеперечисленных систем репарации поврежденной ДНК распространяется не только на фотопродукты, но и на другие модифицированные основания, образующиеся под действием химических мутагенов. Отдельно следует упомянуть систему, распознающую неправильно спаренные основания в двойной спирали ДНК, возникающие в результате ошибок репликации. Большинство исследованных организмов обладают системами репарации ДНК в различных комбинациях. Так, клетки E. coli для удаления фотопродуктов используют системы NER и PHR, тогда как у человека пиримидиновые димеры циклобутанового типа удаляются исключительно системой NER. Системы эксцизионной репарации NER и BER благодаря своей универсальной полифункциональности занимают центральное место среди систем репарации ДНК. 5.2.2.Эксцизионная репарация в клетках животныхЭксцизионная репарация ДНК путем удаления поврежденных азотистых оснований (BER). Система BER вызывает защиту геномной ДНК от повреждений, вызываемых главным образом алкилирующими агентами, а также эндогенными генотоксическими соединениями, включая внутриклеточные радикалы кислорода и другие реакционноспособные метаболиты, часть из которых уже обсуждалась в начале этой главы. BER начинает функционировать с отщепления ошибочно включенных или модифицированных оснований от дезоксирибозы под действием ключевого фермента – ДНК-гликозилазы, обладающего способностью отщеплять большое число модифицированных оснований ДНК (рис. I.57). Кроме этих модифицированных оснований в процессе BER может происходить удаление и других производных, образующихся под действием химических мутагенов. В частности, недавно было показано, что по такому же механизму происходит вырезание этонопуриновых производных оснований, образующихся под действием винилхлорида, а также С8-аддуктов аминофлуорена с остатками гуанина. Разные ДНК-гликозилазы благодаря их различной субстратной специфичности осуществляют удаление конкретных модифицированных оснований (табл. I.20). Таблица I.20 ДНК-гликозилазы и эндонуклеазы клеток микроорганизмов и человека, участвующие в BER
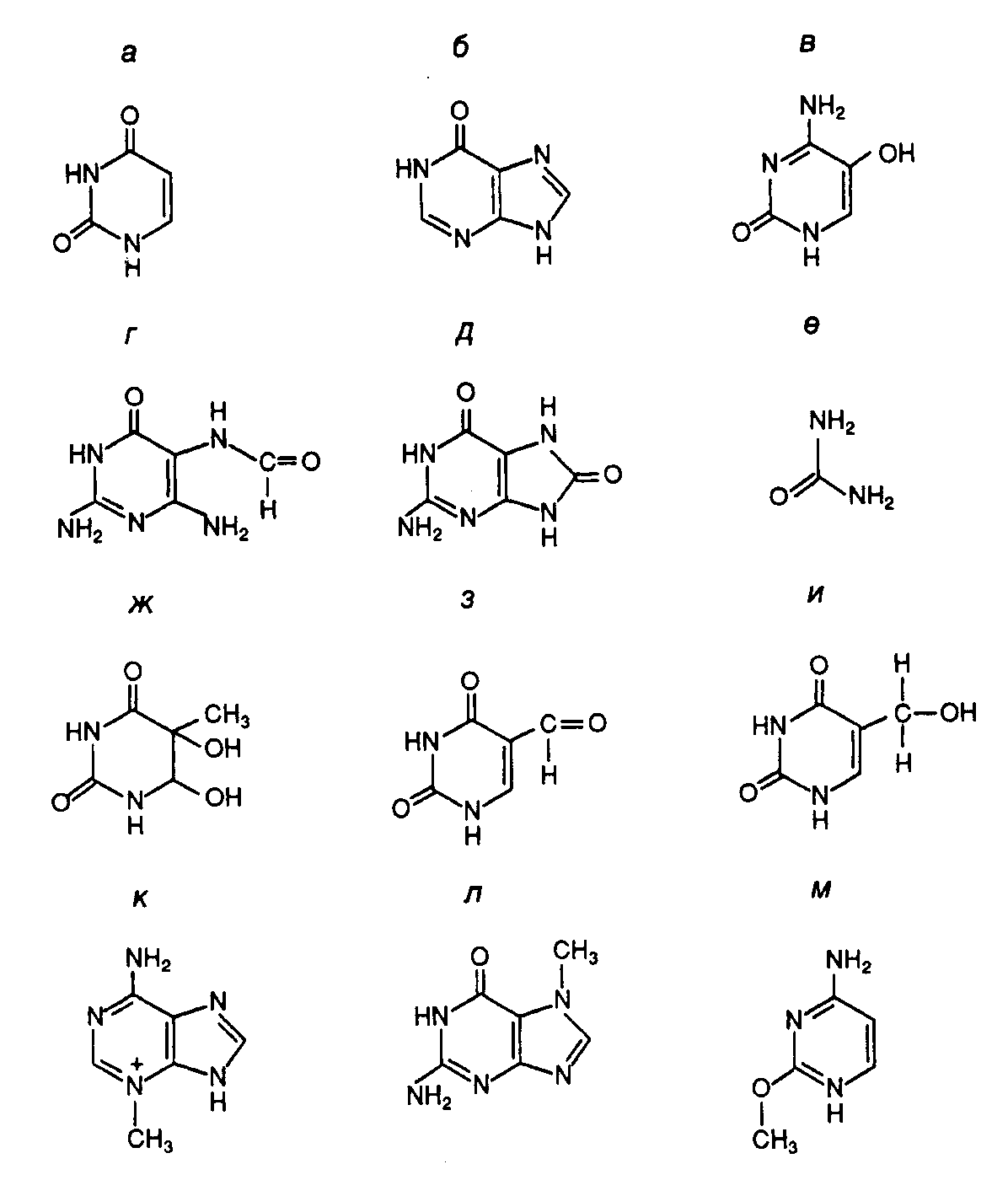 Рис. I.57. Модифицированные азотистые основания ДНК, удаляемые ДНК–гликозилазами при функционировании BER а – урацил; б – гипоксантин; в – 5–гидроксицитозин; г – 2,5-диамино-4-формамидопиримидин; д – 7,8-дигидро-8-оксогуанин; е – мочевина; ж – тимингликоль; з – 5-формилурацил; и – 5-гидроксиметилурацил; к – 3-метиладенин; л – 7-метилгуанин; м – 2-метилцитозин АР-дезоксирибоза (apurinic/apyrimidinic deoxyribose), образовавшаяся в результате удаления модифицированного азотистого основания апуринового/апиримидинового (AP-) сайта, далее вырезается с помощью АР-лиазы, которая освобождает ее 3’-конец, и АР-эндонуклеазы, гидролизующей ее 5’-концевую фосфодиэфирную связь в АР-сайте (см. рис. I.58). Однонуклеотидная брешь затем заполняется с помощью ДНК-полимеразы, и фосфодиэфирная связь восстанавливается в реакции лигирования. У E. coli репаративный синтез ДНК выполняет ДНК-полимераза I, у дрожжей – ДНК-полимераза . Из трех ДНК-лигаз, которыми обладают клетки животных, в BER, по-видимому, участвует ДНК-лигаза III. 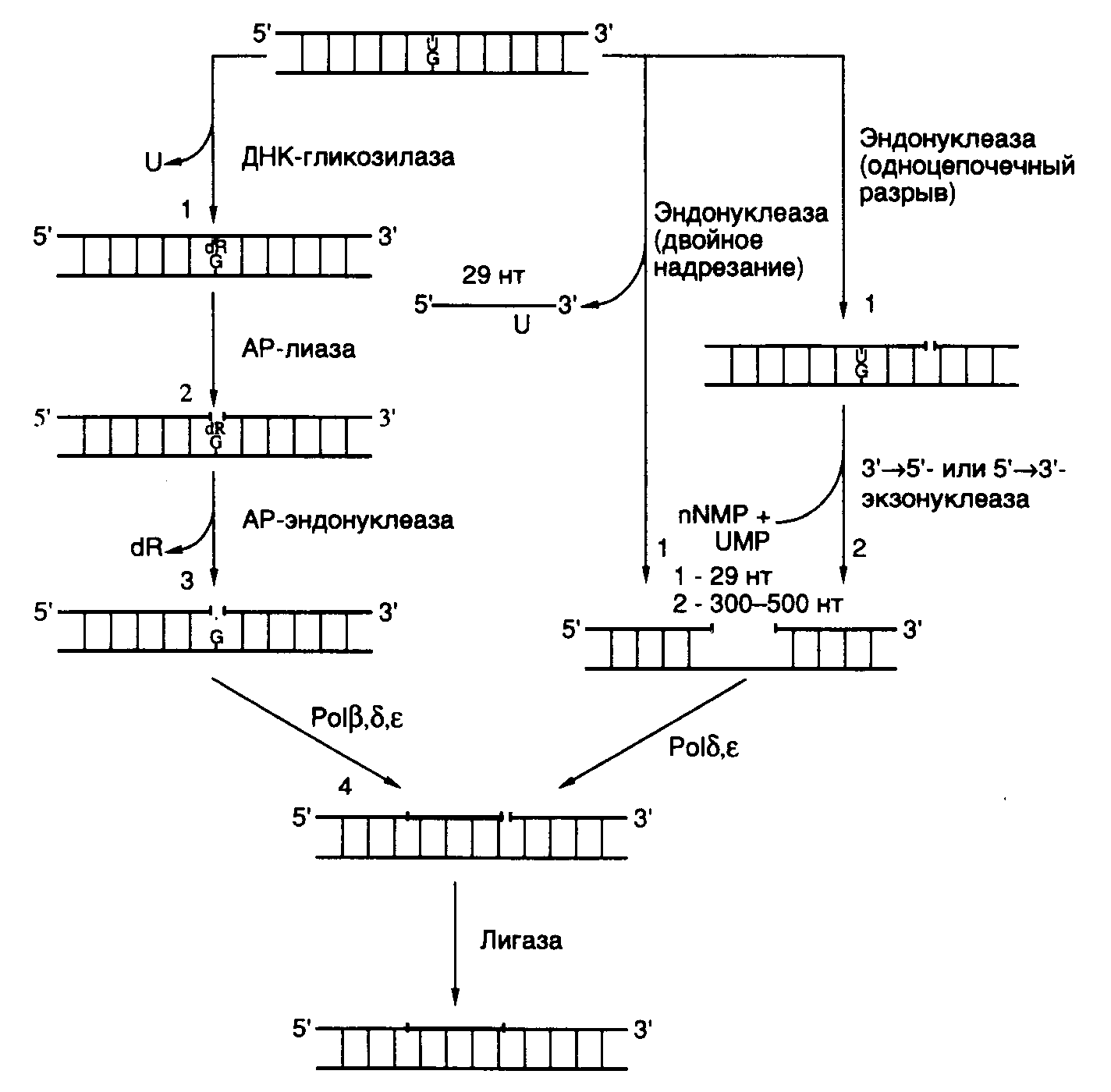 Рис. I.58. Основные пути и этапы эксцизионной репарации у животных Цифрами обозначены последовательные этапы функционирования BER и NER В последнее время начаты исследования механизмов сопряжения BER с другими генетическими процессами, протекающими внутри клеток: транскрипцией, репликацией ДНК и регуляцией клеточного цикла. Для соматических клеток менее опасно иметь повреждения ДНК, связанные с появлением некодирующих (AP-) участков, чем ошибочно кодирующих оснований, поскольку последние приводят к образованию мутаций, тогда как первые допускают осуществление полноценной пострепликативной репарации повреждений. ДНК-гликозилазы, участвующие в BER, способны переводить сайты, содержащие модифицированные основания (например урацил), в некодирующие сегменты одной из цепей ДНК. Урацилгликозилазы, ассоциированные с белковыми комплексами репликативных вилок, действуют очень эффективно на одноцепочечные ДНК, и их активность регулируется во время клеточного цикла. Эксцизионная репарация ДНК путем удаления нуклеотидов (NER). Если в системе BER происходит удаление отдельных поврежденных азотистых оснований ДНК путем разрыва соответствующих N-гликозидных связей между азотистыми основаниями и остатками дезоксирибозы, то в системе NER поврежденные азотистые основания вырезаются в составе олигонуклеотидов. NER может осуществляться двумя путями. В первом случае происходит гидролиз фосфодиэфирной связи по 3’- или 5’-концу на некотором расстоянии от ошибочно спаренного (поврежденного) нуклеотида, который далее целиком удаляется под действием 5’3’- (или 3’5’-) экзонуклеазы, гидролизующей цепь ДНК нуклеотид за нуклеотидом в соответствующем направлении от первоначального одноцепочечного разрыва в репарируемой ДНК. Образующаяся брешь далее заполняется ДНК-полимеразой. Такой механизм репарации реализуется у E. coli и человека для вырезания неповрежденных (немодифицированных) ошибочно спаренных нуклеотидов. Механизм последовательного эндо- и экзонуклеазного расщепления ДНК не используется для удаления поврежденных (измененных) нуклеотидов. Это связано, по-видимому, с тем, что такие нуклеотиды (например возникшие в результате образования аддуктов с мутагенами) часто являются ингибиторами экзонуклеаз. Одним из решений данной проблемы представляется использование ферментной системы, которая вносила бы одноцепочечные разрывы по обе стороны от поврежденного нуклеотида на некотором расстоянии от него с последующим удалением одноцепочечного фрагмента ДНК, содержащего измененный нуклеотид. Действительно, такой второй механизм эксцизионной репарации функционирует у всех исследованных видов живых организмов и будет рассмотрен ниже более подробно. В универсальном механизме эксцизионной репарации как прокариоты, так и эукариоты гидролизуют 3–5-ю фосфодиэфирную связь с 3'-конца от повреждения (см. рис. I.56). При этом прокариоты гидролизуют также 8-ю связь от 5’-конца измененного нуклеотида, тогда как у эукариотических организмов происходит одноцепочечный разрыв на расстоянии 21–25 нуклеотидов от повреждения со стороны его 5’-конца. Таким образом, прокариоты удаляют измененный нуклеотид в составе 12–13-членных олигомеров, тогда как эукариоты – в составе одноцепочечных фрагментов ДНК длиной в 27–29 нуклеотидов. Ферментная система, вносящая такие двойные одноцепочечные разрывы, получила название эксцизионной нуклеазы (эксцинуклеазы). Образующаяся в молекуле репарируемой ДНК одноцепочечная брешь далее заполняется с помощью ДНК-полимеразы, а фосфодиэфирная связь в остающемся одноцепочечном разрыве восстанавливается ДНК-лигазой. Генетика NER. Гены NER E. coli uvrA, uvrBиuvrC не обнаруживают гомологии с соответствующими генами человека. В отличие от них гены NER дрожжей и человека высокогомологичны, и энзимология эксцизионной репарации в этих двух системах также обладает большим сходством. По крайней мере, три заболевания у человека вызываются генетическими нарушениями системы эксцизионной репарации: пигментная ксеродерма, синдром Кокейна и трихотиодистрофия. Кожа больных пигментной ксеродермой обладает повышенной чувствительностью к дневному свету, что проявляется в виде фотодерматозов, включая рак кожи. В ряде случаев отмечены аномалии нервной системы, причиной которых являются мутации в одном из семи генов: XPA, XPB, ...XPG. Однако описаны больные с классическими симптомами пигментной ксеродермы, но с ненарушенной системой NER. Для клеток этих больных характерны изменения в так называемой пострепликативной репарации. Больным с синдромом Кокейна присущи нарушения роста, умственная отсталость, катаракты, повышенная чувствительность к свету с сопутствующими дерматозами. Обнаружены мутации в двух группах генов, приводящие к этому заболеванию. У больных с мутантными генами CS-A или CS-B клетки способны нормально репарировать УФ-повреждения ДНК. У другой группы больных обнаружены мутации в генах XPB, XPD или XPG. У больных трихотиодистрофией со смешанными симптомами выявлены мутации в генах XPB или XPD. Классические симптомы этого заболевания, по-видимому, являются следствием мутации в гене транскрипционного фактора TFIIH. Получение мутантов с измененной NER у грызунов позволило разбить такие гены на 11 групп комплементации, большинство из которых соответствует группам комплементации XP и CS человека. Часть соответствующих генов человека удалось клонировать, используя их способность исправлять (комплементировать) генетические дефекты в культивируемых мутантных клетках грызунов. Эти гены получили название кросс-комплементирующих генов эксцизионной репарации (ERCC – excision repair cross complementing). Среди них гены XPE и ERCC6–ERCC11 не требовались для прохождения основных реакций эксцизионной репарации, и их функция неизвестна. Структура и функции белков NER. В табл. I.21 суммированы некоторые свойства белков животных, участвующих в NER. Большинство таких белков существует in vivo в виде комплексов, поэтому необходимо иметь в виду, что ферментативные активности, обнаруживаемые у отдельных Таблица I.21 Белки животных, участвующие в NER
белков в очищенном состоянии, могут не иметь прямого отношения к их функциям в системе NER. XPA – белок с молекулярной массой 31 кДа, обладает доменом типа "цинковые пальцы", участвует в распознавании поврежденного участка ДНК. Он также взаимодействует с другими компонентами системы и может функционировать в качестве фактора нуклеации для экзонуклеазы. XPA взаимодействует своим N-концевым доменом с гетеродимером ERCC1–XPF, а С-концевым доменом – с TFIIH. Кроме того, белок RPA (HSSB) образует комплекс с XPA и усиливает его специфичность в отношении поврежденной ДНК. RPA (HSSB) – тример, состоящий из белковых субъединиц р70, р34 и р11, необходим для репликации ДНК и репаративного синтеза, а также для прохождения этапа двойного надреза ДНК во время эксцизионной репарации. Он обладает умеренным сродством к поврежденной ДНК. TFIIH – олигомерный комплекс, в состав которого входят белки р89, р80, р62, р44, р41, р38 и р34. Этот белковый комплекс первоначально был открыт как один из семи основных факторов транскрипции, необходимых для эффективного функционирования РНК-полимеразы II. Случайно было установлено, что его субъединица р89 идентична белку репаративного комплекса XPB, а также обнаружено отсутствие функциональной комплементации между бесклеточными экстрактами клеток с мутантными белками XPB и XPD, определяемой по восстановлению репарирующей активности в смешанных экстрактах. Все это привело к пониманию того, что весь комплекс TFIIH представляет собой фактор репаративной системы. Белки XPB и XPD являются ДНК-зависимыми АТРазами, обладают так называемыми хеликазными доменами и могут (как и сам фактор TFIIH) вызывать диссоциацию гибридов, образованных между короткими фрагментами ДНК и одноцепочечной ДНК. XPC – белок с молекулярной массой 125 кДа, существует в виде гетеродимера в комплексе с белком р58, который является гомологом белка Rad23 дрожжей (HHR23B). XPC слабо связывается с TFIIH и очень прочно – с одноцепочечной ДНК. ERCC1/XPF – чрезвычайно прочный белковый комплекс, с которым взаимодействует белок XPA. Он обладает эндонуклеазной активностью, специфичной в отношении одноцепочечной ДНК. XPG – белковый комплекс, обладающий эндонуклеазной активностью, специфичной в отношении одноцепочечной ДНК; вовлекается в эксцизионный комплекс посредством взаимодействия с TFIIH и RPA. Механизм NER. Процесс NER условно можно разделить на четыре этапа: а) распознавание поврежденного участка ДНК; б) двойное надрезание (инцизия) цепи ДНК по обеим сторонам поврежденного участка и его удаление (эксцизия); в) заполнение бреши в процессе репаративного синтеза; г) лигирование оставшегося одноцепочечного разрыва ДНК. Феномен NER, как и многие другие генетические явления, имеющие общебиологическое значение, впервые обнаружен у E. coli. Было установлено, что мутантные УФ-чувствительные клетки E. coli не могут удалять из ДНК тиминовые димеры, возникающие в ответ на действие УФ-света. Вскоре стало ясно, что система эксцизионной репарации не является специфичной в отношении только тиминовых димеров, но способна распознавать и удалять любые повреждения ДНК, возникающие в результате ковалентных модификаций составляющих ее мономеров. Для понимания механизмов узнавания системой эксцизионной репарации поврежденных участков ДНК необходимо ответить, по крайней мере, на три важных вопроса: 1) распознает ли система только поврежденные (модифицированные) основания в ДНК; 2) как система осуществляет выбор цепи ДНК для репарации; 3) каковы молекулярные механизмы распознавания поврежденных участков? Оказалось, что поврежденные (модифицированные) основания – не единственный субстрат для этой ферментной системы. NER человека распознает и удаляет одиночные ошибочно спаренные нуклеотиды, а также петли длиной в 1–3 нуклеотида. Однако в отличие от истинной репаративной системы, удаляющей неправильно спаренные основания, NER не может идентифицировать, нуклеотид какой цепи ДНК оказывается правильным. В результате происходит вырезание неспаренных нуклеотидов из любой цепи случайным образом. В отличие от только что рассмотренной ситуации NER человека способна различать цепи ДНК в случае распознавания поврежденных нуклеотидов. В частности, показано, что при наличии в ДНК димеров тимина циклобутанового типа вырезание нуклеотидов происходит исключительно из поврежденной цепи. Механизм такого распознавания в настоящее время неизвестен. К сожалению, остается непонятным и молекулярный механизм узнавания самих поврежденных оснований. Следует заметить, что система способна распознавать повреждения как сильно, так и слабо деформирующие вторичную структуру ДНК. При этом не обнаружена линейная зависимость между коэффициентом специфичности нуклеазы (kcat/km) и уровнем деформации двойной спирали ДНК. Показано, что в процессе распознавания участвуют белковые комплексы XPA/RPA, которые преимущественно связываются с поврежденной ДНК, и TFIIH, обладающий АTP-зависимой ДНК-расплетающей активностью. Последний взаимодействует с поврежденным участком ДНК и по аналогии с соответствующим механизмом у E. coli локально раскручивает ДНК, создавая основной преинцизионный комплекс с поврежденной ДНК. Недавно было установлено, что три фермента репарации, обладающие узкой субстратной специфичностью: ДНК-фотолиаза (удаление пиримидиновых димеров), урацилгликозилаза (удаление урацила из ДНК) и экзонуклеаза III (гидролиз ДНК в AP-сайтах), втягивают поврежденный участок из двойной спирали в полость фермента, что приводит кофактор или аминокислотные остатки активного центра этих ферментов в непосредственный контакт с расщепляемыми связями ДНК. Не исключено, что система эксцинуклеазы действует таким же образом. Основные этапы функционирования NER, следующие за распознаванием поврежденного участка ДНК, представлены на рис. I.59. После того как комплекс XPA–RPA связывается с измененным участком ДНК, XPA взаимодействует с комплексом TFIIH, который создает преинцизионный комплекс, что сопряжено с гидролизом ATP. ATP-зависимое расплетание ДНК комплексом TFIIH подготавливает ее к взаимодействию с двумя XP-белками, обладающими нуклеазной активностью. XPG связывается с TFIIH и вносит одноцепочечный разрыв с 3’-конца повреждения. Аналогично комплекс ERCC1–XPF взаимодействует с XPA в составе преинцизионного комплекса и способствует одноцепочечному разрыву с 5’-конца повреждения. Образование обоих разрывов является ATP-зависимым, и их расположение на ДНК высокоспецифично. Как правило, происходят разрывы 5-й и 24-й фосфодиэфирных связей соответственно от 3’- и 5’-концов поврежденных участков. Однако расположение точек разрывов может варьировать (см. выше). Таким образом, в результате подобных одноцепочечных надрезов ДНК может освобождаться фрагмент длиной 24–32 нуклеотида с преобладанием фрагментов длиной 27–29 нуклеотидов. На расположение сайтов одноцепочечных разрывов оказывают влияние как характер повреждения, так и последовательности нуклеотидов (контекст), окружающих поврежденный участок. Ту же самую картину инцизии обнаруживают in vivo в ооцитах Xenopus и у Schizosaccharomyces pombe. На этом основании делают вывод об универсальном механизме эксцизионной репарации у эукариот. 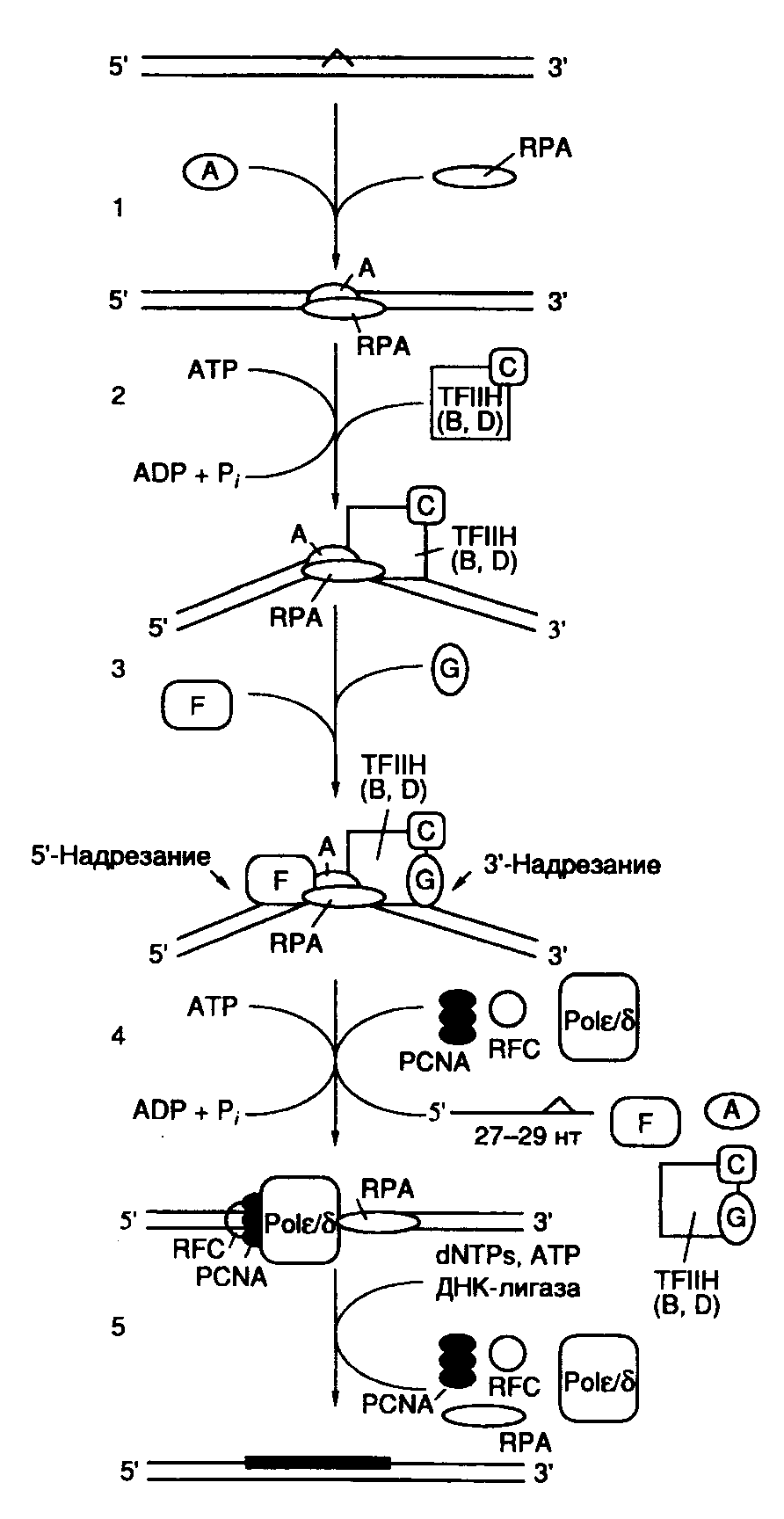 Рис. I.59. Модель эксцизионной репарации (NER) у млекопитающих Обозначены белок-белковые и белково-нуклеиновые взаимодействия, возникающие при функционировании NER. A–F – продукты генов XPA–XPF Репаративный синтез ДНК у человека является PCNA-зависимым (см. раздел 4.1.3), т.е. может осуществляться с участием ДНК-полимераз Pol и Pol. PCNA связывается с системой праймер–матрица под действием фактора репликации RFC, откуда следует, что последний также участвует в репаративном синтезе ДНК. В опытах с бесклеточными системами моноклональные антитела к Pol специфически подавляют репаративный синтез. Однако оказалось, что в тех же высокоочищенных бесклеточных системах вместо Pol с аналогичным эффектом могут быть использованы Pol и даже фрагмент Кленова ДНК-полимеразы I E. coli. Это означает, что реконструированные из очищенных компонентов бесклеточные системы лишь в ограниченной степени имитируют биохимические процессы, происходящие в живых клетках. В настоящее время считается, что обе ДНК-полимеразы – Pol и Pol участвуют в репаративном синтезе ДНК у человека. Сопряжение NER с транскрипцией. Транскрибируемые последовательности нуклеотидов ДНК, особенно в матричной цепи, репарируются с большей скоростью, чем нетранскрибируемые последовательности. Интересно, что в клетках больных с синдромом Кокайна не наблюдается такой асимметрии в репарации. В клетках E. coli белковый фактор, кодируемый геном mfd и сопрягающий транскрипцию и репарацию, замещает остановившиеся перед повреждением молекулы РНК-полимеразы, что приводит к диссоциации транскрипционного комплекса. При этом он одновременно привлекает экзонуклеазный репаративный комплекс к поврежденному участку ДНК. В клетках животных ген CSB кодирует белок с молекулярной массой 160 кДа, который содержит так называемый хеликазный домен (мотив) и, возможно, выполняет те же функции, что и белок Mfd у E. coli. На основе поведения клеток с мутантными генами белков CSA и CSB разработана простая модель механизма, с помощью которого обеспечивается асимметричная репарация цепей ДНК. В соответствии с этой моделью РНК-полимераза II, остановившаяся в процессе транскрипции перед поврежденным участком ДНК, распознается комплексом CSA–CSB и перемещается в сторону от повреждения без разрушения четвертичной структуры транскрипционного комплекса. Одновременно комплекс CSA–CSB привлекает компоненты репаративной системы XPA и TFIIH к месту повреждения ДНК и помогает сборке эксцинуклеазного комплекса. Нуклеотиды поврежденной цепи вырезаются, и брешь репарируется. После этого РНК-полимераза в составе транскрипционного комплекса продолжает транскрипцию. Регуляция NER. Для клеток животных не характерен так называемый SOS-ответ, свойственный клеткам E. coli и представляющий собой суммарную реакцию бактериальной клетки на повреждение ДНК различными агентами, что проявляется, в частности, в усилении транскрипции генов NER. Точно так же посттрансляционные модификации белков репарации, происходящие в ответ на повреждение ДНК, не влияют на активность эксцинуклеазы человека. Было обнаружено, что повреждения ДНК стабилизируют белок р53 – белок-супрессор опухолевого роста, который является регулятором транскрипции. Имеются данные о том, что белок р53 может взаимодействовать с белками XPB и RPA, необходимыми для NER. Однако клетки с инактивированными генами р53 (p53(-/-)), как и клетки дикого типа, эффективно удаляют из поврежденной ДНК два основных фотопродукта, возникающих под действием УФ-света, и обладают такой же устойчивостью к УФ. Поэтому в настоящее время считается, что белок р53 не оказывает прямого влияния на NER. Белки Cdk7 и циклин H, которые образуют Cdk-активирующую киназу, входят в состав комплекса TFIIH, что позволяет предполагать наличие связи репарации ДНК с фазами клеточного цикла. 5.2.3.Гомологичная рекомбинация в репарации ДНКДавно известно, что быстро делящиеся бактериальные клетки, содержащие несколько репликонов, образованных недореплицированными хромосомами (см. введение к разделу 4.2), более устойчивы к действию ионизирующей радиации, которая индуцирует двухцепочечные разрывы ДНК, чем клетки с небольшим числом репликонов, находящиеся в стационарной фазе. Гаплоидные клетки дрожжей в фазе G1 перед началом синтеза ДНК чрезвычайно чувствительны к действию ионизирующей радиации, тогда как те же клетки в фазе G2 перед митозом так же устойчивы к ионизирующему излучению, как и диплоидные клетки. Эти факты указывают на то, что для эффективного исправления повреждений, вызываемых ионизирующей радиацией, необходимо одновременное присутствие в клетке двух гомологичных молекул ДНК. 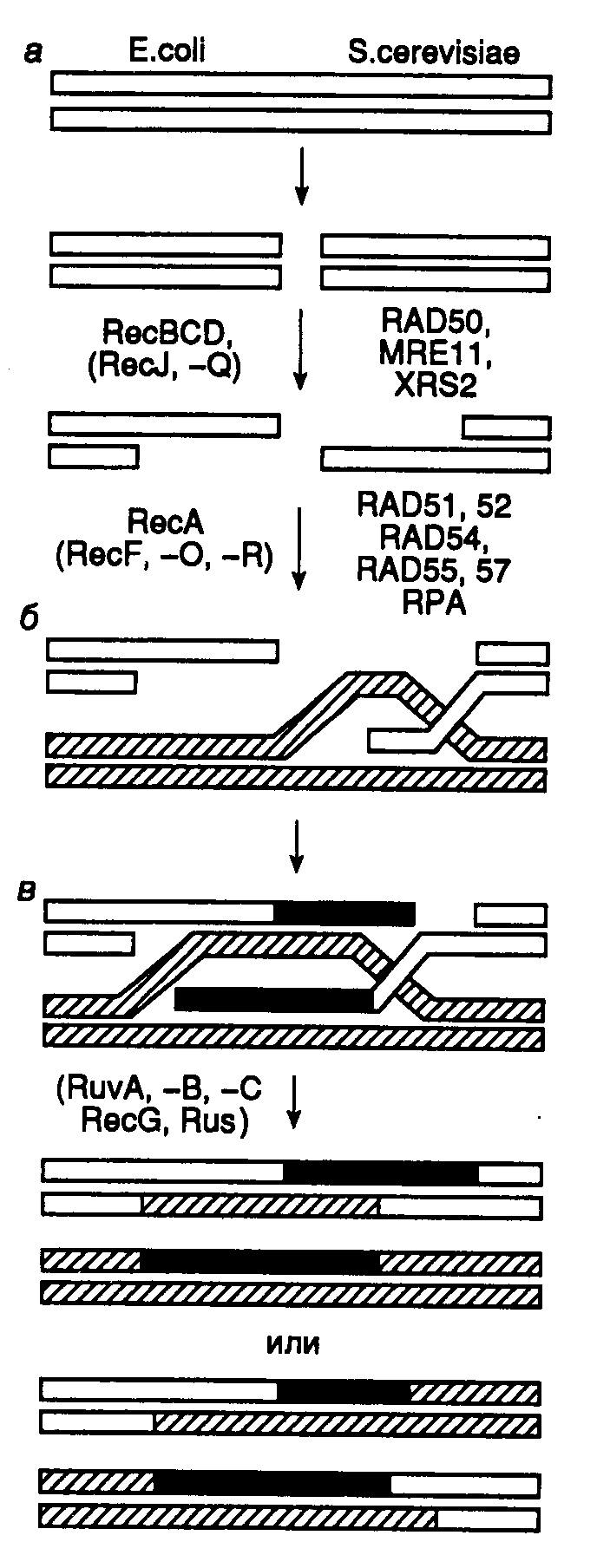 Рис. I.60. Схема репарации двухцепочечных разрывов ДНК с участием гомологичной рекомбинации Обозначены продукты генов E. coli и S. cerevisiae, необходимые для прохождения соответствующих этапов репарации повреждений ДНК. Разделены пресинаптическая (а), синаптическая (б) и постсинаптическая (в) фазы репарации Существует несколько моделей, объясняющих механизм репарации повреждений ДНК с участием системы гомологичной рекомбинации. Схема одного из таких механизмов репарации двухцепочечных разрывов ДНК у E. coli изображена на рис. I.60. В соответствии с этой моделью процесс репарации условно разделяют на три этапа. В первой, пресинаптической, фазе репарации происходит внесение двухцепочечного разрыва в ДНК или, при его наличии, сразу осуществляется нуклеазное расщепление концов разрыва. В создании одноцепочечных 3’-OH-выступающих концов ДНК в месте разрыва принимает участие белок RecBCD, который обладает как хеликазной, так и экзонуклеазной активностями. RecBCD расплетает двухцепочечную молекулу ДНК в месте разрыва и гидролизует одну из цепей в направлении 5’3’, оставляя выступающий одноцепочечный участок. Во второй фазе наблюдается синапсис гомологичных участков двух молекул ДНК с вхождением комплементарного одноцепочечного участка в ДНК-дуплекс и последующим репаративным синтезом ДНК. Поиск гомологичных участков и обмен цепями, необходимые для рекомбинации, происходят с участием белка RecA. В третьей, постсинаптической, фазе репарации образовавшиеся структуры Холидея разделяются с помощью белков RuvA, -B и -C, RecG, а также белков SOS-системы репарации (RecN, UvrD, RecF и RecJ). Похожие механизмы используются клетками для рекомбинационной репарации одноцепочечных брешей, остающихся в молекулах ДНК из-за блокировки репликативного синтеза ДНК модифицированными нуклеотидами. Многие продукты генов E. coliи дрожжей, участвующие в рекомбинационной репарации повреждений ДНК, имеют гомологи у животных и человека. Отличительной особенностью эукариотической рекомбинации и репарации является вхождение соответствующих белков в многочисленные белковые комплексы, в частности транскриптосомы и реплисомы, что указывает на их важную роль в матричном биосинтезе нуклеиновых кислот эукариотических клеток. 5.2.4.Репарация ошибочно спаренных нуклеотидовСистема, осуществляющая репарацию ошибочно спаренных нуклеотидов (mismatch repair), выполняет в клетке несколько важных функций. Прежде всего она исправляет ошибки репликации ДНК, меняя ошибочно включенные нуклеотиды. Кроме того, при участии этой системы происходит процессинг промежуточных продуктов рекомбинации, приводящий к образованию новых сочетаний генетических маркеров. Ферменты данной системы обеспечивают рекомбинацию между дивергировавшими последовательностями гомологичных ДНК, а также задержку клеточного цикла в ответ на повреждения ДНК. Система репарации ошибочно спаренных нуклеотидов у E. coli, использующая белки MutHLS, распознает и репарирует все некомплементарные пары оснований за исключением C–C. Кроме того, эта система репарирует небольшие вставки в одну из цепей ДНК, образующиеся в результате ошибок репликации, длина которых не превышает четырех нуклеотидов. Обычно у E. coli ДНК метилирована Dam-метилазой по сайтам GATC. Однако после завершения репликации дочерняя цепь ДНК некоторое время остается неметилированной. Система MutHLS избирательно репарирует дочернюю цепь ДНК, тем самым значительно повышая точность репликации. Эта система может быть реконструирована in vitro с использованием ДНК с одной метилированной цепью в качестве субстрата, к которой добавляются очищенные белки MutH, MutL, MutS, UvrD (хеликаза II), холофермент ДНК-полимеразы III, ДНК-лигаза, белок SSB, а также одна из экзонуклеаз: ExoI, ExoVII или RecJ. Процесс репарации инициируется внесением одноцепочечного разрыва в неметилированную цепь вблизи частично метилированного сайта GATC с последующим гидролизом цепи ДНК и заполнением образующейся одноцепочечной бреши. При этом белок MutS связывается с ошибочно спаренными нуклеотидами. У белка MutL не обнаружено ферментативной активности, хотя он взаимодействует с MutS и необходим для активации MutH – эндонуклеазы, осуществляющей одноцепочечный разрыв ДНК. Таким образом, комплекс MutS–MutL, собранный на участке ДНК с ошибочно спаренным нуклеотидом, стимулирует эндонуклеазную (никазную) активность MutH. Бесклеточная система не требует присутствия MutH при наличии в ДНК-субстрате одноцепочечного разрыва. MutHLS-система репарации может использовать частично метилированные последовательности GATC, расположенные выше и ниже поврежденного участка ДНК. При этом в вырезании ошибочно включенного нуклеотида помимо хеликазы II принимает участие одна из экзонуклеаз: ExoI (3’-экзо), ExoVII (3’- и 5’-экзо) или RecJ (5’-экзо) в зависимости от расположения GATC-сайта по отношению к корректируемому нуклеотиду. Вслед за вырезанием нуклеотида образовавшаяся одноцепочечная брешь заполняется холоферментом ДНК-полимеразы III в присутствии SSB-белка и ДНК-лигазы. Следует подчеркнуть, что использование белка MutH и Dam-метилазы для распознавания дочерней цепи реплицировавшейся ДНК является уникальным свойством грамотрицательных бактерий. У грамположительных бактерий не происходит метилирование цепей ДНК в целях маркировки. Если сайты GATC полностью метилированы, MutHLS-система репарации E. coli изменяет ошибочно спаренные нуклеотиды в обеих цепях ДНК с одинаковой эффективностью. У E. coli существуют, по крайней мере, еще два специфических пути репарации ошибочно спаренных нуклеотидов. Система VSP (very short patch repair pathway) репарирует некомплементарные пары G–T, заменяя их на G–C. Считается, что такие пары образуются в результате дезаминирования 5-метилцитозина в сайтах, где остатки С метилированы Dcm-метилазой. С более низкой эффективностью эта же система заменяет пары G–U на G–C. Другая MutY-зависимая система репарации специфически ликвидирует последствия окислительных повреждений гуанина. Если dGTP окисляется с образованием 8-оксо-dGTP, белок MutT расщепляет последний, предотвращая его включение в ДНК. Если же он все-таки включается напротив остатка С, то Fpg-гликозилаза (MutM) удаляет это модифицированное основание. В том случае, когда 8-оксо-G остается в составе ДНК, в следующем раунде репликации он спаривается с А, и в итоге может произойти трансверсия G–CT–A. В этом случае белок MutY действует как ДНК-гликозилаза, удаляющая остаток A из некорректной пары, и как AP-лиаза, вносящая одноцепочечный разрыв по соседству с AP-сайтом. Далее следуют процессы, уже рассмотренные выше в связи с функционированием системы репарации BER. Последовательность реакций с участием MutY также репарирует некомплементарные пары A–G и A–C с образованием соответственно пар C–G и G–C. Репарация ошибочно спаренных оснований у эукариот происходит при участии комплекса белков, подобного системе MutHLS бактерий. Белок GTBP человека представляет собой гомолог бактериального белка MutS, а у дрожжей в соответствующей роли выступает белок Msh6. Распознавание ошибочно спаренных нуклеотидов у человека осуществляется гетеродимером MSH2–GTBP. Гомологами MutL в клетках S. cerevisiae являются белки MLH1 и PMS2, которые также существуют в виде гетеродимерных комплексов. Мутации в генах, кодирующих эти белки у человека, сопровождаются формированием мутаторного фенотипа и развитием наследственного неполипозного рака кишечника (синдром HNPCC – hereditary nonpolyposis colon cancer). 5.2.5.Полимераза поли(ADP-рибозы) в репарации ДНК у эукариотВ отличие от бактерий одним из первых ответов клеток животных на тяжелые повреждения ДНК является массированная полимеризация остатков ADP-рибозы специальным ферментом – полимеразой поли(ADP-рибозы) (poly(ADP-ribose polymerase) – PARP). В ядрах клеток млекопитающих PARP присутствует в количестве 106 копий, и она обнаружена у большинства эукариот за исключением дрожжей. Процесс синтеза поли(ADP-рибозы) предшествует началу репарации повреждений ДНК. Большие затраты энергии на биосинтез этого полимера указывают на его важную, хотя и до конца не понятную, роль в выходе ядер клеток из стрессового состояния, вызванного премутационными повреждениями ДНК. In vivoполи(ADP-рибоза) характеризуется очень малым временем полужизни. Цепи полимера, синтезированные в ядрах в ответ на мутагенное воздействие, в основном распадаются уже через 1–2 мин после завершения их синтеза. Такой быстрый обмен полимера в ядрах становится возможным благодаря совместному действию двух ферментов – PARP и гликозилазы поли(ADP-рибозы). Экспрессия PARP-кДНК в ядрах дрожжей, у которых отсутствуют оба фермента, летальна для клеток. Это связано, главным образом, с тем, что внутриядерное накопление поли(ADP-рибозы) сопровождается подавлением репликации ДНК и транскрипции. Ген PARP, картированный на участке 1q41–1q42 хромосомы человека, кодирует полипептид, состоящий из двух функционально различающихся частей: N-концевого ДНК-связывающего и C-концевого каталитического доменов. Первый домен содержит две структуры типа "цинковые пальцы", которые обеспечивают взаимодействие PARP с разрывами в ДНК. С помощью футпринтинга установлено, что PARP связывается преимущественно с одноцепочечными разрывами ДНК, закрывая своей полипептидной цепью по семь–восемь нуклеотидов по обе стороны от разрыва. При этом PARP индуцирует образование V-образного изгиба ДНК в месте одноцепочечного разрыва. Для синтеза поли(ADP-рибозы) фермент использует NAD в качестве субстрата. Структурные аналоги NAD часто являются ингибиторами PARP, например 3-аминобензамид – один из самых эффективных ингибиторов PARP. Каталитический домен PARP обнаруживает гомологию с различными NAD-связывающими ферментами. Одноцепочечные разрывы, остающиеся между фрагментами Оказаки при синтезе отстающей цепи ДНК, не индуцируют образование поли(ADP-рибозы), вероятно, из-за их экранирования белками реплисомы. 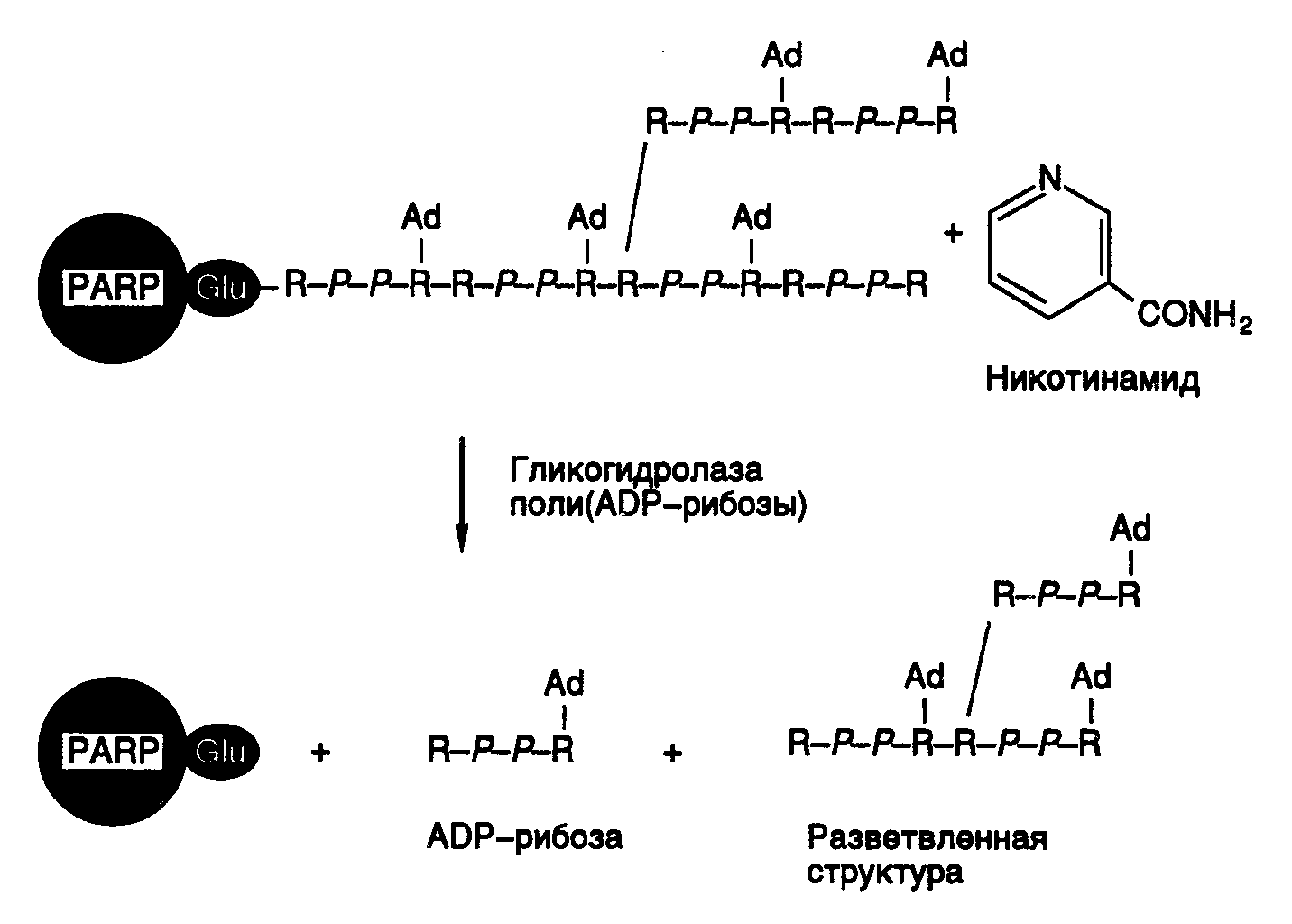 Рис. I.61. Схематическое изображение молекулы поли(ADP-рибозы), присоединенной к полипептидной цепи полимеразы поли(ADP-рибозы) и продуктов ее деградации Синтез поли(ADP-рибозы) можно рассматривать как один из редких случаев посттрансляционной модификации белков, при которой PARP использует свою собственную полипептидную цепь в качестве субстрата (рис. I.61). Такая массированная аутомодификация резко изменяет физические свойства фермента. Остатки Glu (25–30), расположенные в полипептидной цепи PARP между двумя вышеупомянутыми доменами, служат точками инициации синтеза поли(ADP-рибозы). В процессе синтеза происходит разветвление полимера, и длина боковых цепей может достигать нескольких сотен остатков. В настоящее время до конца неизвестно, модифицирует ли молекула PARP сама себя или же это осуществляют другие молекулы PARP. На основании имеющихся кинетических данных наиболее вероятной считается модель, в соответствии с которой молекула PARP, ассоциированная с одноцепочечным разрывом, образует комплекс с другой молекулой и уже вторая молекула PARP служит акцептором полимеризуемой ADP-рибозы. Гликогидролаза поли(ADP-рибозы) расщепляет цепи полимера с их концов, освобождая мономеры и олигомеры ADP-рибозы. Таким образом, в результате синтеза и деградации поли(ADP-рибозы) в ядрах образуются не только остатки никотинамида и ADP-рибозы, но и более сложные разветвленные продукты, состоящие из трех–четырех молекул мономера. В присутствии ингибиторов PARP клетки животных становятся чрезвычайно чувствительными к действию алкилирующих агентов и ионизирующей радиации. Кроме того, в этом случае наблюдается повышенный уровень сестринских хроматидных обменов (СХО). Однако до сих пор нет доказательств прямого участия поли(ADP-рибозы) в репарации ДНК. Сверхэкспрессия рекомбинантного N-концевого домена PARP в клетках животных сопровождается теми же эффектами, что и действие ингибиторов PARP, в частности 3-аминобензамида. В неповрежденных клетках происходят дестабилизация генома и рост числа СХО. Опыты с трансгенными мышами, у которых ген PARP инактивирован в результате генного нокаута (см. раздел 10.3.4), показывают, что PARP-дефицитные мыши, тем не менее, здоровы и фертильны. Следовательно, PARP не играет существенной роли в пролиферации клеток, их дифференцировке и онтогенезе мыши. Клетки таких животных обладают нормальной способностью к эксцизионной репарации ДНК системами BER и NER. PARP-дефицитным мышам свойственны не совсем понятные физиологические дефекты, проявляющиеся в гиперплазии эпидермиса, вызванной повышенной пролиферацией кератиноцитов у старых особей, а также пониженной способностью тимоцитов к пролиферации после -облучения. Клетки панкреатических островков у PARP-дефицитных мышей обладают повышенной устойчивостью к цитотоксическому действию NO. Это может указывать на недостаток NAD, вызываемый повышенным синтезом поли(ADP-рибозы), как одну из причин цитотоксичности NO у нормальных животных. В настоящее время предложено несколько моделей, объясняющих физиологическую роль PARP в клетках животных. Все они подчеркивают, что PARP не участвует прямо в эксцизионной репарации ДНК, но необходима для быстрой мобилизации ресурсов клеток при исправлении повреждений их генома. Способность ингибиторов PARP вызывать гиперчувствительность клеток к алкилирующим агентам и ионизирующей радиации позволяет рассматривать этот фермент в качестве удобной мишени в химиотерапии опухолей. Рассмотренные в данной главе механизмы образования мутаций указывают на большое разнообразие путей повреждения генетической информации, заключенной в экспрессирующихся и временно молчащих генах. Эволюционное развитие животного и растительного мира противопоставило мутагенным воздействиям мощное противоядие в виде эффективных систем репарации ДНК. Тем не менее, из-за ошибок систем репарации и повреждения самих этих систем происходит необратимое накопление мутаций, приводящих к нарушениям метаболизма и развитию различных патологических состояний организма. В этой связи еще более эффективным средством защиты генетической информации является блокирование (инактивация) химических мутагенов на подступах к жизненно важным генетическим локусам. Именно такую нагрузку несут рассмотренные выше ферментные системы детоксикации ксенобиотиков. На мой взгляд, одной из функций поли(ADP)-рибозы в клетках, подвергнутых мутагенному воздействию, может быть очистка ядер от мутагенов, ковалентно взаимодействующих с нуклеиновыми кислотами, в том числе свободных радикалов, возникающих под действием ионизирующего излучения. Это соединение может играть роль чистильщика (scavenger) ядер от химических мутагенов и понижать их внутриядерную концентрацию через образование соответствующих аддуктов. Синтез поли(ADP)-рибозы является быстрым адаптивным ответом клеток в ответ на массированное мутагенное воздействие. Однако в естественных условиях существования организмов такие ситуации встречаются редко. В природных условиях, свободных от присутствия антропогенных экологических факторов, скорее имеется слабый мутагенный фон, постоянно окружающий информационные макромолекулы на протяжении всей жизни организма. В недавно разработанной модели альтруистичной ДНК (Л.И. Патрушев, 1997 г.) избыточные последовательности нуклеотидов эукариотической ДНК рассматриваются в качестве еще одной специфической системы защиты генетической информации, характерной для многоклеточных организмов. Далее будут представлены основные положения этой модели. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
