4.2.Регуляция репликации ДНК
Подробное рассмотрение молекулярных механизмов регуляции репликации ДНК выходит за рамки книги, поэтому ограничимся несколькими замечаниями по данному вопросу и более детально обсудим лишь механизм регуляции репликации у E. coli, в том числе и бактериальных плазмид, что имеет непосредственное отношение к функционированию плазмидных векторов в бактериальных клетках.
Синтез ДНК тесно связан с другими процессами, подготавливающими деление клеток, так как передача необходимой генетической информации родительских клеток дочерним является для клеток-потомков жизненно важной. Наличие избыточной генетической информации отрицательно сказывается на жизнеспособности клеток, тогда как недостаток ее, возникающий вследствие недорепликации ДНК, приводит к летальному эффекту из-за отсутствия жизненно важных генов. Однако процесс передачи генетической информации от родительских клеток дочерним у эукариот не ограничивается простой редупликацией ДНК хромосом. Так, для насекомых многих видов характерно наличие гигантских политенных хромосом, которые возникают в результате множественных раундов репликации ДНК исходных хроматид, не сопровождающейся их расхождением.
Политенизация хромосом представляет обширный класс генетических явлений, связанных с избирательной избыточной репликацией (мультипликацией) или недорепликацией отдельных генетических локусов эукариот. Ярким примером такого рода является изменение числа генов рибосомных РНК у животных. Амплификация генов рРНК в ооцитах амфибий происходит путем образования их внехромосомных (экстрахромосомных) копий в виде кольцевых молекул рибосомных (р) ДНК, которые далее реплицируются по механизму "катящегося кольца". При этом в каждой клетке амплифицируется только по одному из сотен повторов рДНК, так что амплификация рДНК на одном повторе каким-то образом подавляет процесс амплификации на других, и все образовавшиеся повторы одного ооцита идентичны, но отличаются от наборов амплифицированных рДНК других ооцитов. Строгая стадие- и тканеспецифичность, а также избирательная амплификация только одного повтора рДНК указывают на наличие тонких регуляторных механизмов процесса репликации и в этом случае.
Характерными примерами возрастания числа генов вследствие их избирательной репликации являются магнификация генов рРНК и изменение числа генов, определяющих устойчивость клеток к лекарственным препаратам. В первом случае утрата части генов рРНК у дрозофилы в результате делеции сопровождается постепенным восстановлением их числа, тогда как во втором случае у клеток, находящихся в условиях селективного действия токсичного для них лекарственного препарата, возрастает число копий генов, необходимых для его нейтрализации. В частности, это характерно для гена дигидрофолатредуктазы в присутствии метотрексата. Высказывается предположение, что в основе изменения числа копий таких генов лежит механизм неравного кроссинговера.
Репликация хромосом бактерий тесно сопряжена с метаболизмом клеток. Например, частота инициаций новых раундов репликации зависит от скорости роста бактериальных клеток, и в клетках быстро растущих бактерий могут содержаться хромосомы с несколькими работающими репликативными вилками, хотя для репликации одной бактериальной хромосомы их требуется только две, инициированные в единственной области начала репликации (ori) и расходящиеся в противоположных направлениях. Это позволяет бактериям при благоприятных условиях затратить для генерации меньше времени, чем для полной репликации бактериальной хромосомы. Очевидно, что для поддержания строго упорядоченного характера репликации должны существовать тонкие механизмы регуляции репликации на уровне инициации новых раундов. Такие механизмы, действительно, существуют.
Наиболее хорошо изученными в настоящее время являются механизмы регуляции синтеза ДНК у E. coli, в том числе механизмы контроля числа копий у небольшой плазмиды E. coli ColE1, которые будут рассмотрены ниже более подробно из-за важности этих явлений для генной инженерии.
4.2.1.Инициация репликации ДНК у E. coli и ее регуляция
Репликация хромосомной ДНК у бактерий играет ключевую роль в их жизненном цикле. В ходе этого процесса микроорганизмы редуплицируют свой геном, а образовавшиеся дочерние геномы далее переходят в дочерние клетки. Высокая точность, с которой бактерии осуществляют такие процессы, указывает на наличие специальных механизмов их координации и контроля.
Структура области начала репликации oriC. Хромосома E. coli содержит единственную область начала репликации (origin), названную oriC, на которой происходит инициация репликации (рис. I.47,а). Размер минимальной области начала репликации, обеспечивающей автономную репликацию хромосомы, составляет 258 п.о. (положение 11–268 на рис. I.47). Сравнение первичных структур областей начала репликации различных энтеробактерий показало, что их последовательности представлены короткими консервативными участками, которые перемежаются дивергировавшими сегментами ДНК, длины которых, однако, высококонсервативны. Консервативные участки оказались сайтами связывания регуляторных белков, разделенных спейсерными последовательностями. OriC содержит пять консенсусных 9-нуклеотидных сайтов связывания инициатора DnaA (непалиндромные повторы), названных DnaA-боксами. У всех энтеробактерий области начала репликации содержат 9–14 сайтов GATC, положение восьми из которых консервативно.
В левой части oriC находится AT-богатая область, содержащая три похожих последовательности длиной в 13 нуклеотидов, каждая из которых начинается с GATC. Здесь же локализован AT-кластер, который вместе с левой 13-нуклеотидной последовательностью образует область нестабильной спирали ДНК (ДНК-расплетающий элемент). Этот участок ДНК может быть заменен без потери функции на аналогичный по нуклеотидному составу, но с другой последовательностью нуклеотидов.
OriC содержит сайты связывания белков, изгибающих ДНК, IHF (integration host factor) и FIS (factor for inversion stimulation). Оба белка, по-видимому, помогают инициатору DnaA раскручивать ДНК.
Димерный белок IciA, состоящий из субъединиц с молекулярной массой 33 кДа, специфически связывается с AT-богатыми 13-мерными повторами. Функция этого белка неизвестна, так же как и функция белка Rob, который специфически взаимодействует с 26-нуклеотидным сайтом в правой части DnaA-бокса R4. ДНК вблизи Rob-сайта обнаруживает изгиб, который более ярко выражен у молекул, полностью метилированных Dam-метилтрансферазой (см. ниже). С такими полностью метилированными ДНК взаимодействует гистоноподобный белок H-NS, сайт связывания которого перекрывается с Rob-сайтом. Это взаимодействие оказывает влияние на функционирование oriC.
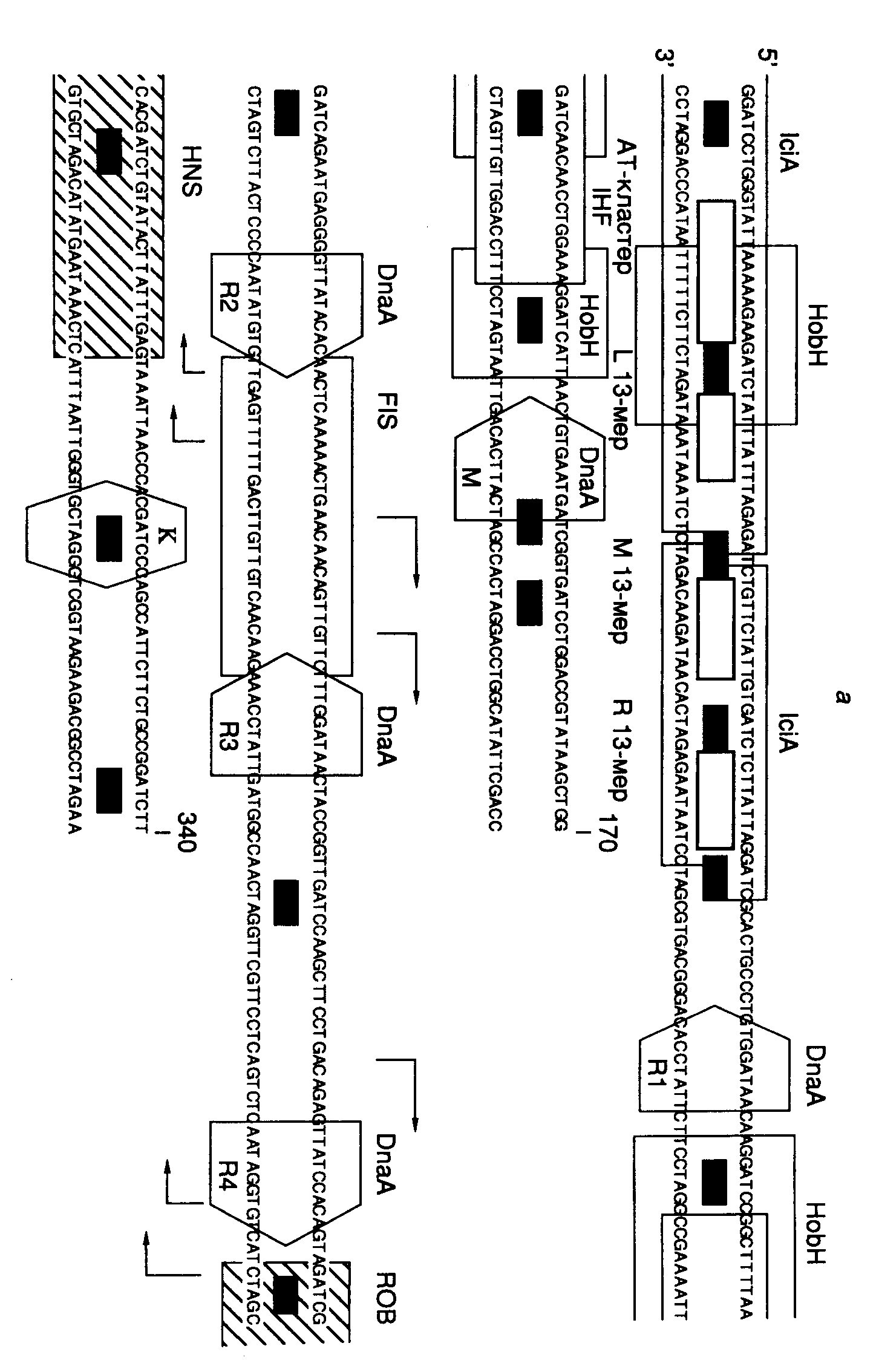
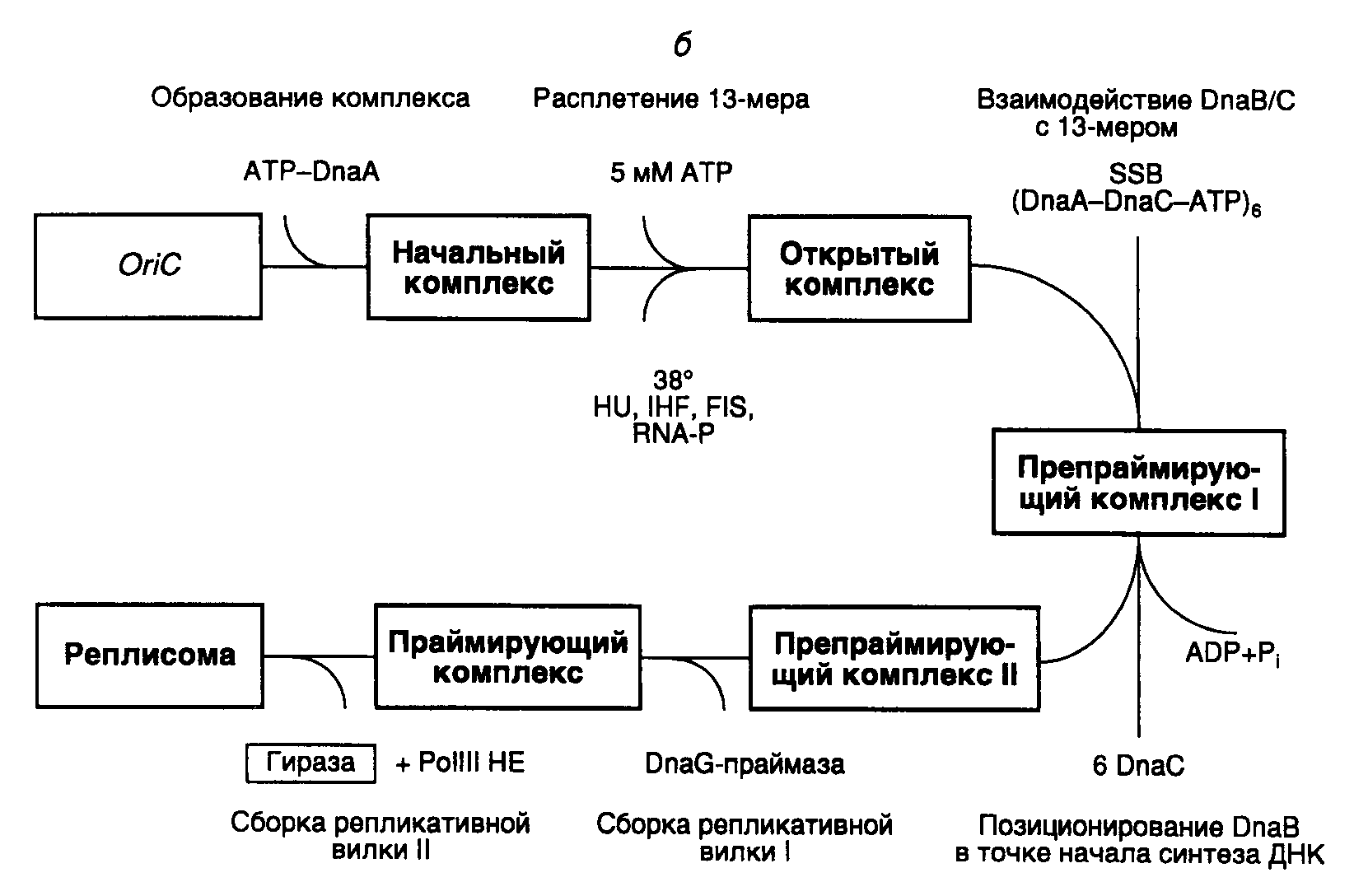
Рис. I.47. Структура области начала репликации хромосомы E. coli (а) и схема инициации ее репликации (б)
HobH – белок, взаимодействующий с метилированной по одной цепи ДНК области начала репликации (hemimethylated origin binding)
Функции белка DnaA. Белок DnaA играет ключевую роль в сборке реплисомы – многокомпонентного белкового комплекса, осуществляющего двунаправленный синтез ДНК. Белок распознает область начала репликации и привлекает к месту сборки остальные белковые компоненты реплисомы.
Этапы инициации синтеза ДНК на oriC. Сборка исходного комплекса начинается с взаимодействия белка DnaA с DnaA-боксами R1–R4 и M (см. рис. I.47,б). Для успешного прохождения последующих этапов сборки реплисомы белок DnaA должен находиться в комплексе с ATP и взаимодействовать с сверхспирализованным oriC. С помощью электронного микроскопа исходный комплекс обнаруживается в виде компактной эллипсоидной структуры, содержащей 20 мономеров DnaA, которая закрывает oriC. Исходный комплекс обладает высокоупорядоченной структурой.
В присутствии ATP в высокой концентрации (5 мМ) исходный комплекс превращается в открытый комплекс. В этом комплексе происходит частичное расплетение АТ-богатых 13-нуклеотидных повторов, расположенных в левой части oriC. При 37° или выше единственный белок DnaA может обеспечивать расплетение ДНК. Для образования открытого комплекса при более низких температурах требуется участие структурирующего белка HU или интеграционного фактора бактерии-хозяина IHF. В открытом комплексе обнаруживают небольшие участки расплетенной ДНК в правой части oriC между DnaA-боксами R2 и R4, которые рассматривают как места посадки хеликазы.
Белок DnaB является хеликазой репликативной вилки и входит в открытый комплекс с образованием препраймирующего комплекса I, взаимодействуя с одноцепочечными участками частично расплетенной ДНК. Такие участки подготавливаются белком DnaA, который вытесняет SSB-белок с соответствующих сайтов. DnaB входит в препраймирующий комплекс I в виде гексамеров, образовавших комплекс с шестью мономерами DnaC, каждый из которых связывает одну молекулу ATP. В этом комплексе хеликазная активность белка DnaB блокирована. Освобождение DnaC из комплекса происходит в результате гидролиза ATP. Следствием этого является активация хеликазы DnaB и ее правильное расположение в комплексе. Совокупность этих событий превращает препраймирующий комплекс I в препраймирующий комплекс II.
Хеликаза должна начать функционировать в месте старта репликативной вилки в правой части oriC вблизи DnaA-боксов R2, R3 и R4. Для этого она должна быть транслоцирована от места ее первоначального вхождения в комплекс к точке начала репликации. Предполагается, что транслокация ассоциирована с ATP-зависимым освобождением из комплекса белка DnaC, что сопровождается активацией хеликазы.
В праймирующем комплексе хеликаза DnaB взаимодействует с DnaG-праймазой, которая играет ключевую роль в обеспечении инициации репликации именно на oriC. Оба этих фермента обеспечивают сопряжение функционирования двух репликативных вилок, движущихся в противоположные стороны. В бесклеточной системе при низких концентрациях праймазы репликация становится однонаправленной и может инициироваться не на oriC. В праймирующем комплексе присутствие белка DnaA больше не требуется, и он после освобождения из комплекса может быть повторно использован для инициации репликации на другом oriC. Полагают, что во время координированной сборки двух репликативных вилок в одной из них синтезируется праймер, который становится затравкой при синтезе ведущей цепи другой репликативной вилкой, движущейся в противоположном направлении. Праймаза в праймирующем комплексе функционирует по дистрибутивному механизму. После синтеза праймеров она покидает репликативную вилку и заменяется новой молекулой праймазы во время образования очередного фрагмента Оказаки.
При образовании реплисомы в каждой репликативной вилке происходит ATP-зависимое формирование димерного комплекса холофермента ДНК-полимеразы III, связанного с 3'-концами праймеров (скользящий зажим, см. выше). Вслед за этим происходит координированная элонгация праймеров, сопровождаемая двунаправленным синтезом ведущих и отстающих цепей ДНК. В бесклеточной системе точки начала синтеза ведущих цепей локализованы в oriCвблизи DnaA-боксов R2, R3 и R4.
Механизмы контроля инициации репликации in vivo. Инициация репликации ДНК у E. coli регулируется, по крайней мере, на трех уровнях: 1) инициация синхронизирована с клеточным циклом; 2) синтез ДНК в каждой области начала репликации в клеточном цикле инициируется только один раз; 3) инициация происходит синхронно во всех областях начала репликации, присутствующих в данной бактериальной клетке. Установлено, что синтез ДНК начинается после того, как масса бактериальной клетки в расчете на одну область начала репликации достигает определенного значения, названного массой инициации (initiation mass). В качестве основного водителя ритма (пейсмекера), играющего ключевую роль в контроле инициации репликации, в настоящее время рассматривается белок DnaA.
Подавление синтеза белка in vivo сопровождается завершением уже инициированного синтеза ДНК на фоне прекращения новых раундов инициации. Возобновление синтеза белка приводит к инициации репликации после лаг-периода в одну клеточную генерацию. При наличии всех необходимых белков инициация чувствительна к рифампину – специфическому ингибитору бактериальной РНК-полимеразы, что указывает на зависимость инициации от синтеза нетранслируемой РНК.
Роль топологии oriC в инициации репликации. Топоизомераза I и топоизомераза II (ДНК-гираза) поддерживают бактериальную хромосому в негативно суперскрученном состоянии. Приблизительно половина супервитков нейтрализуется гистоноподобными белками HU, IHF и FIS, тогда как остающаяся сверхспирализация бактериальной хромосомы облегчает транскрипцию, репликацию и сайт-специфическую рекомбинацию. Предполагается, что бактериальная хромосома состоит из 40–50 суперскрученных доменов с 25 супервитками на 1 т.п.о. ДНК. В настоящее время отсутствуют точные данные о топологическом состоянии oriC, необходимом для инициации репликации у E. coli. Известно, что мутации в гене топоизомеразы topA супрессируют температурно-чувствительные мутации dnaA(Ts). Предполагается, что в этих мутантных штаммах топология oriC изменена таким образом, что допускает инициацию репликации при меньших внутриклеточных концентрациях белка DnaA. Кроме того, на важность определенного топологического состояния oriC для инициации указывает факт нарушения инициации у мутантных бактерий с измененным геном gyrB(Ts), кодирующим B-субъединицу ДНК-гиразы.
Активация репликации транскрипцией. В том случае, если сверхспирализация минихромосом или плазмид, содержащих oriC, недостаточна для инициации их репликации, инициация может происходить при одновременной транскрипции ДНК в окрестностях oriC. Изменение топологии oriC в этом случае может осуществляться за счет образования R-петель (ДНК–РНК-гибрида в двухцепочечной ДНК) или вследствие транскрипции, как таковой, при которой перед транскрибирующей РНК-полимеразой имеет место локальная положительная сверхспирализация ДНК, а вслед за ней – отрицательная. Это облегчает образование открытых комплексов при инициации синтеза ДНК.
Роль белка DnaA в регуляции инициации репликации.
60 минут необходимо бактерии для репликации хромосомной ДНК, разделения дочерних хромосом и подготовки к новому делению. Следовательно, клетки со временем генерации короче этого периода (например при повышенных температурах на богатых питательных средах) должны инициировать репликацию хромосом, предназначенных для последующих делений, до завершения предыдущего раунда репликации. Таким образом, в отдельной клетке может содержаться реплицирующаяся хромосома со множественными точками начала репликации. При этом инициация репликации на множественных областях начала репликации происходит одновременно.
Сверхпродукция DnaA в бактериях приводит к резкому возрастанию частоты инициаций репликации без изменения общей скорости синтеза ДНК, что указывает на DnaA как на позитивный регулятор этого процесса. Среди моделей, объясняющих механизм регуляторного действия белка DnaA наибольшее распространение получила модель титрования DnaA. В соответствии с этой моделью весь вновь синтезируемый белок DnaA связывается (титруется) DnaA-боксами oriC хромосомы. Как только количество молекул инициатора превышает число внутриклеточных DnaA-боксов (все DnaA-боксы оказываются занятыми белком), происходит инициация синтеза ДНК. После запуска инициации на одном oriC наблюдается освобождение молекул DnaA, резкое повышение его внутриклеточной концентрации и синхронная инициация синтеза ДНК на других доступных областях начала репликации. При этом ассоциация с мембранами первой oriC защищает ее от использования в реинициации.
Роль Dam-метилирования в инициации синтеза ДНК. Как уже упоминалось выше, Dam-метилтрансфераза E. coli модифицирует остатки аденина в последовательностях 5'-GATC. В результате репликации молекула ДНК временно превращается из полностью метилированной молекулы в метилированную по одной цепи, что позволяет клетке распознавать вновь синтезированную ДНК. Расположение кластеров Dam-сайтов в oriC энтеробактерий высококонсервативно (см. рис. I.47,а). Неметилированная или наполовину метилированная плазмидная ДНК в клетках dam-мутантов не реплицируется, хотя и служит субстратом в бесклеточной системе репликации. Репликация хромосомной ДНК у dam-мутантов начинается на oriC, однако контроль репликации нарушен, что проявляется в асинхронности репликации на множественных oriC. Оказалось, что лишь наполовину метилированная, но не полностью метилированная или неметилированная oriC-ДНК специфически связывается с фракцией мембран E. coli in vitro. При этом в быстро растущих клетках 1/3 времени генерации oriC-ДНК находится в наполовину метилированном состоянии, после чего полностью метилируется. То же самое характерно и для промотора гена инициатора DnaA, у которого метилированное наполовину состояние связано с подавлением транскрипции гена. В отличие от этого реметилирование вновь синтезированной цепи ДНК остальной части бактериальной хромосомы происходит быстро – в течение 1–2 мин. На основании такого рода данных высказывается предположение, что в не полностью метилированном состоянии вышеупомянутые последовательности экранированы бактериальными мембранами от контактов с регуляторными белками и не могут участвовать в повторном раунде инициации репликации (период эклипса). Мутации в гене seqA резко уменьшают время эклипса, что проявляется в асинхронности инициаций репликации. Белок SeqA оказался негативным регулятором инициации репликации, действующим на этапе взаимодействия oriC с бактериальными мембранами.
Роль белка SeqA в регуляции репликации бактериальных хромосом. Ген seqAкодирует белок длиной в 181 аминокислотный остаток, инактивация которого летальна для бактериальных клеток. Исследование взаимодействия этого белка с неметилированной, частично и полностью метилированной областями начала репликации методом смещения полос при электрофорезе в полиакриламидном геле показало его предпочтительное связывание с частично метилированными последовательностями. Однако для полной (контекст-зависимой) специфичности его взаимодействия требуется присутствие дополнительных факторов. Действительно, в составе ДНК-белковых комплексов, образованных с участием частично метилированных последовательностей oriC, обнаружен белок с молекулярной массой 24 кДа, который специфически взаимодействует с метилированной цепью ДНК в oriC. Скрининг клонотеки последовательностей E. coli позволил клонировать ген hobH(hemimethylated origin binding), кодирующий этот белок. Мутации по данному гену приводили к частичной утрате бактериальными клетками синхронизации в инициациях репликации, что также косвенно указывает на участие белка HobH в регуляции инициации репликации бактериальных хромосом на ранних стадиях клеточного цикла. Однако истинная роль этого белка в репликации окончательно не известна.
Период эклипса может заканчиваться в результате постепенного завершения метилирования частично метилированной последовательности oriC, находящейся в комплексе с мембранами. Полное метилирование этих последовательностей предотвращает их взаимодействие с мембранами и делает доступными для инициатора DnaA.
Терминация репликации. Встреча двух репликативных вилок в конце цикла репликации бактериальной хромосомы сопровождается несколькими событиями, которые необходимы для полного разделения двух образовавшихся бактериальных хромосом до деления клетки. Движение репликативных вилок навстречу друг другу сопровождается гомологичной рекомбинацией между дочерними хроматидами. В том случае, если количество произошедших рекомбинаций нечетное, образуется димер бактериальной хромосомы, тогда как при четном числе рекомбинаций – две катенированные (зацепленные друг за друга) хромосомы. Во втором случае разделение катенанов с помощью топоизомеразы IV приводит к полному разделению дочерних хромосом, тогда как в случае димера бактериальной хромосомы этого недостаточно. Разделение димера с образованием мономеров происходит в результате сайт-специфической рекомбинации в локусе dif под действием резольвазы (сайт-специфической рекомбиназы) XerCD.
4.2.2.Регуляция репликации плазмиды ColE1
Многие клетки прокариот в дополнение к основной хромосоме содержат небольшие внехромосомные ДНК, называемые плазмидами. Плазмиды, размеры которых варьируют от нескольких тысяч до сотен тысяч пар оснований, а число копий на клетку – от одной до нескольких сотен, способны к автономной (независимой от основной хромосомы) репликации и стабильно наследуются в ряду клеточных поколений. Хотя многие плазмиды дают клеткам-хозяевам ощутимые селективные преимущества (устойчивость к антибиотикам, тяжелым металлам и т.п.), большинство из них являются криптическими, т.е. не проявляющимися в видимом фенотипе клеток. Поскольку их существование – это весомая нагрузка на метаболизм клеток-хозяев, остается непонятным смысл их эволюционной стабильности. Несмотря на то что в природных условиях бактериальные клетки, по-видимому, не испытывают давления отбора, направленного на сохранение плазмид внутри клеток, последние с помощью тонких механизмов, регулирующих число их копий в клетках, стабильно сегрегируют между дочерними бактериальными клетками.
Область начала репликации небольшой плазмиды ColE1, несущей гены устойчивости к колицинам, традиционно используется в генной инженерии при конструировании векторных молекул ДНК, которые находят применение для клонирования и экспрессии в клетках E. coli коротких последовательностей нуклеотидов. Именно поэтому целесообразно рассмотреть механизмы контроля репликации плазмиды ColE1.
Инициация репликации плазмиды ColE1.Репликация плазмиды ColE1 происходит в одном направлении (однонаправленная репликация) с использованием репликативного аппарата клетки-хозяина. Сама по себе плазмида не кодирует ни одного фермента, который требовался бы для ее репликации. Область начала репликации содержит два промотора, один из них обеспечивает синтез РНК-праймера (РНК II), необходимого для инициации репликации плазмиды. Синтезированная РНК II, длина которой зависит от типа реплицируемой плазмиды, далее подвергается процессингу с помощью РНКазы H с образованием РНК длиной в 550 нуклеотидов. Эта молекула эффективно используется ДНК-полимеразой I в качестве праймера при синтезе ведущей цепи ДНК. В отсутствие РНКазы H затравкой во время репликации служит 3’-конец РНК II, хотя и с меньшей эффективностью. В клетках, дефектных по РНКазе H и ДНК-полимеразе , инициация репликации ColE1 осуществляется ДНК-полимеразой III с участием РНК II по механизму, подробно рассмотренному выше.
Все три механизма инициации репликации плазмиды основаны на уникальном свойстве РНК II образовывать стабильный ДНК–РНК-гибрид в области начала репликации. Действительно, обычные транскрипты освобождаются из транскрипционного комплекса после завершения транскрипции и отделения РНК-полимеразы от матрицы, чего не происходит с РНК II. Анализ мутантов плазмиды, дефектных по репликации, а также их ревертантов показал, что в стабильном гибриде РНК II с матрицей происходит взаимодействие между G-богатой петлей РНК II, образованной 265 нуклеотидами выше точки инициации репликации (положение –265), и С-богатым участком ДНК, расположенным в окрестностях нуклеотида –20 (рис. I.48,а). Обе эти последовательности оказались консервативными у родственных плазмид pMB1, p15A и KSF1030. Взаимодействия между указанными последовательностями, по-видимому, происходят в тот момент, когда РНК-полимераза еще находится в транскрипционном комплексе и цепи ДНК в окрестностях комплекса расплетены. Равновесие между двумя альтернативными конформациями РНК II является критическим в определении доли молекул РНК, остающейся в ДНК–РНК-гибриде, необходимом для инициации репликации плазмиды. Выбор между двумя альтернативными конформациями РНК II определяется первичной структурой участка, расположенного между нуклеотидами –359 и –380 (последовательность ) (см. рис. I.48,б). Эта последовательность может взаимодействовать с выше расположенной комплементарной последовательностью (структура ) или с гомологичной последовательностью , расположенной ниже (структура ). После того как РНК-полимераза транскрибирует первые 200 нуклеотидов, образовавшаяся РНК II формирует временную вторичную структуру, для которой характерно наличие трех доменов типа "стебель–петля" (I, II и III). Удлинение РНК II еще на несколько нуклеотидов приводит к разрушению стебля III и образованию стебля IV, который стабилизируется в результате комплементарных взаимодействий между последовательностями и . В течение последующей элонгации РНК II у нее возникают две альтернативные возможности формировать свою вторичную структуру. Выбор в пользу той или иной конформации зависит от того, останется ли последовательность связанной с последовательностью или же образует новые контакты с -последовательностью. Переход от комплементарных пар к сопровождается сильными изменениями конформации РНК II, которые в конечном счете определяют ее способность служить праймером при репликации плазмиды. Молекулы РНК II в конформации могут образовывать РНК–ДНК-гибрид, служащий субстратом для РНКазы H, а в конформации такой способностью не обладают. Предложенная модель подтверждается, прежде всего, тем, что мутации, делающие предпочтительным образование конформации из-за дестабилизации стебля IV, затрудняют функционирование РНК II в качестве праймера и приводят к понижению числа копий плазмиды ColE1 внутри бактериальных клеток. Такие мутантные плазмиды, дефектные по репликации, активизируются в результате супрессорных мутаций, стабилизирующих стебель IV. Таким образом, инициация репликации плазмиды ColE1 зависит от способности РНК II образовывать РНК–ДНК-гибрид вблизи точки начала репликации (ori). При этом на образование гибрида оказывают влияние вторичная и третичная структуры выше расположенной последовательности нуклеотидов предшественника праймера.
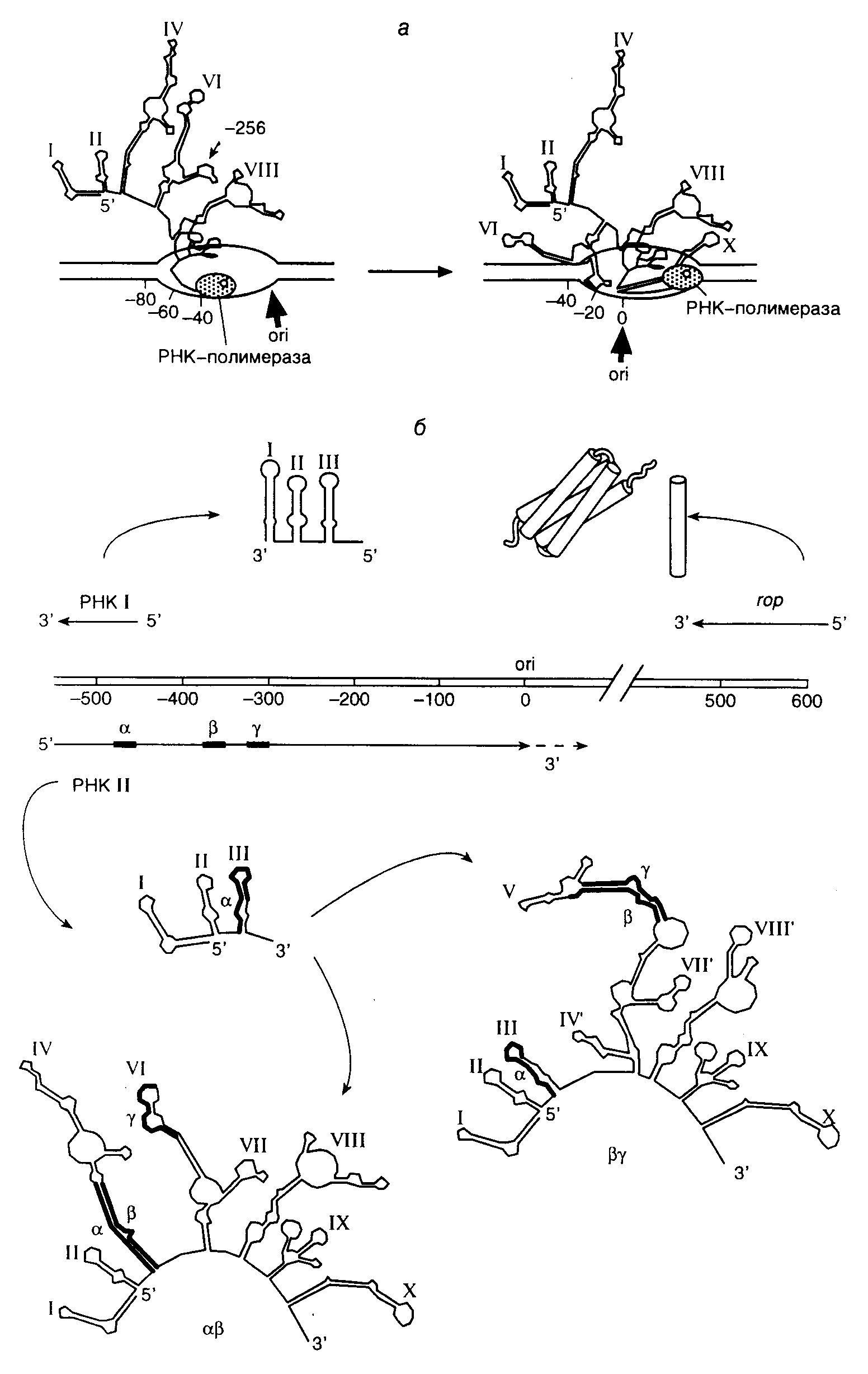
Рис. I.48. Схема регуляции репликации плазмиды ColE1
а – предполагаемая вторичная структура РНК II, после транскрибирования РНК-полимеразой 500 нуклеотидов ДНК плазмиды; дальнейшее удлинение РНК II сопровождается образованием ДНК–РНК-гибрида (жирная стрелка) между РНК II и транскрибируемой ДНК;
б – возможный механизм контроля репликации плазмиды. В верхней части рисунка изображена генетическая карта участка ДНК, необходимого для инициации репликации плазмидной ДНК и ее контроля. Схематически представлены пространственные структуры двух ингибиторов репликации плазмиды: РНК I и белка Rop. В нижней части изображены две альтернативные конформации РНК II, образующиеся под действием РНК I, I–X – элементы вторичной структуры
Контроль числа копий плазмиды ColE1. Контроль инициации репликации плазмиды ColE1 осуществляется главным образом на уровне изменения пространственной структуры РНК II. Поскольку плазмиды контролируют собственный биосинтез, т.е. их репликация проходит по аутокаталитическому механизму, было постулировано, что инициация репликации ColE1 находится под влиянием ингибитора, кодируемого плазмидой, концентрация которого в клетке тем выше, чем больше число внутриклеточных копий плазмиды. Действительно, анализ механизмов репликации мутантных плазмид, для которых характерна высокая копийность, позволил выявить два транс-действующих фактора, кодируемых плазмидой и оказывающих влияние на репликацию плазмиды in vivo.
Основным ингибитором репликации оказалась небольшая РНК длиной в 108 нуклеотидов, названная РНК I, полностью комплементарная 5’-концевой последовательности предшественника праймера (РНК II). Промотор гена РНК I расположен в области начала репликации плазмиды ColE1 и направлен в противоположную сторону по отношению к промотору РНК II (см. рис. I.48). Комплементарные взаимодействия между РНК I и РНК II оказывают влияние на образование пространственной структуры РНК II таким образом, что предпочтительно возникает конформация βγ, неактивная в отношении инициации репликации (см. рис. I.48,б, внизу справа).
Взаимодействие между РНК I и РНК II происходит продуктивно лишь до тех пор, пока синтезируется короткий транскрипт РНК II длиной не более 80 нуклеотидов. Хотя взаимодействие РНК I с такой короткой последовательностью нуклеотидов происходит медленнее, чем с транскриптом длиной в 360 нуклеотидов, в последнем случае РНК I не оказывает влияния на конформацию 5’-концевой части РНК II и на ее способность функционировать в качестве затравки при репликации плазмиды (конформация αβ, рис. I.48,б, внизу слева). Из этого ясно, что скорость образования гибридов между РНК I и РНК II является определяющей для эффективного функционирования механизма регуляции репликации плазмиды. Процесс взаимодействия РНК I и РНК II в настоящее время детально изучен. Он проходит через образование нескольких промежуточных продуктов и завершается получением стабильного гибрида между полностью комплементарными друг другу РНК I и 5’-концевой областью РНК II.
РНК-организующий белок Rop.Ген второго компонента, негативно регулирующего репликацию плазмиды ColE1, картирован непосредственно за областью начала репликации. Этот ген кодирует 63-звенный белок, названный Rop (repressor of primer), существующий в растворе в виде димера. Как in vivo, так и in vitro Rop усиливает ингибирующую активность РНК I, не оказывая влияния на синтез РНК II. При этом Rop влияет на начальные фазы взаимодействия РНК I и РНК II, облегчая переход очень нестабильного промежуточного продукта С* в более стабильный – Сm*. Белок Rop обладает высоким сродством к С* и лишь слабо взаимодействует с изолированными РНК I и РНК II in vitro. Предполагают, что Rop проявляет незначительную специфичность в отношении последовательностей нуклеотидов и распознает некоторые общие особенности структуры комплекса РНК I–РНК II, возникающего на ранних этапах их взаимодействия. Таким образом, функции белка Rop, по-видимому, заключаются в преобразовании нестабильного комплекса РНК–РНК в более стабильный, что, в свою очередь, сопровождается подавлением формирования праймера, необходимого для инициации репликации плазмиды ColE1.
Использование антисмысловых РНК в контроле репликации бактериальных плазмид является распространенным приемом. В частности, репликация небольшой, низкокопийной плазмиды R1 контролируется белком RepA, который участвует в инициации репликации плазмиды в качестве позитивного регуляторного фактора. Синтез RepA, в свою очередь, регулируется посттранскрипционно с помощью небольшой антисмысловой РНК CopA, которая связывается с RepA-мРНК в результате многоступенчатой реакции, напоминающей образование гибрида между РНК I и РНК II, рассмотренное выше. Такое взаимодействие подавляет экспрессию гена repA, возможно, вследствие расщепления РНК–РНК-дуплекса РНКазой III. Внутриклеточная концентрация антисмысловой CopA-РНК прямо пропорциональна числу копий плазмиды R1. Аналогичный механизм описан и для регуляции инициации репликации плазмиды pT181 Staphylococcus aurеus.
При получении бактериальных векторов для генной инженерии, многие из которых содержат область начала репликации плазмиды ColE1, с целью повышения числа их копий в бактериальных клетках часто используют ингибиторы биосинтеза белка, в частности хлорамфеникол. После обсуждения механизмов регуляции контроля репликации этой плазмиды становятся понятными принципы, на которых основан данный прием. Действительно, внесение в культуральную среду хлорамфеникола блокирует биосинтез бактериальных белков, в том числе, и белка Rop, который необходим для эффективного подавления инициации репликации плазмиды под действием РНК I. В результате нарушается контроль копийности плазмид в бактериальных клетках, и они начинают непрерывно реплицироваться, используя для этой цели предварительно синтезированные бактериальные белки.
Известно, что две фенотипически различающиеся плазмиды, использующие одинаковый механизм контроля репликации, несовместимы в одной бактериальной клетке. Клетки, содержащие две плазмиды из разных групп совместимости, в процессе размножения быстро образуют две популяции, каждая из которых содержит только один тип плазмид. Это происходит вследствие случайного выбора плазмид для репликации внутри бактериальных клеток и случайного распределения исходного пула плазмид по дочерним клеткам. Эволюционное возникновение механизма контроля репликации бактериальных плазмид с использованием антисмысловых РНК расширило возможности появления плазмид, принадлежащих к разным группам совместимости и сосуществующих в одних и тех же бактериальных клетках. Действительно, несмотря на использование одного и того же механизма, антисмысловые РНК, обладающие разными последовательностями нуклеотидов, не смогут узнавать "чужие," гетерологичные РНК-мишени. Это позволяет таким плазмидам сосуществовать в одной бактериальной клетке и создает условия для их более широкого распространения в природных популяциях микроорганизмов.
4.3.Особенности репликации линейных геномов
Кольцевые замкнутые геномы характерны для многих бактерий, их плазмид и некоторых вирусов. У подавляющего большинства других организмов геном представлен линейными молекулами ДНК в составе одной или нескольких хромосом. Размышления о механизмах репликации линейных молекул ДНК породили так называемую проблему отстающей цепи ДНК, которая в природных условиях решается весьма эффективно. Проблема заключается в том, что синтез отстающей цепи ДНК, как уже было показано выше, происходит в виде коротких фрагментов Оказаки, для инициации синтеза которых требуются РНК-затравки (рис. I.49). После удаления затравки на конце, по крайней мере, одной из вновь синтезированных в процессе репликации молекулы ДНК образуется одноцепочечная брешь, которая не может быть заполнена ДНК-полимеразой, поскольку она не функционирует в отсутствие праймера. Вследствие этого в каждом раунде репликации должно было бы происходить укорачивание хромосом с обоих концов, что приводило бы к потере генетической информации, закодированной в концевых фрагментах ДНК. Кроме того, большие размеры молекул ДНК, заключенных в индивидуальные хромосомы, требуют специальной организации их реплицирующего аппарата. В соответствии с этим представляется целесообразным кратко рассмотреть особенности репликации ДНК линейных геномов.
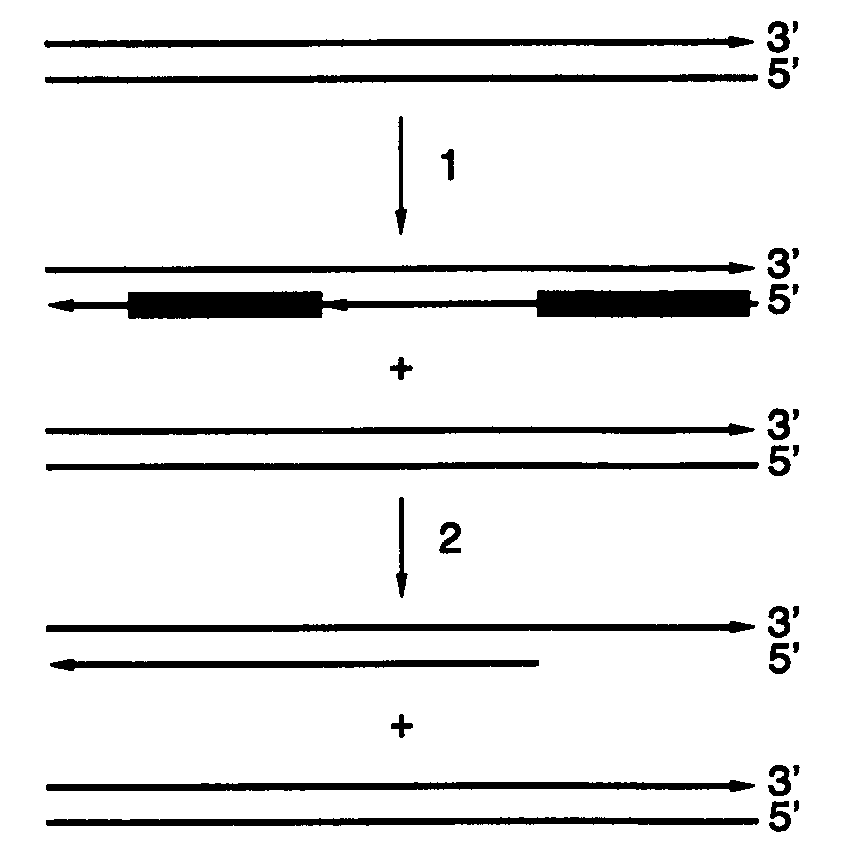
Рис. I.49. Проблема репликации отстающей цепи ДНК линейных хромосом
1 – отстающая цепь реплицирующейся ДНК синтезируется с использованием фрагментов Оказаки, содержащих на 5’-концах РНК-затравки (зачерненные прямоугольники); 2 – по завершении синтеза затравки удаляются и фрагменты лигируются с образованием бреши на 5’-конце вновь синтезированной цепи ДНК, прилегающем к концу хромосомы
4.3.1.Линейные хромосомы бактерий
Афоризм Жака Моно: "То, что верно для E. coli, – верно и для других бактерий (слона)" получил широкое распространение. К счастью, на деле все обстоит не так скучно. До недавнего времени общепринятым было представление о кольцевой структуре бактериальных хромосом. Однако в 1989 г. была впервые описана у спирохеты Borrelia burgdorfery линейная бактериальная хромосома, которую идентифицировали с помощью электрофореза в импульсном электрическом поле. Размер этого генома составлял всего 960 т.п.о. Вскоре было обнаружено, что линейная и кольцевая хромосомы сосуществуют одновременно у Agrobacteriumtumefaciens, а у грамположительных бактерий рода Streptomyces, обладающих одним из самых больших бактериальных геномов (8000 т.п.о.), имеется одна линейная хромосома. Представитель актиномицетов Rhodococcusfascians также, по-видимому, обладает линейной хромосомой. Линейные хромосомы у бактерий часто сосуществуют с линейными плазмидами и широко распространены в природе.
Линейные хромосомы и плазмиды наиболее хорошо изученных бактерий рода Streptomyces содержат концевые инвертированные повторы (terminal inverted repeats – TIRs), с которыми ковалентно связаны концевые белки (TP). Несмотря на то что подобные структуры характерны для хромосом аденовирусов и бактериофага 29 Bacillus subtilis, механизм репликации хромосом стрептомицетов существенно отличается от такового вирусных геномов. Если у вирусов синтез ДНК инициируется на конце хромосомы с использованием в качестве затравки TP, ковалентно связанного с нуклеотидом, и продолжается через весь геном до его конца, то репликация хромосомы и линейных плазмид стрептомицетов начинается с внутренней области начала репликации oriC. Синтез ДНК распространяется в обе стороны от области начала репликации по стандартному полуконсервативному механизму и завершается на концах линейных молекул ДНК с образованием 3’-концевых брешей (рис. I.50,а). Наиболее простым решением проблемы заполнения этой бреши могла бы быть прямая инициация репликации теломерных участков хромосом с TP-белка, ковалентно связанного с инициирующим нуклеотидом, что имеет место у аденовирусов (см. рис. I.50,б). Действительно, стрептомицеты используют ТР для репликации теломерных участков, однако механизм распознавания теломер в данном случае существенно отличается. В настоящее время рассматриваются три модели заполнения брешей в теломерных участках линейных хромосом бактерий.
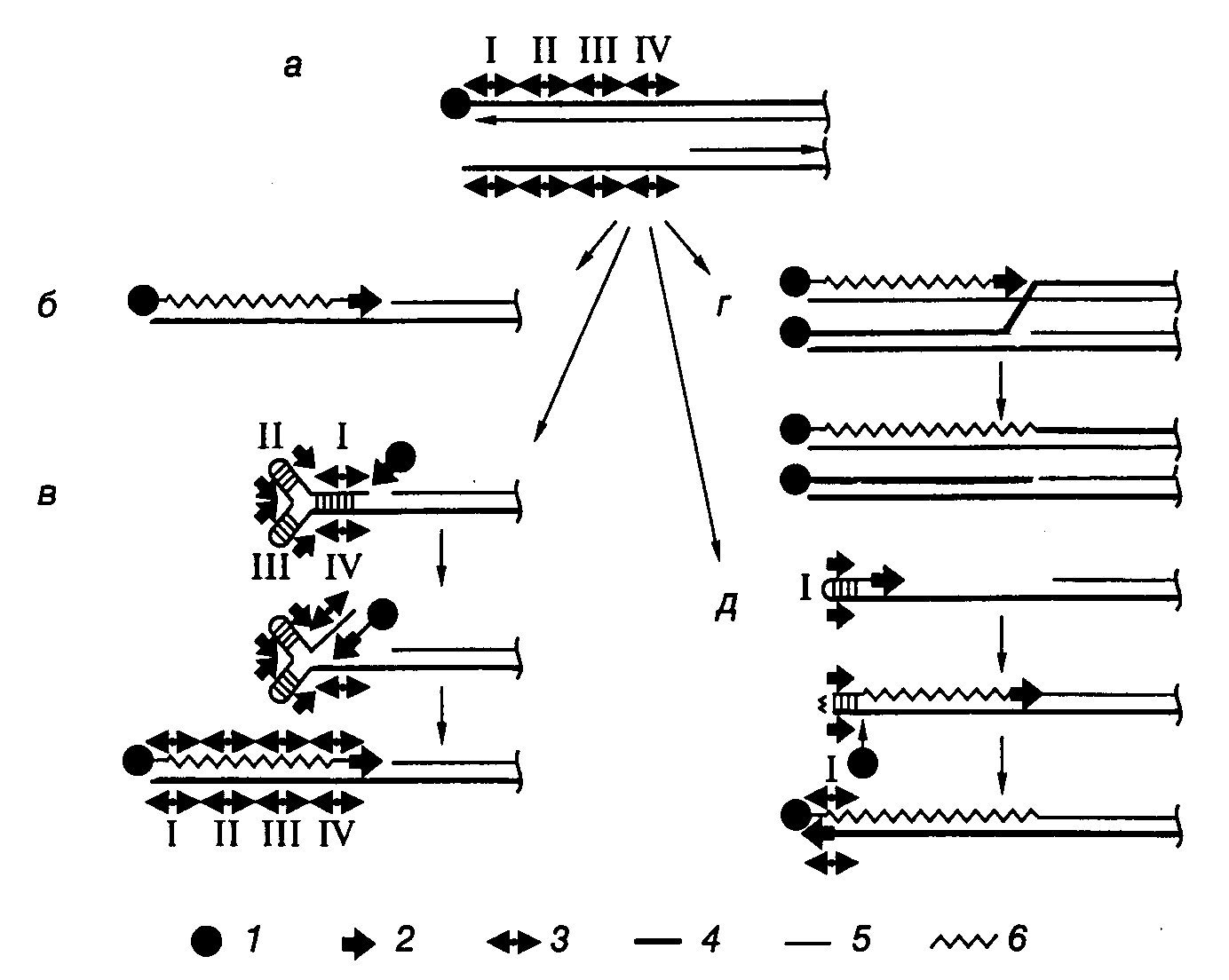
Рис. I.50. Модель достройки теломерных участков хромосом и плазмид Streptomyces
а – структура теломеры после репликации: верхняя цепь ДНК полностью реплицирована, в нижней имеется одноцепочечная брешь, обозначены четыре палиндромные последовательности нуклеотидов; б – маловероятный механизм с участием концевого белка и ДНК-полимеразы; в–д – альтернативные модели репликации, основанные на других механизмах. 1 – концевой белок, 2 – ДНК-полимераза, 3 – палиндром, 4 – родительская цепь ДНК, 5 – дочерняя цепь, 6 – репаративный синтез
В соответствии с первой моделью одноцепочечный участок теломеры, содержащий TIR-последовательность, образует концевую шпильку путем комплементарных взаимодействий нуклеотидов внутренних участков бреши и 3’-концевых нуклеотидов (см. рис. I.50,в). В этом случае синтез ДНК, репарирующий одноцепочечную брешь, инициируется на двухцепочечном участке, образованном палиндромными последовательностями I-IV, с участием ТР и ДНК-полимеразы и продолжается вдоль 3’-концевого одноцепочечного участка хромосомы. Согласно второй модели ТР инициирует репликацию на полностью двухцепочечной дочерней ДНК, вытесняя 5’-концевую цепь родительской ДНК, с которой связан ТР (см. рис. I.50,г). Вытесняемая цепь далее спаривается с выступающим 3’-концом хромосомы, после чего такая разветвленная структура разрешается с помощью гомологичной рекомбинации. Эта модель предполагает участие в заполнении брешей белка RecA (для переноса цепи ДНК) и продуктов генов ruv (для разрешения структуры Холидея), что подтверждается генетическими данными. В третьей модели одноцепочечный палиндром I образует шпильку, 3’-конец которой служит затравкой для синтеза ДНК, в результате которого заполняется брешь (см. рис. I.50,д). ТР образует одноцепочечный разрыв напротив первоначального 3’-конца, который является затравкой для последующего синтеза ДНК. В результате шпилька разворачивается и восстанавливается структура теломеры. Эта модель аналогична модели "катящейся шпильки", предложенной для объяснения механизма репликации генома парвовирусов. В данной модели роль ТР отличается от его функций в качестве белка-затравки в рассмотренных выше примерах.
Неизвестно, как много форм линейных бактериальных хромосом существует в природе. Не изучены и таксономические проблемы, связанные с топологией хромосом в царстве эубактерий. Если каждый тип хромосом характерен для отдельного таксономического домена, то можно предполагать, что топология хромосом играет важную роль в эволюции бактерий. Альтернативно топологические взаимопревращения хромосом могут быть относительно частыми событиями, а линейные и кольцевые хромосомы присутствуют только у близких видов бактерий. Нестабильность хромосом стрептомицетов (образование протяженных делеций и амплификация последовательностей нуклеотидов) недавно стали связывать с перестройками в их концевых участках, часть из которых сопровождалась образованием кольцевых хромосом. Таким образом, эволюционная роль топологии бактериальных хромосом может быть определена только в результате будущих исследований.
4.3.2.Репликаторы эукариот
Хромосомы эукариот содержат линейные молекулы ДНК, а следовательно, остаются все те же проблемы, связанные с их репликацией, которые обсуждались в связи с воспроизводством линейных хромосом бактерий. Однако проблемы, которые эукариотическим клеткам необходимо решить при редупликации своих хромосом, несомненно серьезнее, так как размер заключенной в них ДНК значительно превышает размеры хромосомных ДНК бактериальных клеток. Кроме того, в связи с многоклеточностью большинства эукариот возникает необходимость более тонкой координации репликации ДНК в отдельных полностью дифференцированных и дифференцирующихся клетках, что является одной из основных целей регуляции клеточного цикла у данных организмов. В связи с этим организация репликации ДНК у эукариот характеризуется рядом существенных особенностей.
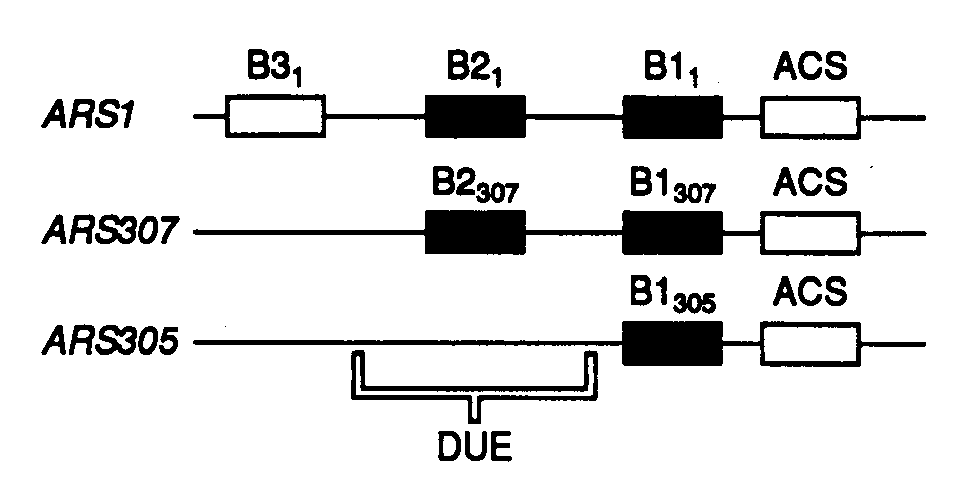
Рис. I.51. Структура репликаторов дрожжей S. cerevisiae
Обозначено взаимное расположение различных регуляторных элементов в репликаторах ARS1, ARS307 и ARS305. ACS – каноническая последовательность ARS, DUE – ДНК-расплетающий элемент. Подстрочные индексы указывают на принадлежность регуляторных элементов соответствующим репликаторам
Инициация репликации у эукариот происходит на специфических множественных последовательностях нуклеотидов – репликаторах. Наиболее изученными являются репликаторы дрожжей S. cerevisiae, впервые идентифицированные как автономно реплицирующиеся последовательности (ARS – autonomously replicating sequence), способные поддерживать внехромосомную репликацию плазмид в дрожжевых клетках. Исследование структуры ARS1 показало, что этот хромосомный элемент состоит из нескольких коротких регуляторных последовательностей. Аналогичная организация характерна и для других ARS дрожжей (рис. I.51). В частности, ARS307 в дополнение к канонической последовательности ACS, общей для всех ARS, содержат еще два элемента – B1 и B2, которые необходимы для выполнения репликатором своих функций in vivo. Несмотря на то что эти последовательности в разных репликаторах не строго консервативны, внутри групп (B1, B2 и т.п.) они функционально взаимозаменяемы. Изменение положения по отношению к ACS предотвращает их функционирование.
Первым этапом инициации репликации у дрожжей является взаимодействие регуляторных последовательностей репликатора, по крайней мере, с шестью различными белками, которые образуют комплекс, распознающий область начала репликации ORС (origin-recognition complex). ARS определяет место инициации репликации в клетках дрожжей. Элемент B3 ARS1 взаимодействует с белком Abf1, который стимулирует репликацию доменом, характерным для белков-активаторов транскрипции, тогда как B1 взаимодействует с ORC. Остающиеся регуляторные последовательности области начала репликации дрожжей образуют ранее неизвестный элемент, названный ДНК-расплетающим элементом DUE (DNA-unwinding element), который, как полагают, облегчает раскручивание цепей ДНК при инициации репликации. Точковые мутации в элементе B2 не влияют на функции репликатора, что является общим свойством структурных элементов, тогда как мутации в ACS, B1 и B3 нарушают инициацию репликации, как и следовало ожидать от регуляторных элементов нуклеиновых кислот, взаимодействующих с белками.
Исследования репликаторов у дрожжей S. pombe показали, что область начала репликации ura4 включает в себя три отдельных репликатора, которые располагаются на участке ДНК длиной в 5 т.п.о. У млекопитающих области начала репликации располагаются на расстоянии 100 т.п.о. друг от друга; часть их уже удалось клонировать и изучить на молекулярном уровне. Установлено, что синтез ДНК в отдельных репликонах происходит по двум направлениям, причем перемещение репликативной вилки осуществляется предпочтительно в одном направлении, которое может изменяться в зависимости от стадии развития организма и уровня экспрессии генов, содержащих репликаторы. Частота использования отдельных репликаторов изменяется в онтогенезе, уменьшаясь в клетках взрослого организма. Сравнение первичных структур шести отдельных репликаторов эукариот показало, что все они содержат DUE-элементы, участки прикрепления к ядерному матриксу (SAR/MAR), канонические ARS-последовательности дрожжей, пиримидиновые тракты, а также ранее неидентифицированную каноническую последовательность WAWTTDDWWWDHWGWHMAWTT, где W = A/T, D = A/C/T, H = A/C/T, a M = A/C. Имеются отдельные сообщения о том, что в репликаторах животных присутствуют пуриновые тракты, канонические последовательности, взаимодействующие с факторами транскрипции и белками репликативного комплекса, энхансерный октамерный мотив, сайты связывания продуктов онкогенов, AT-богатые последовательности и участки перегибов (bent) ДНК. В настоящее время до конца непонятно, какое непосредственное отношение имеют все эти регуляторные последовательности к инициации репликации ДНК. Предполагается, что многие из них участвуют в регуляции транскрипции (а следовательно, и регуляции экспрессии генов) как таковой, поскольку большинство из известных в настоящее время репликаторов локализованы в 5’-концевых последовательностях функционирующих генов.
4.3.3.Репликация теломерных участков эукариотических хромосом
Исследование механизмов репликации теломерных участков эукариотических хромосом показало, что они принципиально отличаются от механизмов репликации центральных областей ДНК. Изучение этих механизмов длительное время сдерживалось тем, что в клетках животных количество хромосом, а следовательно, и теломерных участков, невелико – они составляют лишь небольшую часть от всех остальных последовательностей. Прорыв произошел в 1978 г., когда в качестве объекта исследований Е. Блэкберн стала использовать простейшее жгутиковое – Thetrahymena, в клетках которого содержатся тысячи линейных хромосом. Было установлено, что теломеры тетрахимены построены из коротких повторяющихся последовательностей. Вскоре стало ясно, что такая структура характерна для теломерных участков хромосом всех исследованных эукариот. В частности, у человека теломеры содержат единственный повтор GGGTTA. Длина ДНК в теломерах хромосом человека варьирует и в клетках зародышевой линии составляет 10–15 т.п.о, а в лейкоцитах периферической крови – 5–12 т.п.о. У дрожжей длина теломер приближается к 300 п.о., и они составлены неидентичными повторами C1 3A/TG1-3. Таким образом, для теломерных участков хромосом характерна значительная гетерогенность в разных клетках и тканях даже одного организма. Еще более разительными оказываются межвидовые различия в размерах теломер – от 50 п.о. в клетках жгутиковых до 50 т.п.о. у одного из видов мышей.
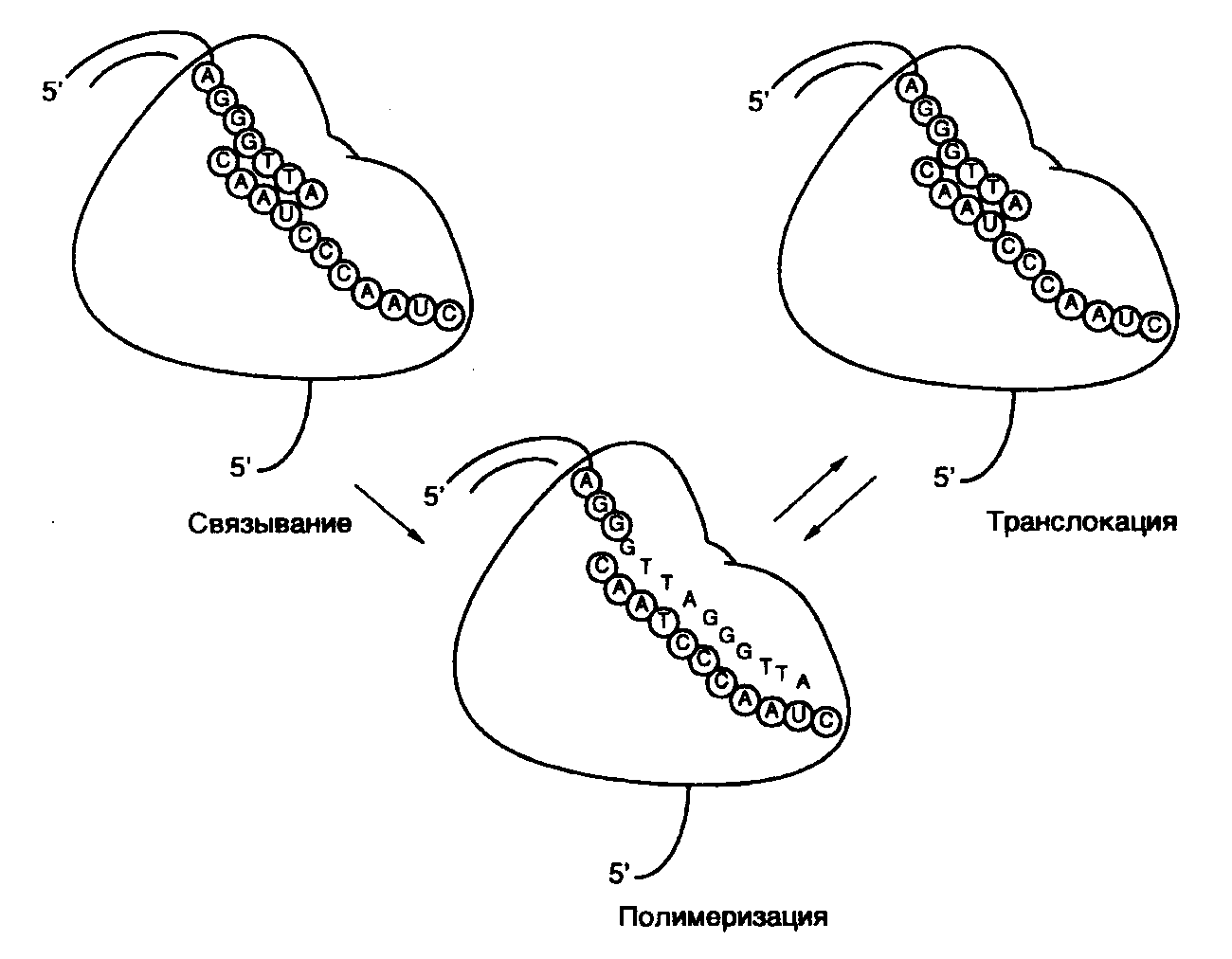
Рис. I.52. Механизм функционирования теломеразы
Изображено комплементарное взаимодействие внутренней матричной молекулы РНК теломеразы с ДНК теломерного участка хромосомы
Синтез теломерных последовательностей ДНК осуществляется специальными ферментами – теломеразами, для которых нет аналогов среди других известных нуклеотидилтрансфераз. Особенностью этих ферментов является присутствие у них в качестве составной части короткого фрагмента РНК – компонента, абсолютно необходимого для их функционирования и служащего матрицей при синтезе теломерных последовательностей хромосом (рис. I.52). Комплементарное взаимодействие внутренней РНК теломеразы с 3’-концевым выступающим одноцепочечным сегментом ДНК хромосомы инициирует синтез теломерных последовательностей. При этом 3’-концевой фрагмент ДНК служит затравкой для удлинения этой ДНК на РНК-матрице. После удлинения (элонгации) выступающей цепи ДНК до конца матрицы происходит транслокация фермента на один теломерный повтор вперед относительно матрицы с освобождением последовательности матричных нуклеотидов, после чего он готов для вступления в следующий цикл элонгации только что добавленной 3'-концевой последовательности хромосомы. После завершения удлинения одноцепочечной 3'-концевой теломерной последовательности вторая цепь ДНК достраивается обычным способом. Таким образом происходит решение "проблемы отстающей цепи ДНК" при репликации ДНК у эукариот.
Наличие у животных тканеспецифичности в распределении теломер по размерам, а также изменение размеров этих последовательностей в онтогенезе предполагают существование механизмов, регулирующих данный процесс. Создается впечатление, что для активной пролиферации клеток теломерные последовательности не должны становиться короче определенного порогового размера. Недавние исследования обнаружили резкое повышение активности теломераз, характерное для опухолевых клеток, что служит в настоящее время чувствительным физиологическим маркером их злокачественного перерождения. В этой связи сегодня в качестве одного из подходов к терапии опухолей рассматривают подавление активности теломераз, функционирование которых, как полагают, необходимо для иммортализации клеток и роста опухолей. Именно благодаря таким свойствам теломеразы в последнее время вызывают особый интерес, что сопровождается расширением исследований в данной области молекулярной генетики.
4.3.4.Пространственная организация синтеза ДНК у эукариот
Пространственная организация репликативного синтеза ДНК у эукариот является одним из наиболее ярких примеров внутриядерной компартментализации генетических процессов. Анализ локализации мест синтеза ДНК в ядрах млекопитающих с использованием импульсной метки бромдезоксиуридина или биотинилированного dUTP обнаруживает всего 150 мест включения этих предшественников (центров репликации), которые приблизительно равномерно удалены друг от друга. Во время инициации синтеза ДНК размер этих центров мал, и они обнаруживаются в виде небольших четко очерченных "точек", которые со временем становятся более диффузными. В данных центрах репликации происходит аккумуляция белков, участвующих в синтезе ДНК: ДНК-полимеразы , PCNA и RP-A, а также регуляторных молекул типа циклина А, cdk2 и RPA70. Иммунохимическими методами с использованием частиц коллоидного золота было показано, что растущие цепи ДНК выходят из центров репликации. Это позволяет предполагать, что во время репликативного синтеза цепи ДНК перемещаются через фиксированные внутри ядра структуры аппарата репликации. Такая внутриядерная компартментализация синтеза ДНК позволяет концентрировать регуляторные, структурные и ферментативные компоненты, участвующие в репликации и поддержании пространственной структуры хромосом. Ступенчатая сборка функционально активных элонгирующих комплексов в микрокомпартментах ядра предоставляет большие возможности для регуляции инициации репликативного синтеза ДНК.
Роль ядерных пространственных структур в обеспечении функциональных свойств ДНК можно рассмотреть на примере репликации хромосом в ооцитах Xenopus laevis. Инъекция прокариотической ДНК в ооциты или ее добавление к экстрактам ооцитов сопровождается образованием псевдоядер, компетентных в отношении репликации ДНК. Репликация в таких системах пространственно упорядочена: она происходит в дискретных участках ДНК, содержащих кластеры репликативных вилок. При этом наблюдается замечательная корреляция между числом и пространственным распределением центров репликации в искусственных псевдоядрах и ядрах культивируемых клеток, находящихся в S-фазе. Следовательно, сборка функционирующих комплексов, способных инициировать репликацию, не находится в строгой зависимости от последовательностей нуклеотидов ДНК хромосом, но в большой степени зависит от внутренней пространственной структуры ядра и может эффективно происходить даже на прокариотических ДНК. Это означает, что пространственная структура ядра может непосредственно контролировать его функции, в данном случае – инициацию репликации хромосом. Следует, однако, иметь в виду, что на ранних эмбриональных стадиях развития Xenopus контроль репликации ослаблен, и число зон начала репликации значительно больше, чем в соматических клетках. Нормальный контроль репликации устанавливается после увеличения продолжительности клеточного цикла на стадии средней бластулы.
В нормальных соматических клетках не все центры репликации одновременно начинают синтез ДНК. Некоторые из них функционируют в ранней, а некоторые в поздней S-фазе клеточного цикла. Такая дифференциальная репликация хромосом является важным регуляторным механизмом, обеспечивающим локальную организацию хроматина и активность генов. Аналогичное явление обнаружено в клетках дрожжей, где функционирование во времени центров репликации зависит от положения хромосом в ядре.
|
 Скачать 5.83 Mb.
Скачать 5.83 Mb.






