Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
3.5.Синтез белков, содержащих остатки селеноцистеинаС помощью своеобразного механизма осуществляется передача генетической информации от генов к полипептидным цепям селенопротеинов с необычным аминокислотным остатком – селеноцистеином, входящим в их состав. У бактерий и млекопитающих известно более десяти ферментов, в состав активных центров которых входит остаток селеноцистеина, содержащего, в отличие от цистеина, атом селена вместо атома серы. Так, у E. coli гены форматдегидрогеназ H, N или O имеют в одной рамке считывания с кодирующей последовательностью нуклеотидов триплет TGA. Этому триплету в мРНК соответствует бессмысленный кодон UGA, на котором у подавляющего большинства других мРНК E. coli происходит терминация трансляции. Оказалось, что именно кодон UGA в мРНК вышеупомянутых генов кодирует селеноцистеин. Встраивание этого аминокислотного остатка в полипептидные цепи регулируется весьма тонким механизмом. Перенос остатка селеноцистеина к рибосомам у E. coli осуществляется с помощью специальных молекул тРНК (тРНКSec), которые на первом этапе соединяются с остатком L-Ser при участии серил-тРНК-синтетазы. Образовавшаяся серил-тРНКSec далее в результате многоступенчатого процесса под действием селеноцистеилсинтазы превращается в селеноцистеил-тРНКSec. Селеноцистеилсинтаза обладает высокой специфичностью и не взаимодействует с другими изоакцепторными серил-тРНК бактериальных клеток. Именно селеноцистеил-тРНКSec в процессе трансляции распознает в мРНК кодон UGA, но лишь в определенном контексте: для правильного узнавания UGA-кодона как осмысленного важна последовательность длиной в 45 нуклеотидов, расположенная вслед за UGA-кодоном. Кроме того, для правильного узнавания UGA-кодона селеноцистеил-тРНКSec необходимо участие белкового продукта гена selB, который является гомологом фактора элонгации трансляции EF-Tu и обладает высоким сродством именно к селеноцистеил-тРНКSec, но не к серил-тРНКSec. К тем же результатам, хотя и с использованием другого, не вполне понятного механизма, приводит встраивание в полипептидные цепи остатков селеноцистеина у млекопитающих. Рассмотренный пример показывает, что при необходимости живой организм может изменять смысл стандартного генетического кода. В этом случае генетическая информация, заключенная в генах, кодируется более сложным образом. Смысл кодона определяется лишь в контексте с определенной протяженной последовательностью нуклеотидов и при участии нескольких высокоспецифических белковых факторов. Данный пример по-новому освещает понятие гена и смысл заключенной в нем генетической информации и не является единственным в своем роде. Описано изменение смысла антикодона в тРНК путем посттранскрипционной модификации остатка цитозина с образованием так называемого лизидина. В этом случае происходит ферментативное присоединение Lys к гетероциклу цитидина в положении 2. В результате образовавшееся модифицированное основание – лизидин распознается как уридин, что изменяет специфичность антикодона модифицированной тРНК. Другое U-подобное азотистое основание – 5-карбамоилметилуридин (U*), обнаружено в антикодоне тРНКPro (U*GG), хотя в соответствующем гене этот антикодон детерминирован последовательностью CGG. По-видимому, здесь происходит посттранскрипционное дезаминирование цитозина с последующей его гипермодификацией. Таким образом, во всех приведенных примерах живым организмам недостаточно генетической информации, заключенной в их генах, для ее полноценной реализации в фенотипе. Пока не понятны причины, по которым организм избегает прямого кодирования соответствующих последовательностей нуклеотидов в своих генах, а предпочитает создание требуемых последовательностей в РНК путем посттранскрипционных модификаций первичных транскриптов. Такие факты меняют наше традиционное представление о генах как первичных носителях генетической информации. 3.6.Посттрансляционная регуляция экспрессии геновСинтезом полноценного полипептида в результате трансляции кодирующей его мРНК рибосомами обычно завершается процесс передачи генетической информации от генов к белкам как у бактерий, так и у высших организмов. Однако в большинстве случаев при синтезе конечного белкового продукта эукариотическими клетками используются различные его модификации, в результате которых он и приобретает требуемые свойства. Кроме того, необходимо иметь в виду, что конечный уровень содержания конкретных белков в клетке зависит не только от скорости их биосинтеза рибосомами, но и от скорости внутриклеточной деградации. Поэтому дифференциальная регуляция стабильности белков является важнейшим механизмом, регулирующим экспрессию генов у любого организма. В этом разделе рассмотрены примеры посттрансляционных модификаций полипептидов, которые необходимы для получения физиологически активных пептидов или белков, т.е. завершения полноценной экспрессии конкретных генов. 3.6.1.Последствия фолдинга вновь синтезированных полипептидных цепейВ процессе трансляции растущие полипептидные цепи начинают приобретать высокоспецифическую пространственную структуру, которая формируется полностью вскоре после завершения их биосинтеза. Процесс сворачивания полипептидной цепи в правильную пространственную структуру получил название фолдинга. В результате фолдинга в водных растворах у водорастворимого полипептида уменьшается свободная энергия, гидрофобные остатки аминокислот упаковываются преимущественно внутрь молекулы, а гидрофильные остатки располагаются на поверхности белковой глобулы. Гидрофобные области образуются и на внешней поверхности молекул белков, формируя полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и биологическими мембранами. Увеличение гидрофобности поверхности белков снижает их внутриклеточную стабильность, так как множество протеолитических ферментов гидролизуют с большой скоростью пептидные связи, образуемые гидрофобными аминокислотами или находящиеся вблизи от них. Опасность протеолитической деградации для растущей полипептидной цепи возникает сразу после ее появления на поверхности транслирующей рибосомы. Установлено, что 1/3 вновь синтезированных полипептидных цепей претерпевает протеолитический распад сразу же после завершения их синтеза рибосомами. Большинство вновь синтезированных белков избегает подобной участи благодаря образованию так называемого комплекса NAC (nascent polypeptide associated complex), ассоциированного с растущими полипептидными цепями. Имеется группа белков с молекулярными массами 21–33 кДа, которые взаимодействуют как с такой цепью, так и с самой рибосомой, предохраняя растущий полипептид от деградации путем формирования NAC. Когда же гидрофобная сигнальная последовательность синтезируемого белка достигает длины в 70 аминокислотных остатков и покидает NAC, с ней взаимодействует комплекс белков SRP (signal recognition particle), который не только предохраняет гидрофобную часть растущего полипептида от ранней деградации протеиназами, но и направляет ее к месту назначения – к мембранам эндоплазматического ретикулума. Растущие полипептидные цепи, у которых отсутствует сигнальная последовательность, покидая NAC, взаимодействуют с обеспечивающей фолдинг системой, в состав которой входят, в частности шапероны Hsp70 и Hsp40. Эти белки теплового шока (Hsp – heat shock protein), образуя комплекс с растущей полипептидной цепью, предотвращают их неспецифическую агрегацию и деградацию под действием внутриклеточных протеиназ, способствуя их правильному фолдингу, происходящему с участием других шаперонов. С другой стороны, Hsp70 принимает участие в ATP-зависимом разворачивании полипептидных цепей, делая неполярные участки полипептидных цепей доступными действию протеолитических ферментов. Различные сигнальные последовательности аминокислотных остатков обеспечивают направленную доставку вновь синтезированных белков к внутриклеточным органеллам и микрокомпартментам. Они же оказывают влияние на характер фолдинга, посттрансляционные модификации и метаболическую стабильность. Существуют, по крайней мере, пять биохимических процессов с участием вновь синтезируемых белков, контролируемых сигнальными последовательностями аминокислотных остатков. К ним относятся: транслокация белка через плоскость мембраны; внутриклеточный перенос белка без пересечения плоскости мембраны; химические модификации белка без гидролиза пептидных связей; расщепление некоторых или даже всех пептидных связей в белке; конформационные и иные пространственные изменения белков, включая фолдинг и олигомеризацию полипептидных цепей. Время существования внутриклеточных белков может различаться на несколько порядков. Структурные и конститутивно экспрессирующиеся белки обычно обладают большой продолжительностью жизни. Напротив, регуляторные белки, как правило, быстро распадаются. Протеолитический гидролиз регуляторных белков, который может точно регулироваться, позволяет эукариотической клетке быстро переключаться с одной функциональной программы на другую. По времени полужизни белки животных разделяют на четыре группы: 1) очень быстро обновляющиеся белки (время полужизни – < 1 ч): белок-супрессор опухолей p53, продукты протоонкогенов c-fos и c-myc, орнитиндекарбоксилаза, циклины; 2) быстро обновляющиеся белки (время полужизни – 1–24 ч): тирозинаминотрансфераза, триптофан-2,3-диоксигеназа, -глутамилтрансфераза, Hsp70, РНК-полимераза I, рецептор инсулина, убиквитин; 3) медленно обновляющиеся белки (время полужизни – 1–5 дней): каталаза, калпаины, катепсины, протеасомы, тубулины, актины, альдолаза, лактатдегидрогеназа, аргиназа; 4) очень медленно обновляющиеся белки (время полужизни – >5 дней): митохондриальная фумараза, цитохромы b и c, миозин, гемоглобин, гистоны в интерфазном ядре, эластин, коллаген. Большинство внутриклеточных белков заканчивают свое существование в результате протеолитического гидролиза, превращаясь в небольшие пептиды и свободные аминокислоты, которые далее утилизируются в синтезе новых белков. Многие протеолитические ферменты используют в качестве субстратов индивидуальные белки, проявляя тем самым высокую специфичность. Тем не менее, в клетке имеется и множество протеиназ широкой субстратной специфичности, чья неразборчивость в субстратах компенсируется их строгой компартментализацией. Они локализованы в лизосомах и вакуолях, где гидролизуют любые белки после их попадания в эти органеллы. Такая компартментализация протеолитических ферментов является жизненно важным условием существования клетки. Система протеолитической деградации внутриклеточных белков с участием протеасом и убиквитина отличается от вышеописанных систем тем, что, обладая широкой субстратной специфичностью, она безопасна для окружающих белков и реагирует на регуляторные воздействия. Ниже будет рассмотрено функционирование некоторых из этих систем. 3.6.2.Специфические протеиназы в посттрансляционном процессинге белковОдним из характерных примеров специфического действия протеиназ является активация предшественников (зимогенов) протеолитических ферментов (трипсина и химотрипсина) после их переноса от места синтеза (поджелудочная железа) к месту функционирования в пищеварительном тракте. Активация происходит вследствие протеолитического отщепления части полипептидной цепи зимогена, приводящего к появлению у укороченного полипептида требуемой ферментативной активности. Необходимость в посттрансляционной регуляции активности зимогенов очевидна – таким путем организм защищает клетки, синтезирующие протеолитические ферменты, от разрушения этими же ферментами. Аналогичный механизм посттрансляционной активации используется во время биосинтеза инсулина и других пептидных гормонов. Предшественник инсулина синтезируется в виде длинного полипептида с тремя дисульфидными связями. Полипептид приобретает активность гормона только после протеолитического отщепления центральной части полипептида-предшественника и избыточной N-концевой аминокислотной последовательности. Две оставшиеся части предшественника, удерживаемые дисульфидными связями, составляют активную молекулу инсулина. В системах биосинтеза адренокортикотропного гормона (АКТГ) и эндорфина несколько небольших пептидных гормонов синтезируются в виде одного полипептида-предшественника. Дальнейшая судьба предшественника зависит от типа клеток, в которых он синтезируется. В клетках передней доли гипофиза этот полипептид расщепляется с образованием АКТГ, -липотропина и -эндорфина, причем АКТГ является конечным продуктом протеолиза и может секретироваться для стимуляции синтеза стероидных гормонов в коре надпочечников. В клетках промежуточной доли гипофиза АКТГ расщепляется с образованием -меланоцитстимулирующего гормона (-МСГ). 3.6.3.Убиквитин-зависимая система протеолиза в регулируемой деградации белковУбиквитин-зависимая система протеолиза проводит поиск потенциальной мишени для протеолитической деградации среди огромного числа внутриклеточных белков. Все белки несут в себе специфические сигналы деградации по аналогии с сигнальными последовательностями, которые направляют вновь синтезируемые белки к определенным органеллам или микрокомпартментам клетки. Однако сигналы протеолитической деградации должны быть более сложными и разнообразными, так как с их помощью не только маркируются белки, удаляемые с помощью протеолиза, но и определяется время удаления, а также скорость их протеолитического расщепления. Для распознавания и декодирования таких сигналов в клетках эукариот имеется убиквитин-конъюгирующая система. Как в ядре, так и в цитоплазме эта система отделена пространственно и функционально от протеолитических ферментов, организованных в протеасомы. Распознанные данной системой белки-субстраты маркируются путем ковалентного присоединения к ним молекул небольшого стабильного 76-звенного белка – убиквитина. В результате убиквитин соединяется C-концом с боковыми остатками лизина в субстрате. Наличие такой метки в белке, по-видимому, является первичным сигналом сортировки, направляющей образовавшиеся конъюгаты к протеасомам. В большинстве случаев к субстрату присоединяется несколько молекул убиквитина, которые организованы в виде бусинок на нитке. Молекулы белков, содержащие убиквитин, по-видимому, являются для протеасом предпочтительными субстратами. Конъюгацию убиквитина с субстратом можно представить следующим образом (рис. I.41). Вначале убиквитин-активирующий фермент (E1) связывает убиквитин, гидролизует ATP и образует тиоэфирную связь между AMP и убиквитином с последующим переносом молекулы убиквитина на один из своих остатков Cys. Молекула активированного убиквитина далее соединяется с одним из ферментов семейства убиквитин-конъюгирующих ферментов (E2) и часто вслед за этим с убиквитин-лигазой (E3). Процесс конъюгации убиквитина с субстратом может катализироваться как самим E2, так и E2 совместно с E3. Белки E2 и E3 в клетках существуют в виде больших семейств, члены которых различаются по свойствам и внутриклеточной локализации. Мутации в генах семейства E2 у дрожжей показывают, что в ДНК-репарацию, прохождение клеточного цикла, биогенез пероксисом, а также в обеспечение устойчивости к тепловому шоку и ионам кадмия вовлечены разнообразные ферменты. Некоторые из ферментов E2 способны образовывать между собой гетеродимеры, которые, вероятно, в сочетании с различными белками E3 обеспечивают весь большой репертуар субстратных специфичностей убиквитин-конъюгирующих комплексов. 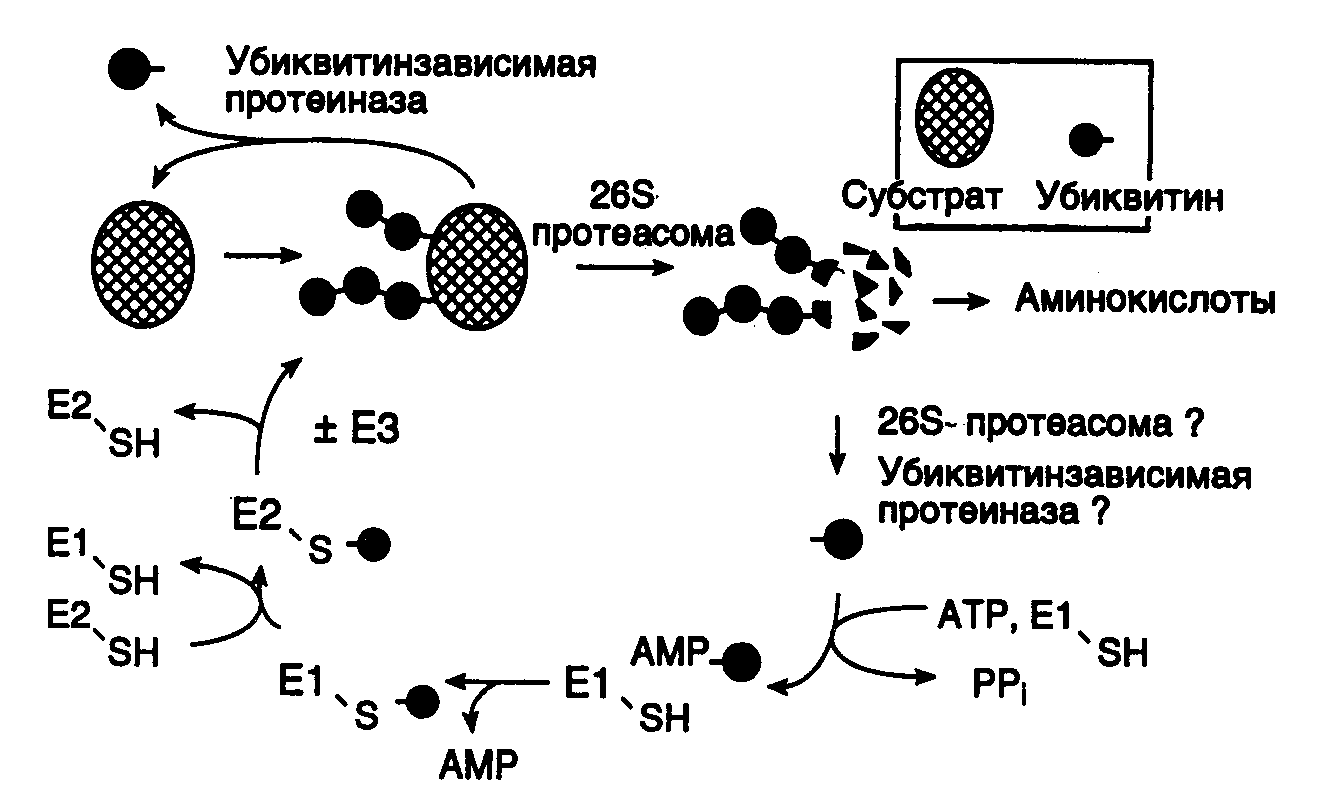 Рис. I.41. Этапы функционирования убиквитинзависимой системы протеолиза Е1–Е3 – ферменты, активирующие убиквитин с функционально-активными SH-группами, PPi – неорганический пирофосфат Структура и функционирование протеасомы. Белки, меченные цепями убиквитина, после взаимодействия с протеасомами расщепляются до коротких пептидов и свободных аминокислот в результате ATP-зависимой реакции. У эукариот протеасомы присутствуют в цитозоле и ядрах, но не в других клеточных органеллах. Протеасомы выделяют в виде индивидуальных частиц с коэффициентами седиментации 20S и 26S. 20S частица является коровой частью 26S частицы, которая обладает протеолитической активностью. Коровая частица представляет собой белковый комплекс в виде цилиндра, через центральный канал которого "протягивается" молекула гидролизуемого белка. В настоящее время в качестве модельного объекта часто используют протеасомы архебактерии Thermoplasma, которые были закристаллизованы и исследованы с помощью рентгеноструктурного анализа. Установлено, что протеасома Thermoplasma построена из двух ( и ) субъединиц. Кольцевые структуры на обоих концах цилиндра протеасомы составлены из -, а центральная часть – из -субъединиц в отношении 7777 (рис. I.42). Протеолитическая активность присуща -субъединицам, причем их активные центры направлены внутрь полости цилиндра протеасомы. Кроме того, кольца -субъединицы по обоим концам молекулы образуют узкие отверстия диаметром 13 Å, через которые может пройти только развернутая цепь полипептида. Это механистически объясняет, каким образом протеасома избирательно расщепляет полипептидные цепи белков, меченные убиквитином. Прежде чем войти в контакт с активными центрами протеиназ, полипептидная цепь деградируемого белка должна быть развернута. Пептиды и аминокислоты, образующиеся в центральной части цилиндра протеасомы, покидают ее через переднее или заднее отверстия, сформированные -субъединицами. Протеасомы Thermoplasma лишены специфичности в отношении деградируемых белков, и их функционирование требует наличия в N-концевой части -полипептидов остатка Thr. Интересно, что остатки Thr эукариотических -субъединиц являются мишенью для антибиотика лактацистина из Streptomyces, который ковалентно связывается с этими остатками, необратимо инактивируя протеасомы. 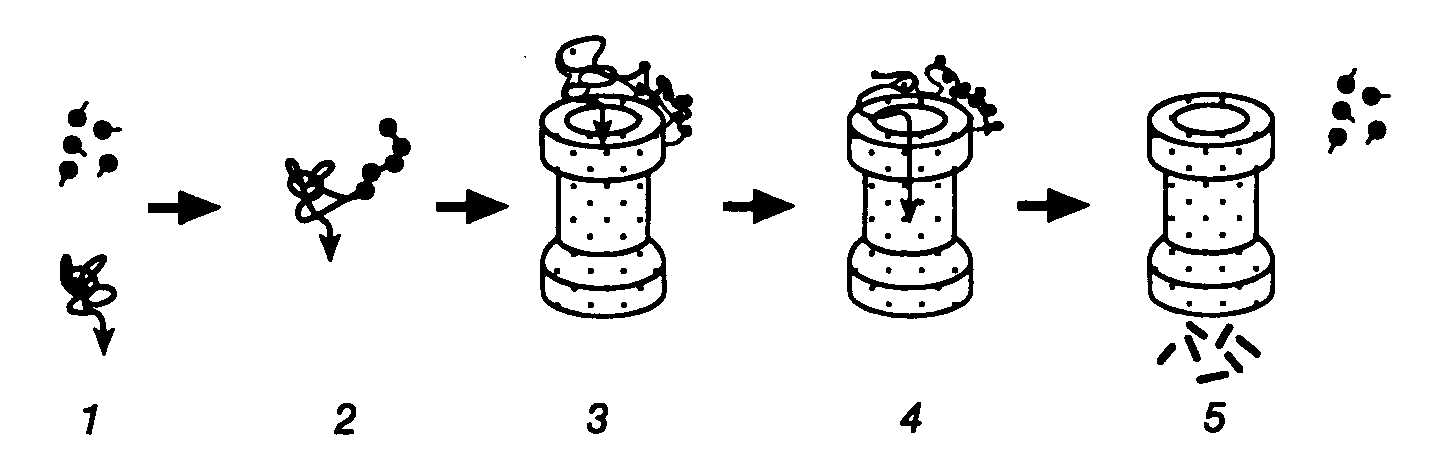 Рис. I.42. Гипотетическая схема функционирования протеасомы убиквитинзависимой системы протеолиза Молекулы убиквитина присоединяются к деградируемой полипептидной цепи (1,2) и конъюгат далее взаимодействует с 26S протеасомой (3). Узкий цилиндр изображает кόровую 20S субчастицу протеасомы, обладающую протеолитической активностью. Полипептидная цепь, разворачиваясь, входит в центральную полость 20S субчастицы, где последовательно подвергается протеолизу (4, 5). При этом цепи убиквитина отделяются от деградируемого белка Локализация активных центров -субъединиц внутри протеасомы затрудняет неконтролируемую деградацию окружающих белков. Отдельные субъединицы до включения их в состав зрелых протеасом синтезируются в виде неактивных предшественников, что предотвращает их преждевременное протеолитическое действие и является общим принципом биосинтеза протеолитических ферментов. Подобно тому как ферменты лизосом активируются только после их перемещения в соответствующий компартмент клетки, процессинг -предшественников сопряжен с их включением в состав протеасом. Сборка протеасом начинается с образования гептамерных -субчастиц (7), которые стимулируют аутокаталитическое удаление пропоследовательности предшественника -субъединиц, что приводит к их упорядоченной самосборке с образованием гептамерных -субчастиц (7), состыкованных с -субчастицами. Две предварительно собранные половины протеасомы (77) далее ассоциируют друг с другом с образованием активных 20S протеасом. Очищенные 20S протеасомы эффективно расщепляют небольшие пептиды, но не способны гидролизовать интактные белки. Распознавание конъюгатов убиквитина и разворачивание белковой глобулы происходят с участием 16 белков, ассоциированных с 20S протеасомой и образующих 26S комплекс. Эти белки способны объединяться в отдельные комплексы, получившие название 19S-кэп-структур. 19S-комплексы ассоциируют друг с другом в присутствии ATP и с 20S протеасомами in vitro, присоединяясь к концам цилиндра. Протеасомы обеспечивают не только полную деградацию полипептидов, но и участвуют в процессинге предшественников с образованием зрелых, активных белков. В частности, процессинг субъединицы p50 транскрипционного фактора NF-B животных, сопровождающийся отщеплением и деградацией С-концевой части полипептида, происходит с помощью 26S протеасом. Процессинг антигенов. В настоящее время сформировалось мнение о том, что протеасомы клеток животных участвуют в процессинге антигенов, представляемых молекулами первого класса главного комплекса гистосовместимости (MHC). Из семи -субъединиц протеасом человека лишь три обладают протеолитической активностью. Эндогенный антивирусный агент -интерферон селективно стимулирует синтез неактивных -субъединиц, одновременно подавляя образование активных. Две из этих стимулируемых субъединиц, названные LMP2 и LMP7, кодируются генами MHC. До конца не ясно, какой биологический смысл имеет замещение почти всех активных субъединиц на неактивные, однако предполагается, что такое явление может иметь отношение к процессингу антигенов, представляемых для распознавания молекулами MHC. Действительно, для мышей с дефектными LMP2 или LMP7 характерно нарушение презентации некоторых антигенов. По-видимому, пептиды, образующиеся в таких реконструированных протеасомах, по размерам или составу аминокислотных последовательностей соответствуют тому стандарту, который требуется для эффективного действия антигенных детерминант во время иммунного ответа. 3.6.4.Сплайсинг белковФеномен сплайсинга белков, обнаруженный в 1990 г. в группой Т.Стивенса, пошатнул еще один постулат молекулярной биологии, в соответствии с которым последовательности нуклеотидов зрелых мРНК всегда колинеарны аминокислотным последовательностям кодируемых ими полипептидов. Во время сплайсинга белков удаление избыточной генетической информации из макромолекул происходит не на уровне пре-мРНК, как это имеет место во время обычного сплайсинга, а на уровне синтезированного полипептида путем вырезания из его внутренней части короткой аминокислотной последовательности. Именно данный механизм отличает сплайсинг белков от повсеместно распространенного процессинга предшественников полипептидов, который, как известно, сопровождается только протеолитическим расщеплением полипептида-предшественника с образованием более коротких белков без изменения их внутренней первичной структуры. Открытие сплайсинга белков было сделано при исследовании экспрессии гена VMA1 дрожжей S. cerevisiae, известного также под названием TFP1, который кодирует субъединицу ATPазы вакуолей с молекулярной массой 119 кДа (рис. I.43,а). При исследовании гомологии данного гена с генами других ATPаз микроорганизмов было установлено, что все они кодируют более короткие полипептиды с молекулярными массами 70 кДа, и их гомология с геном дрожжей распространяется только на концевые последовательности нуклеотидов, резко нарушаясь в центральной части гена. Более того, использование инсерционного мутагенеза (генного нокаута) (см. раздел 9.1.3) для инактивации этого гена приводило к прекращению синтеза в клетках дрожжей полипептида с молекулярной массой 69, а не 119 кДа. Механизм такого явления прояснился после постановки двух контрольных экспериментов. В первом из них введение мутаций со сдвигом рамки считывания в сегмент гена VMA1, который кодировал центральную часть полипептида, отсутствующую в зрелом белке, приводило к прекращению синтеза всего белка рибосомами из-за возникновения новых терминирующих кодонов в этой рамке считывания мРНК. Подобное бы не происходило, если бы центральная часть пре-мРНК гена VMA1 удалялась в результате сплайсинга. Во втором эксперименте исследование экстрактов клеток дрожжей с помощью антител к центральной части полипептида, отсутствующего в зрелой субъединице, обнаружило белковый продукт с предсказанной молекулярной массой 50 кДа. Он присутствовал в соотношении 1:1 к функционально активному полипептиду с молекулярной массой 69 кДа. Это указывало на то, что последовательности РНК центральной части гена транслируются рибосомами и соответствующая часть полипептида-предшественника удаляется посттрансляционно. Дальнейшие исследования данного явления полностью подтвердили предположение о том, что внутренняя аминокислотная последовательность из предшественника с молекулярной массой 119 кДа отщепляется в результате сплайсинга на уровне его полипептидной цепи (см. рис. I.43,а). Внутренняя часть полипептида, удаляемая в результате белкового сплайсинга, получила название интеина, а наружные N- и C-концевые части – экстеинов. Позднее белки, изменяемые посттрансляционно в результате белкового сплайсинга, были обнаружены у многих микроорганизмов (см. рис. I.43,б). Во всех случаях аминокислотные последовательности интеинов фланкированы короткими консервативными последовательностями. На основании особенностей первичной структуры интеинов и экстеинов разработаны алгоритмы поиска белков, подвергаемых сплайсингу посттрансляционно, в соответствующих базах данных. С использованием этого алгоритма, в частности обнаружена последовательность интеина в продукте гена dnaB хлоропластов красной водоросли Porphira porphira. Для объяснения механизма белкового сплайсинга предложено несколько моделей. Одна из них, разработанная группой Ф. Перлера и включившая в себя многие черты ранних моделей, представлена на рис. I.44. В соответствии с этой моделью белковый сплайсинг является аутокаталитическим процессом и для своего осуществления не требует других кофакторов в дополнение к самому полипептиду-предшественнику. Событием, запускающим белковый сплайсинг, может быть: а) нуклеофильная атака OH-группой консервативного остатка Ser, расположенного в C-концевом сайте сплайсинга, по карбонильной группе пептидной связи, расположенной в N-концевом сайте сплайсинга, или же: б) N–O-сдвиг в N-концевом сайте сплайсинга с последующей атакой OH-группой C-концевого сайта и переэтерификацией. В результате функционирования обоих механизмов образуется разветвленное промежуточное соединение, которое при участии остатка Asn распадается на интеин-сукцинимид и экстеины, связанные друг с другом сложноэфирной связью. Эта связь преобразуется в пептидную в результате N–O-сдвига. 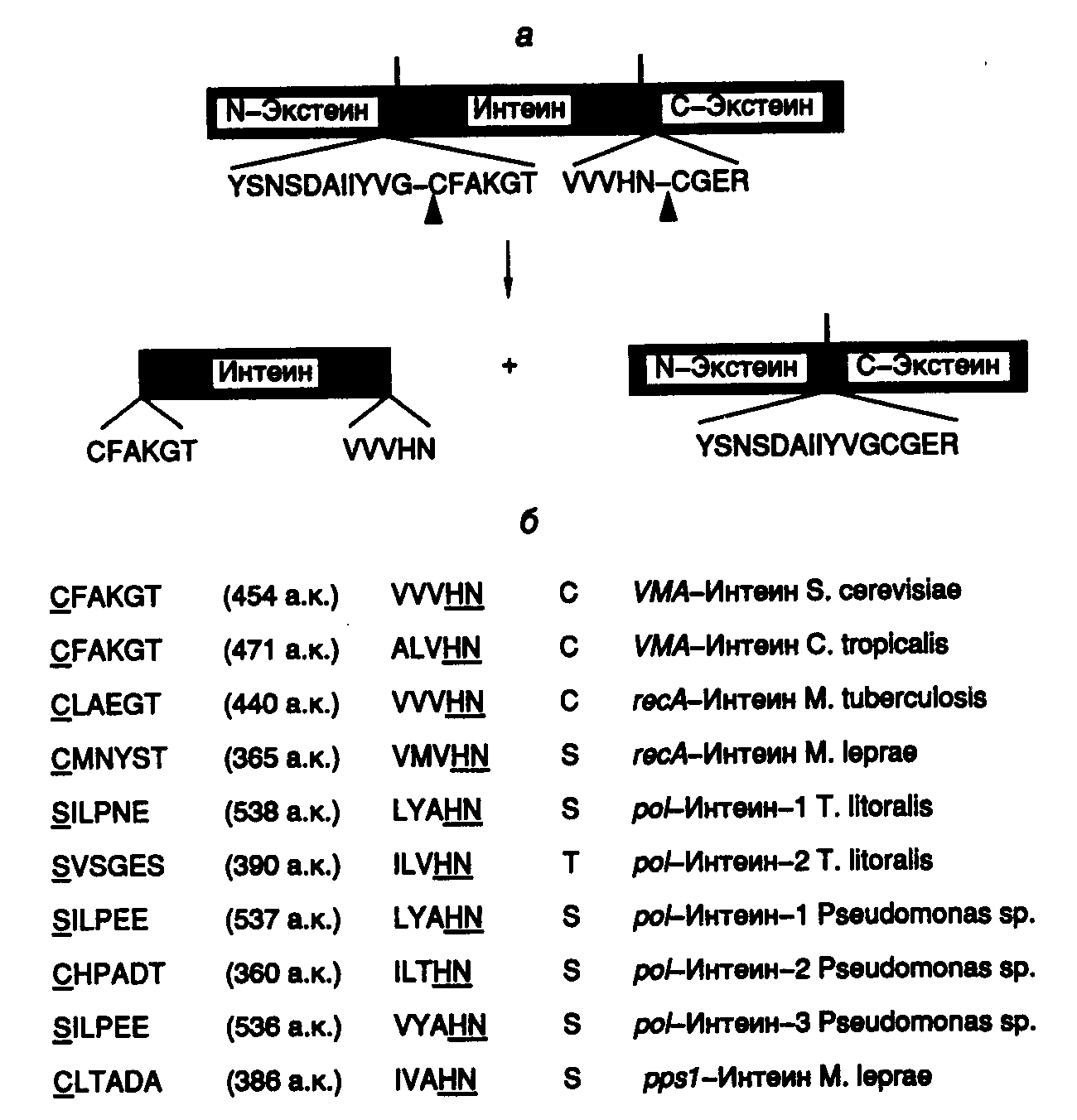 Рис. I.43. Сплайсинг белка гена TFP1 S. cerevisiae (а) и перечень генов, белки которых подвергаются сплайсингу на уровне полипептидных цепей (б) Стрелки указывают места разрыва полипептидной цепи белка-предшественника TFP1. Консервативные последовательности 10 известных интеинов в окрестностях сайтов сплайсинга изображены с использованием однобуквенного кода Генетическая мобильность последовательностей интеинов в ДНК является одной из самых больших неожиданностей, обнаруженных после их открытия. Оказалось, что полипептидная цепь интеина обладает эндонуклеазной активностью, которая обеспечивает транспозиции последовательностей интеинов в геноме. Аналогичный процесс, ранее получивший название "хоуминга интронов", описан у интронов группы I. В результате хоуминга происходит однонаправленный перенос копии последовательности ДНК интрона (или интеина) из гена, содержащего эту последовательность, к аллельному гену, не содержащему ее. Данная цепь реакций инициируется эндонуклеазным разрывом обеих цепей ДНК в аллельном безинтеиновом гене, образующемся под действием эндонуклеазы интеина. Далее с использованием последовательности ДНК интеина в качестве донора информации происходит репарация двухцепочечного разрыва, которая сопровождается конверсией гена с включением в его состав последовательности интеина. Это указывает на большое сходство механизмов хоуминга интронов группы I и интеинов. 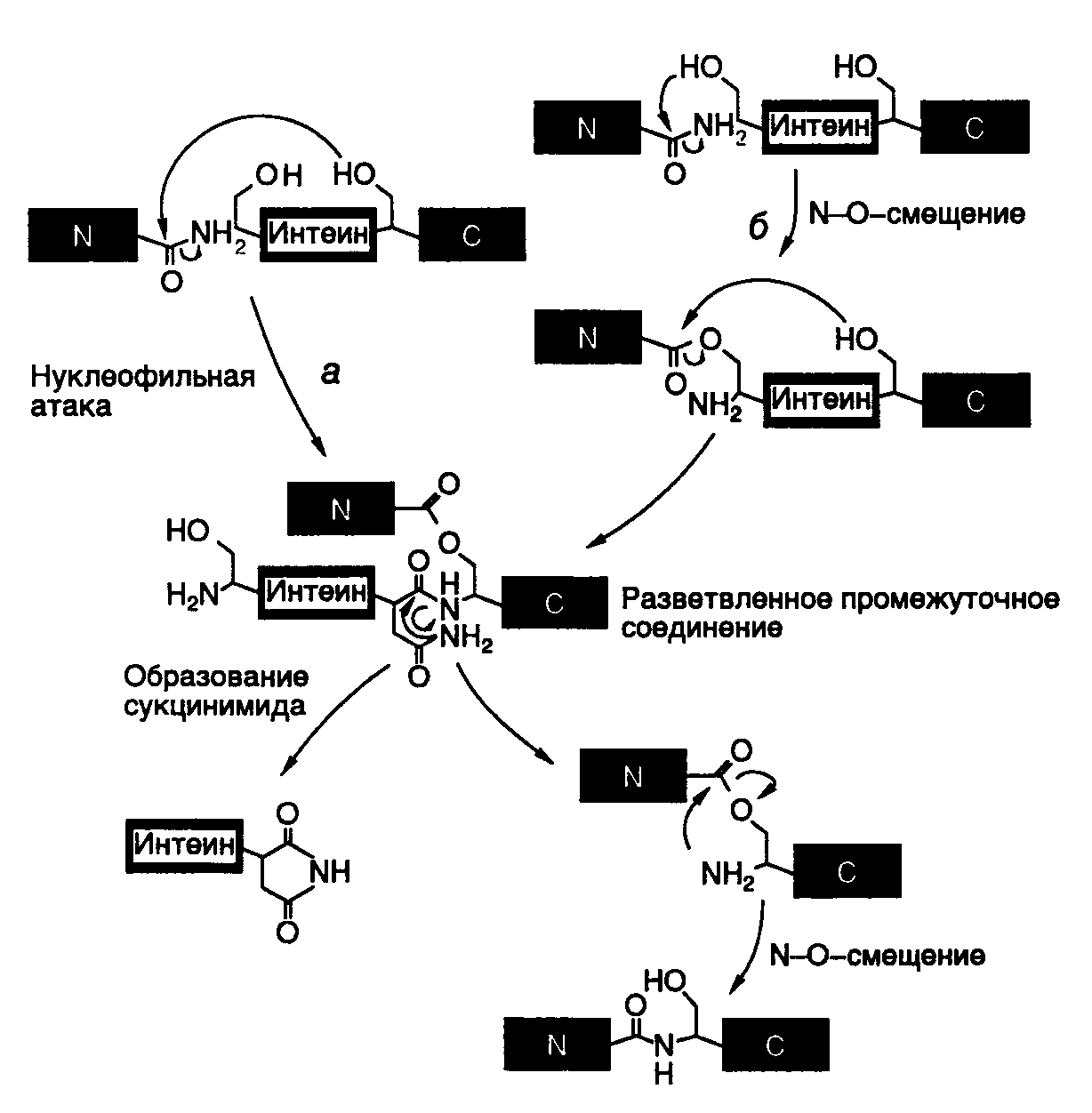 Рис. I.44. Предполагаемый механизм сплайсинга белков а, б – альтернативные механизмы инициации сплайсинга, N, C – N- и C-концевые экстеины белков-предшественников Сплайсинг белков является сложной задачей для исследования in vitro. Процесс вырезания последовательности интеина происходит настолько быстро, что не удается обнаружить промежуточные соединения. Проблему удалось решить методами генной инженерии, вставив последовательность ДНК интеина из гена ДНК-полимеразы термофильной бактерии Pyrococcus в одну рамку считывания между геном белка, связывающего мальтозу, и частью гена парамиозина Dirofilaria immitis. Образующийся химерный белок не претерпевал сплайсинга при 12–20°, но при 37–65° сплайсинг индуцировался. Именно с помощью этого подхода удалось обнаружить разветвленные промежуточные соединения, образующиеся при сплайсинге белков. Кроме того, такой подход может стать продуктивным для биотехнологии, так как он позволяет нарабатывать токсические для клетки белки в виде химерных предшественников при низких температурах, которые затем простым повышением температуры быстро превращаются в полезные белковые продукты. 3.6.5.Другие посттрансляционные модификации белковМногие белки и секретируемые пептиды претерпевают различные структурные изменения в результате котрансляционных и посттрансляционных модификаций, т.е. во время или после завершения их синтеза рибосомами. Подобные модификации существенно влияют на функциональную активность белков и пептидов, значительно расширяя возможности экспрессии генов, кодирующих эти молекулы, и их кодирующий потенциал. Одна из таких модификаций, а именно фосфорилирование факторов транскрипции протеинкиназами, рассмотрена выше. Кроме того, посттрансляционные модификации включают в себя гликозилирование остатков Asn в последовательностях Asn-X-[SerThr], N-концевое ацилирование, циклизацию N-концевого остатка Glu с образованием пироглутаминовой кислоты, C-концевое амидирование последовательностей освобождающихся пептидов, гидроксилирование остатков Lys и Pro, метилирование различных остатков аминокислот. Многие из перечисленных модификаций являются критическими для биологической активности пептидов. В частности, карбоксиамидирование C-концевого Gly активирует окситоцин и вазопрессин, а перенос сульфогруппы на остаток Tyr в холецистокинине-8 оказывается критическим для проявления его активности в поджелудочной железе. N-Ацетилирование -эндорфина блокирует его опиоидную активность, тогда как ацетилирование меланоцитстимулирующего гормона усиливает его влияние на синтез меланинов. Поскольку большинство этих модификаций – тканеспецифические, пептиды, обладающие различной биологической активностью, должны быть доставлены к различным тканям в виде предшественников, где они претерпевают специфический процессинг. Среди ковалентных посттрансляционных модификаций пептидов, синтезируемых рибосомами, занимает особое место эпимеризация L-аминокислотных остатков с образованием D-энантиомеров, присутствие которых оказывает принципиальное влияние на биологическую активность пептидов. Известно, что только L-стереоизомеры аминокислот участвуют в синтезе белка рибосомами. В природных белках D-аминокислоты обнаруживаются редко, как правило, в составе антибиотиков пептидной природы, которые синтезируются ферментативными комплексами микроорганизмов без привлечения рибосом. Другим источником D-аминокислот в белках может быть спонтанная рацемизация их L-стереоизомеров в составе полипептидных цепей в результате старения. Недавно обнаружено, что у ряда природных пептидов, обладающих биологической активностью, D-аминокислоты образуются во время посттрансляционных модификаций. В частности, это явление характерно для опиоидных пептидов, секретируемых кожей некоторых амфибий. Структура наиболее известных из таких пептидов –дерморфина и дермэнкефалина представлена на рис. I.45,а. Активность этих пептидов как анальгетиков, по крайней мере, в 1000 раз превышает соответствующую активность морфина, и для ее проявления необходимо обязательное присутствие D-аминокислот в указанных положениях молекул. Дерморфиноподобные молекулы с теми же особенностями структуры были обнаружены в мозге крыс, а у амфибий найдена серия новых гексапептидов, делторфинов (Tyr-D-Ala-X-Val-Val-Gly, где X = Asp или Glu), которые являются агонистами -опиоидных рецепторов и для активности которых также необходимы D-аминокислоты. К пептидам той же природы относятся полициклические пептидные антибиотики грамположительных бактерий, в частности низин, субтилин и эпидермин, а также некоторые нейропептиды высших беспозвоночных. Механизм образования D-аминокислот в составе пептидов до конца не понятен, однако предполагается, что имеют место ферментативные реакции, в результате которых происходят последовательные дегидрогенизация и гидрогенизация L-изомеров аминокислот (см. рис. I.45,б). Поскольку в последнее время появились высокочувствительные аналитические методы, позволяющие обнаруживать следовые количества D-аминокислот в природных белках, можно предполагать скорое подтверждение гипотезы о том, что эта группа явлений имеет гораздо большее биологическое значение, чем ей сегодня отводится в системе биохимических превращений макромолекул. 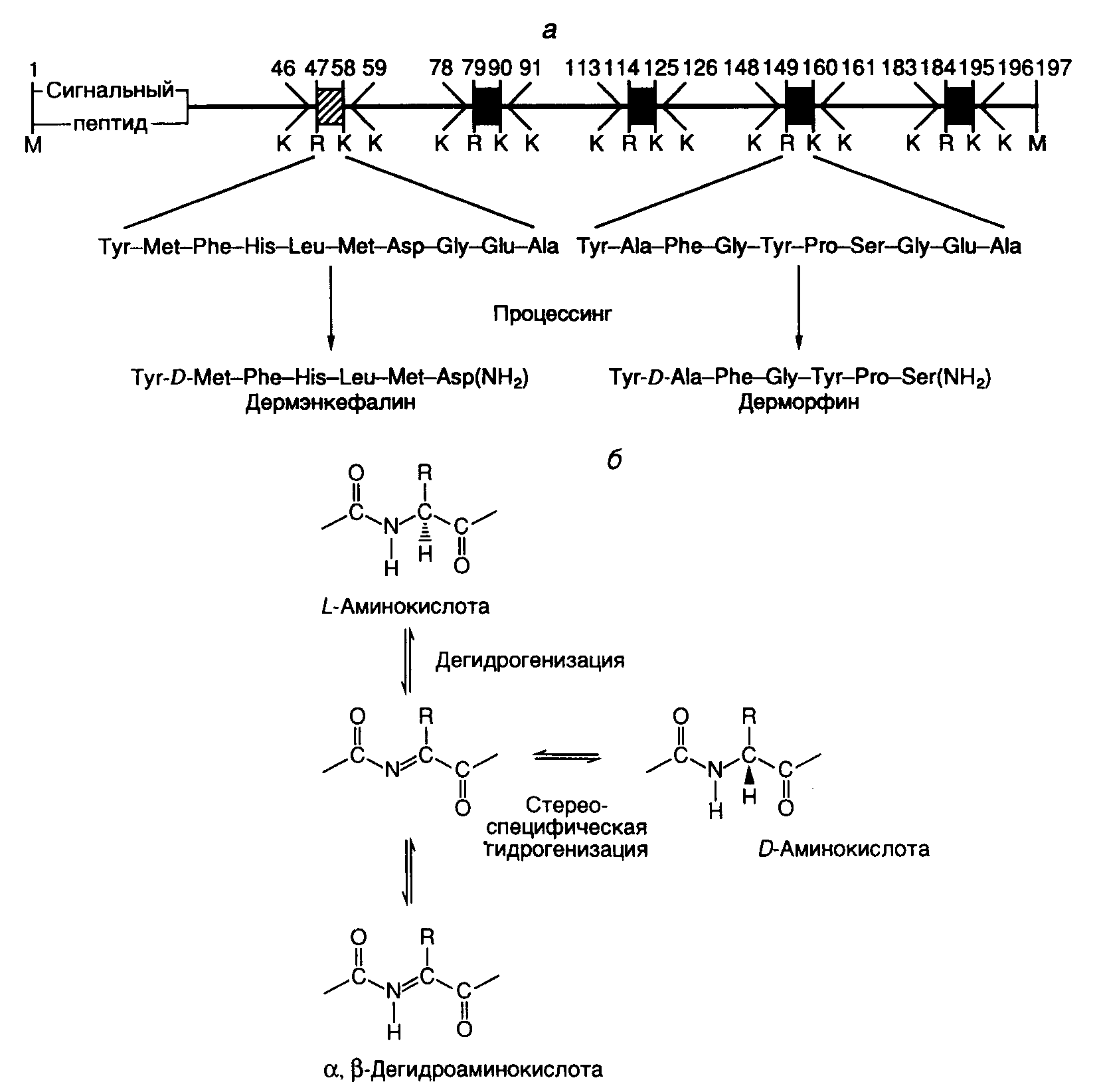 Рис. I.45. Схема строения предшественника дермэнкефалина и дерморфина, а также их посттрансляционных модификаций с предполагаемым механизмом реакций а – посттрансляционные модификации предшественника. Показано, что вслед за сигнальным пептидом в предшественнике располагаются пять высокогомологичных аминокислотных последовательностей, первая из которых является предшественником дермэнкефалина, а четыре других – дерморфина. Цифры обозначают положение аминокислотных остатков, приведенных ниже в однобуквенном коде; б – предполагаемый механизм реакции эпимеризации L-аминокислот в составе пептидов Много этапов различных преобразований информационных макромолекул и белков отделяют генетическую информацию, заключенную в конкретных генах, от ее реализации в соответствующих фенотипических признаках клетки и организма, располагающих этой информацией. Такая реализация требует точной координации в функционировании многих генетических систем организма на всех основных уровнях экспрессии генов. Многоступенчатый и сложный характер регуляции функционирования генов, особенно у высших организмов, накладывает большие ограничения на возможности получения полноценной экспрессии рекомбинантных генов в гетерологичных системах. Тем не менее, расширение знаний об этих механизмах приближает момент, когда появится возможность целенаправленно изменять или корректировать работу отдельных генов организма, осуществлять наработку их полноценных белковых продуктов в искусственных генетических системах. О некоторых экспериментальных подходах к решению таких задач методами генной инженерии пойдет речь во второй части книги. |
