Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Белки в организмах | Функции компонентов комплексов | ||
| E. coli | Фаг Т4 | Вирус SV40 / человек | |
| DnaB | Белок 41 | T-антиген | ДНК-хеликаза, стимулирует образование затравок на одноцепочечной ДНК |
| DnaC | Белок 59 | » | Обеспечивает взаимодействие хеликазы и праймазы с ДНК, находящейся в комплексе с SSB-белком |
| SSB | Белок 32 | RPA | Белок, связывающийся с одно-цепочечной ДНК, стимулирует ДНК-полимеразы, облегчает вхождение хеликазы в репликативный комплекс |
| -Комплекс (‘) | Белок 44/62 | RFC | ДНК-зависимая АТРаза, обеспечивает связывание затравки с матрицей, стимулирует ДНК-полимеразу |
| - Белок | Белок 43 (?) | | Обеспечивает сборку и димеризацию холофермента ДНК-полимеразы, необходим для образования инициационного комплекса |
Таблица I.16 (окончание)
| Белки в организмах | Функции компонентов комплексов | ||
| E. coli | Фаг Т4 | Вирус SV40 / человек | |
| (*)-Белок | Белок 45 (?) | PCNA (?) | Стимулирует ДНК-полимеразу и ДНК-зависимую АТРазу, выполняет функцию "скользящего зажима", обеспечивающего процессивность репликации |
| Pol III (), минимальный фермент | Белок 43 | Pol | ДНК-полимераза, 3’5’-экзонуклеаза; -субъединица Pol III катализирует полимеризацию, а -субъединица – является корректирующей экзонуклеазой |
| | | Pol | |
| | | Pol | ДНК-полимераза, осуществляет репликацию ДНК митохондрий, кодируется ядерным геном |
| DnaG | Белок 61 | Праймаза, (Pol ) | Праймаза, синтез РНК-затравок |
| Лигаза | Т4-лигаза | Лигаза I | Лигирование фрагментов ДНК |
| Pol I | Белок 43 | FEN-1 или MF-1 | Экзонуклеаза, удаляет РНК-затравки |
| РНКаза Н | РНКаза Н | РНКаза Н1 | Нуклеаза, удаляет РНК-затравки |
В табл. I.16 включены белки наиболее хорошо изученных систем репликации: E. coli и ее бактериофага Т4, а также вируса SV40, размножающегося в культивируемых клетках человека (использованы общепринятые сокращения). При рассмотрении таблицы видно, что основные компоненты системы репликации ДНК в филогенезе функционально консервативны, и любой белковый компонент системы прокариот имеет свой прототип в системе репликации ДНК млекопитающих. Принимая во внимание только этот факт, можно ожидать наличие значительного сходства в механизмах репликации ДНК прокариотических и эукариотических организмов. Более удивительным представляется то, что у белков разных организмов, выполняющих одинаковые функции, в большинстве случаев отсутствует гомология в аминокислотных последовательностях. В частности, не обнаружено сходства у белка SSB (single-stranded DNA binding protein) E. coli, белкового продукта гена 32 фага Т4 и белка RPA (replication protein A) репликативной системы человека. То же самое характерно и для -субъединицы ДНК-полимеразы III (Pol III) E. coli (-белок), белка 45 фага Т4 и белка PCNA (proliferating cell nuclear antigen) человека. Это указывает на возможность выполнения одних и тех же функций полипептидными цепями с разными аминокислотными последовательностями, а также на вероятное конвергентное эволюционное происхождение таких белков и их функций из разных неродственных белков-предшественников.
4.1.2.Репликативная вилка E. coli и бактериофага T4
Во время редупликации ДНК ее дочерние синтезирующиеся цепи расходятся из точки репликации, образуя Y-подобную структуру, называемую репликативной вилкой. Именно в окрестностях этой точки разветвления и локализован функционирующий репликативный комплекс. Современные представления о строении репликативной вилки E. coli схематически изображены на рис. I.46,а. В соответствии с этой моделью, ДНК-хеликаза перемещается в репликативной вилке впереди ДНК-синтезирующего белкового комплекса и расплетает цепи родительской ДНК, причем SSB-белок связывается с образующимися одноцепочечными участками, облегчая процесс расплетения.
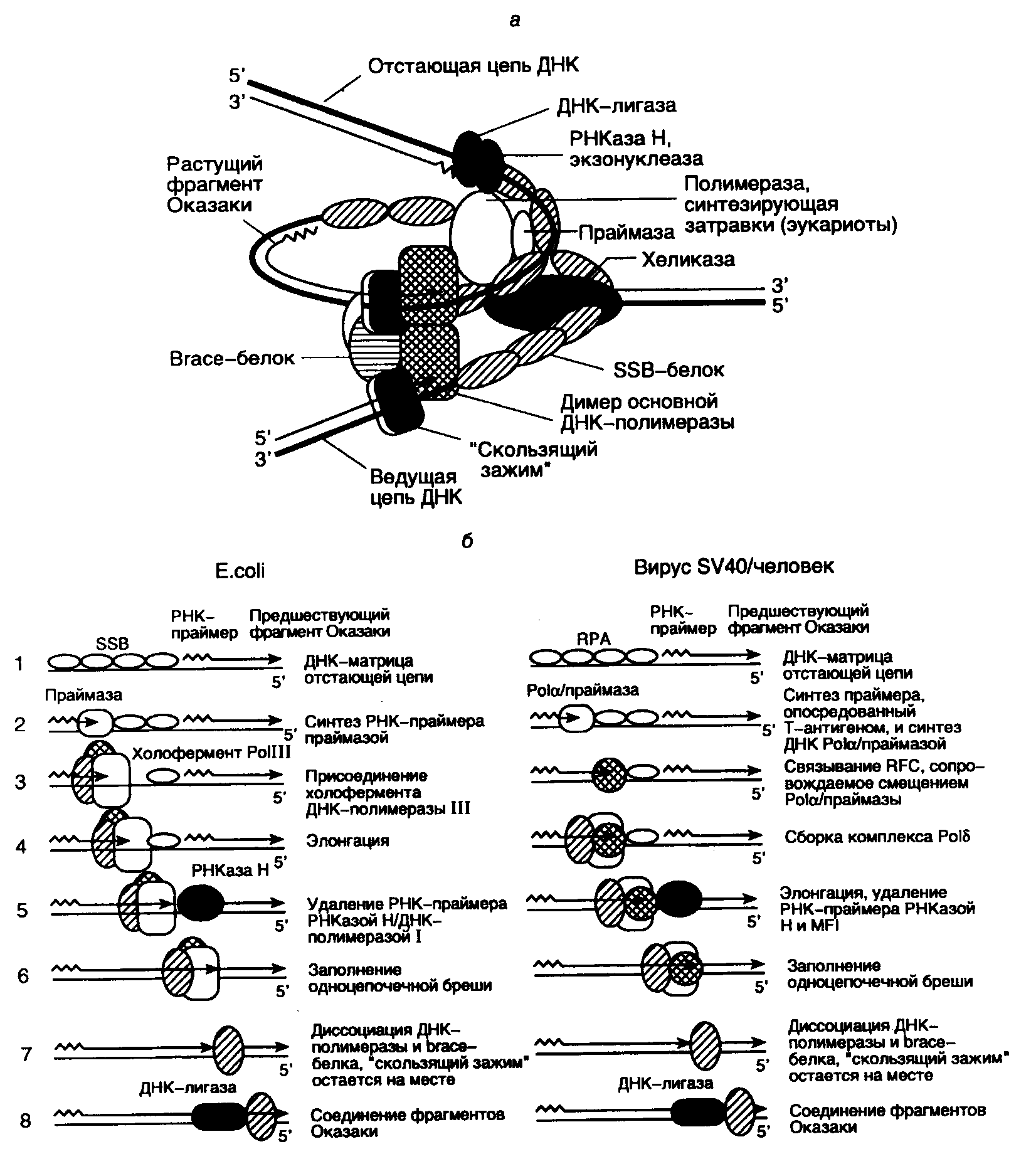
Рис. I.46. Схема функционирующей репликативной вилки E. coli и эукариот и основных этапов репликации ДНК
а – репликативная вилка с основными белками репликации, в которой димер ДНК-полимеразы синхронно реплицирует обе цепи ДНК; б – этапы репликации (1–8) отстающей цепи ДНК. Этап 7 у эукариот является гипотетическим
Из-за антипараллельности и комплементарности цепей ДНК механизм репликации этих двух цепей существенно различается. Действительно, ДНК-полимераза обладает способностью синтезировать ДНК только в одном направлении: от 5’-конца к 3’-концу, перемещаясь вдоль ДНК-матрицы в направлении 3’5’. В то же время комплементарные цепи ДНК противоположно направлены (антипараллельны), и в силу своих свойств ДНК-полимераза не может реплицировать молекулу ДНК, просто перемещаясь от одного конца матричного дуплекса к другому. Для разрешения этого противоречия репликативный комплекс использует изящный механизм. На одной цепи ДНК синтез новой цепи происходит непрерывно, и образующаяся цепь называется ведущей, тогда как синтез другой цепи осуществляется прерывисто в виде коротких фрагментов, получивших название фрагментов Оказаки в честь ученого, впервые их открывшего. Эта вновь синтезируемая цепь ДНК называется отстающей. И хотя фрагменты Оказаки также синтезируются в направлении 5’3’, перемещение работающей ДНК-полимеразы вдоль матричной цепи ДНК при синтезе каждого индивидуального фрагмента Оказаки должно быть противоположным тому, которое имеет место в случае синтеза ведущей цепи. Образующиеся фрагменты Оказаки отстающей цепи далее соединяются друг с другом с помощью ДНК-лигазы.
Репликативный комплекс, который осуществляет синтез ведущей цепи ДНК, включает в себя минимальный (кор-) фермент ДНК-полимеразы III (белок 43 в случае фага Т4), подвижный связывающий -белок с молекулярной массой 41 кДа ("sliding clamp", белок 45 у фага Т4) и белки -комплекса, состоящего из пяти полипептидов ‘ (скрепляющие белки – brace proteins). Функциональным аналогом белков -комплекса у бактериофага Т4 служит комплекс белковых продуктов генов 44/62. При облучении клеток E. coli УФ-светом в них индуцируется синтез укороченного *-белка (26 кДа), который является продуктом того же гена, что и -субъединица холофермента ДНК-полимеразы III. По-видимому, функциональная роль *-белка заключается в обеспечении репликации ДНК на матрице, поврежденной УФ-светом.
При синтезе ведущей цепи ДНК репликативный комплекс E. coli функционирует весьма эффективно с высокой процессивностью. Напомним, что мерой процессивности является длина фрагмента вновь синтезированной макромолекулы, которую комплекс (или индивидуальные ферменты) способен образовывать в одном цикле, не диссоциируя от матрицы. Установлено, что холофермент ДНК-полимеразы III, в состав которого входят минимальный фермент (субъединицы , и ), -белок, белки -комплекса и -белок, синтезирует ведущую цепь ДНК длиной в 50000 нуклеотидов со скоростью >500 нуклеотидов в секунду в одном цикле, ни разу не диссоциируя от ДНК-матрицы. Точность репликации ДНК холоферментом ДНК-полимеразы III поражает воображение. Частота ошибочных включений нуклеотидов не превышает 10-9–10-10 на нуклеотид за один раунд репликации. В то же время очищенные каталитические субъединицы реплицируют ДНК с пониженной точностью. В частности, изолированная -субъединица допускает ошибки в опытах in vitro с частотой 6 10-1 на нуклеотид за один раунд репликации. Частота ошибок, возникающих в ДНК, облученной УФ-светом, одна и та же в ведущей и отстающей цепях вновь синтезируемой ДНК in vivo.
Роль -комплекса заключается в распознавании РНК-затравок (праймеров) на матричной ДНК. -Комплекс связывается с единственным праймером ведущей цепи ДНК или с каждым из праймеров фрагментов Оказаки отстающей цепи, что, в свою очередь, делает возможным присоединение к промаркированным таким образом праймерам минимального фермента ДНК-полимеразы и -белка (см. рис. I.46,б).
Две молекулы -белка входят в состав репликативного комплекса вслед за белками -комплекса, связываясь с ДНК позади белков -комплекса и оставляя 3’-конец праймера доступным для ДНК-полимеразы. Димер -белка образует кольцо вокруг молекулы ДНК и стимулирует АТРазную активность белков -комплекса. Как уже упоминалось выше, функциональный аналог -белка – продукт гена 45 бактериофага Т4, образует такую же пространственную структуру, охватывающую молекулу ДНК тремя молекулами. Молекулярная масса белка 45 составляет 2/3 от таковой -мономера, и их аминокислотные последовательности негомологичны друг другу. Тем не менее, четвертичные структуры этих полипептидов и механизмы их функционирования обладают большим сходством.
-Белки и белки -комплекса, будучи связанными с дуплексом праймер–матрица, обеспечивают присоединение к этому комплексу минимального фермента ДНК-полимеразы. Затем ДНК-полимераза при наличии доступных четырех дезоксирибонуклеозидтрифосфатов, используя праймер для инициации синтеза ДНК, с высокой эффективностью синтезирует цепь ДНК, комплементарную ДНК-матрице. Те же самые белки участвуют и в синтезе отстающей цепи ДНК. В этом случае прерывистый синтез ДНК многократно инициируется на большом количестве праймеров, и ДНК синтезируется в виде фрагментов Оказаки длиной 1000 нт. Синтез затравок, представляющих собой короткие последовательности РНК, обеспечивает продукт гена dnaG (белок 61 фага Т4). ДНК-полимераза начинает элонгацию цепей ДНК, присоединяя первый дезоксирибонуклеозидмонофосфат к 3’-концевому нуклеотиду РНК-затравки. В процессе элонгации участвуют -белок и белки -комплекса, которые перемещаются вдоль молекулы ДНК вместе с каталитической субъединицей ДНК-полимеразы.
Ведущая и отстающая цепи ДНК реплицируются координированно, что обеспечивается димеризацией ДНК-полимеразных комплексов. В таком димере, который образуется при участии -белка, один ДНК-полимеразный комплекс осуществляет непрерывный синтез ведущей цепи ДНК, а другой – фрагментов Оказаки отстающей цепи. Для димеризации ДНК-полимеразы III E. coli необходим -белок, в то время как продукт гена 43 бактериофага Т4, по-видимому, изначально находится в виде димера. Другое различие репликативных комплексов E. coli и фага Т4 заключается в том, что холофермент ДНК-полимеразы E. coli (субъединицы ·‘···) сохраняется в виде стабильного комплекса и в отсутствие ДНК, тогда как холофермент Т4-ДНК-полимеразы существует только в присутствии матрицы.
Необычность ситуации во время синтеза ДНК в репликативной вилке заключается в том, что один и тот же белковый комплекс осуществляет как высоко процессивный непрерывный синтез ведущей цепи ДНК, так и прерывистый синтез фрагментов Оказаки отстающей цепи, претерпевая во втором случае периодическую диссоциацию от матрицы для инициации синтеза ДНК с каждого нового праймера. Для объяснения такого парадокса предположили, что холофермент ДНК-полимеразы способен узнавать 5’-конец каждого РНК-праймера, встречающегося после завершения синтеза очередного фрагмента Оказаки во время образования отстающей цепи ДНК в процессе репликации. Недавно с помощью оригинального экспериментального подхода удалось решить этот вопрос. В участок полипептидной цепи -белка, контактирующий с минимальным ферментом ДНК-полимеразы III, методами генной инженерии ввели аминокислотную последовательность, узнаваемую и фосфорилируемую протеинкиназой. Измеряя скорость фосфорилирования этих сайтов в условиях избытка протеинкиназы во время синтеза ДНК in vitro, определили кинетику ассоциации и диссоциации комплексов -белок–ДНК-полимераза по изменению уровня защищенности сайтов фосфорилирования от действия протеинкиназы. Полученные результаты интерпретировали таким образом, что во время связанного с синтезом фрагментов Оказаки перемещения минимального фермента ДНК-полимеразы и -комплекса вдоль одноцепочечной ДНК-матрицы, покрытой SSB-белком, оба белка прочно связаны с -белком и матрицей. При встрече репликативного белкового комплекса с дуплексом, образованным матричной ДНК и РНК-затравкой, -белок остается связанным с вновь синтезированной ДНК, а у отделившихся ДНК-полимеразы и белков -комплекса появляется возможность вступить в новый цикл синтеза фрагмента Оказаки путем взаимодействия с очередным дуплексом РНК-затравка–матрица. При этом вхождение ДНК-полимеразы в новый репликативный комплекс облегчается наличием в нем -белка и белков -комплекса, ассоциированных с очередным РНК-праймером. Таким образом, холофермент ДНК-полимеразы III обладает способностью распознавать молекулярное окружение, создаваемое матричной ДНК, осуществлять терминацию синтеза ДНК при наличии сигнала в виде дуплекса ДНК–затравка и реинициировать синтез ДНК на следующем праймере. В итоге одна и та же молекула ДНК-полимеразы III в составе реплицирующего комплекса способна проводить синтез всех фрагментов Оказаки отстающей цепи реплицируемой ДНК, последовательно осуществляя инициацию, терминацию и реинициацию синтеза каждого из них.
После очередной терминации синтеза ДНК отстающей цепи 3’-конец вновь синтезированной ДНК оказывается вплотную приближенным к 5’-концу праймера следующего фрагмента Оказаки. Для соединения двух фрагментов с помощью ДНК-лигазы необходимы предварительное удаление РНК-праймера и достройка цепи ДНК в образующейся бреши. РНК-затравка удаляется с помощью РНКазы H, нуклеазы, специфически расщепляющей РНК в ДНК–РНК-гибридах, и(или) с участием 5’3’-экзонуклеазы ДНК-полимеразы I. Во втором случае одновременно с удалением праймера происходит застройка образующейся бреши той же ДНК-полимеразой. В итоге два соседних фрагмента Оказаки вплотную приближаются друг к другу и оказываются отделенными лишь одноцепочечным разрывом, который может репарироваться ДНК-лигазой. В настоящее время остается открытым вопрос о механизмах координации удаления РНК-праймеров из фрагментов Оказаки с самим процессом репликации ДНК.
Кроме вышеупомянутых дуплексов праймеры–ДНК, холоферменты бактериальных и фаговых ДНК-полимераз, по-видимому, способны адекватно реагировать на другие стерические препятствия, возникающие на пути следования вдоль реплицируемой молекулы ДНК. В частности, ДНК-полимераза фага Т4 в процессе репликации может расходиться с транскрибирующими ту же ДНК молекулами РНК-полимеразы, не диссоциируя из репликативного комплекса и не вытесняя РНК-полимеразу с матрицы. Кроме того, репликативный комплекс может распознавать повреждения ДНК, возможно, маркированные специфическими белками, и прекращать репликацию соответствующего участка, останавливаясь или диссоциируя от матрицы. Репликация таких участков ДНК возобновляется после ликвидации повреждений ферментами репаративной системы. Для диссоциировавшей ДНК-полимеразы это становится возможным благодаря тому, что 3’-конец вновь синтезированной цепи ДНК в месте остановки репликации остается связанным с -белком, который облегчает повторное вхождение диссоциировавшей ДНК-полимеразы в репликативный комплекс.
4.1.3.Особенности функционирования репликативной вилки эукариот
Механизмы репликации ДНК у высших эукариот менее изучены из-за их большей сложности. Основные результаты получены на модельной системе с ДНК вируса SV40, в которой процесс репликации исследовали в зараженных клетках человека, культивируемых in vitro. В этой системе вирусный белок, называемый Т-антигеном, выполняет многие функции, необходимые для репликации вирусной ДНК. Во-первых, он является белком-инициатором, необходимым для инициации репликации; во-вторых, он обладает ДНК-хеликазной активностью, т.е. расплетает цепи реплицируемой ДНК перед работающей ДНК-полимеразой, и, в-третьих, Т-антиген необходим для правильного взаимодействия с ДНК ферментного комплекса, синтезирующего праймеры (праймосомы). Тем не менее, вирус SV40 использует для репликации ДНК своей небольшой хромосомы и многие белки клетки-хозяина, что позволяет исследовать функционирование репликативного комплекса клеток человека в такой относительно простой системе.
У эукариот обнаружены шесть ДНК-полимераз, три из которых – , и – непосредственно участвуют в репликации хромосомной ДНК (табл. I.17). Аминокислотные последовательности этих трех ферментов гомологичны друг другу и последовательности продукта гена 43 бактериофага Т4. Эукариотическая ДНК-праймаза в отличие от аналогичного белка прокариот образует постоянный комплекс с ДНК-полимеразой , роль которого, по-видимому, ограничивается синтезом праймеров при репликации обеих цепей ДНК.
Белок PCNA и фактор репликации C (RFС) также образуют стабильный комплекс с ДНК-полимеразой , а в определенных условиях стимулируют и активность ДНК-полимеразы . Во многих отношениях PCNA и RFС являются функциональными аналогами соответственно -белка и белков -комплекса E. coli (см. рис. I.46,б), и их роль в синтезе ведущей и отстающей цепей ДНК вируса SV40 хорошо известна. Механизмы репликации ДНК прокариот и эукариот существенно различаются в том отношении, что во втором случае синтез ведущей и отстающей цепей ДНК
Таблица I.16
Эукариотические ДНК-полимеразы и их функциональные гомологи у прокариот
| ДНК-полимераза | Ген дрожжей | Гомолог E. coli | Молекулярные массы субъединиц, кДа | Биологические функции |
| | POL1 | ? | 160–185 | Синтез ведущей цепи геномной ДНК в репликативной вилке; в комплексе с праймазой обеспечение синтеза праймеров на обеих цепях ДНК |
| | | Pol I | 40 | Заполнение брешей при эксцизионной репарации ДНК, участие в рекомбинации |
| | MIP1 | | 140 (человек) 116 (дрожжи) | Репликация митохондриальной ДНК |
| | POL3 | Pol III | 125 | Синтез отстающей цепи геномной ДНК в репликативной вилке |
| | POL2 | Pol II (?) | 210–230 | Репарация ДНК, регуляция клеточного цикла (?) |
| | REV3 и REV7 | Pol IV (DinB/P) | 173 и 29 | Синтез ДНК на поврежденной матрице при SOS-ответе |
| η | RAD30 | DinB, UmuC | 70 | Синтез ДНК на поврежденной матрице, с включением остатков А напротив тиминовых димеров |
| Примечание. ? гомологи неизвестны. | ||||
осуществляют разные ДНК-полимеразы ( и соответственно), тогда как у E. coli обе цепи ДНК синтезируются димером ДНК-полимеразы III. ДНК-полимераза проводит инициацию синтеза ведущей цепи в точках начала репликации, а ДНК-полимераза осуществляет циклические реинициации синтеза фрагментов Оказаки, по-видимому, распознавая наличие 5’-концевого нуклеотида очередного праймера с последующей диссоциацией от матричной ДНК и присоединением к ней для реинициации синтеза следующего фрагмента Оказаки. Созревание фрагментов Оказаки у эукариот требует удаления РНК-затравок с помощью 5’3’-экзонуклеазы (белковые факторы FEN-1 или MF-1) и РНКазы H1, а также ковалентного соединения фрагментов друг с другом под действием ДНК-лигазы I.
Роль ДНК-полимеразы в настоящее время не ясна. Возможно, этот фермент непосредственно участвует в репликации или в сопряженной с репликацией репарации повреждений ДНК, а также в регуляции клеточного цикла.
ДНК-полимераза обнаружена в 1996 г. у дрожжей S. cerevisiae. При исследовании белков Rev3 и Rev7, которые необходимы для мутагенеза, индуцируемого в ответ на повреждения ДНК, оказалось, что их комплекс обладает ДНК-полимеразной активностью. Эта полимераза способна эффективно использовать в качестве матрицы ДНК, содержащую циклобутановые димеры. В таких условиях активность ДНК-полимеразы составляет лишь 1% от активности ДНК-полимеразы .
ДНК-полимераза η, так же как и предыдущий фермент, участвует в SOS-ответе дрожжей на генотоксические воздействия. В присутствии всех четырех дезоксирибонуклеозидтрифосфатов она осуществляет включение в строящуюся цепь ДНК напротив тиминовых димеров только правильных нуклеотидов (А). Подробнее о функциях бактериальных гомологов двух последних ДНК-полимераз в SOS-мутагенезе см. в разделе 5.1.2.
