Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
5.3.Альтруистичная ДНККак следует из вышеизложенного, стабильность генетической информации любого организма обеспечивается двумя различными путями. Прежде всего, системы детоксикации ксенобиотиков и эндогенных мутагенов осуществляют блокирование токсического потенциала таких соединений путем их химических модификаций, обеспечивающих эффективное выведение из клетки и организма. С другой стороны, если генотоксические агенты, прорвав этот барьер, все-таки модифицируют ДНК, начинает функционировать многокомпонентная система репарации поврежденных генов. Анализ структуры генома эукариот показывает, что для соматических клеток многоклеточного организма остается еще один путь защиты своего генома от мутагенов экзогенного и эндогенного происхождения – разбавление кодирующих последовательностей нуклеотидов некодирующими таким образом, чтобы последние выступали в роли ловушек мутагенов, будь то химические мутагены, непосредственно взаимодействующие с ДНК, или же модифицированные нуклеотиды с измененной специфичностью спаривания, ошибочно включаемые ДНК-полимеразами в ДНК из внутриклеточного пула модифицированных предшественников в процессе репликации. В живом организме, обеспечивающем поддержание внутриклеточного гомеостаза, внутриядерная среда соматических и половых клеток, включающая низкомолекулярные метаболиты, на протяжении больших промежутков времени (соизмеримых со временами клеточного цикла или даже продолжительности жизни самого организма) должна находиться в стационарном состоянии. Можно полагать, что в обычных экологических условиях, к которым организм адаптирован, внутриядерные мутагены, поступающие из цитоплазмы или образующиеся в самом ядре, находятся в стехиометрическом недостатке по отношению к потенциальным мишеням, способным их акцептировать, в том числе и азотистым основаниям геномной ДНК. Кроме того, в первом приближении можно считать, что расположенные по соседству кодирующие и некодирующие последовательности нуклеотидов ДНК в равной степени доступны действию на них внутриядерных мутагенов. В таких условиях вероятность образования аддуктов внутриядерных мутагенов с кодирующими последовательностями нуклеотидов геномной ДНК будет прямо пропорциональна их суммарной длине (доле) в геномной ДНК или обратно пропорциональна "разбавлению" этих последовательностей некодирующими последовательностями нуклеотидов. Такое разбавление могло бы произойти в результате эволюционных преобразований генома-предшественника путем включения в него некодирующих избыточных последовательностей при участии разных молекулярных механизмов. Вовлечение систем репарации повреждений ДНК в поддержание генетической стабильности информационных макромолекул клетки является вынужденной мерой, указывающей на то, что действие всех остальных систем защиты не обеспечивает полной сохранности нативного состояния генома. Тем не менее, любая генетическая система будет функционировать надежнее в том случае, если наиболее важные в обеспечении жизнедеятельности генетические локусы будут дополнительно защищены от действия химических мутагенов. Действительно, с точки зрения защиты информации гораздо большего эффекта можно достичь путем создания дополнительных препятствий на пути генотоксических агентов к таким локусам, чем репарацией поврежденных генов, так как в последнем случае не всегда повреждение может быть исправлено и исходная первичная структура ДНК восстановлена. Как следует из дальнейшего изложения, любому, и особенно эукариотическому, геному свойственна дифференциальная защита индивидуальных генетических локусов с помощью очень простого механизма. Необходимость дополнительной защиты генетической информации особенно актуальна для многоклеточных организмов в связи с тем, что у них существует опасность накопления соматических мутаций во время онтогенетического развития, когда создаются гигантские клоны высококооперированных и специализированных соматических клеток. 5.3.1.Парадокс возможности существования многоклеточных организмовОгромный размер генома многоклеточных организмов с генетической точки зрения должен создавать для их существования многочисленные и, на первый взгляд, трудноразрешимые препятствия. Проблемы начинаются уже при редупликации гигантских молекул геномной ДНК с помощью ферментных систем, точность функционирования которых не является абсолютной. Кроме того, репликация происходит в присутствии мутагенов экзогенного и эндогенного происхождения. Принято считать, что частота спонтанных мутаций в геноме соматических клеток млекопитающих, растущих в культуре, варьирует от локуса к локусу одного и того же генома и, по разным оценкам, достигает значений от 10-8 до 10-12 на нуклеотид за клеточную генерацию. Точное определение частоты спонтанных мутаций в геномной ДНК высших эукариот in vivo является сложной задачей. По ряду экспериментальных и косвенных данных, в частности, исходя из частоты встречаемости некоторых наследственных заболеваний в популяциях человека (например серповидно-клеточной анемии, вызываемой заменой единственного нуклеотида в геномной ДНК), полагают, что эти показатели, по крайней мере, не ниже значений, полученных in vitro. 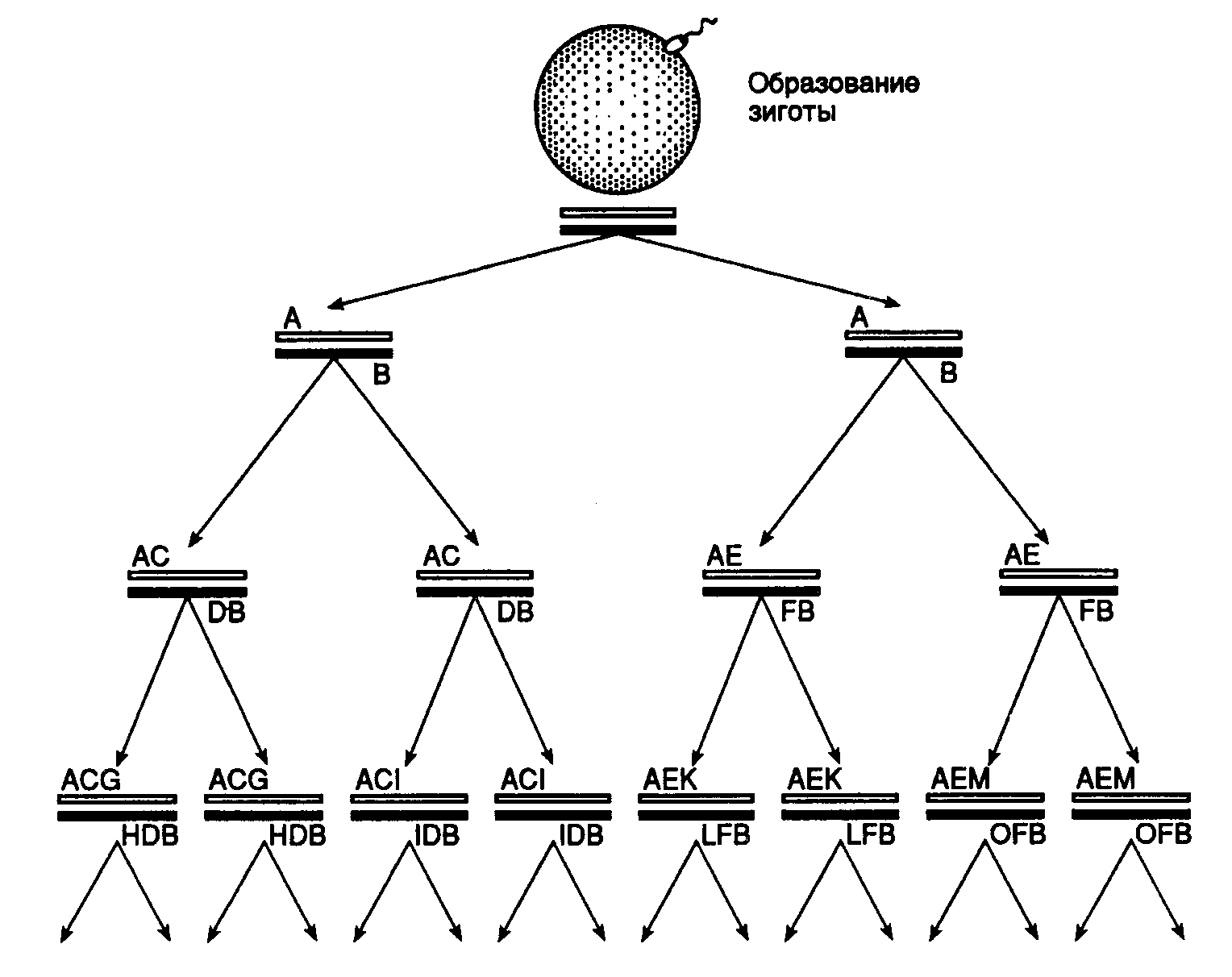 Рис. I.62. Происхождение генетического груза в геноме соматических клеток многоклеточных организмов Развитие многоклеточного организма начинается с дробления зиготы, образующейся в процессе оплодотворения яйцеклетки и содержащей диплоидный набор хромосом (две параллельные линии вверху рисунка). А–М – наборы мутаций Принимая, что суммарная ДНК гаплоидного генома человека насчитывает 3·109 п.о., а частота спонтанных мутаций в среднем составляет 10-8 на нуклеотид за генерацию, можно предположить, что, начиная с первого деления оплодотворенной яйцеклетки в процессе онтогенетического развития организма человека, каждое следующее деление должно сопровождаться появлением в их геномной ДНК, по крайней мере, 30 независимых мутаций (рис. I.62). Организм человека состоит из 1015 клеток. Для образования стольких клеток из оплодотворенной яйцеклетки требуется 50 клеточных генераций. Следовательно, гаплоидный геном каждой из соматических клеток человека 50-й генерации должен содержать в разных частях, по крайней мере, 1500 мутаций. Если предположить далее, что набор из 30 мутаций возникает и закрепляется в каждом последующем клеточном делении независимо от мутаций, полученных во время предыдущих делений клеток, то получается, что любая дочерняя соматическая клетка наследует от клетки-предшественницы все имеющиеся в ее геноме мутации и приобретает блок новых 30 мутаций. При этом набор соматических мутаций в потомстве каждой из делящихся клеток одного поколения будет отличаться один от другого, в том числе и в парах аллельных локусов ДНК отдельных клеток, поскольку они редуплицируются независимо. При таком развитии событий мутации, возникающие в геноме соматических клеток каждой последующей генерации, случайным образом сканируют шаг за шагом всю реплицирующуюся геномную ДНК, а результаты сканирования не повторяются в каждом новом поколении клеток. Так, блок из 30 спонтанных мутаций, возникающих после гипотетической 50-й генерации соматических клеток в онтогенезе многоклеточного организма, должен присутствовать в 1015 (250) вариантах. Проблема становится еще более очевидной, если иметь в виду, что многие клетки организма, например эпителиальные или стволовые клетки крови, пролиферируют на протяжении всей жизни многоклеточного организма, совершая громадное число клеточных делений. По некоторым оценкам, общее число клеточных циклов, в которых участвуют клетки человека на протяжении его жизни, приближается к 1016. Кроме того, соматические мутации возникают в многоклеточном организме не только в активно пролиферирующих, но и покоящихся клетках. Частоты возникновения спонтанных мутаций в пролиферирующих и в покоящихся клетках млекопитающих в ряде случаев различаются лишь незначительно. Парадоксальность эволюционно сложившейся генетической ситуации заключается в том, что если бы большая часть последовательностей нуклеотидов геномной ДНК заключала в себе жизненно важную генетическую информацию, существование многоклеточных организмов было бы невозможно. Их гибель происходила бы из-за неизбежного накопления в делящихся соматических клетках вредных или летальных мутаций, приводящих к обрыву линий дифференцирующихся в онтогенезе соматических клеток. Это особенно относится к мутациям в жизненно важных генах половых хромосом, которые в соматических клетках находятся в гемизиготном состоянии. Альтернативно основные генетические локусы многоклеточных организмов могут находиться под дополнительной защитой от мутационных изменений.2 На основании приведенных выше аргументов можно сделать вывод о том, что большая часть некодирующих избыточных последовательностей нуклеотидов геномной ДНК эукариот не заключает в себе жизненно важной генетической информации и/или у эукариотических клеток имеются механизмы, обеспечивающие дополнительную защиту геномной ДНК от мутаций. Не соглашаясь с основными положениями концепции "эгоистической" и "паразитической" ДНК, можно предположить, что именно такая организация генома эукариотических организмов, в корне отличающаяся от структуры генома прокариот, имеет отношение к разрешению проблемы генетической парадоксальности существования многоклеточных организмов, которую можно назвать парадоксом М (Metazoa, Metaphyta). Создается впечатление, что именно избыточная ДНК генома эукариот может иметь отношение к повышению его информационной стабильности до уровня, необходимого для реализации многоклеточности в природе. |
