Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
7.2.3.Космиды и фазмиды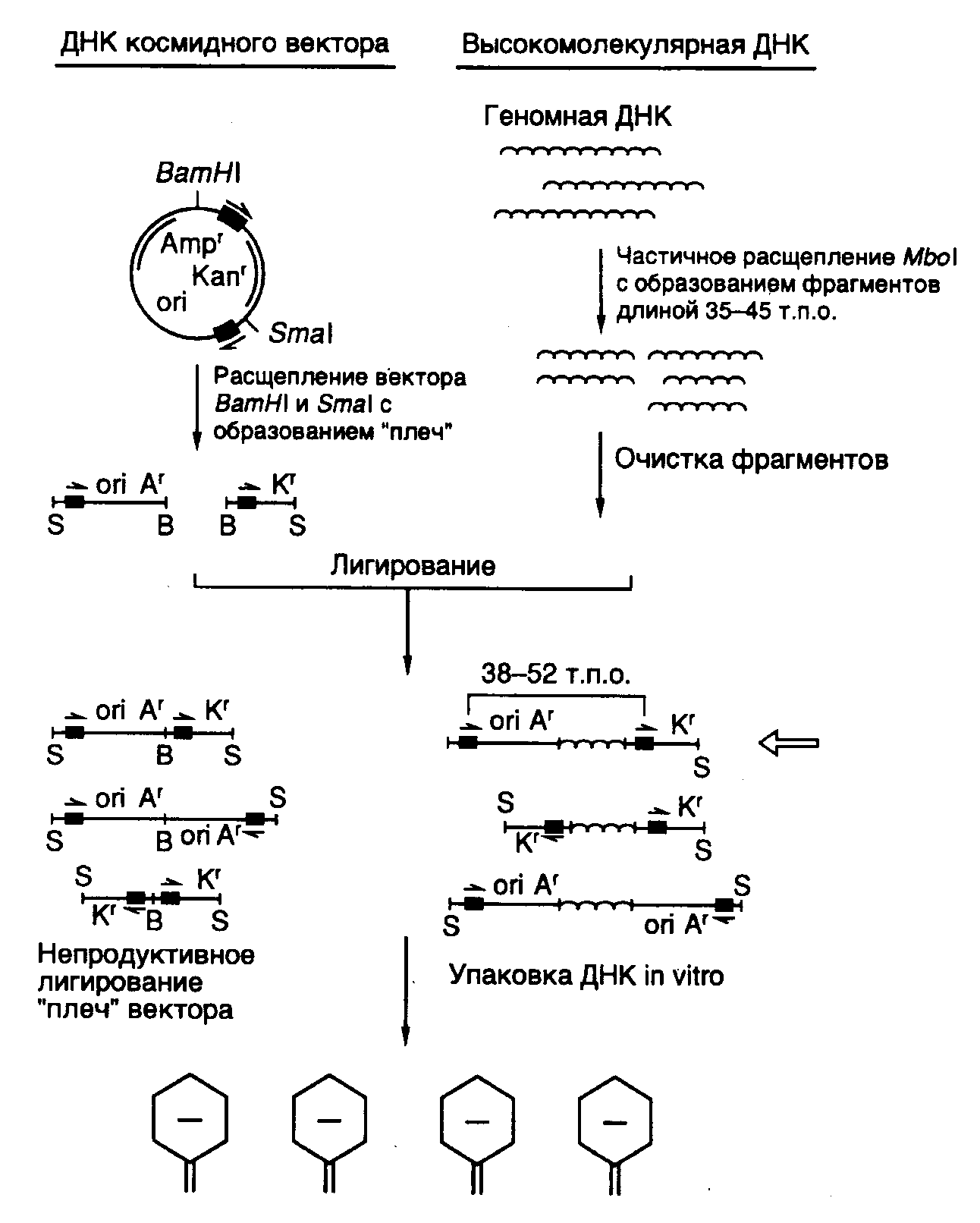 Рис. II.8. Космидный вектор и конструирование клонотеки геномной ДНК на его основе Как уже упоминалось выше, фаговые векторы позволяют клонировать фрагменты ДНК длиной 15–25 т.п.о. Однако этого явно недостаточно, чтобы клонировать целиком многие гены животных и растений, длина которых зачастую превышает 35–40 т.п.о. Требуемой емкостью обладают векторные молекулы, называемые космидами (рис. II.8). Космиды представляют собой небольшие плазмиды, в которые in vitro введены cos-сайты ДНК фага . Отсюда происходит название всего типа данных векторов (cosmid). В ДНК нормальных фаговых частиц cos-сайты расположены на концах молекул, они разделяют мономеры фаговой ДНК в конкатемерах, объединяющих несколько соединенных "голова к хвосту" мономеров, которые являются предшественниками зрелых фаговых ДНК перед упаковкой в фаговые частицы. В таких конкатемерах соседние cos-сайты располагаются на расстоянии 35–45 т.п.о. друг от друга и заключают между собой весь фаговый геном. В процессе упаковки cos-сайты узнаются компонентами ферментативной системы и по ним происходит последовательное отделение (отрезание) упакованной в фаговую частицу -ДНК от остальной неупакованной ДНК конкатемера. Таким образом, наличие cos-сайтов в ДНК является, по существу, единственным необходимым условием упаковываемости ДНК в фаговые частицы. Это означает, что последовательность нуклеотидов -ДНК, расположенная между двумя cos-сайтами, которая заключает в себе весь фаговый геном (35–45 т.п.о.), может быть замещена in vitro на аналогичный по длине (38–52 т.п.о.) фрагмент чужеродной ДНК и эффективно упакована в фаговые частицы (такова максимальная емкость головки фага). Естественно, что такая искусственная фаговая частица оказывается нежизнеспособной. Однако после адсорбции химерной фаговой частицы на поверхности бактериальной клетки заключенная в ней ДНК проникает (вводится фаговой частицей) внутрь бактерии и начинает автономно реплицироваться как плазмида, размер которой составляет 30–40 т.п.о. Поскольку такая плазмида (космида) содержит в своем составе селектируемые маркеры в виде генов устойчивости к антибиотикам, ее поддерживают в бактериальных клетках путем выращивания бактерий на среде с соответствующими антибиотиками. Несмотря на то что емкость космидных векторов значительно выше фаговых, эффективность клонирования в космидах ниже, хотя и достигает в ряде случаев 105–106 колоний на 1 мкг клонируемой ДНК. При такой эффективности упаковки требуется всего лишь 2–4 мкг клонируемой ДНК для получения полной клонотеки большинства эукариотических геномов. Стадия упаковки ДНК космид в фаговые частицы используется лишь для облегчения процесса введения рекомбинантных ДНК большого размера внутрь бактериальных клеток. Такой процесс имитирует проникновение фаговой хромосомы в бактерии во время фаговой инфекции. В случае космид сходство между их проникновением в бактериальные клетки и фаговой инфекцией на этом заканчивается. Однако сходство является более глубоким в случае векторов, называемых фазмидами. Фазмиды представляют собой векторные молекулы ДНК, которые содержат в себе генетические элементы плазмид и хромосом бактериофагов. Они могут обладать емкостью в отношении клонируемой ДНК, характерной для -векторов, и существовать в определенных условиях в бактериальных клетках в виде плазмиды или же упаковываться в фаговые частицы in vivo при изменении этих условий. 7.2.4.Сверхъемкие векторы YAC, BAC и PAC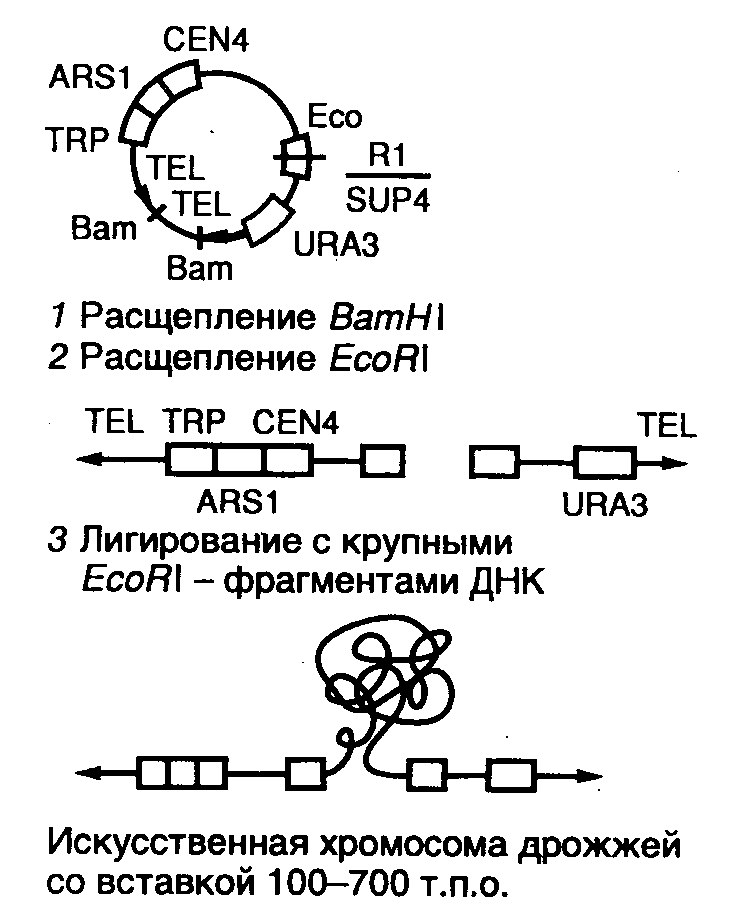 Рис. II.9. Схема клонирования сверхдлинных молекул ДНК с использованием вектора YAC 1 – линеаризация ДНК вектора рестриктазой BamHI; 2 – расщепление линеаризованной ДНК вектора рестриктазой EcoRI с образованием "плечей"; 3 – введение в вектор клонируемого EcoRI-фрагмента ДНК Хромосомы высших организмов содержат в своем составе протяженные молекулы ДНК. Например, длина ДНК одной из типичных хромосом человека составляет 100–200 миллионов пар оснований (м.п.о.). Исследование генов в хромосомах высших растений, животных и человека потребовало создания векторов для клонирования фрагментов ДНК длиной в несколько сотен тысяч пар оснований. Этим задачам отвечает недавно созданная система для клонирования сверхдлинных молекул ДНК на основе искусственно полученной мини-хромосомы дрожжей YAC (yeast artificial chromosome). YAC-вектор представляет собой кольцевую молекулу ДНК, содержащую ряд генетических элементов, которые позволяют ей существовать во внехромосомном состоянии в клетках дрожжей (рис. II.9). Вектор заключает в себе две теломерные последовательности нуклеотидов TEL, необходимые для репликации концов мини-хромосомы, и область начала репликации ARS1, соединенную с последовательностью центромеры. Все эти функциональные элементы требуются для репликации YAC-вектора и его правильной передачи в дочерние ядра во время митоза. Кроме того, вектор содержит два селектируемых маркера TRP, восстанавливающих способность к росту ауксотрофных по триптофану клеток дрожжей в отсутствие экзогенного триптофана, а также маркер URA3, компенсирующий генетический дефект клеток дрожжей, который нарушает биосинтез урацила. В векторе имеется также ген супрессорной тРНК sup4, являющийся селектируемым маркером для поддержания вектора в мутантных бактериальных клетках, содержащих амбер-мутации в жизненно важных генах. Помимо этого, он обладает последовательностями нуклеотидов, необходимыми для его репликации в бактериальных клетках. При подготовке к клонированию YAC-вектор, выделенный в виде плазмиды, расщепляют рестриктазой BamHI и отделяют от образовавшегося короткого фрагмента ДНК, который не требуется для репликации YAC-вектора в дрожжах (этап 1). После этого проводят второе расщепление вектора рестриктазой EcoRI, сопровождающееся образованием двух его "плеч", каждое из которых на одном из концов содержит теломерные последовательности хромосомы дрожжей (этап 2). На заключительном этапе (3) полученные "плечи" лигируют с крупными EcoRI-фрагментами клонируемой ДНК, которые получают путем частичного расщепления высокомолекулярной хромосомной ДНК, предназначенной для клонирования. Полученными таким образом рекомбинантными ДНК трансформируют протопласты клеток дрожжей, и образовавшиеся трансформанты отбирают на селективной твердой питательной среде. В таком векторе удавалось осуществлять клонирование фрагментов ДНК длиной до 700 т.п.о. При всех своих достоинствах системы клонирования, основанные на векторах семейства YAC, обладают рядом существенных недостатков. В рекомбинантных ДНК, поддерживаемых в таких системах, часто возникают внутренние делеции. Кроме того, при введении рекомбинантных ДНК в клетки дрожжей иногда имеет место проникновение в одну клетку нескольких молекул вектора со вставками. В итоге отдельные клоны дрожжевых клеток могут содержать несколько несцепленных друг с другом молекул рекомбинантных ДНК, а рекомбинация между ними вообще может приводить к образованию химерных молекул. Все это очень затрудняет физическое картирование генов в хромосомах исследуемых объектов. Для преодоления такого рода трудностей были сконструированы альтернативные векторные системы, среди которых наиболее популярными в настоящее время являются системы, основанные на искусственных хромосомах бактерий – BAC (bacterial artificial chromosome). 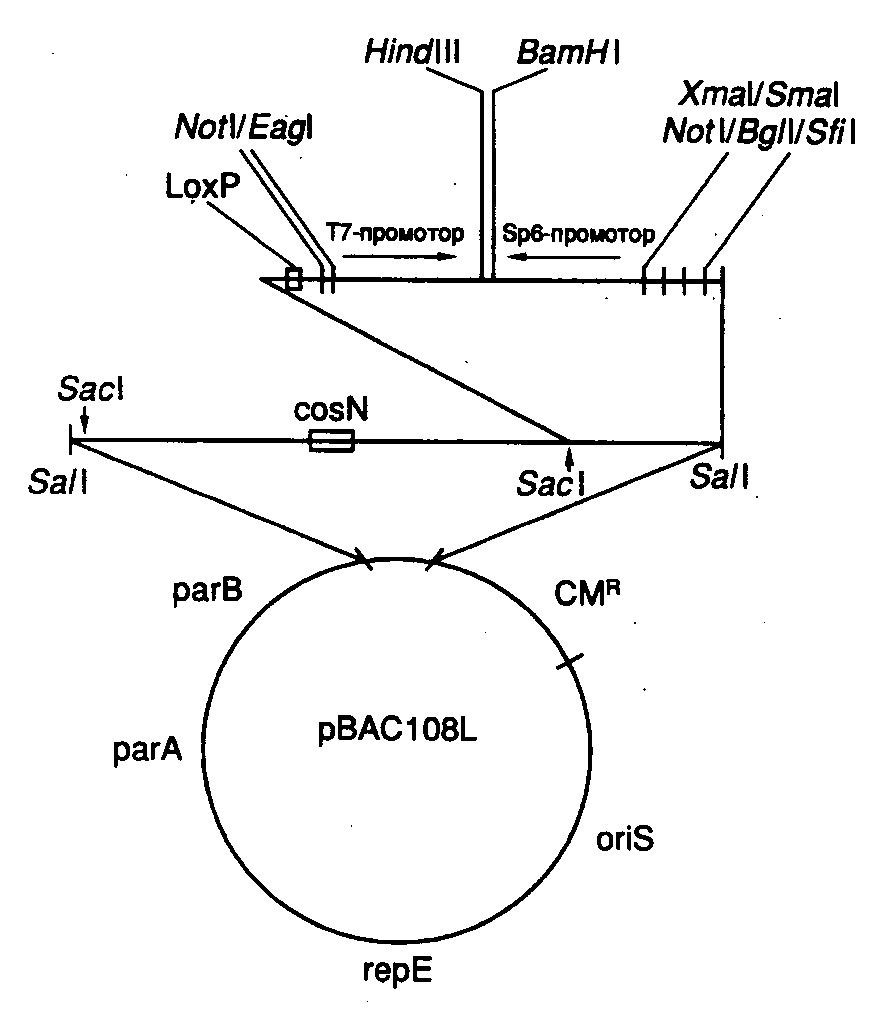 Рис. II.10. Вектор pBAC108L – представитель семейства BAC-векторов В векторных системах BAC используется ДНК хорошо изученного полового фактора (F-фактора) E. coli – гигантской плазмиды мужских бактериальных клеток, которые являются донорами бактериальной ДНК при конъюгации с женскими клетками (рис. II.10). Типичный F-фактор содержит гены oriS, repE, parA и parB, регулирующие его собственную репликацию и контролирующие число его копий в бактериальных клетках. В частности, гены oriS и repE обеспечивают однонаправленную репликацию F-фактора, а гены parA и parB поддерживают число его копий на уровне одной-двух на бактериальную клетку. Классический вектор BAC (pBAC108L) включает в себя все эти гены, а также ген устойчивости к хлорамфениколу, используемый в качестве селектируемого маркера. Вектор содержит также сегмент ДНК, по которому производится клонирование. В этом сегменте имеется типичный полилинкер, а также два уникальных сайта рестрикции HindIII и BamHI, фланкированные промоторами T7- и Sp6-РНК-полимераз. Эти промоторы могут быть использованы для получения РНК-зондов, необходимых для осуществления "прогулок по хромосомам" (раздел 7.6.2), а также прямого секвенирования клонированной ДНК в месте стыковки с вектором. Кроме того, во фрагменте имеется сайт cosN, обеспечивающий расщепление вектора со вставкой в уникальном месте с помощью терминазы фага без применения ферментов рестрикции. Этот фермент используется бактериофагом для специфического разрезания конкатемеров своей хромосомы при упаковке в фаговые частицы. Для той же цели может быть применен и сайт loxP бактериофага Р1, который является мишенью для фаговой эндонуклеазы Cre. Эти сайты используются для получения специфических концов клонированной ДНК с целью ее дальнейшего рестрикционного картирования путем введения концевой метки с последующим неполным расщеплением с помощью рестриктаз и электрофоретическим разделением образовавшихся фрагментов (см. раздел 7.6.1). Современные BAC-векторы позволяют клонировать фрагменты ДНК длиной до 300 т.п.о. и выше. Рекомбинантные молекулы вводятся в клетки E. coli с помощью электропорации (см. раздел 7.3.2), причем эффективность образования трансформантов в 10–100 раз выше, чем при обычной трансформации сферопластов дрожжей векторами семейства YAC. Это позволяет уменьшить исходное количество ДНК, необходимое для конструирования репрезентативных клонотек генов (см. раздел 7.3). При скрининге таких клонотек используются традиционные методы работы с бактериальными колониями (раздел 7.3.3). В отличие от YAC-ДНК, которая находится в клетках дрожжей в линейной форме, BAC-векторы со вставками, как и традиционные F’-факторы, существуют в бактериальных клетках в виде кольцевых суперскрученных молекул. Это облегчает их выделение и последующую работу с рекомбинантными молекулами ДНК в растворе, а кроме того, допускает простое повторное введение в бактериальные клетки этих ДНК, выделенных минипрепаративными методами. Поскольку рекомбинантные BAC-векторы существуют в бактериальных клетках в виде одной копии, исключаются совместное клонирование в одной клетке разных фрагментов ДНК и образование химерных молекул, что весьма существенно для физического картирования больших геномов методами "снизу вверх" (см. раздел 12.1.4). Весьма существенным свойством системы клонирования, основанной на векторах семейства BAC, является ее генетическая стабильность. Исходная структура клонированных фрагментов ДНК в пределах точности использованных методов сохраняется в таких векторах даже после 100 серийных пересевов бактериальных клеток, содержащих рекомбинантные молекулы ДНК. Все вышеперечисленные свойства переводят векторы BAC в разряд сверхъемких векторов нового поколения. В заключение следует упомянуть о семействе векторов PAC (P1-derived artificial chromosome), также часто используемых в современных исследованиях. Векторы этой серии содержат гены бактериофага Р1, обеспечивающие репликацию фаговой хромосомы в зараженных бактериальных клетках. Рекомбинантные ДНК на их основе (размер вставки 150–200 т.п.о.) также вводятся в бактериальные клетки с помощью электропорации. |
