|
|
Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
8.2.Белковая инженерия
После рассмотрения способов получения сайт-специфических мутаций необходимо сделать лишь один шаг, чтобы оказаться лицом к лицу с бурно развивающимся направлением молекулярной генетики, называемым белковой инженерией. Действительно, разработка методов направленного мутагенеза дала возможность не только с высокой точностью модифицировать отдельные белки и изучать их структурно-функциональные взаимоотношения, но и конструировать новые белки, не существовавшие в природе. Впечатляющими результатами применения такого подхода являются гибридные белки, получаемые путем объединения фрагментов и функциональных доменов разных полипептидных цепей с использованием генно-инженерных методов.
Другое перспективное направление белковой инженерии – это конструирование биологически активных пептидов, обладающих фармакологической активностью.
8.2.1.Библиотеки пептидов и эпитопов
В живом организме большинство биологических процессов управляется посредством специфических белок-белковых или белково-нуклеиновых взаимодействий. К таким процессам относятся, например регуляция транскрипции генов под действием различных белковых факторов, взаимодействие белковых лигандов с рецепторами на поверхности клеток, а также специфическое связывание антигенов соответствующими антителами. Понимание молекулярных механизмов взаимодействия белковых лигандов с рецепторами имеет большое фундаментальное и прикладное значение. В частности, разработка новых лекарственных препаратов белковой природы обычно начинается с идентификации исходной последовательности аминокислот, обладающей требуемой биологической активностью (так называемая "основная" (lead) последовательность). Однако пептиды с основной последовательностью аминокислот могут обладать и нежелательными биологическими свойствами: низкой активностью, токсичностью, малой стабильностью в организме и т.п.
До появления библиотек пептидов улучшение их биологических свойств осуществляли путем последовательного синтеза большого числа аналогов и проверкой их биологической активности, что требовало больших затрат времени и средств. В последние годы появилась возможность с помощью автоматических синтезаторов создавать за короткое время тысячи различных пептидов. Разработанные методы направленного мутагенеза также позволили резко расширить число белков, получаемых одновременно и последовательно тестируемых на биологическую активность. Однако только недавно разработанные подходы к созданию библиотек пептидов привели к получению миллионов последовательностей аминокислот, требуемых для проведения эффективного скрининга с целью выявления среди них пептидов, максимально удовлетворяющих предъявляемым критериям. Такие библиотеки используются для исследования взаимодействия антител с антигенами, получения новых ингибиторов ферментов и антимикробных агентов, конструирования молекул, обладающих требуемой биологической активностью, или придания новых свойств белкам, например антителам.
По способам получения библиотеки пептидов разделяются на три группы. К первой группе можно отнести библиотеки, полученные с использованием химического синтеза пептидов, в которых индивидуальные пептиды иммобилизованы на микроносителях. При таком подходе после присоединения очередных аминокислот в индивидуальных реакционных смесях к пептидам, иммобилизованным на микроносителях, содержимое всех реакционных смесей объединяют и разделяют на новые порции, которые используют на следующей стадии присоединения новых аминокислотных остатков. После проведения ряда таких этапов оказываются синтезированными пептиды, содержащие последовательности использованных в синтезе аминокислот во всевозможных случайных сочетаниях.
Библиотеки пептидов, иммобилизованных на микроносителях, обладают существенным недостатком: они требуют при скрининге использования очищенных рецепторов, находящихся в растворимой форме. В то же время в большинстве случаев при биологических испытаниях, проводящихся для фундаментальных и фармакологических исследований, чаще всего находят применение рецепторы, ассоциированные с мембранами. По второму способу библиотеки пептидов получают с помощью твердофазного синтеза пептидов, при котором на каждой стадии химического присоединения очередной аминокислоты к растущим пептидным цепям используют эквимолярные смеси всех или некоторых аминокислот-предшественников. На конечной стадии синтеза проводят отделение пептидов от носителя, т.е. перевод их в растворимую форму. Третий подход к конструированию библиотек пептидов, к описанию которого мы сейчас переходим, стал реальным именно благодаря развитию методов генной инженерии. Он прекрасно иллюстрирует возможности таких методов и, несомненно, является крупным достижением в их применении. В этой связи рассмотрим более подробно результаты использования библиотек пептидов в исследовании эпитопов (антигенных детерминант) белков.
Генно-инженерная технология получения гибридных белков позволила разработать эффективный метод наработки коротких пептидов для анализа их биологической активности. Как и в случае клонотек генов, библиотеки пептидов, полученные генно-инженерными методами, представляют собой большой (часто исчерпывающий) набор коротких пептидов. Два недавно сделанных наблюдения позволяют рассматривать библиотеку пептидов одновременно и в качестве библиотеки эпитопов белков. Во-первых, короткие пептиды могут включать все основные остатки аминокислот, играющие главную роль во взаимодействии с антителами, и они в состоянии имитировать крупные антигенные детерминанты белков. Во-вторых, в большинстве случаев нековалентные связи, образуемые между немногими наиболее важными остатками аминокислот белковых лигандов и их рецепторами, вносят основной вклад в общую энергию взаимодействия лиганд–рецептор. С учетом этого любой пептид можно рассматривать как потенциальный лиганд, гаптен или часть антигенной детерминанты более крупных полипептидов, а любую библиотеку пептидов – как библиотеку эпитопов белков или потенциальных лигандов для соответствующих белковых рецепторов.
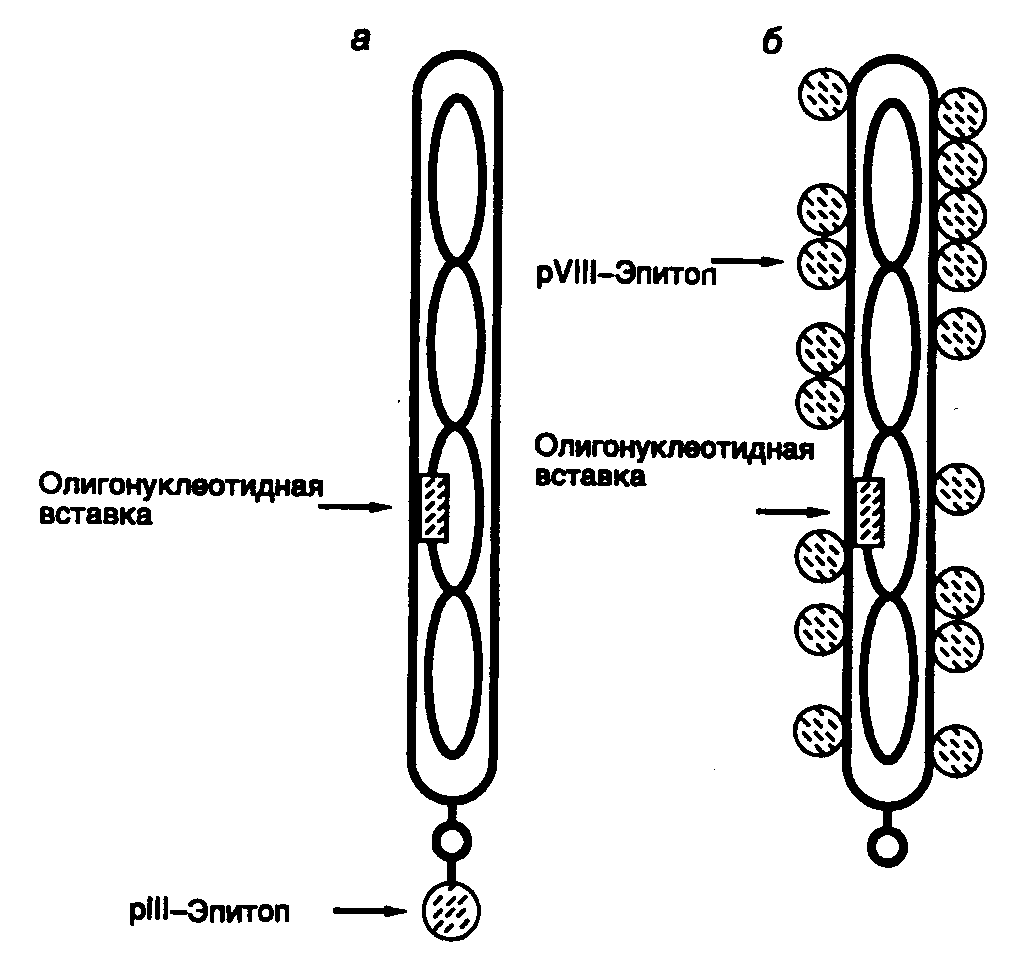
Рис. II.19. Схема экспрессии пептидных эпитопов на поверхности оболочки нитевидных колифагов
Пептидные эпитопы находятся в составе гибридных полипептидных цепей минорного белка pIII (а) или основного белка pVIII вирусной оболочки (б). Стрелки указывают положение кодирующих эпитопы олигонуклеотидных фрагментов в геноме бактериофага, а также положение самих эпитопов. В составе полипептида pIII (а) показана только одна копия эпитопа (на самом деле их число достигает 4–5)
Библиотека пептидов, полученная в результате реализации третьего подхода, в современном виде представляет собой набор десятков или даже сотен миллионов коротких различающихся последовательностей аминокислот, которые экспрессированы на поверхности вирионов бактериофагов в составе их собственных структурных белков. Это становится возможным благодаря введению методами генной инженерии в геном бактериофагов гибридных рекомбинантных генов, кодирующих измененные структурные белки его вирионов. (Данный метод известен под названием фагового дисплея.) В результате экспрессии таких генов образуются гибридные белки, на N- или С-концах которых (см. ниже) присутствуют дополнительные последовательности аминокислот. В наиболее хорошо разработанной системе, позволяющей конструировать библиотеки пептидов генно-инженерными методами, используют небольшой нитевидный колифаг f1 и два его белка: основной и минорный белки оболочки pVIII и pIII. In vivo оба белка синтезируются в виде полипептидных цепей с короткими N-концевыми сигнальными последовательностями, которые отщепляются сигнальной пептидазой во время их созревания после переноса к внутренней части бактериальной мембраны. Зрелые белки встраиваются в оболочку бактериофага в процессе ее сборки. При этом белок pVIII образует основную оболочку бактериофага, тогда как четыре или пять молекул pIII ассоциированы с концевой частью вириона и обеспечивают взаимодействие вирусных частиц с половыми ворсинками клеток E. coli (рис. II.19). Генно-инженерными методами пептиды соединяют с белками – непосредственно с их N-концевыми последовательностями или на небольшом от них расстоянии. Концевые последовательности большинства белков являются более гибкими и, как правило, экспонируются на поверхности глобулы, что позволяет получать гибридные рекомбинантные белки без существенного нарушения их основных свойств, а также делает интегрируемые пептиды доступными для распознавания извне. Кроме того, в таком положении и пространственная структура самих пептидов испытывает меньшее влияние белка-носителя. В ходе экспериментов было установлено, что введение чужеродных пептидов в N-концевую часть белка pIII не оказывает существенного влияния на жизнеспособность и инфекционность фаговых частиц, тогда как соединение пептидов длиной >5 аминокислотных остатков с N-концевой частью белка pVIII нарушает сборку вирионов. Последнее затруднение можно преодолеть доставкой к месту сборки вирионов молекул белка pVIII дикого типа, синтез которых направляется соответствующим геном вируса-помощника. В этом случае оболочка бактериофага будет содержать как измененные белки pVIII, так и полипептиды дикого типа от вируса-помощника.

Рис. II.20. Схема конструирования рекомбинантного вирусного генома, содержащего вставки вырожденных олигонуклеотидов, для получения библиотеки эпитопов
Двухцепочечный олигонуклеотид (а), содержащий вырожденные кодоны NNK и те же самые сайты рестрикции в составе линкеров, лигируют с ДНК вектора Fuse5 (б), расщепленного рестриктазой SfiI, с образованием рекомбинантного генома (в), который направляет синтез гибридного рекомбинантного белка (г), содержащего на N-конце указанную аминокислотную последовательность
При конструировании библиотеки пептидов прежде всего синтезируют два комплементарных друг другу олигонуклеотида, которые после отжига образуют двухцепочечную молекулу, центральная часть которой кодирует собственно пептиды (рис. II.20,а), а выступающие по концам одноцепочечные участки комплементарны "липким" концам вектора, получающимся под действием соответствующей рестриктазы (см. рис. II.20,б).
Для кодирования аминокислот пептидов используют вырожденные кодоны вида NNK или NNS, которые включают все четыре нуклеотида (N) в первом и втором положениях, G или T (K), а также G или С (S) в третьем положении. При таком подходе информация о всех 20 аминокислотах и одном стоп-кодоне заключена в 32 различных кодонах NNK и NNS, а не в 64, как это имеет место в случае природного генетического кода.
В процессе синтеза вырожденных олигонуклеотидов, кодирующих исследуемые пептиды, на каждой стадии используют индивидуальные нуклеотиды для кодонов инвариантных аминокислот, фланкирующих вариабельный участок пептида, а также эквимолярные смеси нуклеотидов для участков, кодирующих случайные последовательности. Образовавшийся в итоге набор вырожденных олигонуклеотидов далее клонируют в виде одноцепочечных фрагментов в соответствующих сайтах гена белка оболочки бактериофага в составе фагового вектора или фазмиды. Альтернативно для такого набора олигонуклеотидов (химически или с помощью ПЦР) синтезируют комплементарные цепи с включением инозина в вариабельные участки, поскольку его остатки, как известно, спариваются с основаниями С и T матрицы, что облегчает образование правильных дуплексов между соответствующими олигонуклеотидами. Образующиеся двухцепочечные олигонуклеотиды в случае необходимости обрабатывают соответствующими рестриктазами и клонируют в фаговом векторе. Итоговые рекомбинантные молекулы (см. рис. II.20,в) ДНК вводят в бактериальные клетки, получая
109 трансформантов на 1 мг рекомбинантной ДНК, образовавшиеся фаговые частицы размножают в бактериях и после очистки исследуют на присутствие рекомбинантных пептидов (см. рис. II.20,г), способных взаимодействовать с исследуемыми рецепторами в белках их вирионов.
Число индивидуальных фаговых клонов в библиотеке является определяющим для ее использования. К примеру, библиотека, заключающая в себе все возможные гексапептиды, должна содержать 64 млн (206) разных шестичленных аминокислотных последовательностей, кодируемых
1 млрд (326) различных гексакодонов (32 – число кодонов, с помощью которых можно закодировать любую из 20 аминокислот предложенным выше способом, а именно с использованием кодонов NNK или NNS). Для решения такой задачи должны быть получены очень большие библиотеки, содержащие, по крайней мере, 2·108 – 3·108 индивидуальных, независимых клонов, а величина 109 в настоящее время является верхним пределом для числа индивидуальных клонов библиотеки, которую еще можно практически использовать.
Исходя из этого, можно заключить, что максимальная длина пептидов, включающих в себя все возможные сочетания 20 аминокислот, с которыми возможно работать с помощью библиотек пептидов, составляет 6 аминокислотных остатков. Тем не менее, следует иметь в виду, что библиотека 15-членных пептидов того же размера (2–3·108 клонов) будет содержать больше разнообразных гексапептидов, чем рассмотренная выше библиотека 6-членных пептидов. Кроме того, поскольку лишь ограниченное число аминокислотных остатков в пептиде действительно определяет его биологическую активность, библиотека 15-членных пептидов может оказаться представительнее библиотеки более коротких пептидов с тем же числом клонов.
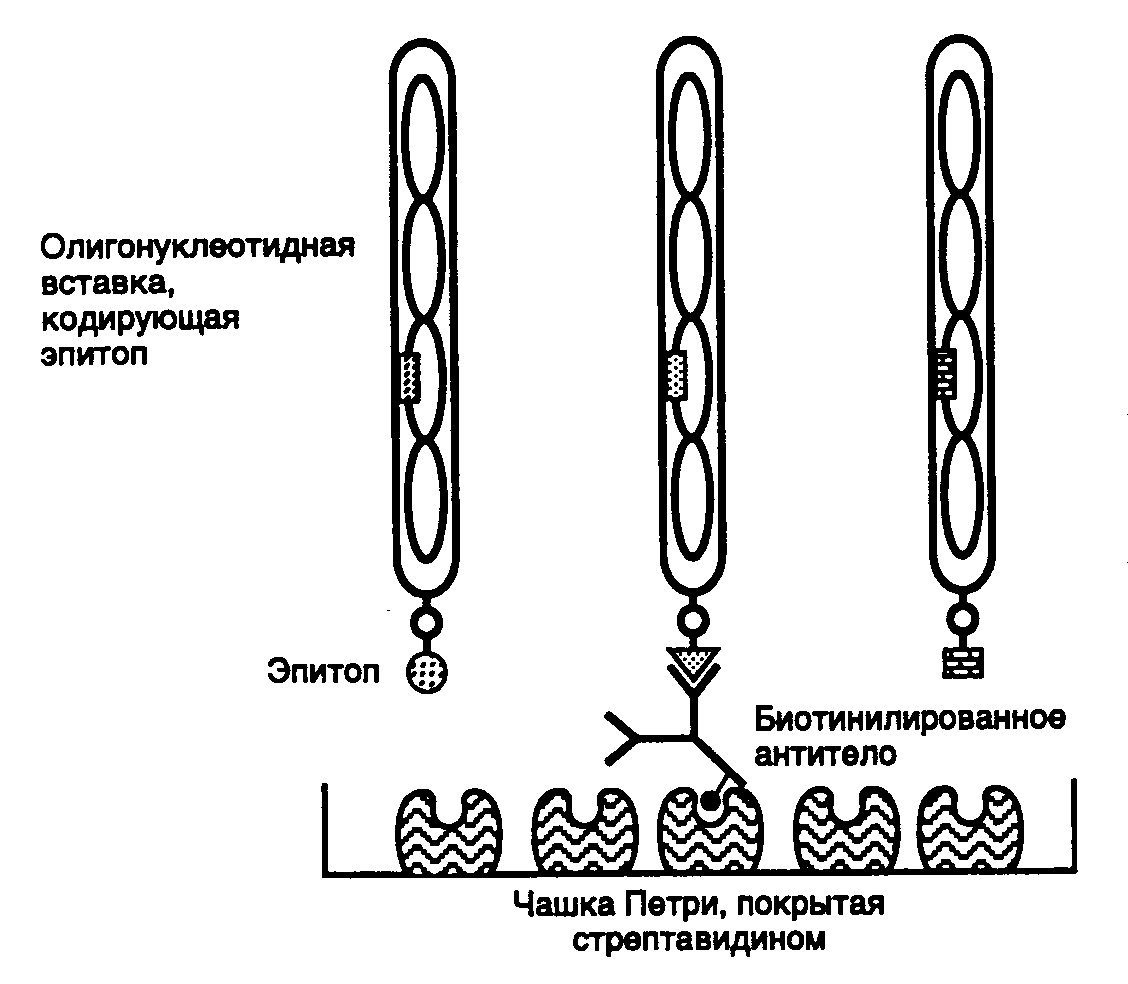
Рис. II.21. Схема отбора фаговых частиц, обладающих требуемыми эпитопами
Показаны три рекомбинантных фаговых частицы, экспрессирующие разные эпитопы в составе pIII. Только эпитоп центральной фаговой частицы распознается молекулой биотинилированного антитела, иммобилизованного на чашке Петри с помощью стрептавидина и использованного для скрининга библиотеки
Для того чтобы выделить из библиотеки пептиды с искомой биологической активностью, применяют различные методы скрининга. В частности, для выделения пептидов, имитирующих определенные эпитопы, используют биотинилированные моноклональные антитела соответствующей специфичности, которые иммобилизуют на твердой подложке с помощью стрептавидина (рис. II.21). Фаговые частицы, экспрессирующие на своей поверхности соответствующие эпитопы, взаимодействуют с антителами и задерживаются подложкой, тогда как другие рекомбинантные фаговые частицы удаляются в процессе промывания. Задержанные на подложке фаговые частицы далее элюируют кислотой, индивидуальные клоны дополнительно размножают в бактериальных клетках и экспрессированные на них эпитопы исследуют по различным критериям. Наличие идентичных или сходных последовательностей нуклеотидов среди клонированных последовательностей свидетельствует о специфичности процесса очистки. Индивидуальные клоны затем охарактеризовывают другими, в частности иммуноферментными методами. На заключительной стадии исследования осуществляют синтез выделенных пептидов и их всестороннее изучение в очищенном состоянии.
В настоящее время имеются данные о некоторых работах, проведенных с использованием пептидных библиотек. В одном из таких исследований из библиотеки были выделены пептиды, последовательность аминокислот в которых резко отличалась от последовательности аминокислот истинного эпитопа исследуемого антигена. Тем не менее, такой пептид прочно связывался со специфическими антителами и конкурировал за связывание с природным антигеном. Это позволило сделать вывод о возможности существования мимотопов – коротких пептидов, имитирующих природные эпитопы, последовательности аминокислот которых существенно различаются между собой. Удалось установить канонические последовательности аминокислот пептидов, имитирующих эпитопы природных белков, а среди них идентифицировать аминокислотные остатки, играющие ключевую роль во взаимодействии антиген–антитело.
Одним из многообещающих приложений библиотек пептидов является идентификация пептидных лигандов, имитирующих "структурные" эпитопы, образующиеся на поверхности белковых глобул в результате сворачивания их полипептидных цепей, что сопровождается пространственным сближением аминокислотных остатков, расположенных в полипептидной цепи на значительном расстоянии друг от друга. С помощью пептидных библиотек возможна идентификация пептидных аналогов различных эпитопов небелковой природы. По-видимому, в ближайшем будущем возможно использование пептидных библиотек для получения новых лекарственных препаратов, создания диагностических средств и производства эффективных вакцин. В области конструирования новых лекарственных препаратов усилия исследователей могли бы быть направлены на создание пептидных лигандов, специфически взаимодействующих с рецепторами, представляющими медико-биологический интерес. Знание структуры таких лигандов позволило бы упростить получение на этой основе лекарственных препаратов небелковой природы.
Библиотеки пептидов и эпитопов найдут свое применение и в исследованиях механизмов гуморального иммунного ответа, а также заболеваний иммунной системы. В частности, большинство аутоиммунных заболеваний сопровождается образованием аутоантител против антигенов собственного организма. Эти антитела во многих случаях служат специфическими маркерами того или иного аутоиммунного заболевания. С использованием библиотеки эпитопов, в принципе, можно получить пептидные маркеры, с помощью которых было бы возможно следить за специфичностью аутоантител во время развития патологического процесса как в индивидуальном организме, так и в группе пациентов и, кроме того, определять специфичность аутоантител при заболеваниях неизвестной этиологии.
Библиотеки пептидов и эпитопов потенциально могут быть использованы также для скрининга иммунных сывороток с целью выявления пептидов, специфически взаимодействующих с защитными антителами. Такие пептиды будут имитировать антигенные детерминанты патогенных организмов и служить мишенями для защитных антител организма. Это позволит использовать подобные пептиды для вакцинации пациентов, у которых отсутствуют антитела против соответствующих патогенов. Изучение эпитопов с помощью библиотек пептидов является частным случаем одного из многочисленных направлений их использования в прикладных и фундаментальных исследованиях взаимодействия лигандов и рецепторов. Дальнейшее усовершенствование этого подхода должно способствовать созданию новых лекарственных препаратов на основе коротких пептидов и быть полезным в фундаментальных исследованиях механизмов белок-белковых взаимодействий.
8.2.2.Белки-репортеры в гибридных белках
В рассмотренных выше библиотеках пептидов последние ковалентно связаны с белком-носителем. В таком виде они являются одними из представителей гибридных белков, получаемых методами генной инженерии.
В другом случае гибридные белки применяют для получения высокого уровня экспрессии коротких пептидов в бактериальных клетках благодаря стабилизации этих пептидов в составе гибридных белков. Часто гибридные белки используют для идентификации и очистки трудноопределяемых рекомбинантных белков. Например, присоединив к С-концу исследуемого белка в качестве белка-репортера -галактозидазу, можно производить очистку рекомбинантного белка по активности -галактозидазы, определяя ее антигенные детерминанты иммунохимическими методами. Соединяя фрагменты ДНК, содержащие открытые рамки считывания (ОРС), с генами белков-репортеров, можно очистить такие гибридные белки по активности белка-репортера и использовать их для иммунизации лабораторных животных. Полученные антитела далее применяют для очистки нативного белка, в состав которого входит рекомбинантный полипептид, кодируемый ОРС, и тем самым идентифицируют клонированный фрагмент гена.
С помощью гибридных белков решают и обратную задачу клонирования неизвестного гена, к белковому продукту которого имеются антитела. В таком случае конструируют клонотеку последовательностей нуклеотидов, представляющих ОРС неизвестных генов, в векторах, которые позволяют соединять клонируемую ОРС в одной рамке считывания с геном-репортером. Образующиеся в результате экспрессии этих рекомбинантных генов гибридные белки идентифицируются с помощью антител иммуноферментными методами. Гибридные гены, объединяющие секретируемые белки и белки-репортеры, дают возможность по-новому исследовать механизмы секреции, а также локализацию и перемещение в тканях секретируемых белков.
8.2.3.Гибридные токсины
Серия работ И. Пастана с сотрудниками по конструированию гибридных токсинов направленного действия прекрасно иллюстрирует возможности белковой инженерии в части комбинирования различных функциональных доменов белков для достижения конкретных биологических эффектов.
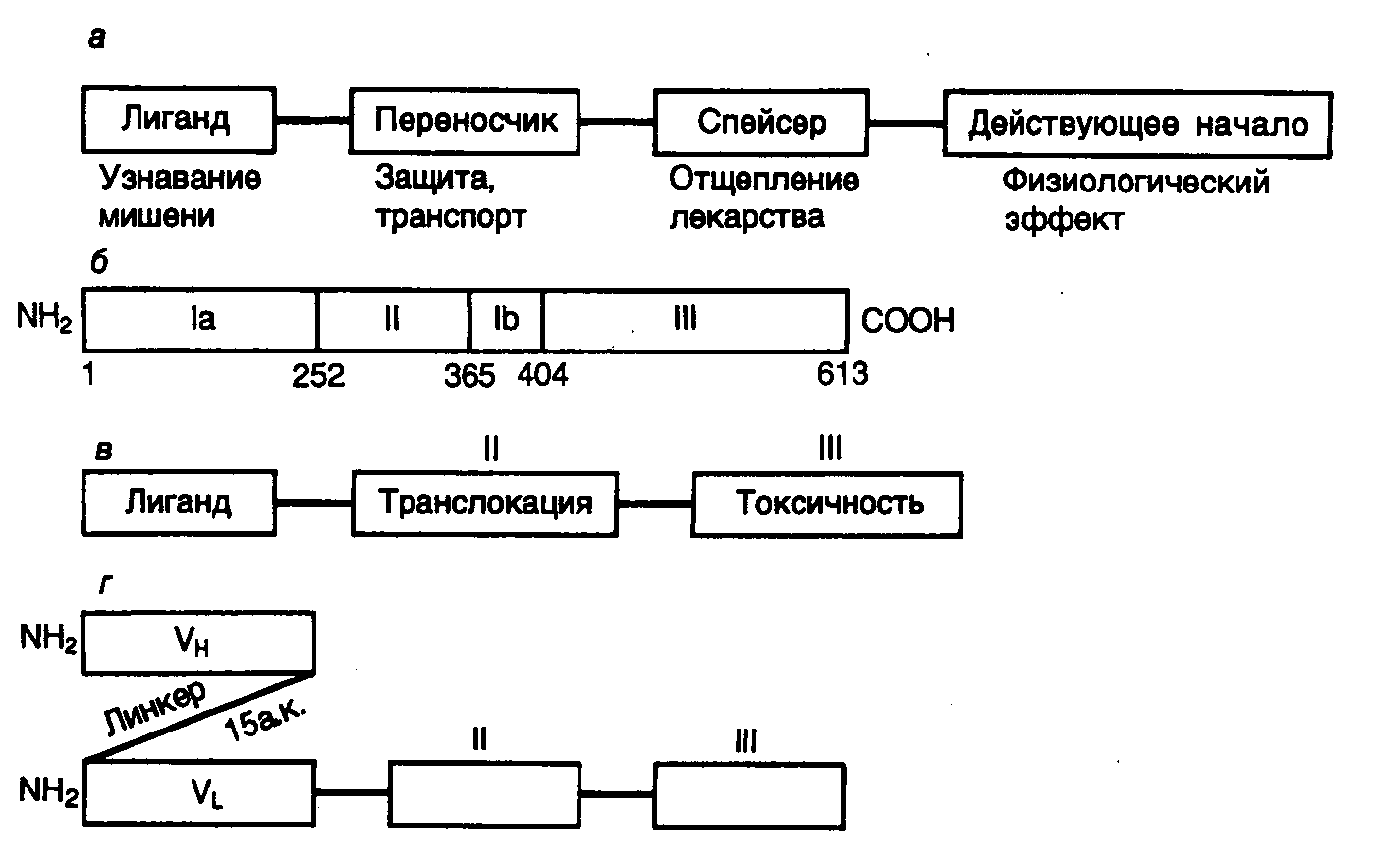
Рис. II.22. Лекарственные препараты направленного действия на основе гибридных токсинов
а – обобщенная схема структуры лекарственного препарата направленного действия; б – строение псевдомонадного токсина (цифрами обозначено положение аминокислотных остатков); в – строение гибридного токсина; г – гибридный токсин на основе моноклональных антител
Идеальное лекарственное средство строго специфического избирательного действия должно обладать, по крайней мере, следующими структурно-функциональными особенностями (рис. II.22,а). Такой лекарственный препарат должен заключать в себе действующее начало для достижения физиологического эффекта и лиганд, распознающий рецептор на поверхности клеток-мишеней. Кроме того, в нем должны быть структурные элементы, распознаваемые системой транспорта организма, для доставки лекарства к клеткам-мишеням, а также спейсерный участок, необходимый для отделения действующего начала от остальных функциональных частей препарата после его доставки по адресу. Именно такая идеальная схема реализуется в природном экзотоксине Pseudomonas aeruginosa. Экзотоксин А P. aeruginosaпредставляет собой белок, состоящий из одной полипептидной цепи длиной в 613 аминокислот, которая организована в три функциональных домена (см. рис. II.22,б). N-Концевой домен Ia (аминокислотные остатки 1–252) необходим для взаимодействия с поверхностью клеток-мишеней (прототип лиганда идеального лекарства направленного действия). Функции домена Ib (аминокислотные остатки 365–404) в настоящее время неизвестны. Домен II (аминокислотные остатки 253–364) обеспечивает эффективный перенос токсина в цитозоль клеток (система транспорта лекарства), а домен III (аминокислотные остатки 405–613) осуществляет ADP-рибозилирование фактора элонгации трансляции EF2, что приводит к подавлению трансляции и гибели клеток-мишеней. Таким образом, для оказания цитотоксического действия экзотоксину A необходимо с помощью домена Iа распознать рецепторы на поверхности клеток, проникнуть в клетку с помощью эндоцитоза, опосредованного рецепторами, и быть транслоцированным через внутреннюю мембрану в цитозоль, где локализуется фактор EF2. Основная идея в создании токсинов направленного действия заключалась в том, чтобы заменить домен Iа на какой-либо иной пептидный лиганд, взаимодействующий с другой группой рецепторов на поверхности клеток, и тем самым изменить специфичность действия токсина в отношении самих клеток (см. рис. II.22,в).
Было установлено, что удаление домена Iа генно-инженерными методами резко (в сотни и тысячи раз) снижает токсичность такого укороченного белка как в отношении клеток различных линий, так и in vivo. Присоединение к С-концевой части укороченного полипептида молекулы интерлейкина 2 человека осуществляли путем объединения структурных частей соответствующих генов в экспрессирующем векторе. Очищенный гибридный токсин оказался чрезвычайно токсичным в отношении клеток, несущих на своей поверхности рецепторы интерлейкина 2, и не действовал на клетки, у которых эти рецепторы отсутствовали и которые погибали под действием природного токсина. Интернализация (транслокация внутрь клеток) гибридного токсина была опосредована субъединицами р55 и р70 рецептора интерлейкина 2. Таким образом, в результате действия гибридного токсина на популяцию клеток, часть из которых экспрессирует на своей поверхности рецепторы интерлейкина 2, происходит избирательная гибель именно этих клеток.
В организме большинство покоящихся T-клеток и T-клеток памяти не экспрессируют на своей поверхности высокоаффинных рецепторов интерлейкина 2, тогда как T-клетки, стимулированные аллоантигенами, содержат такие рецепторы. Поэтому внутрибрюшинное введение гибридного токсина крысам с экспериментальным артритом – заболеванием, обусловленным патологической активацией T-клеток, снижало симптомы заболевания. Гибридный токсин существенно уменьшал у мышей и реакции отторжения трансплантата.
Вслед за этими пионерскими работами последовала целая серия исследований, направленных на создание аналогичных систем адресной доставки различных цитотоксических полипептидов. В процессе дальнейшего усовершенствования системы адресной доставки псевдомонадного токсина с использованием интерлейкина 2 в качестве лиганда отказались от полного удаления адресного домена токсина и ограничились его инактивацией путем введения в ген токсина четырех сайт-специфических мутаций. Молекулы такого гибридного токсина оказались в 10–100 раз более эффективными цитотоксическими агентами против клеток человека и обезьян, экспрессирующих на своей поверхности рецепторы для интерлейкина 2, а также обладали значительно большим временем полужизни в крови мышей in vivo по сравнению с ранее полученной конструкцией.
На основе псевдомонадного токсина были созданы гибридные токсины, содержащие в качестве лигандов полипептидные цепи интерлейкина 4, интерлейкина 6, трансформирующего фактора роста типа и инсулиноподобного фактора роста I. Для всех этих гибридных белков была показана высокоспецифическая цитотоксичность в отношении опухолевых клеток (включая клетки миеломы человека), обладающих соответствующими рецепторами. Использование в гибридном токсине в качестве лиганда части полипептидной цепи CD4 – гликопротеина поверхности T-клеток, который является рецептором вируса ВИЧ и взаимодействует с его гликопротеином gp120, позволило избирательно поражать T-клетки, зараженные вирусом ВИЧ и экспрессирующие на своей поверхности вирусный белок gp120.
Тот же принцип подавления инфекции, вызванной вирусами ВИЧ, растворимыми рецепторами CD4 был использован при конструировании гибридных белков, объединяющих части полипептидных цепей CD4 с константными частями тяжелых или легких цепей иммуноглобулинов человека. При этом в процессе объединения генов были удалены последовательности нуклеотидов, кодирующие трансмембранный и цитоплазматический домены CD4, а также вариабельную часть полипептидных цепей иммуноглобулинов. Образующиеся гибридные молекулы, названные иммуноадгезинами, за счет константной части молекулы иммуноглобулина приобретали повышенную стабильность в организме и, кроме того, сохраняли специфические свойства, опосредуемые константными частями иммуноглобулинов: связывание Fс-рецептора и белка A, способность к фиксации комплемента и перенос через плацентарный барьер. Совокупность всех этих свойств давала возможность иммуноадгезинам эффективно прерывать инфекцию T-клеток вирусом ВИЧ-I, блокируя как сам вирус, так и зараженные им клетки, экспрессирующие на своей поверхности вирусный антиген gp120.
Дальнейшее усовершенствование генно-инженерных конструкций на основе псевдомонадного экзотоксина А произошло после того, как в качестве адресной части гибридного токсина стали использовать вариабельные домены моноклональных антител к компоненту p55 рецептора интерлейкина 2 человека. В этом рекомбинантном белке с помощью 15-звенного пептидного линкера аминокислот соединяли вариабельный домен тяжелой цепи этого иммуноглобулина с вариабельным доменом его легкой цепи, а С-конец легкой цепи – с N-концом укороченного псевдомонадного токсина (см. рис. II.22,г). Такие молекулы гибридного токсина также оказались высокоспецифичными цитотоксическими агентами по отношению к лейкозным клеткам человека, экспрессирующим на своей поверхности рецепторы интерлейкина 2.
Разработанный подход продемонстрировал возможность использования специфических антител в качестве адресных частей гибридных токсинов. Это дает в руки исследователей универсальный способ адресной доставки токсинов, который в будущем позволит оказывать цитотоксическое действие на любые группы клеток, экспрессирующих на своей поверхности специфические антигены, т.е. значительно расширить количество мишеней для химиотерапевтических воздействий с использованием рекомбинантных белков.
Помимо псевдомонадного экзотоксина A в качестве действующего начала в гибридных токсинах успешно применяли дифтерийный токсин, фактор некроза опухолей и A-цепь рицина. Поскольку A-белок избирательно взаимодействует с константными (Fс) частями иммуноглобулинов класса G многих млекопитающих, такой гибридный токсин в паре с иммуноглобулином, полученным против какого-либо антигена на поверхности клеток, избирательно связывается с этими клетками и убивает их. Такие иммунотоксины являются еще одним потенциальным противоопухолевым агентом и могут быть использованы против клеток, экспрессирующих на своей поверхности специфические антигены.
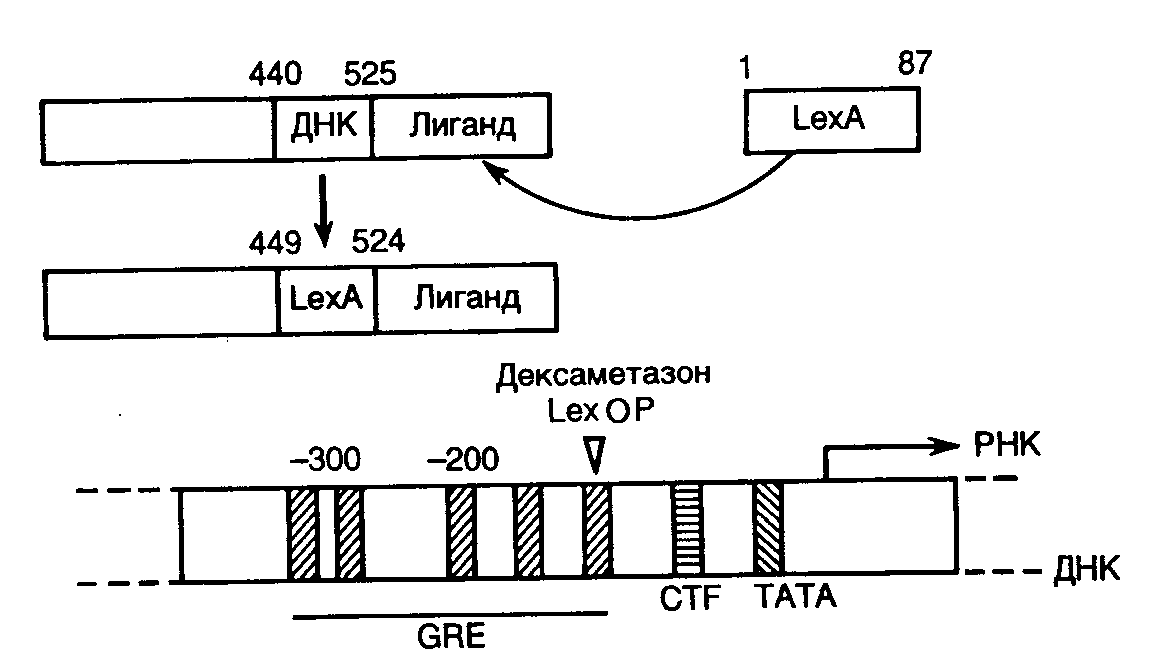
Рис. II.23. Использование гибридного белка для регуляции экспрессии гена
Методы генной инженерии открывают безграничные возможности конструирования новых белков путем объединения в разных комбинациях различных функциональных доменов полипептидных цепей. Получение гибридных токсинов направленного действия иллюстрирует возможности такого подхода в белковой инженерии. В качестве последней иллюстрации возможностей этой группы методов рассмотрим гибридный белок как новый регулятор активности генов. При конструировании такого белка методами генной инженерии был заменен ДНК-связывающий домен в рецепторе глюкокортикоидных гормонов на соответствующий домен LexA-репрессора E. coli (рис. II.23).
Введение операторной последовательности гена lexA в область промотора глобинового гена (или других генов) приводило к активации промотора под действием гибридного белка в присутствии дексаметазона – синтетического гормона, взаимодействующего с рецептором глюкокортикоидов. Таким образом, в новом генетическом окружении последовательность нуклеотидов оператора гена lexA E. coli функционировала в качестве энхансера транскрипции в присутствии гибридного белка-активатора, узнающего эту последовательность. Результаты работы демонстрируют возможность создания новых белков – регуляторов активности генов путем комбинирования известных функциональных доменов.
Развитие белковой инженерии во многом сдерживается недостатком знания о структурно-функциональных взаимоотношениях в белках, что обусловлено сложностью объекта исследования. Многочисленные работы, направленные на изучение таких связей, как правило, носят эмпирический характер и завершаются локализацией аминокислот, существенных для функционирования активных центров ферментов. Поэтому основная задача белковой инженерии – по известной последовательности аминокислотных остатков получить белок с заданными свойствами – в настоящее время еще далека от своего разрешения. Тем не менее, уже сейчас иногда удается целенаправленно изменять некоторые свойства существующих ферментов путем замен небольшого числа аминокислотных остатков их полипептидных цепей с помощью направленного мутагенеза.
8.2.4.Подходы к созданию новых ферментов
Подавляющее большинство исследований, в которых методы белковой инженерии используют для замен отдельных аминокислотных остатков в полипептидных цепях белков, заканчиваются получением мутантных производных, у которых отсутствует, резко ослаблена или остается неизменной исходная ферментативная активность. В таких опытах обычно локализуют отдельные остатки аминокислот, участвующих в формировании активных центров ферментов. Однако в ряде случаев методами направленного мутагенеза удается целенаправленно и кардинально изменять свойства белков. В опытах такого рода можно повысить термостабильность исследуемых белков, усилить их устойчивость по отношению к окислению, протеолизу и другим неблагоприятным воздействиям, а также изменить у исходных ферментов субстратную специфичность.
Серия работ была проведена на субтилизине – протеолитическом ферменте бактерий рода Bacillus. В активном центре субтилизина B. lentus в положении 222 находится метионин. Окисление Met-222 сопровождается образованием соответствующего сульфоксида и полностью инактивирует фермент. Методом направленного мутагенеза произвели замену Met-222Cys и остатки цистеина модифицировали тиоалкилирующим агентом. Это делало фермент высокоустойчивым к окислению и сопровождалось лишь незначительной потерей его активности. Новые свойства модифицированного субтилизина расширяют возможности его применения в биотехнологии. Путем замены отдельных аминокислотных остатков субтилизина в других работах удавалось изменять его субстратную специфичность, повышать удельную активность, изменять оптимум pH и увеличивать устойчивость по отношению к щелочи.
Эти работы иллюстрируют возможности данного направления исследований в белковой инженерии, направленных на создание высокотехнологичных ферментов, способных длительное время функционировать в жестких условиях ферментации на промышленных установках. На еще одно направление развития исследований в белковой инженерии указывают работы по направленному изменению субстратной специфичности ферментов путем замены отдельных аминокислотных остатков в их полипептидных цепях. Например, замена Met-73 у ингибитора субтилизина Streptomyces lividans на Lys или Arg приводила к появлению у него способности ингибировать трипсин. При этом у мутантного ингибитора с заменой Met-73Lys появлялась также способность ингибировать лизилэндопептидазу, а ингибитор с заменой Met-73 на Tyr или Trp подавлял активность -трипсиногена. Исследования продемонстрировали функциональную значимость остатка Met-73 в так называемом PI-сайте участка полипептидной цепи, контактирующего с ингибируемыми ферментами, и позволили создать модель такого белок-белкового взаимодействия. Кроме того, эти работы являются основой для конструирования новых ингибиторов сериновых протеиназ, а также более глубокого изучения механизма их ингибирующего действия.
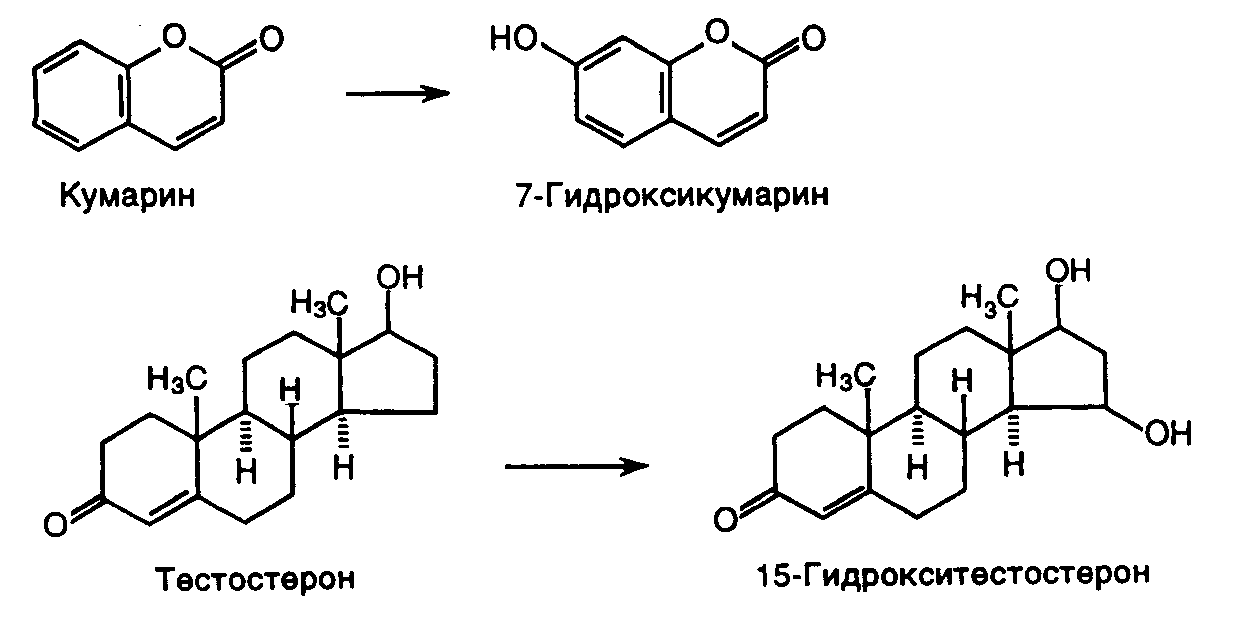
Такой же подход с целенаправленными заменами отдельных аминокислотных остатков был использован для изменения субстратной специфичности трипсина. В этом случае предварительный теоретический анализ структурных особенностей активного центра трипсина и особенно его субстрат-связывающего участка позволил предсказать аминокислотные остатки, существенные для взаимодействия субстрата с ферментом и обеспечивающие специфичность его действия. Проведенная на основании такого анализа замена Gly-226 на Ala резко (в 100 раз) уменьшила способность мутантного трипсина гидролизовать субстраты, содержащие Arg, и в значительно меньшей степени повлияла на его активность в отношении лизиновых субстратов. Обратную, хотя и менее ярко выраженную, картину наблюдали при замене Gly-216 Ala. Проведенная группой И. Сигала замена Ser-70 в активном центре -лактамазы на Cys также изменяла ее субстратную специфичность. Константа связывания субстрата – пенициллина – мутантным ферментом оставалась неизменной, тогда как скорость его расщепления уменьшалась в 50–100 раз. В то же время мутантная -лактамаза была более активна, чем фермент дикого типа по отношению к цефалоспоринам – аналогам пенициллина, так называемым антибиотикам третьего поколения. Возможность изменения субстратной специфичности путем замены отдельных аминокислот была продемонстрирована недавно и для цитохромов группы P-450. Мышиные цитохромы P-45015 и P-450coh экспрессируются в клетках печени самок и почек самцов соответственно. Первый из них катализирует 15-гидроксилирование 4-3-кетостероидов типа тестостерона, тогда как второй – гидроксилирование кумарина в положении 7. Несмотря на свою разную субстратную специфичность оба фермента различаются лишь по 11 (из 494) аминокислотным остаткам. Осуществляя последовательные замены этих 11 аминокислот, установили, что замена единственной аминокислоты Phe-209Leu в полипептидной цепи цитохрома P-450coh приводит к появлению у него способности гидроксилировать стероиды, т.е. активности цитохрома P-45015, и к потере способности использовать кумарин в качестве субстрата.
Эти далеко не исчерпывающие примеры демонстрируют возможности одного из двух основных подходов к созданию методами белковой инженерии белков с новыми каталитическими активностями. Такой подход заключается в изменении существующих активных центров ферментов путем замен отдельных аминокислотных остатков, которые участвуют в формировании активных центров. Принципиально другой подход к получению ферментов новой специфичности заключается в модификации методами белковой инженерии биологических рецепторов путем введения каталитических функциональных групп в центры связывания лигандов-субстратов. Такой подход был, в частности, реализован при конструировании методом направленного мутагенеза каталитических антител – абзимов.
Была поставлена задача методами белковой инженерии на основе иммуноглобулинов, специфически взаимодействующих с динитрофенильными группами антигенов, получить абзимы, гидролизующие эфиры динитрофенола следующей структуры:
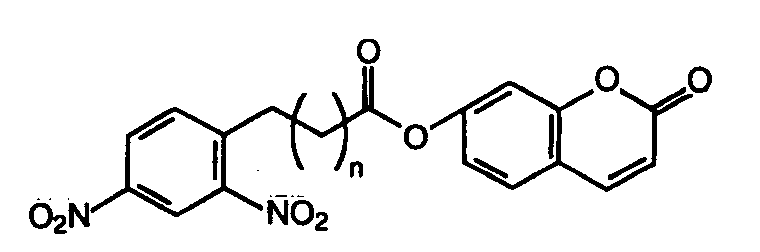
Исходя из того, что имидазол действует в качестве нуклеофильного катализатора при гидролизе карбоксиэфиров в водных растворах, предполагали, что введение остатка гистидина в центр связывания динитрофенильных лигандов иммуноглобулина может придать ему способность осуществлять гидролиз сложных эфиров динитрофенола. В качестве исходного белка при конструировании абзима использовали VL- и VH-фрагменты тяжелой и легкой цепей иммуноглобулина, специфически взаимодействующего с динитрофенильными группами антигенов. VL- и VH-фрагменты представляют собой вариабельные области иммуноглобулина, которые взаимодействуют с антигеном. Фрагмент ДНК, кодирующий VL-область легкой цепи, синтезировали in vitro и экспрессировали в клетках E. coli. При этом в процессе синтеза кодон, кодирующий Tyr-34, был изменен на кодон His, так как было известно, что именно Tyr-34 контактирует с молекулами динитрофенола в комплексах антиген–антитело. Очищенный рекомбинантный VL-фрагмент объединяли с VH-фрагментом тяжелой цепи природного иммуноглобулина, взаимодействующего с динитрофенолом, что приводило к образованию так называемого Fv-фрагмента.
Оказалось, что такой мутантный Fv-фрагмент способен катализировать гидролиз кумаринового эфира 5-(2,4-динитрофенил)аминопентаноевой кислоты (см. выше структурную формулу, n=4) в 90 000 раз более эффективно, чем 4-метилимидазол, и начальная скорость гидролиза была в 45 раз выше, чем у Fv-фрагмента дикого типа. При этом мутантный Fv-фрагмент был неактивен в отношении аминопропаноевого (n=2) и аминогексаноевого (n=5) аналогов субстрата. Таким образом, с помощью замены единственной аминокислоты в антигенсвязывающем центре иммуноглобулина удалось создать на его основе высокоспецифичный гидролитический фермент, а сам процесс его конструирования был основан на знании молекулярных механизмов катализа и взаимодействия антигенов с антителами.
В настоящее время реализованы оба подхода к созданию искусственных ферментов с новыми субстратными специфичностями, основанные на изменении отдельных аминокислотных остатков в субстрат- или лигандсвязывающих центрах ферментов или рецепторов. По мере углубления знаний о механизмах действия ферментов и закономерностей реализации потенций первичной структуры полипептидных цепей в их пространственной структуре появится возможность конструирования абсолютно новых белков с заданной ферментативной активностью. С этого момента значительно расширится поле деятельности белковой инженерии, которая вместе с генной инженерией сможет решать задачи, связанные с целенаправленным изменением уже известных и созданием новых метаболических путей в клетках живых организмов.
8.2.5. Субтилигаза в лигировании пептидов
В заключение рассмотрим еще одно неожиданное направление белковой инженерии, четко обозначившееся в самое последнее время. Во всех вышеупомянутых подходах конструирование белков с новыми свойствами основано на использовании молекулярно-генетических методов направленного мутагенеза. К сожалению, все эти методы обладают одним существенным недостатком: с их помощью невозможно осуществить встраивание в исследуемые полипептидные цепи многих неприродных аналогов аминокислот или других химических соединений, что весьма существенно ограничивает возможности структурно-функциональных исследований белков. Такие модификации можно было бы вносить в процессе химического синтеза пептидов, однако в этом случае невозможно получать пептиды большой длины (как правило, >40 остатков аминокислот) из-за накопления побочных продуктов синтеза, что затрудняет последующую очистку основного продукта и снижает выход пептидов.
Недавно был разработан альтернативный подход к химическому синтезу длинных пептидов, заключающийся в ферментативном лигировании предварительно синтезированных химическими методами коротких пептидов друг с другом. Этот подход стал возможен благодаря созданию с помощью направленного мутагенеза аналога субтилизина, так называемого субтилизина BPN’, катализирующего образование пептидных связей в водных растворах. Такой мутантный фермент, получивший название субтилигазы, содержит в своей полипептидной цепи две мутационные замены: Ser заменен на остаток Cys, а Pro – на Ala. Первая замена в активном центре субтилизина резко повышает его способность к аминолизу (т.е. образованию пептидной связи) по сравнению с гидролитической активностью при использовании в качестве субстратов тетрапептидных эфиров. Вторая мутация изменяет конформацию мутантного активного центра, компенсируя стерические эффекты, вызванные введением остатка Cys, что еще более улучшает каталитические свойства фермента.
Д. Джексоном с соавторами (1994 г.) разработана стратегия синтеза крупных полипептидных цепей с использованием субтилигазы, реализованная в синтезе модифицированной рибонуклеазы А, обладающей ферментативной активностью. На первом этапе синтеза был получен полностью незащищенный пептид, представляющий собой C-концевой фрагмент РНКазы А, и он был использован в дальнейшем в качестве акцепторной молекулы (см. схему).
R-NH-пептидY-CO-R’ + H2N-пептидZ-COOH
1. Субтилигаза
R-NH-пептидY-CO-NH-пептидZ-COOH
2. Zn/CH3COOH
H2N-пептидY-CO-NH-пептидZ-COOH
R-NH-пептидX-CO-R’ 3. Повторение этапов 1 и 2
H2N-пептидX-CO-NH-пептидY-CO-NH-пептидZ-COOH

|

|
Изоникотиноил
|
Гликолат-фенилаланиламид (glc-F-NH2);
|
X, Y, Z – различные пептиды
Следующий N-концевой донорный фрагмент полипептидной цепи этерифицирован по С-концу гликолат-фенилаланиламидом (glc-F-NH2). Полученный эфир эффективно ацилируется субтилигазой, что отражает особенности ее субстратной специфичности: фермент предпочитает использовать в качестве субстрата эфиры, в которых освобождается группа glc-F-NH2. В отличие от этого донорный пептид содержит на N-конце дополнительную изоникотиноильную защитную группу, что предотвращает его лигирование самого на себя. Такая группа вводится на последней стадии твердофазного синтеза пептидов и проявляет устойчивость к разбавленной плавиковой кислоте (HF), которая использовалась для снятия защиты с боковых цепей пептидов и отщепления самих пептидов от твердого носителя. После каждого лигирования пептидов изоникотиноильную группу удаляли в условиях мягкого восстановления (в присутствии цинка и уксусной кислоты) для освобождения NH2-группы – необходимой участницы очередного цикла лигирования.
Исходя из субстратной специфичности субтилигазы (фермент эффективно использует крупные гидрофобные донорные субстраты и малоэффективен с отрицательно заряженными остатками аминокислот или остатками пролина, попадающими в его активный центр), карту полипептидной цепи РНКазы А разделили на шесть фрагментов. Эти фрагменты были синтезированы и лигированы друг с другом в соответствии с вышеприведенной схемой с выходом, достигающим 70% на каждом этапе. В результате была получена полноразмерная полипептидная цепь РНКазы А (124 аминокислотных остатка), которая после спонтанного фолдинга приобрела искомую ферментативную активность. В ходе синтеза отдельных пептидов исследователи заменили два остатка His, находящихся в активном центре фермента (положения 12 и 119), на остатки 4-фторгистидина. Поскольку это производное His обладает pKa = 3,5 (pKa His = 6,8), у искусственной РНКазы А наблюдали резкий сдвиг в оптимуме pH реакции гидролиза субстрата без заметных изменений kкат, что было особенно неожиданным результатом, позволившим сделать интересные выводы о механизме ферментативной реакции, осуществляемой РНКазой А. Позднее субтилигаза была успешно использована для синтеза модифицированного гормона роста человека и циклических пептидов.
Значение результатов, полученных в ходе направленного изменения субстратной специфичности субтилизина, превратившегося в субтилигазу, выходит далеко за рамки чисто прикладного использования нового искусственного фермента. Это и многие другие подобные исследования, осуществленные методами белковой инженерии, однозначно указывают на возможность изменения субстратной специфичности известных ферментов путем замены в них одного или нескольких критических аминокислотных остатков. Такого рода результаты, примеры которых уже были приведены выше и более подробно будут рассмотрены в следующем разделе, приподнимают завесу над механизмами молекулярной эволюции метаболических путей живого организма, лежащих в основе его существования. История развития молекулярной биологии и генетики показывает, что практически любой неизвестный в природе механизм, разработанный и реализованный исследователем в физиологических условиях в пробирке, уже используется in vivo в существующих генетических системах. Однажды на семинаре, когда кто-то пытался выдать банальность за новую информацию, Р.Б. Хесин сказал: "Это новость только для того, кто не читает научной литературы". Мы записаны в библиотеку Природы, однако, несмотря на все усилия, в настоящее время в состоянии читать на разных языках только букварь, написанный под ее диктовку. Вся область белковой инженерии, которая, на первый взгляд, кажется блестящим порождением лишь одного интеллекта человека, не есть исключение, поскольку ферменты с новой субстратной специфичностью могут быть результатом точковых мутаций, непрерывно происходящих в геноме любого живого организма. А следовательно, Природа непрерывно конструирует новые белки и отбирает лучшие варианты с самого момента возникновения жизни на Земле. И этот процесс ежеминутно происходит в биосфере, в том числе и в онтогенезе эукариот.
|
|
|
 Скачать 5.83 Mb.
Скачать 5.83 Mb.








