Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
8.1.Методы направленного получения мутацийРазвитие генной инженерии революционизировало процесс получения мутаций в конкретных участках генома и анализ последствий этих мутаций на молекулярном уровне. Совокупность методов получения мутаций, основанных на использовании генно-инженерных подходов, называют направленным, или сайт-специфическим мутагенезом. Прообразом направленного мутагенеза является простая обработка клонированного гена химическими мутагенами in vitro, которая приводит к четкой локализации возникающих мутаций в пределах этого гена. В настоящее время разработано много эффективных методов сайт-специфического мутагенеза, позволяющих сознательно производить мутационные замены конкретных нуклеотидов. Направленное получение мутаций в сегментах рекомбинантных генов, введение мутантных генов в организм и исследование влияния полученных мутаций на функционирование гена – этот подход прямо противоположен классическим методам получения мутаций. Совокупность таких подходов получила название обратной генетики. Кроме того, возможность замены конкретных аминокислот в белках с известной первичной структурой, а также объединение в одной полипептидной цепи доменов различных белков и ферментов позволили, по сути дела, конструировать in vitro новые белки, не встречающиеся в природе, и привели к созданию в молекулярной генетике нового направления – белковой инженерии. В следующих разделах этой главы будут рассмотрены основные методы направленного мутагенеза и белковой инженерии, а также некоторые впечатляющие результаты, полученные с применением этих методов. 8.1.1.Получение делеций и вставокДелецией называют потерю части нуклеотидов в геноме организма. Такой вид мутаций удобнее всего использовать для локализации (картирования) функционально значимых участков генов и кодируемых этими генами белков. Действительно, последовательное удаление все новых и новых участков ДНК на границах генов с помощью делеций оказалось исключительно плодотворным в обнаружении регуляторных элементов генов, исследовании их структурно-функциональных особенностей, взаимного расположения и влияния друг на друга. Простой и эффективный метод получения делеций любого размера разработан с использованием экзонуклеазы Bal31 для удаления нуклеотидов в окрестностях сайтов рестрикции (рис. II.16). 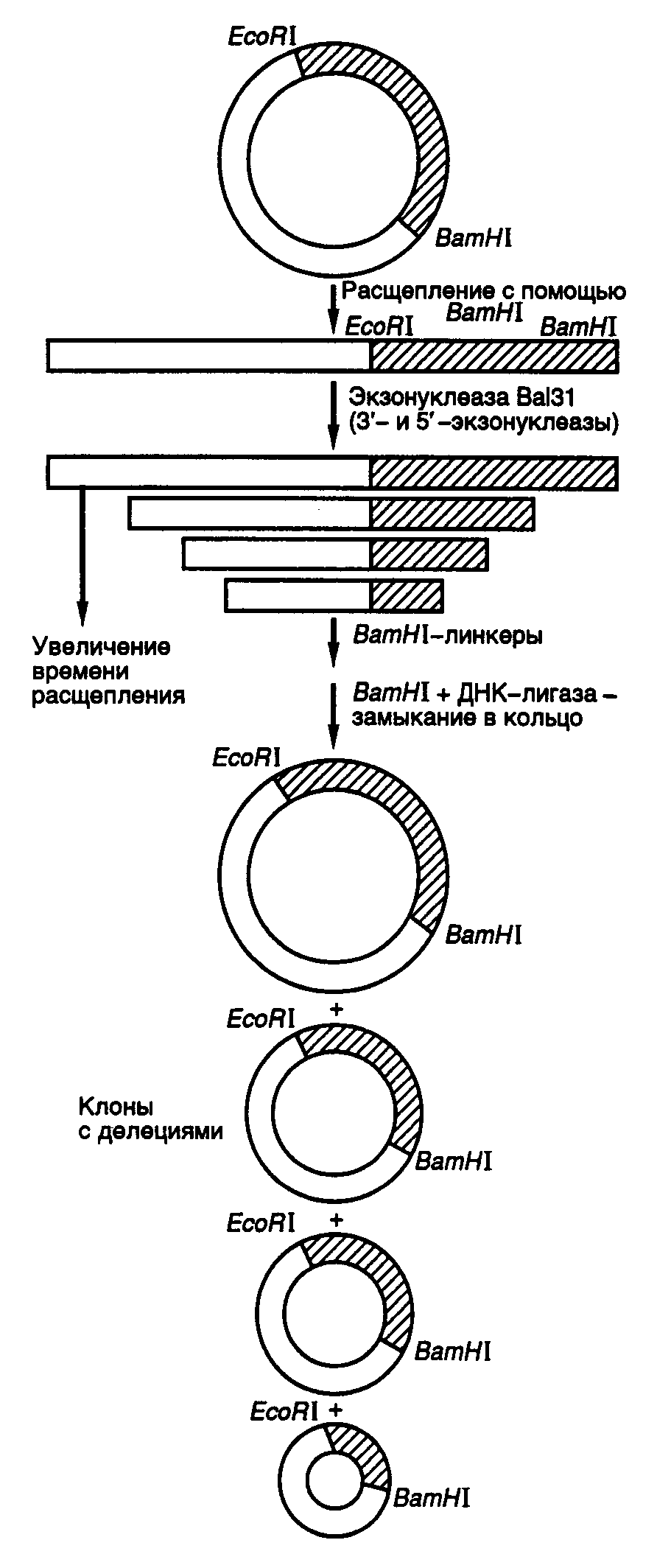 Рис. II.16. Получение делеций с помощью нуклеазы Bal31 Ген, клонированный в плазмиде, расщепляют по уникальному сайту рестрикции и образовавшиеся линейные молекулы ДНК инкубируют в присутствии экзонуклеазы Bal31. При этом экзонуклеаза последовательно удаляет нуклеотиды с обоих концов ДНК, причем количество удаляемых нуклеотидов прямо пропорционально времени инкубации ДНК с нуклеазой, а также зависит от температуры инкубации и концентрации фермента. В результате подобного действия образуется набор фрагментов ДНК разной длины, содержащих делеции различных размеров по обе стороны выбранного сайта рестрикции. К "тупым" концам таких молекул ДНК с помощью ДНК-лигазы присоединяют двухцепочечные олигонуклеотидные линкеры, содержащие уникальный (часто исходный) сайт рестрикции, обрабатывают соответствующей рестриктазой, замыкают молекулы в кольцо посредством лигирования и затем вводят их в бактериальные клетки. Точное картирование концов делеций осуществляют секвенированием соответствующих участков ДНК мутантных плазмид. В результате получают набор делеций разного размера, положение которых в исследуемом фрагменте ДНК строго локализовано. Небольшие делеции в окрестностях сайтов рестрикции можно получать быстрее удалением "липких" концов линеаризованной плазмидной ДНК после рестрикции с последующим замыканием линейной ДНК в кольцо лигированием по образовавшимся "тупым" концам. В этом случае размер делеции соответствует размеру одноцепочечных "липких" концов в сайтах рестрикции. Кроме того, такой метод допускает простую проверку наличия мутаций в требуемом участке ДНК, так как в результате мутации происходит потеря уникального сайта рестрикции. Для получения вставок коротких или протяженных последовательностей нуклеотидов в исследуемые участки клонируемых генов также разработаны эффективные и надежные методы. В простейшем случае такая задача решается путем расщепления исследуемого гена рестриктазой по уникальному сайту рестрикции и встраивания по этому сайту фрагмента природной ДНК или синтетического двухцепочечного олигонуклеотида, который фланкирован соответствующими "липкими" концами. Лигирование может проводиться и по "тупым" концам. В таком случае последовательности нуклеотидов на концах вставки уже не имеют существенного значения для встраивания этого фрагмента по сайту рестрикции. Для создания множественных вставок коротких или протяженных последовательностей нуклеотидов в исследуемых участках ДНК в основном используют два подхода. В первом случае с помощью панкреатической ДНКазы в низких концентрациях в присутствии ионов Mn2+ вносят случайным образом один двухцепочечный разрыв в каждую векторную плазмиду, содержащую клонированный ген. К концам образовавшихся линейных молекул ДНК присоединяют с помощью ДНК-лигазы синтетические олигонуклеотидные линкеры, содержащие сайт рестрикции, который отсутствует в исследуемой плазмиде. Образовавшиеся линейные молекулы ДНК с линкерами обрабатывают рестриктазой, узнающей сайт рестрикции линкера, что приводит к образованию "липких" концов, и замыкают в кольцо с помощью ДНК-лигазы. В итоге кольцевые молекулы ДНК содержат исследуемый клонированный ген, в котором имеется по одной вставке локализованных случайным образом (в соответствии с расположением исходных двухцепочечных разрывов) олигонуклеотидных линкеров. Во втором случае статистические разрывы в двухцепочечной ДНК получают путем частичного (неполного) гидролиза мелкощепящими рестриктазами, которые узнают сайт рестрикции длиной в 4 нуклеотида. Метод получения вставок с использованием синтетических олигонуклеотидных линкеров получил название сканирования линкером. 8.1.2.Химический мутагенезДелеции и вставки, создаваемые в структурных частях генов, как правило, их инактивируют, особенно в тех случаях, когда такие мутации приводят к сдвигу открытых рамок считывания. Поэтому делеции и вставки in vitro используют главным образом для поиска и изучения регуляторных элементов генов, влияющих на эффективность их экспрессии. Большое значение для исследования функционирования белков имеют методы мутагенеза in vitro, направленные на получение точковых мутаций, следствием которых являются одиночные замены аминокислот в полипептидных цепях. Распространенным методом введения большого числа точковых мутаций разной локализации в исследуемые части генов in vitro является химический мутагенез одноцепочечных участков рекомбинантных ДНК. Принцип подобных методов заключается в том, что некоторые химические мутагены, такие как бисульфит натрия, гидроксиламин или метоксиламин, действуют только на одноцепочечные участки ДНК. Следовательно, получив молекулы ДНК, содержащие одноцепочечные бреши в исследуемых участках генов, можно с помощью бисульфита натрия дезаминировать остатки цитозина в этих участках, т.е. превратить их в остатки урацила. После достройки цепи такой мутагенизированной молекулы ДНК с помощью фрагмента Кленова ДНК-полимеразы I E. coli происходит замена исходных G С-пар на T–U. Затем мутагенизированные молекулы ДНК с помощью трансформации вводят в бактериальные клетки, где по завершении первого раунда репликации в молекуле осуществляется замена остатков U на T и полная замена G–С-пары на A–T, т.е. имеет место обычная транзиция. Одноцепочечные мутагенизированные участки ДНК удобно получать путем гибридизации одноцепочечной ДНК вектора с двухцепочечной ДНК того же вектора, содержащего клонированный ген или его участок, который необходимо мутагенизировать. В этом случае в образующемся гибриде-гетеродуплексе, одна цепь которого принадлежит вектору без вставки, а другая – вектору со вставкой, происходит выпетливание последовательности вставки в виде одноцепочечного участка ДНК. Обсуждаемый подход к получению статистического набора точковых мутаций с использованием химических мутагенов позволяет легко создавать большое число мутантных молекул ДНК, содержащих одну или несколько мутаций в разных сочетаниях. Последующий отбор мутантов на основе новых биохимических или иных параметров мутантных белков (исчезновение, ослабление или усиление ферментативной активности, появление новой активности или новых иммунологических свойств и т.п.) позволяет идентифицировать остатки аминокислот в исследуемых белках, отвечающие за эти изменения. Несмотря на удобство введения такого рода мутаций в ДНК in vitro, химический мутагенез накладывает ограничения на спектр возникающих мутаций, так как лишь определенные остатки нуклеотидов ДНК претерпевают обязательные изменения. Поэтому многие мутации никогда не могут быть получены с помощью химических мутагенов. Проблему можно частично решить, используя для репарации одноцепочечных брешей ДНК аналоги нуклеотидов, например N-гидроксицитозинтрифосфат, который в составе ДНК одинаково хорошо спаривается с A и G, или создавая такие условия, при которых репарирующая ДНК-полимераза начинает ошибочно включать в синтезируемую цепь ДНК некомплементарные матрице нуклеотиды. Все перечисленные выше методы локального мутагенеза, осуществляемого in vitro, позволяют, в конечном счете, получать набор случайных мутаций, локализованных на определенном исследуемом участке ДНК. Мутагенизированные молекулы ДНК из одной реакционной пробирки представляют собой сложную смесь, в которой каждая молекула несет несколько независимо возникших мутаций. Для введения мутаций в определенный локус исследуемого гена необходимо проводить трудоемкую процедуру отбора, сопряженную с анализом большого числа мутантов. Подлинную революцию в направленном мутагенезе произвела разработка методов с использованием синтетических олигонуклеотидов. 8.1.3.Сайт-специфический мутагенез с использованием олигонуклеотидов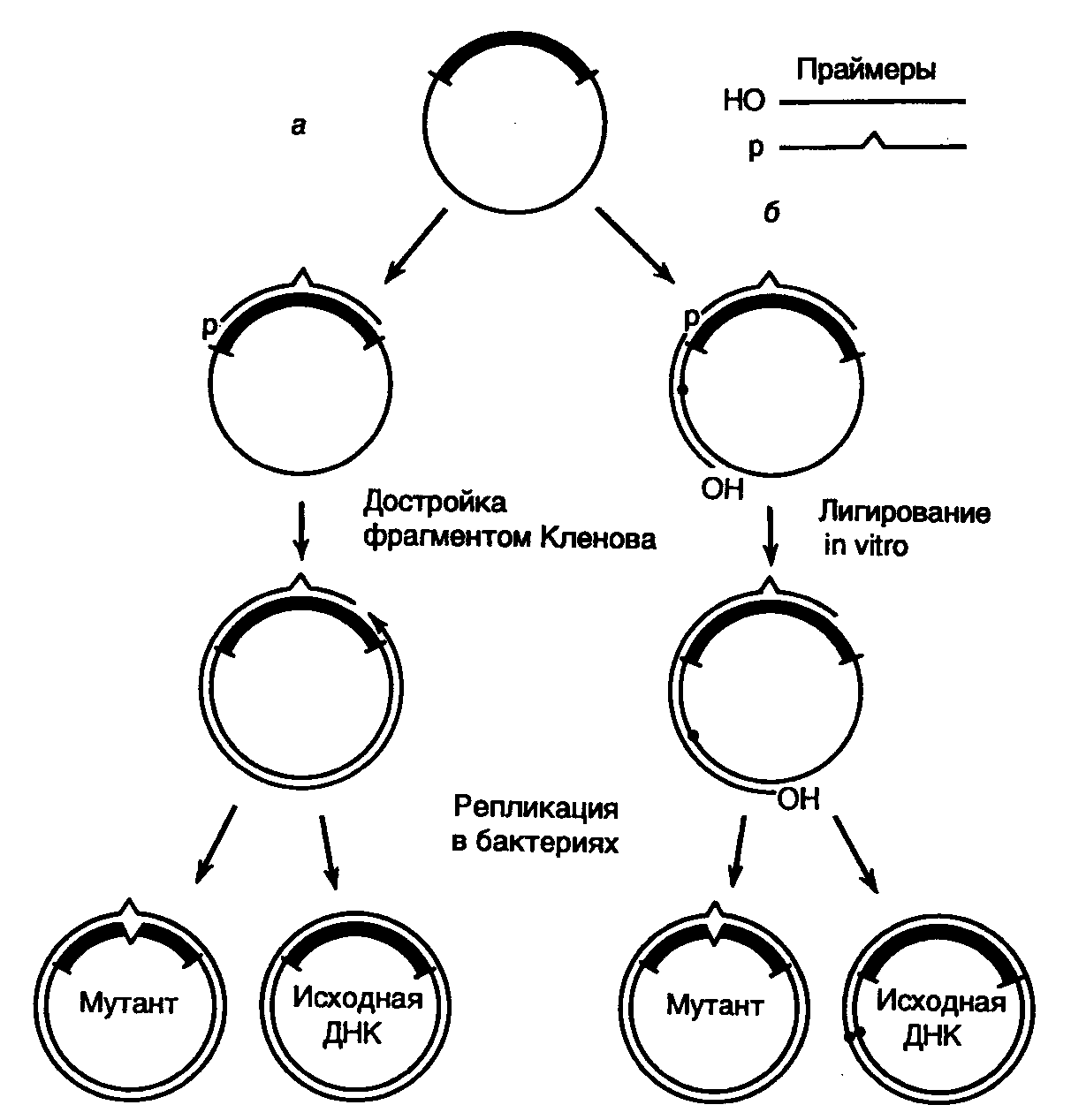 Рис. II.17. Направленный мутагенез с использованием олигонуклеотидов а – система с одним мутагенизирующим праймером; б – система с двумя праймерами и селектируемым маркером В простейшем случае для проведения желаемой замены нуклеотидов синтезируют 15–20-членный олигодезоксирибонуклеотид, комплементарный одной из цепей ДНК исследуемого гена (рис. II.17,а). При этом в данный нуклеотид в процессе синтеза вносят требуемые замены нуклеотидов. Мутагенизируемый ген клонируют в фазмидном векторе, который переводят в одноцепочечную форму. После выделения такой одноцепочечной ДНК с клонированным геном дикого типа с ней гибридизуют синтетический олигонуклеотид и, используя его в качестве затравки, синтезируют с помощью фрагмента Кленова in vitro комплементарную цепь ДНК. Образующаяся в итоге двухцепочечная кольцевая молекула ДНК представляет собой гетеродуплекс, дочерняя цепь которого комплементарна исходной родительской цепи на всем протяжении, кроме участка, занимаемого олигонуклеотидом, где мутантный нуклеотид (нуклеотиды) некомплементарен соответствующему нуклеотиду матрицы. Остающийся после завершения синтеза дочерней цепи ДНК одноцепочечный разрыв ликвидируют с помощью ДНК-лигазы, а образовавшуюся двухцепочечную ковалентно замкнутую ДНК вводят в бактериальные клетки, где она проходит несколько раундов репликации. После первого раунда репликации происходит сегрегация в разные молекулы ДНК мутантного аллеля и аллеля дикого типа исследуемого гена, и далее эти молекулы продолжают реплицироваться независимо друг от друга, что приводит к образованию двух популяций рекомбинантных ДНК, содержащих изучаемый ген в мутантной и исходной формах. Таким образом, теоретически каждая вторая молекула, выделенная из подобных бактериальных клеток, должна содержать в клонированном гене требуемую мутацию, локализованную в строго определенном сайте. Для того чтобы отличить мутантные ДНК от нормальных, проводят либо прямое секвенирование мутагенизируемого участка гена, либо гибридизацию рекомбинантных молекул с олигонуклеотидом, ранее использованным в качестве затравки, предварительно меченным радиоактивными изотопами (например 32P). Связь этого олигонуклеотида, содержащего замены нуклеотидов, в гибриде будет более прочной с мутантной ДНК, чем с ДНК дикого типа, так как в первом случае олигонуклеотид и ДНК будут полностью комплементарны друг другу. Плавление гибрида и отделение олигонуклеотида от ДНК произойдут при более низких температурах, если гибрид был образован с ДНК дикого типа, а не с мутантной ДНК. Освободившиеся в результате плавления гибридов олигонуклеотиды отделяют от ДНК промыванием комплекса на фильтрах, что проявляется в отсутствие сигнала при авторадиографии, тогда как в случае гибридов олигонуклеотида и мутантной ДНК будет появляться четкий сигнал. На практике, однако, частота возникновения мутантных ДНК в общей популяции рекомбинантных мутагенизируемых молекул бывает значительно > 50%. Это обусловлено рядом причин, основными из которых in vitro являются 3'5'-экзонуклеазная активность фрагмента Кленова и его способность вытеснять цепь ДНК в направлении 5’3’. Для преодоления первого затруднения мутантные нуклеотиды в олигонуклеотидном праймере располагают не ближе, чем за четыре нуклеотида от его 3’-конца (обычно за семь–десять нуклеотидов). Чтобы избежать последствий второго источника артефактов, для синтеза комплементарной цепи в мутагенизируемой одноцепочечной молекуле ДНК используют систему из двух праймеров (см. рис. II.17,б). В этой системе второй праймер выбирается таким образом, чтобы его 3’-конец после гибридизации с мутагенизируемой одноцепочечной молекулой ДНК располагался на расстоянии 1–3 т.п.о. от фосфорилированного 5’-конца мутагенизирующего нуклеотида. В этом случае после заполнения бреши между двумя олигонуклеотидами вновь синтезированной ДНК, синтез которой начался с дополнительного праймера, произойдет лигирование одноцепочечного разрыва ДНК-лигазой, которая присутствует в реакционной смеси вместе с фрагментом Кленова, поскольку 5’-конец мутагенизирующего нуклеотида фосфорилирован. Однако здесь не образуется кольцевой ковалентно замкнутой молекулы ДНК, так как на 5’-конце дополнительного праймера отсутствует фосфатная группа. После завершения реакции образовавшимися молекулами ДНК трансформируют клетки E. coli и производят отбор мутантных молекул ДНК в клонах бактерий по гибридизации с мутагенизирующим олигонуклеотидом, меченным радиоактивным изотопом. Эффективность системы направленного мутагенеза с использованием двух олигонуклеотидов приближается к максимально теоретически возможной – 50%. С помощью этого метода можно получать все виды мутаций, как точковые с заменами одного–трех оснований, так и протяженные делеции длиной в 0,5–1,0 т.п.о., а также вставки, например для создания новых сайтов рестрикции. Если для получения точковых мутаций достаточно мутагенизирующего праймера длиной в 17–20 нуклеотидов, то в случае получения делеций праймеры должны быть длиннее (30–40 нуклеотидов), поскольку они удерживают последовательности матричной ДНК, фланкирующие выпетливаемый участок. Дальнейшее развитие системы направленного мутагенеза с использованием двух олигонуклеотидов, получившей название системы сопряженного праймирования, позволило значительно упростить процедуру отбора мутантных ДНК. В таких усовершенствованных системах в дополнительный олигонуклеотид вводится мутация, инактивирующая или восстанавливающая в дочерней мутантной ДНК какой-либо селектируемый маркер. В одной из таких систем, где в качестве вектора используется ДНК фага M13mp18amIV, селектируемым маркером служит амбер-мутация в гене IV. Матричную ДНК получали, выращивая мутантные фаги M13mp18amIV в бактериальных клетках E. coli TG1, содержащих ген-супрессор амбер-мутаций Su2+. При этом данный фаг не развивается в клетках несупрессорных штаммов E. coli Su2-. Для проведения мутагенеза одноцепочечную ДНК фага M13mp18am1Y гибридизуют с двумя праймерами, один из которых мутагенизирующий, а другой, комплементарный гену IV, содержит точковую мутацию в амбер-кодоне, восстанавливающую последовательность нуклеотидов дикого типа. После достройки комплементарной цепи ДНК фага M13mp18am1Y с использованием вышеупомянутых праймеров двухцепочечные ДНК вводят в бактериальные клетки Su2-, которые, кроме того, дефектны по системе репарации. Поскольку бактериальные клетки, дефектные по системе репарации, сами по себе обладают мутаторным фенотипом (т.е. для них характерна повышенная частота возникновения спонтанных мутаций), то для того чтобы в мутируемые ДНК не вносить дополнительные мутации, трансформированные бактериальные клетки высевают на газон клеток E. coli Su2- с нормальной системой репарации. При таком подходе фаговые частицы проходят лишь первый цикл развития в клетках с двумя мутациями, а все последующие – в клетках Su2- с одной мутацией. В результате в таких клетках образуются только те фаговые частицы, ДНК которых содержат сайт-специфическую мутацию и восстановленный ген IV. Аналогичный подход был использован в системе с геном -галактозидазы, находящимся в составе векторов серии M13mp. В такой системе фаговый ген кодирует -пептид -галактозидазы E. coli и комплементирует (восстанавливает) дефектную -галактозидазу бактериальных клеток-хозяев. Введение амбер-мутации в фаговый ген -галактозидазы с помощью праймера, используемого в паре с олигонуклеотидом-мутатором, сопровождается потерей дочерними фаговыми частицами способности комплементировать мутантную -галактозидазу бактериальных клеток. В результате в образующихся фаговых бляшках отсутствует активность -галактозидазы, которая бы расщепляла искусственный субстрат BCIG с образованием продукта, окрашенного в голубой цвет. Вследствие этого бляшки, образованные фаговыми частицами, содержащими ДНК с сайт-специфическими мутациями, не окрашены и их легко отбирать визуально. Хорошо себя зарекомендовали и системы циклического отбора мутантных ДНК, содержащие сайт-специфические мутации, в которых используются свойства систем рестрикции–модификации EcoK и EcoB E. coli. Используемые для трансформации штаммы E. coliмогут содержать системы рестрикции–модификации EcoK- или EcoB-типа. В том случае, если родительскую цепь ДНК для мутагенеза выделяют из клеток, дефектных по метилазам системы модификации, то после достройки комплементарной цепи с мутантного олигонуклеотида такая неметилированная ДНК будет расщепляться системой рестрикции после введения в соответствующий бактериальный штамм. Если одновременно с олигонуклеотидом-мутатором использовать второй олигонуклеотид, изменяющий сайт рестрикции, то лишь ДНК с мутировавшим сайтом рестрикции в результате ошибочного функционирования системы репарации сохранится в бактериальных клетках. Такие ДНК с высокой вероятностью будут содержать и требуемую мутацию. Недавно была описана система, в которой в родительскую цепь ДНК фазмиды вводили вместо остатков тимидина остатки уридина. В этом случае после синтеза дочерней комплементарной ДНК in vitro с использованием мутантного олигонуклеотида в качестве затравки родительская цепь ДНК инактивируется в трансформированных бактериальных клетках с помощью эндогенной урацил-N-гликозилазы, удаляющей из ДНК остатки урацила, что сопровождается частичным гидролизом этой цепи с последующей репарацией брешей по мутантной цепи в качестве матрицы и закреплением введенной мутации. Наконец, следует упомянуть систему олигонуклеотид-зависимого сайт-специфического мутагенеза, в которой для отбора мутантных цепей ДНК используется попеременно то один, то другой селектируемый маркер, в качестве которых выступают гены устойчивости к антибиотикам. Это позволяет вводить с высокой эффективностью в один и тот же ген несколько сайт-специфических мутаций в последовательных циклах направленного мутагенеза. В таких системах в первом цикле вместе с мутагенизирующим праймером в качестве селектируемого используют праймер, вносящий мутацию, которая придает бактериальным клеткам устойчивость к одному антибиотику, а во втором цикле – к другому (с восстановлением чувствительности к первому антибиотику). Далее такие циклы могут быть повторены необходимое число раз, которое определяется количеством требуемых мутаций. Разработка систем сопряженного праймирования позволила значительно увеличить эффективность направленного мутагенеза и довести выход ДНК, содержащих сайт-специфические мутации, до 70% от общего числа образующихся молекул ДНК. Рассмотренные подходы к получению сайт-специфических мутаций с помощью олигонуклеотидов позволяют с высокой точностью и эффективностью производить замены отдельных нуклеотидов в строго определенных локусах. Однако чаще всего невозможно предсказать фенотипические последствия мутационных замен отдельных аминокислот в полипептидных цепях белков, и для получения необходимых фенотипических изменений требуется введение множественных мутаций в определенные участки гена с последующим отбором мутантов требуемого фенотипа. Для решения подобных задач был разработан и эффективно используется метод кассетного мутагенеза. При реализации такого подхода из гена, клонированного в составе векторной плазмиды, по двум близко расположенным уникальным сайтам рестрикции вырезается фрагмент ДНК, в который необходимо внести мутации, и на его место встраивается синтетический двухцепочечный олигонуклеотид, содержащий необходимые замены нуклеотидов (кассету мутаций). В этом случае, если в окрестностях мутагенизируемого локуса гена отсутствуют подходящие природные сайты рестрикции, их вводят с помощью направленного мутагенеза. Разработка автоматических синтезаторов ДНК сделала синтез олигодезоксирибонуклеотидов простой и даже рутинной процедурой. Более того, использование на определенных этапах синтеза вместо одного нуклеотида смеси из двух, трех или даже всех четырех дезоксирибонуклеозидтрифосфатов позволяет получать за один прием сложную смесь олигонуклеотидов, которые могут содержать в определенных сайтах наборы кодонов для многих или даже для всех 20 природных аминокислот. Это дает возможность осуществлять одновременный скрининг по искомому мутантному фенотипу большого числа разных мутантных клонов, полученных в одном цикле клонирования. С помощью кассетного мутагенеза можно легко исследовать функциональную роль отдельных сайтов и целых доменов в полипептидных цепях конкретных белков и создавать рекомбинантные белки с новыми, подчас неожиданными свойствами. Внесение множественных мутаций в разные участки полипептидных цепей исследуемых белков позволяет при наличии соответствующих эффективных методов отбора получать белки с требуемыми свойствами и уже после этого определять, какие именно аминокислоты придают такие свойства белку. Альтернативным методом исследования функциональной значимости отдельных аминокислот в белках является их целенаправленная замена на нейтральную аминокислоту, например аланин. Такая последовательная замена аминокислот в полипептидных цепях изучаемых белков на остатки аланина получила название сканирование аланином. Введение аланина в полипептидные цепи не изменяет их общей конформации, как это имеет место, например в случае замен на глицин или пролин, и не сопровождается ярко выраженными электростатическими или стерическими эффектами. Кроме того, аланин часто встречается в полипептидных цепях и с одинаковой частотой представлен как на внутренних, так и на внешних участках полипептидных цепей белковых глобул. С помощью сканирования аланином можно локализовать аминокислоты, образующие активный центр ферментов, исследовать участки полипептидных цепей, существенные для взаимодействия белков с другими макромолекулами и низкомолекулярными лигандами, изучать структуру эпитопов полипептидных цепей, а также ряд других структурных и функциональных особенностей белков. Еще одним универсальным методом замены определенных аминокислот в полипептидных цепях белков in vivo является использование аминоацилированных различными аминокислотами супрессорных тРНК, которые узнают нонсенс-триплеты в мутантных мРНК в процессе трансляции. В результате в соответствующее место полипептидной цепи взамен аминокислоты, присутствующей в белке дикого типа, встраивается аминокислота, которую несет аминоацилированная супрессорная тРНК. В настоящее время в дополнение к природным супрессорным тРНК E. coli синтезированы in vitro гены, кодирующие супрессорные РНК новой специфичности. В итоге до 13 аминокислотных замен может быть произведено в синтезирующейся in vivo полипептидной цепи в результате супрессии кодона UAG (amber). С использованием такого подхода, в частности, удалось произвести >1600 замен аминокислот Lac-репрессора E. coli и локализовать участки полипептидной цепи, существенные для связывания индуктора, прочного связывания оператора и термостабильности белка. Важным преимуществом метода амбер-супрессии перед другими методами направленного мутагенеза у бактерий и бактериофагов является то, что он не требует синтеза большого числа мутантных генов и их последующего отбора, так как введение одного мутантного гена в составе экспрессирующего вектора в клетки разных супрессорных штаммов E. coli позволяет получать разные замены аминокислот с одновременной сверхпродукцией мутантного белка в бактериальных клетках. Это облегчает его последующую очистку и изучение биохимических свойств. 8.1.4.Полимеразная цепная реакция в направленном мутагенезеРазработка метода полимеразной цепной реакции принципиально изменила ситуацию в исследованиях по направленному мутагенезу. Использование ПЦР для направленного мутагенеза основано на применении в качестве праймеров олигонуклеотидов, не полностью комплементарных матричной ДНК. Повышенные требования к комплементарности накладываются лишь на последний, 3’-концевой, нуклеотид праймера, но даже в случае 3’-концевой некомплементарности праймеры часто продолжают функционировать в системе ПЦР, хотя и с разной эффективностью. В то же время некоторая способность 17-нуклеотидного праймера инициировать ПЦР проявляется даже при наличии всего восьми нуклеотидов, комплементарных матрице, три из которых расположены на его 3’-конце. Таким образом, простейшим способом введения сайт-специфических мутаций в амплифицируемый фрагмент ДНК является использование праймеров, частично комплементарных матрице, т.е. содержащих необходимые мутантные нуклеотиды. Этот способ применяется для создания в амплифицируемом продукте новых сайтов рестрикции для последующего его клонирования. Такой подход удобен для встраивания амплифицируемого продукта в экспрессирующий вектор в одной открытой рамке считывания (ОРС) с инициирующим ATG-кодоном вектора. Действительно, как уже обсуждалось в главе 7, экспрессирующие векторы часто содержат 5’-концевую часть будущего рекомбинантного гена, включая регуляторные последовательности, промотор, ATG-кодон и иногда дополнительные кодоны нескольких последующих аминокислот. При конструировании таких векторов в последовательности, следующие за ATG-кодоном, вводят сайты рестрикции, по которым и встраивают фрагмент экспрессируемого гена, кодоны которого (для полноценной экспрессии гена) должны находиться в одной ОРС с ATG-кодоном вектора. Положение природных сайтов рестрикции в клонируемом гене редко отвечает требованиям ОРС вектора. Поэтому введение искусственных сайтов рестрикции в клонируемый фрагмент с помощью праймеров, не полностью комплементарных матрице, является хорошим решением проблемы. Вырожденные праймеры, которые представляют собой сложную смесь олигонуклеотидов, содержащих многие точковые мутации, также используют для сканирования мутациями определенных участков ДНК. В таком классическом варианте постановки ПЦР кроме точковых мутаций можно легко получать делеции и вставки. Дальнейшим усовершенствованием метода направленного мутагенеза с помощью ПЦР явилась разработка подхода к получению гибридных генов с помощью перекрывающихся праймеров (рис. II.18). Этот метод позволяет не только целенаправленно получать точковые мутации, делеции и вставки, но и гибридные молекулы ДНК без применения ДНК-лигазы. Для получения точковых мутаций используют пару праймеров, в которых изменен соответствующий нуклеотид или небольшая группа нуклеотидов (мутантный сайт обозначен на рис. II.18,1 прямоугольниками внутри праймеров). При этом внутренние праймеры b и с комплементарны друг другу. 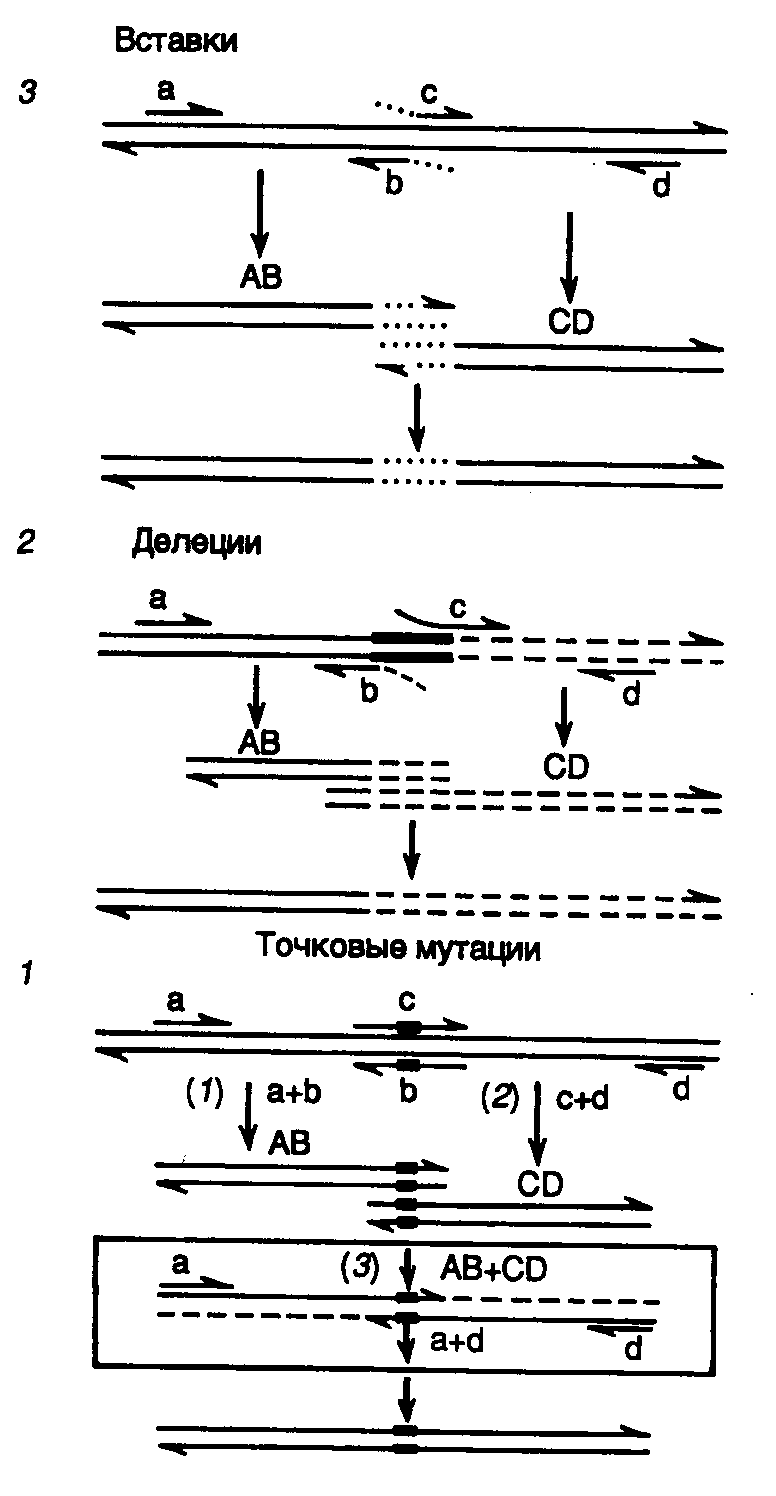 Рис. II.18. Использование ПЦР для получения мутаций Получение точковых мутаций (1), делеций (2) и вставок (3): a и d – внешние праймеры, b и c – внутренние праймеры. AB и CD – фрагменты ДНК, образовавшиеся в результате ПЦР с использованием праймеров a и b, а также c и d соответственно. После гибридизации друг с другом объединяемых фрагментов ДНК сформировавшимися комплементарными последовательностями нуклеотидов одноцепочечные участки достраиваются ДНК-полимеразой в процессе ПЦР В первых ПЦР в отдельных пробирках амплифицируют правую и левую части мутагенизируемого сегмента ДНК с использованием пар праймеров a + b и с + d, что приводит к образованию двух фрагментов ДНК, перекрывающихся на участках, которые содержат включенные праймеры (этапы 1 и 2). Фрагменты очищают от праймеров, смешивают друг с другом в эквимолярном соотношении и после цикла тепловой денатурации и ренатурации используют в качестве матрицы в другой ПЦР с внешними праймерами a и d (этап 3). На этом этапе в первом цикле ПЦР происходит достройка цепей перекрывающихся фрагментов ДНК (пунктирные линии на рис. II.12,1), и образовавшийся фрагмент двухцепочечной ДНК, содержащий требуемую мутацию, далее служит матрицей для амплификации и по завершении ПЦР присутствует в реакционной смеси в препаративном количестве. Тот же принцип объединения двух фрагментов ДНК, перекрывающихся за счет праймеров, используется при получении делеций и вставок. Для создания делеции (на рис. II.18,2 обозначена прямоугольниками на цепях ДНК) берут внутренние праймеры b и с, 5’-концы которых комплементарны матрице по одну сторону делетируемой последовательности нуклеотидов, а 3’-концы – последовательности нуклеотидов, фланкирующей другой ее конец. Образующиеся при этом продукты ПЦР AB и СD перекрываются в точке делеции и далее используются, как и в предыдущем случае. При получении вставок (см. рис. II.18,3) применяют внутренние праймеры b и с, комплементарные друг другу своими 5’-концевыми частями, которые соответствуют образуемой олигонуклеотидной вставке во фрагмент матричной ДНК. 3’-Концы этих праймеров комплементарны участкам ДНК-матрицы, непосредственно примыкающим к сайту, в который производится вставка олигонуклеотида. С помощью метода ПЦР удается легко получать и множественные мутации в конкретных участках ДНК. В этом случае амплификацию мутагенизируемого сегмента ДНК производят в присутствии трех (вместо четырех) дезоксирибонуклеозидтрифосфатов, причем один из них вводят в реакционную смесь в высокой концентрации. Именно этот нуклеотид преимущественно включается в амплифицируемый фрагмент ДНК вместо недостающего нуклеотида, что сопровождается накоплением в ДНК-продукте множественных случайных мутаций в виде соответствующих замен нуклеотидов. В таких искусственных условиях мутации возникают за счет снижения точности функционирования ДНК-полимеразы. |
