Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
9.2.Рибозимы и дезоксирибозимыРегуляция экспрессии генов с помощью антисмысловых РНК характеризуется высокой специфичностью. Это обусловлено большой точностью процесса РНК-РНК-гибридизации, основанной на комплементарном взаимодействии друг с другом протяженных последовательностей нуклеотидов. Однако сами по себе антисмысловые РНК не инактивируют необратимо мРНК-мишени, и для подавления экспрессии соответствующих генов требуются высокие (по крайней мере, эквимолярные по отношению к мРНК) внутриклеточные концентрации антисмысловых РНК. Эффективность действия антисмысловых РНК резко повысилась после того, как в их состав были введены молекулы рибозимов – коротких последовательностей РНК, обладающих эндонуклеазной активностью. Хотя ниже термин "рибозимы" будет использоваться почти исключительно в отношении молекул РНК, обладающих эндонуклеазной активностью, необходимо иметь в виду, что в настоящее время известно множество других ферментативных активностей, ассоциированных с РНК. Поэтому рибозимами в широком смысле называют молекулы РНК, обладающие любой ферментативной активностью. Некоторые из этих активностей будут рассмотрены в разделе 9.3 при обсуждении возможной роли РНК в происхождении жизни. 9.2.1.Типы рибозимовЭндорибонуклеазная активность РНК была впервые обнаружена Т. Чехом в 1980 г. у интрона группы I предшественника рибосомной РНК Tetrahymena, осуществляющего аутокаталитическую реакцию сплайсинга (аутосплайсинга), в результате которой происходит вырезание из молекулы предшественника рРНК последовательности этого интрона и образование зрелой молекулы рРНК. (Молекулярный механизм реакции аутосплайсинга уже был рассмотрен в первой части книги в разделе 3.3.2.) С тех пор аутокаталитические реакции расщепления были выявлены у многих молекул РНК (рис. II.25). Наиболее перспективными для использования в составе антисмысловых РНК оказались рибозимы, образующие пространственную структуру типа "головки молотка" (hammerhead – HH) (см. рис. II.25,а). Такие РНК были найдены у сателлитных РНК вирусов растений, вироидов, а также среди транскриптов сателлитных ДНК тритонов. У РНК подобного типа была определена минимальная каноническая последовательность, необходимая для появления ферментативной активности, длиной в 27 нуклеотидов, из которых высококонсервативны 13 нуклеотидов, а также последовательность из трех нуклеотидов, в пределах которой происходит расщепление фосфодиэфирной связи (см. рис. II.25,а). 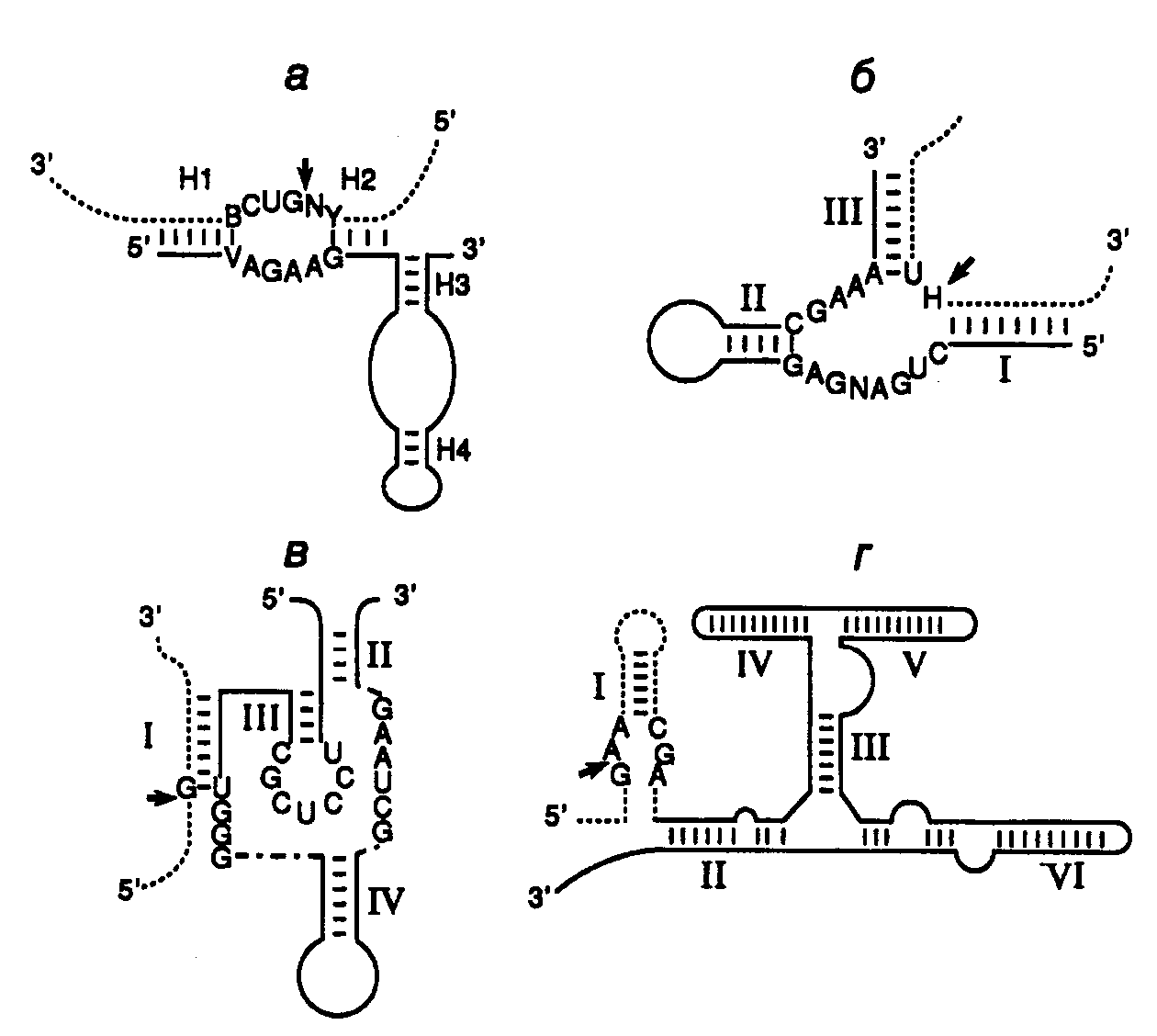 Рис. II.25. Особенности вторичной структуры рибозимов разных типов а – "головка молотка", б – шпилька, в – рибозим вируса гепатита , г – рибозим Neurospora VS. Стрелки обозначают точки расщепления РНК; нуклеозид N может быть A, U, G или C, H – A, U или C, Y – любой пиримидин; приведены общепринятые обозначения элементов вторичных структур рибозимов Другими примерами рибозимов являются РНК, образующие структуры типа шпилек, а также РНК вируса гепатита δ (ВГД) и сателлитная РНК Варкуда (Varcud satellite – VS) нейроспоры (см. рис. II.25,б,в,г соответственно). (Структура и механизм действия рибозимов в составе интронов групп I, II и III были подобно рассмотрены в разделе 2.2.3.) Рибозимы со структурами типа шпилек были впервые обнаружены у вироидов и вирусоидов растений, рибозимы ВГД были идентифицированы среди сателлитных РНК вируса гепатита В человека, а рибозимы VS – среди сателлитных РНК природных изолятов Neurospora. В связи с рибозимами следует вспомнить и о РНКазе Р E. coli, состоящей из небольшого полипептида и РНК длиной в 375 нуклеотидов, о которой уже упоминалось в разделе 2.2.1. Именно РНК обеспечивает этому ферменту эндонуклеазную активность, необходимую для процессинга предшественников тРНК. Хотя у природных РНК сайт расщепления и последовательность нуклеотидов рибозима расположены на одной молекуле (in cis по отношению друг к другу), HH-рибозимы могут действовать и на сайты расщепления, расположенные in trans, т.е. на других молекулах РНК. Именно это свойство рибозимов данного класса позволило использовать их для создания высокоспецифичных эндорибонуклеаз на основе антисмысловых РНК, которые обладают способностью расщеплять in trans молекулы РНК, содержащие тринуклеотидные сайты расщепления. Для создания высокоспецифического рибозима, функционирующего по этому принципу, последовательность рибозима заключают в последовательность антисмысловой РНК таким образом, чтобы при образовании гибрида с РНК-мишенью в контакте с активным центром рибозима оказывалась тринуклеотидная последовательность сайта расщепления. 9.2.2.Свойства рибозимовСтабильность рибозимов в биологических жидкостях. Нестабильность РНК является одним из основных ограничений, препятствующих эффективному их использованию in vivo в качестве лекарственных средств. Поскольку рибозимы представляют собой короткие молекулы, которые можно получать в результате химического синтеза, химические модификации этих олигонуклеотидов рассматриваются как одна из перспективных возможностей повышения их устойчивости к нуклеазам. Было установлено, что введение 2’-O-Me-модифицированных нуклеотидов вместо обычных во все, кроме пяти, положения HH-рибозима позволило повысить его стабильность, по крайней мере, в 1000 раз без существенной потери каталитической активности. Другие модификации нуклеотидов в определенных положениях: введение 2'-О-аллильных групп, фосфоротиоатных связей вместо фосфодиэфирных, замена пиримидинов их 2’-амино- или 2’-фторпроизводными, использование различных 2’-производных сахаров в сахарофосфатном остове РНК и т.п., как правило, приводили к снижению активности рибозимов, но сопровождались повышением их стабильности. Улучшенные конструкции рибозимов с модифицированными сахарами обладали каталитической активностью, свойственной рибозимам дикого типа, со временем полужизни в сыворотке крови человека 5–8 ч. Кроме того, введение на 3’-конец рибозима остатка dT, соединенного связью 3’-3’, сопровождалось увеличением времени его полужизни в сыворотке до 3 дней. Адресная доставка искусственных рибозимов. Существуют два основных подхода к адресной доставке олигонуклеотидов. При одном из них синтезированные молекулы рибозимов объединяют химическими методами или физически с макромолекулами, например липидами или лигандами рецепторов. В зависимости от природы молекул, находящихся в комплексе с рибозимом, его доставка будет либо неспецифической (в составе липосом), либо более специфической, которая может обеспечиваться, например эндоцитозом, опосредованным рецепторами. Другая группа методов использует экспрессирующие векторы, содержащие ген рибозима, транскрипция которого сопровождается внутриклеточным биосинтезом его молекул. В ходе исследований по оптимизации адресной доставки рибозимов были изучены многие конструкции липидных носителей. Такие конструкции позволяют инкапсулировать большое количество молекул рибозимов как в водном окружении, так и растворенными в липидном бислое. Соединение липосом с молекулами соответствующих антител или других лигандов может до некоторой (хотя и небольшой) степени обеспечивать тканеспецифическую доставку рибозимов и их проникновение в клетки требуемых типов, например пораженных вирусами. Циркулирующие липосомы быстро удаляются из кровотока макрофагами ретикулоэндотелиальной системы. Химическая модификация липидного бислоя или покрытие липосом оболочкой из полиэтиленгликоля ослабляют неспецифическую сорбцию белков сыворотки, а следовательно, и неспецифическое распознавание липосом макрофагами. Для создания альтернативных гидрофобных комплексов молекул рибозимов с носителем иногда используют катионные липиды. Такие липиды содержат длинные цепи жирных кислот (обычно C16 или C18), соединенные с полиамином. Полагают, что комплексы катионных липидов с олигонуклеотидами не образуют липосомоподобных структур. Результаты, полученные при исследовании возможностей адресной доставки рибозимов с помощью липосом и другими аналогичными методами, вселяют оптимизм. Однако до сих пор эти методы остаются чисто эмпирическими и должны разрабатываться индивидуально для каждого нового рибозима и типа клеток, в которые предполагается его доставлять. Для адресной доставки генов рибозимов в составе экспрессирующих векторов используют те же приемы, что и при генотерапии (подробнее см. раздел 10.4). Особенно часто для этой цели применяются ретровирусы. Включение в состав рибозима сигнальной последовательности этих вирусов, обеспечивающей упаковку их РНК в вирусные частицы, на 90% снижает титр соответствующих ретровирусов. При этом рибозим не оказывал влияния на те же мишени, локализованные в цитоплазме. Аденоассоциированные вирусы (ААВ), способные доставлять свою ДНК в клетки многих типов, также часто используются в качестве носителей для векторов, экспрессирующих рибозимы. Недавно сконструирован вектор, который из всех последовательностей ААВ содержал только концевые последовательности. С использованием этого вектора получена экспрессия антисмысловых РНК гена tar вируса иммунодефицита человека, которая блокировала его размножение. С помощью аденовирусов можно не только направленно осуществлять доставку экспрессирующихся генов, но и переносить большие молекулы декстранов, белков и плазмид, связанных с лигандами, способными и неспособными к независимой репликации. Например, удается транспортировать гены к дыхательному эпителию в составе комплексов аденовирус–полилизин–ДНК. Адресная доставка векторов к требуемым клеткам или тканям может быть осуществлена также непосредственно в виде аэрозоля (эпителий легких) или ex vivo в случае клеток костного мозга, который далее повторно вводят в организм больного. Исследование функционирования рибозимов in vivo. Для доказательства возможности использования рибозимов как лекарственных средств необходимо было прежде всего продемонстрировать, что осуществляемое ими расщепление мРНК сопровождается ожидаемыми физиологическими и биохимическими изменениями в организме. В одних из первых опытов использовали рибозимы, направленные против мРНК хлорамфениколацетилтрансферазы (ХАТ), ген которой экспрессировался в клетках животных. Рибозимы, синтез которых обеспечивался экспрессирующими векторами, специфически на 60% подавляли внутриклеточный синтез ХАТ. Кроме того, было показано направленное действие рибозимов против 28S рРНК и ее предшественников, а также мРНК -лактальбумина, но не других родственных РНК, находящихся в клетках. В результате в настоящее время считается признанным, что принцип действия рибозимов подтвержден на клеточном уровне. Для доказательства эффективности действия рибозимов in vivo с помощью этих агентов была предпринята попытка индуцировать диабет у мышей путем воздействия на мРНК глюкокиназы -клеток поджелудочной железы с помощью специфически экспрессирующегося в них трансгена рибозима. Оказалось, что у экспериментальных мышей активность глюкокиназы снижена в три раза именно в -клетках, что приводило к нарушению секреции ими инсулина и ответа на глюкозу. При этом рибозим не оказывал влияния на функционирование клеток печени. Тем не менее уровень глюкозы в крови таких трансгенных мышей оставался прежним, что позволило сделать вывод о важности дефицита по глюкокиназе печени, а не только поджелудочной железы для развития симптомов заболевания. Эти опыты продемонстрировали возможность использования рибозимов для исследования физиологии у интактных животных. Эффектные результаты с рибозимами удалось получить и на дрозофиле. Были созданы трансгенные яйца мух, содержащие ген рибозима, действующего на мРНК гена fushitarazu (ftz), находящегося под контролем температурно-чувствительного промотора. Этот гомеозисный ген уже упоминался в связи с обсуждением регулирующих его экспрессию факторов транскрипции в первой части книги. Индуцируя рибозим в определенные фазы эмбрионального развития дрозофилы, установили, что вначале нарушение функционирования гена ftz приводит к нарушению сегментации кутикулы у личинок. Если ген инактивировали во время нейрогенеза, то нарушалось развитие центральной нервной системы на фоне нормального развития кутикулы. Эти опыты показали, что индукция рибозима у дрозофилы фенотипически проявляется точно так же, как мутации, инактивирующие ген ftz,и не сопровождается другими видимыми нарушениями в организме. Введение в мужские пронуклеусы оплодотворенных ооцитов мышей плазмиды, экспрессирующей рибозим, направленный против мРНК 2-макроглобулина, сопровождалось его последующим синтезом в легких, почках и селезенке взрослых животных. При этом в легких происходило снижение уровня мРНК 2-макроглобулина более чем на 90%. Не столь значительное уменьшение содержания мРНК наблюдали в почках и селезенке. Первые опыты с рибозимами, включенными в состав антисмысловых РНК, показали их высокую эффективность и специфичность in vitro и меньшую эффективность in vivo. Это может быть связано с тем, что РНК в эукариотических клетках, как правило, находится в составе больших рибонуклеопротеидных комплексов и может быть труднодоступной для антисмысловых РНК, в связи с чем потребуется разработка дополнительных условий для повышения эффективности рибозимов, включенных в состав антисмысловых РНК. 9.2.3.Рибозимы как лекарственные средстваНа основании результатов рассмотренных опытов, а также других накопленных знаний о рибозимах складывалось мнение о принципиальной возможности использования рибозимов для регуляции активности конкретных генов человека. Область применения рибозимов как лекарственных средств может быть весьма широкой. В качестве возможных сфер их использования в клиниках в настоящее время рассматривают лечение вирусных инфекций, онкологических заболеваний, для которых известны продукты онкогенов, а также патологических состояний организма, вызываемых сверхэкспрессией конкретных генов. Лечение вирусных заболеваний. Большие усилия предпринимаются для использования рибозимов в лечении СПИДа, вызываемого вирусами иммунодефицита человека (ВИЧ). Уже в 1990 г. Н. Сарвер и соавторы продемонстрировали возможность расщепления геномной ВИЧ-РНК с помощью рибозима in vitro в бесклеточной системе, что сопровождалось снижением уровня р24-антигена на 98%. Длительные эксперименты на культурах клеток показали, что клетки, экспрессирующие такие рибозимы, не изменяли своего обычного фенотипа на протяжении, по крайней мере, 9 месяцев. Одновременно с этим было показано, что клетки линии MT4, стабильно трансфецированные вектором, экспрессирующим рибозим под контролем промотора гена тимидинкиназы вируса простого герпеса, были частично устойчивы к ВИЧ-инфекции. Полностью устойчивыми к заражению ВИЧ оказались клетки, содержащие рибозим под контролем вирусного регуляторного элемента tar, в которых вирус не обнаруживали даже через 22 дня после заражения. В этих клетках высокий уровень индукции синтеза рибозима происходит как раз во время ВИЧ-инфекции. Та же самая стратегия была применена и к рибозимам, образующим структуру типа шпильки. Экспрессия гена рибозима под контролем промотора гена -актина подавляла ВИЧ-инфекцию в культивируемых клетках. При этом продукты расщепления ВИЧ-РНК в таких клетках специфически и быстро деградировали. Еще одним подходом к преодолению ВИЧ-инфекции является отщепление 5’-концевой кэп-структуры ВИЧ-РНК с помощью рибозимов. Известно, что у большинства изолятов ВИЧ 5’-концевая лидерная последовательность их геномной РНК высококонсервативна. Из всех известных изолятов только штамм MN содержит замену одного нуклеотида в лидерной области РНК, расщепляемой рибозимом. В то же время исследованные штаммы ВИЧ различаются по другим участкам 5’-концевой лидерной последовательности. Эндонуклеазное удаление в составе олигонуклеотида 5’-концевой кэп-группы РНК ВИЧ подавляет трансляцию РНК и делает ее более доступной мишенью для внутриклеточных нуклеаз. Все имеющиеся экспериментальные данные позволяют сегодня сделать вывод о перспективности использования 5’-концевой лидерной последовательности ВИЧ-РНК в качестве мишени для рибозимов. Основной сложностью, которую приходится преодолевать при конструировании рибозимов, расщепляющих геномную ВИЧ-РНК, является высокая мутабильность этих РНК. Из-за мутационных замен отдельных нуклеотидов в сайтах, по которым происходит расщепление РНК рибозимами, последние утрачивают свою активность по отношению к этим РНК и соответственно противовирусную активность. Новейшая стратегия в решении данной проблемы заключается в создании нескольких рибозимов, действие которых направлено против разных консервативных участков генома ВИЧ, причем отдельные рибозимы должны входить в одну молекулу рекомбинантной РНК ("метод дробовика"). Помимо последовательностей антивирусных рибозимов такие рекомбинантные РНК содержат в себе дополнительные cis-действующие рибозимы, которые осуществляют аутокаталитический процессинг предшественников антивирусных рибозимов с освобождением зрелых рибозимов, действующих на разные участки вирусного генома. Этот метод не позволяет вирусу ВИЧ избежать инактивирующего действия рибозимов путем мутационных преобразований своего генома. 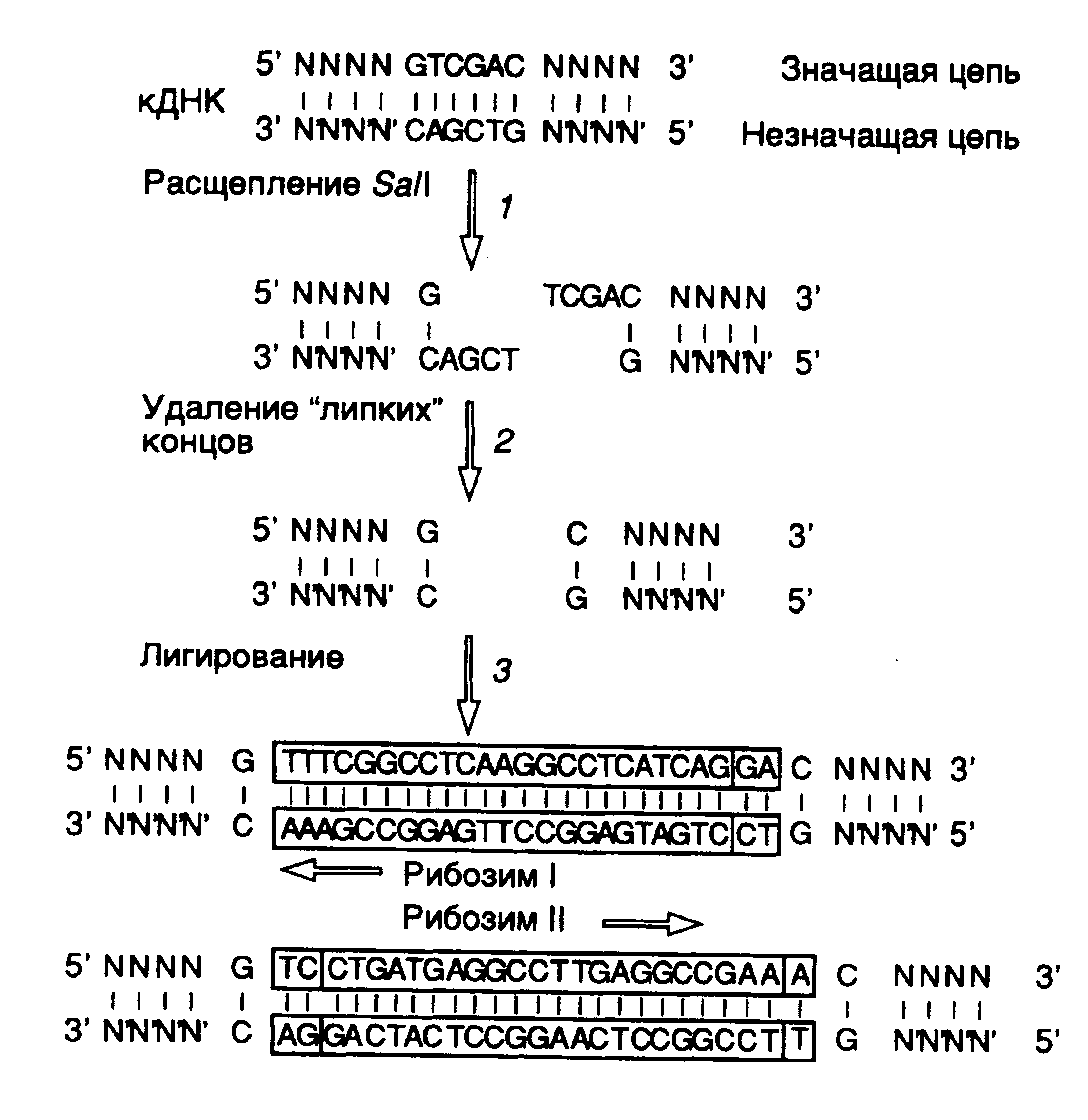 Рис. II.26. Использование сайтов рестрикции для конструирования рибозима, интегрированного в антисмысловую РНК Недавно была получена кассета из девяти идентичных генов рибозимов, расположенных друг за другом в одном экспрессирующем векторе. Рибозимы такой "полицистронной" РНК, направленные против разных частей ВИЧ-генома, сохраняли внутри клетки свою специфичность, но были более эффективными в пересчете на одну копию РНК полирибозима и не утрачивали своей активности даже в частично деградировавших молекулах РНК. 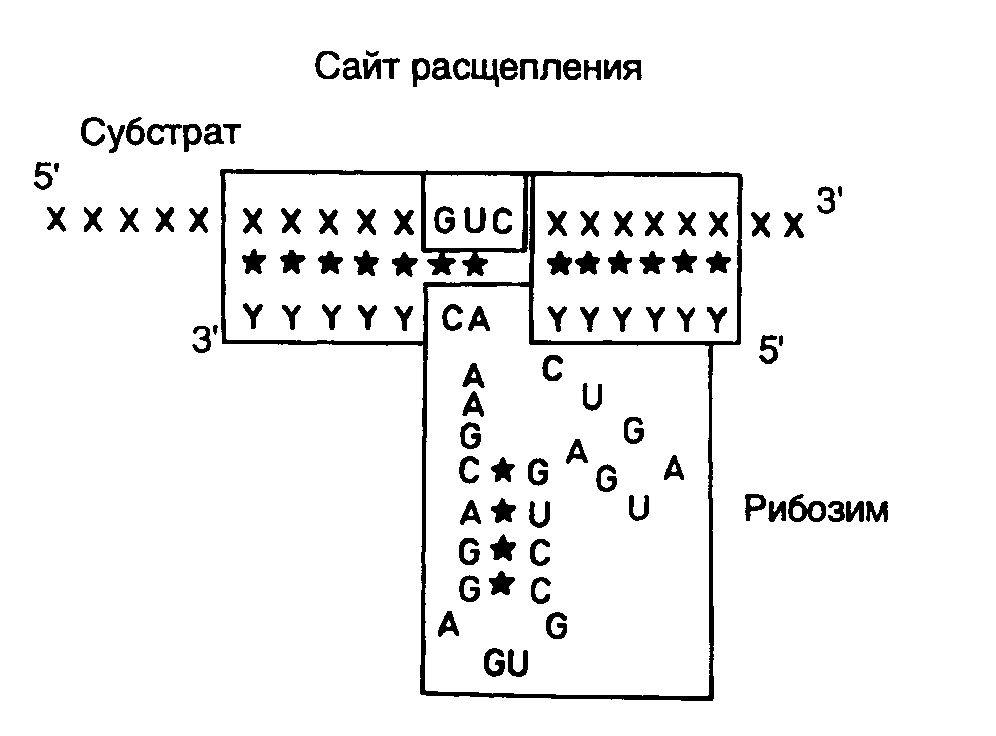 Рис. II.27. Взаимодействие рибозима с РНК-субстратом В заключение этого раздела рассмотрим пример использования рибозимов против вирусов растений в сельском хозяйстве. Как упоминалось выше, рибозимы, образующие структуру типа "головки молотка", распознают в сайте расщепления РНК-мишени последовательности из трех нуклеотидов, рядом с которой происходит гидролиз цепи РНК. Подобными тринуклеотидами могут быть последовательности AUC, CUA, CUC, GUA, GUC, GUU и UUC. В предложенном подходе РНК-связывающий домен рибозима конструируют таким образом, что распознаваемый тринуклеотид входит в состав последовательности нуклеотидов, которая в двухцепочечной ДНК образует сайт рестрикции. Подобный подход дает возможность встраивать последовательность каталитического домена рибозима по этому сайту рестрикции в кДНК, полученную путем обратной транскрипции РНК-мишени. Следовательно, каталитический домен рибозима оказывается фланкированным последовательностями антисмысловой РНК, комплементарной РНК-мишени, которые автоматически выполняют роль РНК-связывающего домена. При таком подходе отпадает необходимость в синтезе большого числа олигонуклеотидов, и в любом необходимом случае рибозим собирается из готовых блоков. В качестве конкретного примера рассмотрим создание рекомбинантного рибозима, специфически расщепляющего РНК, содержащую последовательность сайта рестрикции SalI (рис. II.26). После расщепления кДНК рестриктазой SalI (этап 1) образовавшиеся "липкие" концы гидролизуют нуклеазой S1 (этап 2) и по образовавшимся "тупым" концам встраивают каталитический домен рибозима, заключенный в двухцепочечном фрагменте ДНК (этап 3). В результате транскрибирования такой конструкции синтезируется антисмысловая РНК, в состав которой включен каталитический домен рибозима. После гибридизации с РНК-мишенью образуется двухцепочечная молекула РНК, на одной из цепей которой формируется структура рибозима типа "головки молотка" (рис. II.27), расщепляющего РНК-мишень в строго определенном месте. Описанный подход был реализован при конструировании рибозима, направленного против геномной РНК одного из вирусов сливы. При этом были получены последовательности нуклеотидов рибозима, пригодные для использования с другими 25 сайтами рестрикции. Подавление функционирования онкогенов. Одними из основных различий, обнаруживаемых между нормальными и раковыми клетками, являются генетические различия ряда генов, контролирующих пролиферацию. В геноме опухолевых клеток часто обнаруживают мутации в генах двух типов: онкогенах и генах-супрессорах опухолевого роста, или антионкогенах. Онкогены эволюционно консервативны и вызывают неопластическую трансформацию клеток как при ретровирусной инфекции в природных условиях (поскольку они часто бывают включены в состав генома ретровирусов), так и после введения ДНК онкогенов в культивируемые клетки с помощью трансфекции. Большинство онкогенов вначале было обнаружено именно в составе генома онкогенных вирусов, и они являются мутантными производными протоонкогенов, присутствующих в здоровых клетках многоклеточных организмов и активирующихся во время эмбриогенеза, роста клеток или регенерации тканей. Поскольку активированные онкогены в опухолевых клетках, как правило, сверхэкспрессируются и кодируемая ими РНК по своей первичной структуре отличается от РНК протоонкогенов, РНК онкогенов являются хорошей потенциальной мишенью для рибозимов. Онкоген H-ras. Мутация в кодоне 12 гена H-ras, приводящая к замене GGCGUC, создает консенсусный сайт, по которому HH-рибозим может расщеплять мутантную мРНК. In vitro было продемонстрировано пятикратное различие в эффективности действия рибозима на мутантную H-ras-РНК и соответствующую РНК дикого типа. Получены H-ras-зависимые линии клеток, стабильно трансформированные экспрессирующим вектором, который направлял синтез HH-рибозима под контролем промотора -актинового гена. Для таких клеток характерна пониженная скорость пролиферации, сопряженная с уменьшением внутриклеточных уровней H-ras-РНК и белка р21, кодируемого этим геном. Далее рибозим экспрессировали в клетках линии EJ карциномы мочевого пузыря человека. Введение исходных клеток мышам сопровождалось их быстрой гибелью на фоне развития высокоинвазивных опухолей. В отличие от этого клоны EJ-клеток, экспрессирующих рибозим, в организме мышей обладали резко сниженным опухолевым фенотипом. Образующиеся опухоли были малоинвазивны, и наблюдалось приблизительно двукратное повышение уровня выживаемости мышей с трансплантатами. Гистологические исследования подтверждали слабую способность опухолей к метастазированию. Рибозимы в опухолях обнаруживались методом ПЦР на протяжении 86–90 дней. Таким образом, эти и ряд других экспериментов показали способность рибозимов нормализовать экспрессию активированного H-ras как in vitro, так и in vivo. Онкоген c-fos. Как уже упоминалось в первой части книги, белковый продукт гена c-fos участвует в передаче сигнала эукариотическими клетками, вовлечен в синтез ДНК и может придавать клеткам устойчивость к противоопухолевым препаратам. Последние два свойства этого белка находят подтверждение, в частности в том факте, что при проведении лечения часто используемым противоопухолевым лекарством цисплатином (цис-диаминодихлорплатина) происходит индукция гена c-fos вслед за генами dTMP-синтазы и ДНК-полимеразы. Рибозим, разрушающий c-fos-мРНК, снижал конечный уровень экспрессии гена c-fos, приводил к повышению чувствительности опухолевых клеток к химиотерапевтическим агентам (включая цис-платину) и значительно подавлял экспрессию генов dTMP-синтазы, ДНК-полимеразы и гена металлотионеина человека hMTII-A. Онкогены bcr/abl. Аберрантная филадельфийская хромосома образуется в результате транслокации (9;22)(q34;q11) в стволовых клетках костного мозга, что сопровождается слиянием генов bcr и abl с образованием химерного онкогена bcr/abl и развитием хронических миелоидных лейкозов (ХМЛ). Транскрипт химерного гена кодирует белок р210bcr/abl, который обладает повышенной активностью тирозинкиназы. Такие РНК и белок обнаруживаются почти у всех больных с синдромом ХМЛ, а также у 50% пациентов с острым лимфобластоидным лейкозом, у которых имеется филадельфийская хромосома. С помощью рибозимов, специфически расщепляющих последовательность химерной мРНК в месте стыковки последовательностей двух генов, удалось подавить экспрессию химерного гена bcr/abl в культивируемых клетках. Экспрессия рибозимов в культивируемых клетках вызывала снижение уровня bcr/abl-мРНК, полностью блокировала образование химерного белка р210bcr/abl и ингибировала рост клеток на 84%. Эти результаты были значительно лучше эффектов, вызываемых антисмысловыми олигонуклеотидами. В работах других исследователей был получен рибозим, расщепляющий вышеупомянутую химерную РНК по кодону GUU, расположенному по соседству с местом стыковки последовательностей двух генов. Этот рибозим разрушал соответствующую РНК in vitroиin vivo, а также подавлял тирозинкиназную активность белка р210. 9.2.4.Репарация мутантных РНК с помощью рибозимов, осуществляющих транс-сплайсингПросто устроенные HH- и HP-рибозимы принято рассматривать как рибозимы первого поколения. Во всех примерах, рассмотренных выше, в прикладных целях использовалась их способность осуществлять специфическое эндонуклеазное расщепление молекул РНК. Недавно (Дж. Т. Джонс и др., 1996 г.) удалось приспособить рибозимы для восстановления генетической информации на уровне молекул РНК, структура которых нарушена мутациями. Рибозим интрона группы I Tetrahymena после незначительных генно-инженерных модификаций оказался способным выполнять такие репарирующие функции. Как уже обсуждалось в первой части книги (см. раздел 2.2.3), аутосплайсинг транскриптов, содержащих интроны группы I, начинается с расщепления фосфодиэфирной связи между 5’-концевым экзоном и прилегающим к нему интроном, сопровождаемого полным удалением интрона и лигированием фланкирующих его экзонов, приводящим к восстановлению непрерывной структуры РНК. Идея, лежащая в основе использования рибозимов для репарации РНК, проста. Достаточно лишь с помощью генно-инженерных методов к 3’-концу рибозима присоединить вместо 3’-концевого экзона любую другую последовательность, чтобы она соединялась с последовательностью 5’-концевого экзона в строго определенной точке с образованием гибридной молекулы РНК. Поскольку сайт взаимодействия рибозима с РНК во время транс-сплайсинга и положение точки разрыва РНК целиком определяются внутренней направляющей последовательностью рибозима (internal guide sequence – IGS), присоединение новой 3’-концевой последовательности можно осуществлять практически в любом месте РНК-мишени (рис. II.28). Таким образом, для репарации мутационного повреждения в экзоне 2 на уровне РНК IGS делают комплементарной участку РНК-мишени, локализованному выше точки повреждения (в рассматриваемом примере – А) на стыке экзонов 1 и 2. Экзон 2 дикого типа соединяют с рибозимом, который после взаимодействия с РНК-мишенью вырезает из нее мутантную последовательность экзона 2 и заменяет на эквивалентную последовательность дикого типа. В результате комплекс рибозима и репарированной РНК распадается и обновленная РНК вовлекается в трансляцию. 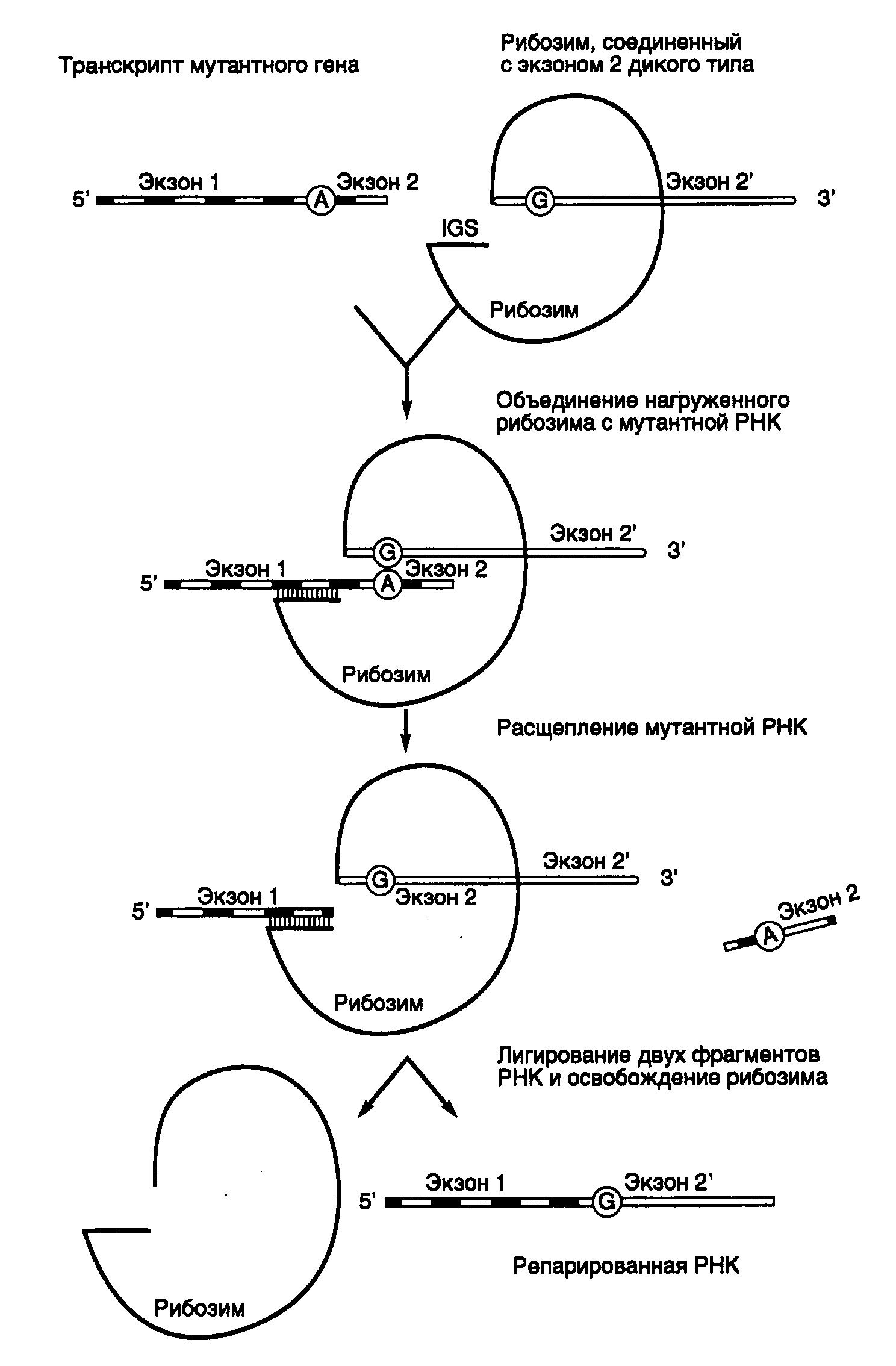 Рис. II.28. Схема репарации мутантной мРНК рибозимом, осуществляющим транс-сплайсинг Молекула рибозима, соединенная 3’-концом с последовательностью экзона 2 дикого типа, взаимодействует с мутантной РНК выше мутантного нуклеотида и замещает мутантную часть репарируемой РНК в реакции аутосплайсинга Такой подход был успешно использован для репарации мРНК гена lacZ как в клетках E. coli, так и в культивируемых клетках животных. Точность транс-сплайсинга, направляемого рибозимом, оказалась абсолютной – в образующихся восстановленных молекулах РНК не наблюдали сдвига рамки считывания. Однако в этих опытах на первый план вышла другая проблема. Длина IGS-последовательности, определяющей специфичность взаимодействия рибозима с РНК, составляет всего шесть нуклеотидов. Такая последовательность из шести нуклеотидов в молекулах РНК встречается достаточно часто (каждые 4096 оснований). Следствием этого было объединение репарирующего фрагмента РНК не только с РНК-мишенью, но и другими РНК, не имеющими отношения к первой. Выход из сложившейся ситуации ищут в увеличении специфичности действия рибозима путем удлинения IGS. Однако с увеличением длины области комплементарного взаимодействия между рибозимом и РНК будут возрастать прочность этого взаимодействия и, как следствие, затруднение последующего распада каталитического комплекса, что должно сопровождаться ингибированием реакции. Применение рибозимов в реакциях транс-сплайсинга для корректировки экспрессии мутантных генов на посттранскрипционном уровне рассматривается как весьма перспективное направление в генотерапии. И хотя более логичной все-таки кажется необходимость репарации мутаций на уровне самих генов, такой подход, возможно, получит право на жизнь и в клиниках. По сути дела он является прототипом реакции редактирования РНК (см. раздел 2.2.2), который эффективно используется клетками при экспрессии ряда генов в природных условиях. Благодаря генной инженерии введение в молекулярную генетику антисмысловых РНК и рибозимов привело к появлению высокоспецифичного инструмента для изучения функциональной роли и регуляции экспрессии индивидуальных генов in vivo. Использование этих методов представляется особенно перспективным в исследованиях по биологии и генетике развития, так как именно здесь инактивация отдельных генов соматических клеток представляется особенно сложной задачей. Плодотворным подходом является объединение последовательностей антисмысловых РНК с рибозимами, поскольку в результате получаются каталитически действующие, высокоспецифические супрессоры генов, а также конструкции, корректирующие экспрессию генов на посттранскрипционном уровне. Полагают, что дальнейшее развитие техники адресной доставки генов антисмысловых РНК, направленных против патогенных вирусов, в клетки зародышевой линии животных и растений может привести к созданию сортов растений и пород животных, устойчивых к действию патогенных вирусов, и дать большой экономический эффект в сельском хозяйстве. Однако хорошо известно, что на любое лекарство у возбудителя заболевания всегда находится адекватный защитный ответ. Поэтому до тех пор, пока генотерапия не будет опираться на самонастраивающиеся генетические системы, что имеет место, например в случае иммунной системы, победа, в конечном счете, будет оставаться за возбудителем. Нельзя не учитывать и возможное использование антисмысловых РНК в будущем для генотерапии как инструмента воздействия на онкогены и другие генные локусы, повышенный уровень экспрессии которых вредно сказывается на жизнедеятельности соматических клеток многоклеточных организмов. Первые результаты, полученные при разработке некоторых из этих направлений молекулярной генетики, кратко изложены в главе 11. 9.2.5.ДезоксирибозимыВ отличие от РНК, выполняющих в клетке разнообразные функции, благодаря возможностям формирования у этих макромолекул сложных пространственных структур, для внутриклеточных ДНК пока известна единственная функция – пассивное хранение генетической информации. Отчетливо различающиеся биохимические функции биополимеров этих двух видов объясняют исключительно особенностями их химического состава. Отсутствие у ДНК в 2'-положении рибозы гидроксильной группы делает ее более устойчивой к расщеплению in vivo, а следовательно, более приемлемым, чем РНК, носителем генетической информации. Наличие же у РНК 2'-OH-группы, напротив, является предпосылкой ее структурной и функциональной сложности. Несмотря на прогноз о большой каталитической инертности ДНК, в течение последних пяти лет ферментативная активность была обнаружена и у ее молекул, правда пока только в искусственных условиях. Молекулы ДНК, обладающие ферментативной активностью, получили название дезоксирибозимов. К настоящему времени описана способность дезоксирибозимов расщеплять, лигировать и фосфорилировать молекулы ДНК, метилировать порфирины или осуществлять гидролиз РНК. Получены дезоксирибозимы с активностями РНКазы, которые используют в качестве кофакторов аминокислоты, ионы металлов, а также не требуют кофакторов вообще. При этом Mg2+-зависимые дезоксирибозимы расщепляют РНК со скоростью, сопоставимой с таковой природных рибозимов (kкат= 10 мин-1). Поиск молекул ДНК, обладающих определенными ферментативными активностями, как правило, осуществляется с применением скрининга пула молекул со случайной первичной структурой. Результативность таких исследований во многом зависит от эффективности системы скрининга. Так, при отборе дезоксирибозимов с полинуклеотидкиназной активностью И. Ли и Р.Р. Брикер (1999 г.) использовали пул из 1015 различных молекул синтетических одноцепочечных ДНК длиной в 100 нуклеотидов со случайной 70-нуклеотидной последовательностью в центральной части. Из пула отбирали молекулы, способные фосфорилировать свой 5'-конец в присутствии различных рибо- или дезоксирибонуклеозидтрифосфатов. Наличие 5'-концевого фосфата обнаруживали по приобретению олигонуклеотидами способности участвовать в реакции лигирования с акцепторным олигонуклеотидом на одноцепочечной матрице, стыкующей их концы, поскольку только фосфорилированные молекулы ДНК могли лигироваться с акцепторной ДНК. Молекулы ДНК, длина которых увеличивалась в результате лигирования, очищали электрофорезом, амплифицировали и использовали в новых раундах скрининга. В итоге из смеси молекул ДНК были выделены олигонуклеотиды, фосфорилирующие свой 5'-концевой нуклеотид с использованием γ-фосфатной группы рибо- и дезоксирибонуклеотидов. Некоторые олигонуклеотиды оказались высокоспецифичными в отношении доноров фосфатных групп и работали только в присутствии конкретных нуклеотидов, тогда как другие были неразборчивы в отношении индивидуальных донорных нуклеотидов. Более того, структурные исследования показали, что полученные молекулы ДНК обладают достаточной сложностью, чтобы делать выбор между различными молекулами субстратов, кофакторов и эффекторов. На основании такого рода данных были сделаны выводы, что молекулы ДНК, как и РНК, способны формировать различные третичные структуры, необходимые для осуществления химического катализа. В будущем они могут быть использованы для конструирования различных дезоксирибозимов. При этом не исключается, что дезоксирибозимы могут быть обнаружены и in vivo. |
