Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
7.2.ВекторыФерменты, описанные в предыдущем разделе, позволяют производить тонкие манипуляции как с протяженными молекулами ДНК, так и с их фрагментами. В частности, с помощью рестриктаз можно с большой точностью разрезать молекулы ДНК, а образовавшиеся в результате фрагменты соединять в любой желаемой последовательности друг с другом, восстанавливая сахаро-фосфатный остов молекулы ДНК с помощью ДНК-лигазы. Однако с использованием только этих ферментов еще нельзя решить одну из основных методических задач молекулярной генетики – выделение любой требуемой нуклеотидной последовательности в чистом виде и в количестве, достаточном для исследования этих последовательностей биохимическими методами. Исключение составляет метод ПЦР, однако его применение ограничивается короткими последовательностями нуклеотидов. Основная идея, позволяющая решать эту задачу, заключается в том, чтобы присоединить исследуемые фрагменты ДНК к молекуле-переносчику, которая могла бы автономно существовать внутри бактериальных или эукариотических клеток в виде одной или нескольких копий и передаваться вместе со встроенным в нее фрагментом ДНК от одной клетки к другой. Такие молекулы-переносчики фрагментов нуклеиновых кислот были созданы, их называют векторами, и они являются одним из важнейших инструментов генной инженерии. Идеальная векторная молекула должна обладать несколькими обязательными свойствами. Во-первых, любой вектор должен длительное время существовать в популяции клеток-хозяев, т.е. реплицироваться автономно или вместе с хромосомами клеток. Во-вторых, в любом векторе должны быть биохимические или генетические маркеры, которые позволяли бы обнаруживать его присутствие в клетках. В-третьих, структура векторной молекулы должна допускать встраивание в нее чужеродной последовательности нуклеотидов без нарушения ее функциональной целостности. Для конструирования векторов в генной инженерии используют небольшие молекулы нуклеиновых кислот, способные к автономной репликации в бактериальных и эукариотических клетках – плазмиды, хромосомы вирусов, а также фрагменты хромосом эукариотических клеток. 7.2.1.Плазмидные векторы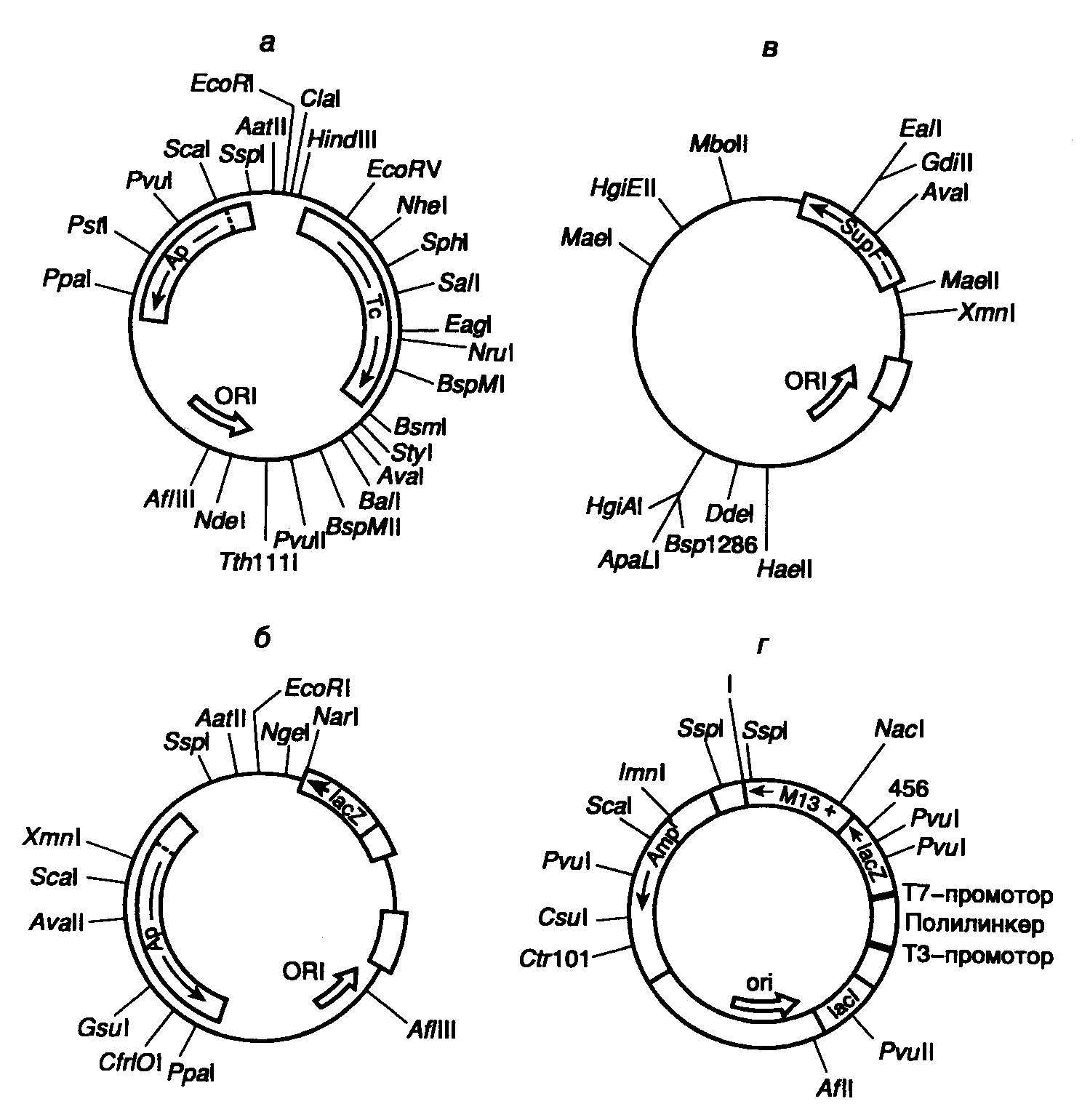 Рис. II.5. Различные векторы для клонирования ДНК и их рестрикционные карты Обозначены положения уникальных сайтов рестрикции, а также функционально значимых генов а – векторная плазмида pBR322; б – экспрессирующая векторная плазмида pUC18; в – векторная плазмида AN7, предназначенная для отбора рекомбинантных клонов с использованием гомологичной рекомбинации; г – многофункциональная векторная плазмида Bluescript Первые эффективные векторы для клонирования фрагментов чужеродной ДНК, не утратившие своего значения и поныне, были получены с использованием бактериальных плазмид. Большая серия векторных плазмид, обозначенных символом pBR, создана на основе репликона природной плазмиды ColEI, придающей клеткам E. coli устойчивость к колицину путем его объединения с генами устойчивости к антибиотикам. Таким образом, бактериальные клетки, несущие подобные комбинированные плазмиды, приобретали устойчивость к соответствующим антибиотикам, и их было легко отличить от бесплазмидных клеток путем простого посева на питательную среду с антибиотиками. Генетическая карта одного широко распространенного вектора этой серии – pBR322 изображена на рис. II.5,а. Такая плазмида представляет собой кольцевую ковалентно замкнутую молекулу ДНК длиной 4363 п.о. Последовательность нуклеотидов pBR322 полностью известна. Плазмида содержит гены устойчивости к тетрациклину (Tc) и ампициллину (Ap), которые были перенесены в плазмиду pBR322 из плазмиды pSC101 и транспозона Tn3 соответственно. Оба этих гена являются селектируемыми генетическими маркерами плазмиды, т.е. позволяют проводить отбор бактериальных клеток с плазмидой pBR322 по их способности к росту на питательных средах в присутствии тетрациклина и(или) ампициллина. Плазмида pBR322 содержит также обеспечивающий ее стабильную репликацию в клетках E. coli участок ДНК, который включает область начала репликации (ori). Характерной чертой плазмиды pBR322, как и любого современного вектора, является наличие в ней нескольких уникальных сайтов рестрикции, обозначенных на генетической карте. Следует иметь в виду, что встраивание в плазмиду клонируемых чужеродных фрагментов ДНК по сайтам рестрикции, расположенным в генах Ар или Tc (например PstI или BamHI), будет нарушать целостность этих генов и их функциональную активность. В результате происходит утрата бактериальными клетками, содержащими рекомбинантные плазмиды, устойчивости к соответствующим антибиотикам. По такому признаку легко различить бактериальные клетки, не содержащие плазмиды (не растут в присутствии ампициллина и тетрациклина), клетки с плазмидой, не содержащей вставки клонируемой ДНК (растут в присутствии обоих антибиотиков), и клетки с рекомбинантными плазмидами (в зависимости от локализации вставки могут расти на среде только с одним из двух вышеупомянутых антибиотиков). Следовательно, наличие в векторных молекулах селектируемых маркеров резко повышает эффективность клонирования из-за возможности проведения быстрого отбора рекомбинантных плазмид на селективных питательных средах. Помимо генов устойчивости к антибиотикам в качестве селектируемых маркеров используют и другие гены или их фрагменты. В частности, для этих целей часто применяются гены различных ферментов, присутствие которых в клетках в составе плазмиды обнаруживают по появлению соответствующей ферментативной активности. В часто используемых векторах серии pUC таким селектируемым маркером является 5’-концевая часть гена галактозидазы E. coli – lacZ’ (см. рис. II.5,б). Эта часть гена, находящаяся под контролем lac-промотора, кодирует N-концевую часть -галактозидазы (так называемый -пептид), которая путем объединения с недостающей С-концевой частью полипептида без образования пептидной связи восстанавливает ферментативную активность -галактозидазы. Галактозидаза обладает способностью расщеплять искусственный субстрат Xgal (5-бром-4-хлор-3-индолил--D-галактопиранозид) с образованием окрашенного в голубой цвет продукта реакции. В том случае, когда в бактериальных клетках, которые содержат в хромосоме недостающую экспрессирующуюся 3’-концевую часть гена lacZ и выращиваются на среде с Xgal, в результате комплементации -пептидом вектора появляется активность -галактозидазы, образованные этими клетками бактериальные колонии окрашиваются в голубой цвет. Уникальные сайты рестрикции для клонирования ДНК локализованы в начале гена -галактозидазы в составе полилинкера (синтетической последовательности нуклеотидов, содержащей несколько перекрывающихся уникальных сайтов рестрикции), который не нарушает функциональной целостности последовательности нуклеотидов -пептида. Вставка рекомбинантной ДНК в эти векторы разрывает структурную часть гена -галактозидазы и инактивирует его, в связи с чем колонии бактерий с подобными рекомбинантными плазмидами, выросшие на питательной среде с Xgal, не окрашены. Поскольку векторы серии pUC одновременно содержат и ген устойчивости к ампициллину, отбор бактерий, несущих рекомбинантные плазмиды, можно проводить одновременно по этим двум маркерам. На питательной среде с ампициллином и Xgal вырастают только бактерии, устойчивые к антибиотику, т.е. содержащие плазмиду pUC, а среди выросших колоний лишь неокрашенные содержат вставку чужеродной ДНК. В качестве селектируемых маркеров в векторных молекулах часто используются гены, присутствие которых может быть обнаружено косвенно по комплементации генетических дефектов бактериальных клеток-хозяев, что делает их жизнеспособными в определенных селективных условиях. Подробнее об одной из таких систем см. в разделе 7.3.3. За короткий период развития генной инженерии было сконструировано труднообозримое количество векторных плазмид, обеспечивающих конкретные потребности исследователей. Одной из вершин генно-инженерного искусства, прекрасно иллюстрирующей возможности генной инженерии, в настоящее время являются полифункциональные векторы серии Bluescript, полученные фирмой "Stratagene" (США) (см. рис. II.5,г). Вектор Bluescript M13+ представляет собой кольцевую ковалентно замкнутую молекулу ДНК длиной около 3 т.п.о. Он включает в себя ген устойчивости к ампициллину Ampr, ген -галактозидазы lacZ, в N-концевую часть которого встроен полилинкер, содержащий уникальные сайты рестрикции для 21 рестриктазы, промоторно-операторную область lacZ, а также ген lac-репрессора lacI. В результате встраивания клонируемого фрагмента ДНК в полилинкер происходят разрыв кодирующей части гена lacZ и инактивация -галактозидазы, что, как и в случае вектора pUC18, можно обнаружить по исчезновению окраски колоний бактерий, содержащих этот вектор со вставкой клонированной ДНК. Кроме того, встроенный в полилинкер фрагмент ДНК попадает под контроль промоторно-операторной регуляторной последовательности гена lacZ и в присутствии индуктора IPTG может быть экспрессирован в клетках E. coli. В дополнение к этому полилинкер в векторной плазмиде содержит на одном конце промотор для Т7-, а на другом – для Т3-РНК-полимераз, которые ориентированы навстречу друг другу. Это позволяет транскрибировать любую из цепей клонированного фрагмента ДНК in vitro с помощью той или другой РНК-полимеразы и получать препаративные количества мРНК или же комплементарной ей антисмысловой РНК. Кроме того, вектор Bluescript M13+ обладает межгенной областью (IG) фага f1, родственного фагу M13. Эта область детерминирует все цис-действующие функциональные последовательности нуклеотидов фага, необходимые для репликации его хромосомы и упаковки ее в фаговые частицы. В присутствии фага-помощника M13 происходит преимущественная упаковка образовавшейся в результате репликации одноцепочечной плазмиды в фаговые частицы M13. Одноцепочечная ДНК Bluescript M13+ после очистки может быть использована непосредственно для секвенирования клонированной ДНК или проведения сайт-специфического мутагенеза. Векторы типа Bluescript M13+, способные существовать либо в виде плазмиды, либо в составе фаговых частиц нитевидных бактериофагов, называют фагмидами. |
