Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
11.2.ДНК-типированиеРезультаты, полученные при исследовании структуры и организации геномной ДНК животных, растений и микроорганизмов, наложили глубокий отпечаток на методологию их систематизации. Проблема адекватного отнесения конкретного организма к той или иной группе не является чисто академической. Основанная на точных критериях систематика живых организмов, определяющая эволюционное родство между ними, помимо чисто теоретического представляет и большой практический интерес. В частности, знание источника различных штаммов патогенных микроорганизмов, вызывающих больничные инфекции, позволило бы выработать эффективные меры защиты против их распространения. Недавно были обнаружены генетические маркеры в виде специфических последовательностей ДНК, которые дают возможность выявлять родственные отношения между особями одного и того же вида путем внутри- и межпопуляционных исследований. Такого рода исследования популяций человека особенно важны с практической точки зрения. В настоящее время молекулярно-генетические методы позволяют осуществлять идентификацию личности в судебно-медицинских исследованиях, а также решать в спорных случаях проблему определения отцовства. Генетическим, или ДНК-типированием, называют определение особенностей генотипа организма путем анализа ДНК его генома. Иными словами, в процессе ДНК-типирования определяют особенности первичной структуры ДНК исследуемого организма в конкретных генетических локусах. Абсолютно консервативных генетических локусов, по-видимому, не существует. Мутационные изменения генома непрерывно накапливаются на протяжении филогенетического (исторического, эволюционного) развития вида. Но такого же рода изменения неуклонно происходят в геномах отдельных особей, принадлежащих одной или разным популяциям. Естественно, что проще всего обнаруживаются межвидовые различия в последовательностях нуклеотидов исследуемых участков генома, поскольку эти различия, как правило, значительны, и именно они определяют эволюционное расстояние между видами (их дивергированность). Таким образом, у каждого вида организмов имеется большое число внутривидовых различий в первичной структуре ДНК отдельных генетических локусов. Генетические локусы, выполняющие одну и ту же функцию (содержащие один и тот же ген или несколько генов), но различающиеся по первичной структуре ДНК, называют полиморфными, а само явление существования в популяции полиморфных локусов получило название генетического полиморфизма. 11.2.1.ДНК-типирование микроорганизмовНаиболее часто в настоящее время используют два способа ДНК-типирования патогенных микроорганизмов, в основе которых лежит метод ПЦР. В первом случае используют один или несколько коротких праймеров произвольной первичной структуры длиной в 6–15 нуклеотидов, которые из-за своих малых размеров обладают низкой специфичностью в отношении конкретных генетических локусов и способны гибридизоваться со многими сайтами геномной ДНК. Во втором случае применяют специфические олигонуклеотидные праймеры длиной в 20–27 нуклеотидов, последовательности которых фланкируют исследуемую последовательность нуклеотидов в бактериальном геноме. 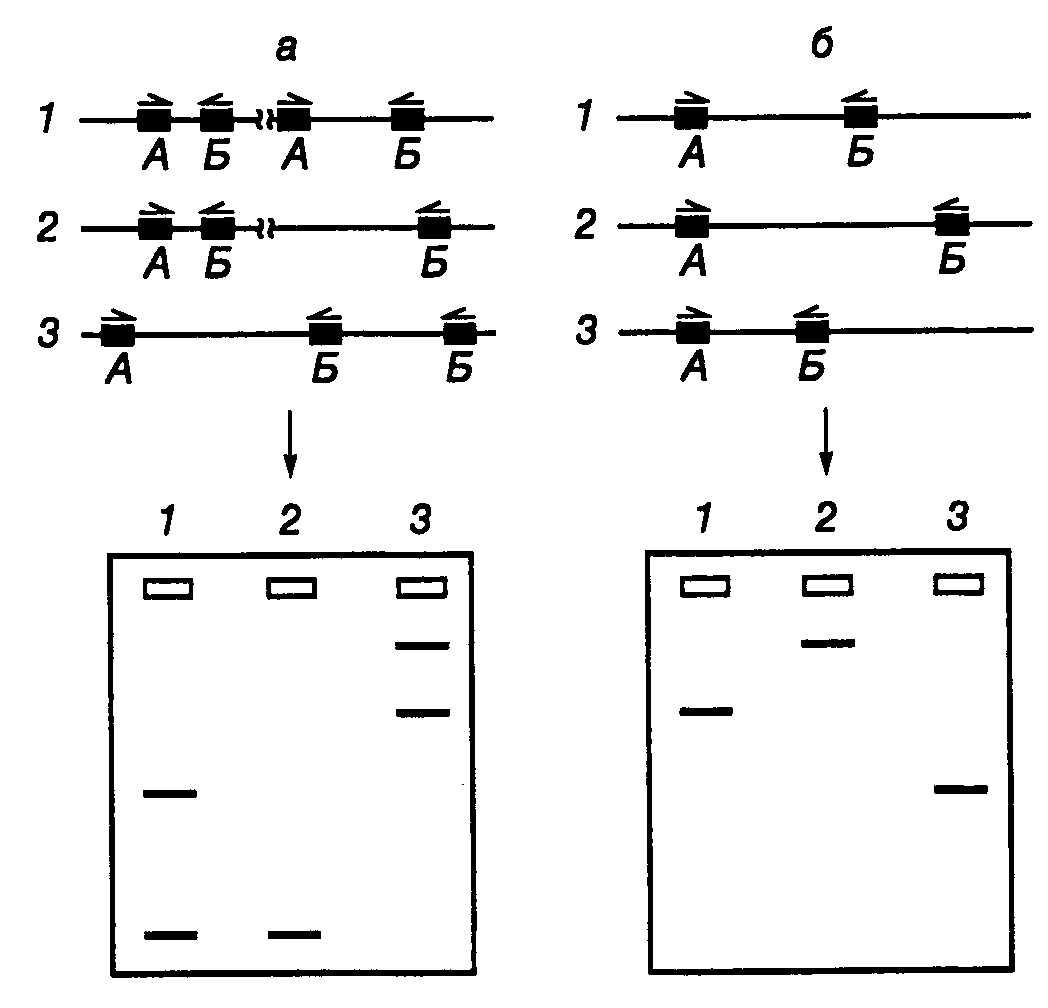 Рис. II.35. Схема ДНК-типирования микроорганизмов с использованием ПЦР и праймеров произвольной структуры а – штаммоспецифические различия, обусловленные разной локализацией участков ДНК, взаимодействующих с праймерами. В ДНК штаммов 2 и 3 отсутствует участок, который имеется в ДНК штамма 1, что приводит к исчезновению соответствующей полосы продукта ПЦР на электрофореграмме; б – результаты амплификации ДНК, содержащей сайты связывания праймеров постоянной локализации. ДНК штаммов 2 и 3 содержат делеции разной длины между сайтами связывания праймеров. Альтернативно, ДНК штаммов 1 и 2 могут содержать вставки, отсутствующие у ДНК штамма 3. Это находит отражение в длинах продуктов ПЦР, разделяемых электрофорезом. А, Б – сайты связывания праймеров на ДНК Генетическое типирование микроорганизмов с использованием праймеров произвольной первичной структуры.Использование коротких олигонуклеотидных праймеров произвольной структуры основано на том, что в больших геномах для них имеются множественные сайты посадки, а следовательно, и инициации ПЦР. Чем короче такие праймеры, тем большее количество сайтов посадки для них должно существовать. Одним из ограничений дальнейшего участия таких праймеров в ПЦР будет расстояние между двумя сайтами посадки для противоположно направленных праймеров. Чем длиннее ПЦР-продукт, который должен образовываться в результате функционирования таких праймеров, тем менее надежно работает вся система типирования. На практике длина образующихся с произвольными праймерами продуктов ПЦР находится в пределах 0,2–2,0 т.п.о. В зависимости от локализации на ДНК мест посадки для пары коротких праймеров могут образовываться два типа продуктов ПЦР. В первом случае различия в длинах продуктов ПЦР обусловлены присутствием на ДНК типируемых микроорганизмов разного числа сайтов связывания для одного или обоих праймеров (рис. II.35,а). Во втором случае такие различия определяются длинами сегментов ДНК (ампликонов), заключенных между парами мест посадки праймеров при неизменном их числе в конкретных генетических локусах (см. рис. II.35,б). На практике могут одновременно реализовываться обе эти возможности. Во время генетического типирования эукариот указанными методами иногда сразу функционируют до 100 ампликонов, тогда как у бактерий это число достигает лишь 20. Несмотря на то что при обсуждаемом подходе последовательности праймеров выбираются произвольно, получаемая картина амплификации, как правило, является видо- и штаммоспецифичной. При этом количество сайтов связывания на одной и той же ДНК для праймеров одинаковой длины, но с разной первичной структурой может существенно варьировать. На рис. II.35 показаны такие свойства двадцати 10-нуклеотидных праймеров, испытанных на ДНК человека, бобов и S. aureus. Видно, что использование праймера AGGGGTCTTG, например, приводит к амплификации 8 ампликонов в ДНК человека, 3 ампликонов в ДНК соевых бобов и не выявляет ни одного ампликона в ДНК S. aureus, тогда как при использовании праймера AATCGGGCTG удается обнаруживать до 40 ампликонов в ДНК человека и соевых бобов и до 20 ампликонов в бактериальной ДНК. Таким образом, при использовании обсуждаемого метода в ДНК-типировании самым важным этапом является подбор праймеров или их комбинаций для наиболее эффективного определения принадлежности организма к тому или иному виду, штамму или линии. Генетическое типирование микроорганизмов с использованием геномных фингерпринтов.При другом подходе к генетическому типированию с использованием ПЦР исследуют полиморфизм конкретных локусов, для которых хотя бы частично известна первичная структура. Синтезируют специфические олигонуклеотидные праймеры, сайты связывания которых фланкируют исследуемую последовательность ДНК с длиной 1,5–2,5 т.п.о. После проведения ПЦР особенности первичной структуры продуктов ПЦР определяют с помощью рестрикционного анализа. Положение сайтов рестрикции в анализируемой последовательности нуклеотидов может иметь видо- или штаммоспецифический характер и служить точным генетическим маркером того или иного микроорганизма. С помощью этого метода, который по своей сути является разновидностью рассмотренного выше способа определения ПДРФ, идентифицируют близкородственные, сходные по фенотипу штаммы возбудителей заболеваний, исследуют генетическую структуру популяций микроорганизмов и механизмы их адаптивной изменчивости. 11.2.2.Идентификация личности на основе минисателлитной ДНК: определение отцовстваОпределение отцовства представляет собой серьезную социальную, юридическую и медицинскую проблему. Решение этой задачи часто требуется в судах, при разрешении частных споров, для пренатальной (внутриутробной) диагностики, генетических консультаций и при пересадках органов. Например, только в США в 1990 г. было проведено более 120000 тестов на определение отцовства, и это число быстро возрастает. Мировой рынок таких диагностических тест-систем оценивался в 1994 г. более чем в 1 млрд долларов и сейчас является крупнейшим рынком среди молекулярно-генетических диагностикумов. С использованием диагностических тест-систем на основе минисателлитных ДНК определение отцовства получило прочную научную основу. С этой целью в настоящее время используют два подхода. При одном из них применяют олигонуклеотидные зонды, специфичные в отношении многих минисателлитных локусов, при другом – наборы зондов (или праймеров), специфичных в отношении отдельных полиморфных локусов VNTR (подробнее о VNTR см. раздел 1.3.1). Теоретические аспекты возможности определения отцовства. Возможность определения отцовства, так же как и отнесение биологических образцов, содержащих ДНК, к тому или иному человеку, основано на наличии в геноме человека четких генетических маркеров в виде определенных последовательностей ДНК, набор которых уникален для конкретного индивидуума. Теоретически такими маркерами могли бы быть любые последовательности нуклеотидов ДНК, для которых характерна большая изменчивость в популяциях человека. Как было уже отмечено выше, тандемно повторяющиеся последовательности минисателлитов (VNTR) являются одними из наиболее полиморфных последовательностей нуклеотидов в геноме человека. Поэтому неудивительно, что именно они были использованы для идентификации личности. Наличие сочетания генетических маркеров среди VNTR, общих для мужчины, женщины и спорного ребенка, в ряде случаев может однозначно указывать на родственные связи между ними. Отсутствие общих генетических маркеров у обследуемых ребенка и мужчины однозначно исключает последнего как отца ребенка. Однако обнаружение у них общих маркеров еще не может быть доказательством того, что подозреваемый мужчина является отцом. Доказательства отцовства основываются на простых статистических расчетах, в которых учитываются частоты встречаемости в популяции общих аллелей исследуемых VNTR-локусов. Рассчитывается отношение (X/Y) вероятности (X) получения наблюдаемого набора маркеров возможного настоящего отца к вероятности (Y) обнаружения этого набора маркеров у любого, выбранного наугад человека, принадлежащего этой популяции. Такое отношение вероятностей получило название индекса отцовства (paternity index – PI). При расчетах PI возникает еще одна проблема, связанная с определением вероятности (X) того, что обследуемый мужчина является отцом. Значение такой вероятности необходимо иметь до проведения каких-либо диагностических тестов. Обычно используемое значение 0,5 нельзя считать достаточно обоснованным во всех конкретных случаях. К счастью, при очень больших значениях PI (>104), которые обычно получаются при таких исследованиях ДНК, выбор этой исходной вероятности оказывается практически несущественным. Как правило, это получается вследствие низких значений вероятности Y. Определение отцовства с использованием олигонуклеотидных зондов, специфичных в отношении нескольких VNTR-локусов. В 1985 г. И.О. Джеффрисом и соавторами впервые было показано, что олигонуклеотидные зонды, комплементарные последовательностям миоглобинового гена человека, одновременно обладают способностью гибридизоваться по Саузерну с множественными локусами минисателлитной ДНК. Профили гибридизации оказались специфичными для отдельных индивидуумов. Совокупность электрофоретически разделяющихся рестрикционных фрагментов анализируемой ДНК, выявляемых после проведения гибридизации с мечеными зондами, которые специфичны в отношении полиморфных минисателлитных локусов, получила название ДНК-фингерпринтов, или генетических отпечатков пальцев. С помощью таких и других аналогичных олигонуклеотидных зондов удается выявлять на одной электрофореграмме до 15–20 различных фрагментов ДНК одного индивидуума, молекулярная масса которых превышает 3,5 т.п.о., а также много более мелких фрагментов, которые не учитываются при определении отцовства этим методом. 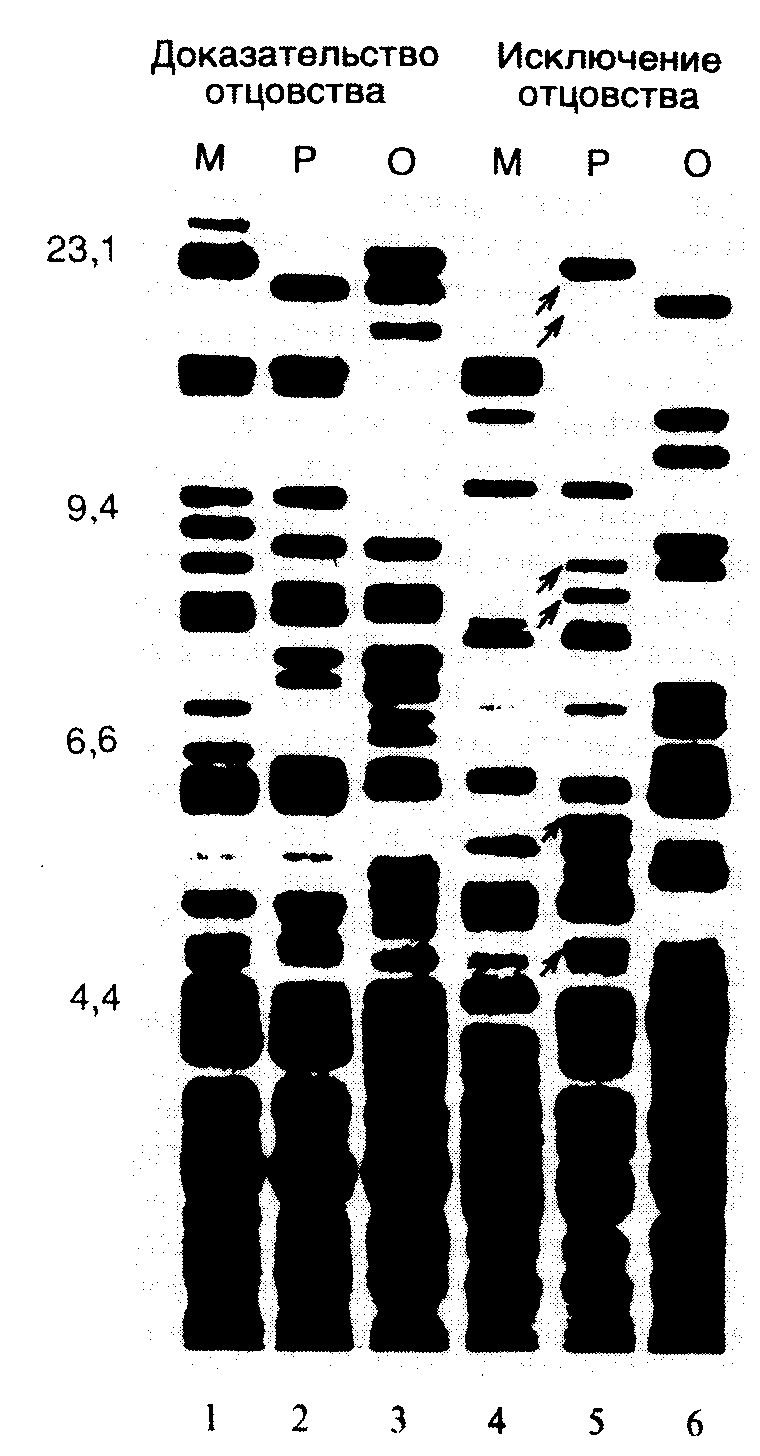 Рис. II.36. Примеры исключения и доказательства отцовства с помощью ДНК-типирования Результаты гибридизации по Саузерну с зондом F10 показывают полную идентичность фрагментов ДНК у ребенка и отца (дорожки 2 и 3), что рассматривается как доказательство отцовства, либо выявляют, по крайней мере, 6 дополнительных фрагментов ДНК у ребенка, обозначенных стрелками, которые отсутствуют у отца (дорожки 5 и 6 – исключение отцовства) На рис. II.36 показаны результаты одного из таких опытов. Интерпретация ДНК-фингерпринтов, полученных при анализе множественных локусов, основана на трех постулатах. Прежде всего, предполагается, что фрагменты ДНК, видимые на фингерпринтах, являются аллельными продуктами отдельных генетических локусов человека и передаются потомству независимо друг от друга. Во-вторых, считается, что для каждого генетического локуса частоты встречаемости в популяции отдельных аллелей следуют нормальному распределению Пуассона. И, наконец, принимается, что фрагменты ДНК, электрофоретическая подвижность которых совпадает, представляют один и тот же аллель конкретного локуса. Накопленный опыт работы с ДНК-фингерпринтами показывает, что первое допущение соблюдается достаточно хорошо: аллелизм (парность гомологичных генов, определяющих разные фенотипические признаки у диплоидных организмов) и генетическое сцепление между исследуемыми локусами наблюдаются редко. Невыполнение второго предположения не сказывается серьезно на результатах тестирования, поскольку выводы делаются без учета частоты встречаемости отдельного аллеля на основе совпадения структуры (фрагментов ДНК) многих локусов. Третий постулат является более спорным, однако его применение придает значениям индекса отцовства стабильность. С этими исходными условиями статистическая оценка ДНК-фингерпринтов множественных локусов основывается только на одном параметре: средней доле фрагментов ДНК (x), которые совпадают у людей без родственных связей. Такой параметр в большей степени зависит от техники лабораторных исследований, чем от свойств обследуемой популяции. Это прежде всего способность используемой системы к электрофоретическому разделению индивидуальных фрагментов ДНК (т.е. разрешающая способность используемого метода), принципы выбора конкретных фрагментов ДНК для анализа, а также критерии принятия решения об идентичности сравниваемых фрагментов ДНК. Следовательно, параметр x может варьировать при сравнении результатов, получаемых в разных лабораториях, но эти различия будут постоянно сохраняться для различных популяций и субпопуляций. Действительно, при использовании, например зондов 33.6 и 33.15, оказалось, что x один и тот же у неродственных индивидуумов, в парах муж–жена и в различных этнических группах. 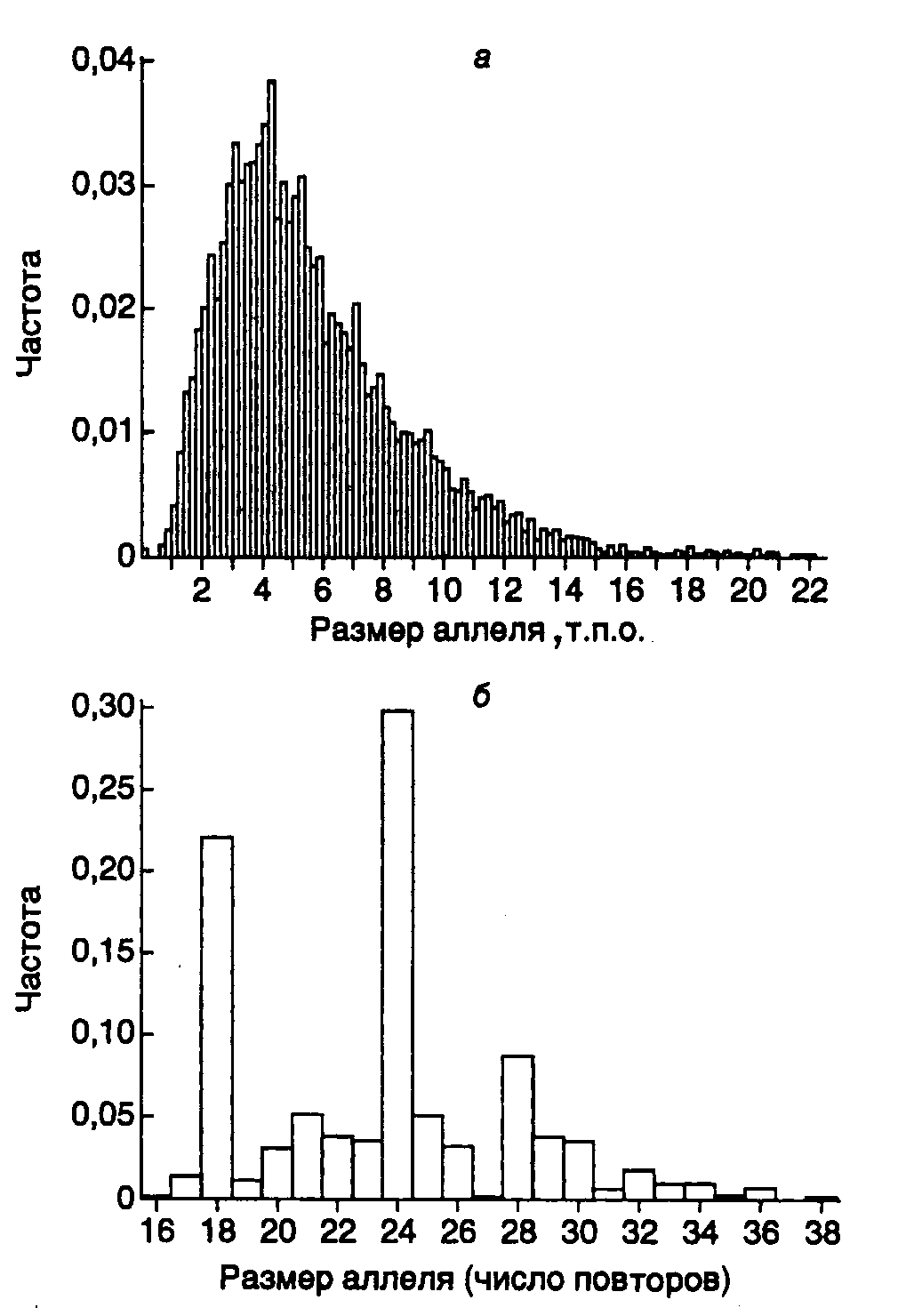 Рис. II.37. Сравнение информативности двух минисателлитных зондов при идентификации личности Частоты встречаемости минисателлитных локусов D1S7 (а) и D1S80 (б) определенного размера в популяции оценивали гибридизацией по Саузерну после расщепления ДНК рестриктазой HaeIII (а) или ПЦР (б). Для локуса D1S7 характерно квази-непрерывное унимодальное распределение, тогда как локус D1S80 характеризуется меньшей гетерозиготностью (84%) с небольшим числом дискретных аллелей, для которых характерно мультимодальное распределение Определение отцовства с использованием ДНК-зондов, специфичных в отношении только одного локуса. ДНК-фингерпринты, получаемые при одновременном исследовании многих локусов, отражают скорее фенотип индивидуума, чем его генотип. Действительно, получаемая в итоге картина заключает в себе множество полос ДНК, в том числе и неразделившиеся, а также слабо разделившиеся фракции. Такая электрофореграмма напоминает сложный фенотипический признак, например форму лица человека, которая является результатом экспрессии громадного числа генов. В отличие от этого с помощью ДНК-зондов, представляющих собой клонированные последовательности минисателлитов и взаимодействующих только с одним локусом, можно получать истинную информацию о генотипе изучаемого организма. Таким образом, имея дело с отдельными полиморфными локусами человека, исследователи получают в свои руки систему кодоминантных аллелей (т.е. аллелей, совместно участвующих в формировании фенотипических признаков), наследуемых по законам Менделя. Именно понимание наследования таких минисателлитных локусов и привело к широкому распространению однолокусного метода определения отцовства. В настоящее время получены сотни клонов минисателлитной ДНК и на их основе разработаны комбинации зондов, пригодные для определения отцовства. При выборе зондов для таких минисателлитных локусов обычно руководствуются следующими критериями: зонды должны обладать строгой локус-специфичностью, а тестируемые локусы быть несцепленными (передаваться потомству независимо друг от друга) и обладать достаточной, но не чрезмерной генетической стабильностью. В частности, среди наиболее широко используемых зондов MS1 (D1S7) соответствует генетическому локусу, гетерозиготному в 99% случаев, однако он мутирует с очень высокой частотой (0,05 на гамету) и поэтому, несмотря на высокую информативность, не используется при определении отцовства (рис. II.37,а). В то же время для локуса D1S80 со значительно меньшей вариабельностью (84% гетерозигот) характерно образование кластеров в частотах распределения фрагмента ДНК по длине (см. рис. II.37,б). Поэтому небольшие ошибки в определении длины аллелей могут привести к значительным ошибкам в оценке частоты их встречаемости. Такие локусы достаточно легко изменяются в результате генетического дрейфа и инбридинга. В настоящее время разработана теория, указывающая на то, сколько локусов должно быть типировано для получения правильного ответа об отцовстве при известных значениях гетерозиготности этих локусов в популяции. Например, если используются локусы, гетерозиготность которых составляет 90%, для установления отцовства необходимо проанализировать шесть таких локусов. В США в настоящее время для этих целей обычно используется набор из трех–пяти однолокусных зондов. Однолокусные зонды обладают низкой разрешающей способностью относительно братьев и сестер (сибсов). В частности, с помощью одного такого зонда можно лишь с вероятностью 75% обнаружить генетические различия между сибсами, и эта вероятность увеличивается до 99,6% при использовании четырех зондов. Данный факт приобретает особую важность, когда при определении отцовства необходимо сделать выбор между братьями. Особенности определения отцовства по отдельным локусам с использованием ПЦР. В качестве альтернативы однолокусным зондам в последнее время для определения отцовства часто используют ПЦР. Отдельные мини- и микросателлитные локусы могут быть амплифицированы с помощью праймеров, комплементарных уникальным последовательностям ДНК, фланкирующим эти повторяющиеся последовательности. При идентификации личности метод ПЦР, который по своей сути является одной из разновидностей однолокусной методики, поскольку имеет дело с отдельными локусами, обладает, по крайней мере, двумя преимуществами перед однолокусными зондами. Во-первых, популяционный полиморфизм длин ДНК аллелей, исследуемых с использованием этого метода, носит более дискретный характер, чем у аллелей, изучаемых с помощью однолокусных зондов (см. рис. II.37,а,б). Это обстоятельство облегчает последующее вычисление индекса отцовства. Во-вторых, метод ПЦР обладает гораздо большей чувствительностью и может быть использован при анализе образцов, содержащих <1 нг геномной ДНК и полученных из разных источников (см. раздел 11.1.1). К недостаткам ПЦР в применении к определению отцовства следует отнести низкую информативность полиморфных микросателлитов и коротких минисателлитов. Это связано с тем, что они обладают <90% гетерозиготности, небольшим числом аллелей и имеют тенденцию к образованию кластеров по размерам (см. рис. II.37,б). Кроме того, на распределение таких последовательностей в геноме оказывают влияние инбридинг и принадлежность индивидуумов к определенным этническим группам. Количество локусов минисателлитов, которое необходимо исследовать методом ПЦР для определения отцовства, приближается к 11, а микросателлитов – к 18. Для типирования с помощью ПЦР наиболее часто используются три минисателлитных локуса человека: в гене аполипопротеина B (APOB), D17S5 (известный также как локус D17S30) и D1S80. Все три локуса легко амплифицируются (максимальный размер их аллельных вариантов не превышает 1 т.п.о.) и легко обнаруживаются с помощью электрофореза. Однако для них характерны низкий уровень гетерозиготности и малая изменчивость (что выражается в небольшом числе известных аллелей). Мутации в этих микросателлитах возникают очень редко. Одним из путей повышения информативности полиморфизмов микросателлитов при ДНК-типировании является одновременная амплификация двух тесно сцепленных микросателлитных локусов, сочетания которых формируют множество гаплотипов. Например, одновременная амплификация двух GATA-повторов, локализованных в интроне 40 гена фактора фон Виллебранда, которые разделены последовательностью длиной в 212 п.о., обнаружила суммарный уровень гетерозиготности объединенного локуса 93%. При этом уровни гетерозиготности индивидуальных локусов составляли лишь 72 и 78% соответственно. В заключение необходимо еще раз отметить, что по своей логике современные методы определения отцовства, основанные на ДНК-типировании, несколько противоречивы. Если отрицательное заключение об отцовстве, основанное на несовпадении аллелей анализируемых мини- или микросателлитных локусов, абсолютно и не подлежит сомнению, то положительный вывод может быть сделан лишь с некоторой долей вероятности, которая основана на частоте встречаемости конкретных аллелей анализируемых локусов в популяции. С другой стороны, в результате методических ошибок легко могут быть сделаны ложноотрицательные выводы, однако положительное заключение об отцовстве в результате лабораторной методической ошибки практически исключено. Высокая информативность многолокусных ДНК-фингерпринтов подтверждена большим числом генетических и популяционных исследований. Эмпирические данные, полученные при обследовании тысяч семей, показали, что с помощью многолокусных зондов можно разрешать все спорные случаи отцовства. Использование однолокусных зондов затруднено невозможностью создания полной классификации соответствующих аллелей в популяции из-за кажущегося непрерывного распределения их по размерам. Однако и в этом случае на практике проблема полностью решается с помощью набора из пяти–шести однолокусных зондов. Применение ПЦР ограничивается большой эволюционной консервативностью амплифицируемых мини- и микросателлитных локусов и, как следствие, малым суммарным числом аллелей. Однако ПЦР бывает очень полезна на первых этапах исследования из-за методической простоты постановки опытов, особенно в условиях малой доступности исходного биологического материала. Все три группы методов хорошо дополняют друг друга и в разных сочетаниях в спорных случаях позволяют однозначно идентифицировать личность человека. 11.3.Микроматрицы и микрочипы ДНКОдним из интенсивно развивающихся направлений биотехнологии нуклеиновых кислот в последнее время становится использование микроматриц ДНК для анализа нуклеотидных последовательностей. В этой группе методов на небольшой по размеру поверхности стекла или другого твердого носителя иммобилизуют в виде правильно расположенных микропятен небольшие фрагменты ДНК с известной последовательностью нуклеотидов (чаще всего синтетические олигонуклеотиды или кДНК), которые далее используют для гибридизации с анализируемыми образцами нуклеиновых кислот. При совпадении первичной структуры ДНК микропятна и анализируемого образца на поверхности стекла образуются правильные ДНК–ДНК-гибриды, которые обнаруживаются по появлению в данных участках микроматрицы сигналов, например в виде микроскопической флуоресцирующей точки или по тушению флуоресценции исходно меченых последовательностей. Такие кусочки твердого носителя с нанесенными на них микроматрицами ДНК получили название микрочипов ДНК. 11.3.1.Методы создания микроматриц ДНК Рис. II.38. Комбинаторный синтез олигонуклеотидов, иммобилизованных на твердой подложке Последовательно предотвращая снятие защитных групп на определенных участках микроматриц (заливка серым цветом) удается соединять четыре нуклеотида во всех возможных комбинациях. В данном примере за 12 (4 х 3) стадий синтеза синтезированы все возможные (34 = 81) тримеры олигонуклеотидов Для нанесения нуклеиновых кислот на поверхность подложки в основном используют три подхода: короткие олигонуклеотиды синтезируют прямо на ее поверхности, а также прикрепляют к ней предварительно полученные фрагменты ДНК ковалентными или нековалентными связями. Во время синтеза олигонуклеотидов непосредственно на поверхности стекла применяют те же реагенты и проходят те же стадии, что и при обычном твердофазном синтезе в современных автоматических синтезаторах. В наиболее распространенном варианте при создании микроматрицы используют фотолитографическую маску, которая избирательно закрывает от света и оставляет открытыми участки микроматрицы с синтезируемыми олигонуклеотидами, содержащими чувствительные к облучению светом защитные химические группы. На каждом этапе синтеза маску, которая на схеме обозначена серыми прямоугольниками, помещают над большей частью микроматрицы, а остающиеся открытыми химические группы активируют светом. Затем происходит соединение 5’-гидроксильных групп фосфорамидитных производных добавляемого нуклеотида с активированным сегментом микроматрицы. Защищая поверхность микроматрицы от света дискретными участками в различных простых комбинациях, удается синтезировать, как это показано на схеме (рис. II.38), за 4·3 = 12 отдельных этапов все теоретически возможные последовательности тринуклеотидов в количестве 34 = 81. В общем случае для синтеза всех возможных последовательностей длиной в N нуклеотидов требуется 4N синтетических стадии. Длина цепи олигонуклеотида, который может быть синтезирован на микроматрице, лимитируется выходом готового продукта на каждой стадии, который составляет 95%. Так, суммарный выход 25-звенного олигонуклеотида будет составлять всего (0,95)25 = 28%. В этой связи рассмотренный метод обычно используют для синтеза олигонуклеотидов, длина которых не превышает 20–25 оснований. При альтернативном подходе микроматрицы олигонуклеотидов синтезируют на подложке с использованием технологии струйных принтеров. В этом случае головка принтера движется вдоль подложки и, в соответствии с заложенной программой, наносит на необходимые участки небольшие количества раствора с фосфорамидитными производными нуклеотидов из индивидуальных резервуаров. Этапы снятия защитных групп и промывания производятся так же, как и при обычном твердофазном синтезе олигонуклеотидов. Эффективность каждого этапа синтеза в этом случае может превышать 99%, что позволяет синтезировать олигонуклеотиды длиной до 40 оснований с суммарным выходом 67% (40 этапов с выходом 99% на этап). Еще одной разновидностью методов создания микроматриц является синтез индивидуальных олигонуклеотидов, их очистка и нанесение с помощью микроробота на поверхность подложки с адгезивным покрытием. Однако создание этим способом микроматриц, содержащих тысячи индивидуальных элементов, – очень трудоемкий процесс. При конструировании микроматриц, элементы которых содержат индивидуальные кДНК, для нанесения на подложку микропятен чаще всего используют микророботы. В этом случае применяют растворы рекомбинантных кДНК длиной 0,5–1,0 т.п.о., очищенных из бактериальных клеток, которые перед применением как правило, амплифицируют с помощью ПЦР. Поверхность стеклянной подложки покрывают тонким слоем полилизина или обрабатывают аминосиланом с целью создания на ней положительного заряда, что обеспечивает возможность электростатического взаимодействия подложки с отрицательно заряженными молекулами кДНК. Недостатком этого способа является неспецифичность электростатических взаимодействий, в которые вовлечены многие участки кДНК, что уменьшает эффективность взаимодействия кДНК с последовательностями анализируемых образцов. Для преодоления этих затруднений с помощью асимметричной ПЦР синтезируют производные кДНК, которые далее ковалентно соединяют с сиалированным стеклом с помощью боргидрида. Разрабатываются и альтернативные конфигурации микроматриц, в которых на поверхности стекла фиксируют сами фрагменты ДНК, анализируемой с помощью олигонуклеотидных зондов. Такой подход был использован, в частности для поиска мутаций в гене белка p53. Дальнейшим расширением этого подхода является нанесение на поверхность стекла кусочков тканей с последующим анализом содержащихся в них ДНК или РНК гибридизацией in situ. 11.3.2.Ограничения в использовании микроматриц ДНКПомимо самой достаточно сложной технологии производства микроматриц, к числу факторов, ограничивающих их широкое применение, относятся кинетические параметры гибридизации, а также точность и чувствительность обнаружения в гибридах ошибочно спаренных нуклеотидов. Кинетика гибридизации.Гибридизация в гетерогенных смесях нуклеиновых кислот происходит медленно. При использовании олигонуклеотидов в качестве зондов для ее завершения обычно требуется несколько часов, тогда как в случае зондов кДНК процесс продолжается в течение 6–24 ч при высокой температуре. Поиск зондом своей иммобилизованной мишени происходит двумя путями. Во-первых, может произойти прямая гибридизация непосредственно из раствора, эффективность которой в первом приближении не зависит от размера зонда. Во-вторых, зонд вначале может неспецифически связаться с поверхностью подложки, диссоциировать из комплекса и, диффундируя вдоль поверхности, достичь мишени. Скорость гибридизации по второму механизму резко возрастает, когда длина зонда становится меньше 1000 нуклеотидов. С учетом этого время, необходимое для гибридизации, может быть уменьшено путем укорачивания молекулы зонда, повышения его концентрации в гибридизационных смесях и сокращения расстояния, которое необходимо преодолеть зонду до мишени путем диффузии. Поскольку концентрация зондов в гибридизационных смесях ограничена их химическими свойствами, основным фактором, с помощью которого можно уменьшать время гибридизации и объем наносимого образца с зондом, становится плотность расположения пятен ДНК-мишеней (элементов) в микроматрицах. Размеры индивидуальных элементов микроматриц, получаемых современными фотолитографическими методами, лежат в пределах 5–10 мкм при общей их максимальной плотности на подложке 106/см2. Плотность элементов в обычно используемых микрочипах, полученных с помощью фотолитографии, составляет 104–105/см2. При использовании микророботов для нанесения кДНК на поверхность подложки плотность расположения элементов достигает лишь 103/см2. И в том, и в другом случае зондам для гибридизации необходимо диффундировать к мишени, находящейся в индивидуальном элементе микроматрицы, общие размеры которой как правило составляют 1 х 1 см. Поскольку время диффузии зонда пропорционально квадрату расстояния до мишени, общее время гибридизации можно понизить путем увеличения плотности расположения элементов на микрочипе. Кроме того, одним из подходов к уменьшению времени гибридизации является придание молекулам зондов направленности перемещения к мишеням в электрическом поле, когда микроматрицу располагают на электроде. Чувствительность метода. Чувствительность метода специфического обнаружения последовательностей ДНК с использованием технологии микроматриц определяется отношением количества зонда, связавшегося со специфической мишенью, к количеству неспецифически связавшегося зонда. Чем выше это отношение, тем больше чувствительность метода. Неспецифическое связывание зонда может происходить как с самой подложкой, так и с гомологичными зонду последовательностями нуклеотидов ДНК-мишени с образованием неправильно спаренных оснований. В последнем случае могут быть получены ложноположительные результаты. Поскольку площадь пятна специфической мишени значительно меньше доступной зонду поверхности микрочипа, при малых временах гибридизации количество неспецифически сорбированного зонда будет значительно превышать количество зонда, находящегося в правильных гибридах. Эту ситуацию улучшают путем увеличения времени гибридизации до достижения процессом стационарной фазы. В этой связи интерпретация картин гибридизации требует постановки адекватных контролей для оценки эффективности неспецифического связывания зонда поверхностью микрочипа. Кроме того, для количественной оценки гибридизации необходимо использовать количества зонда, не насыщающие мишени микрочипа во время отжига. Эффективность детекции флуоресценции как таковой является одним из самых сильных факторов, сдерживающих развитие технологии микрочипов ДНК. По мере уменьшения размеров элементов микроматриц все меньшее количество молекул ДНК-мишени становится доступным зонду. Современные методы позволяют обнаруживать ДНК-мишени в аттомолярных концентрациях (10-18 М) при плотности в одну молекулу ДНК на 1 мкм2. Для этой цели чаще всего используются системы, основанные на конфокальной сканирующей лазерной микроскопии. При определении альтернативных состояний гомологичных последовательностей ДНК-мишеней, в частности, аллельного (нормального или мутантного) состояния конкретного гена, применяют двухцветные системы. В таких системах один из зондов, например специфичный в отношении аллеля дикого типа, метят флуоресцентным красителем одного цвета (красным), а другой (мутантный) – флуорофором другого цвета (зеленым). Зонды одновременно гибридизуют с анализируемым микрочипом, который далее сканируется при обеих длинах волн, что позволяет обнаруживать тот или иной зонд, сохранившийся в гибриде, и на этом основании делать вывод об аллельном состоянии гена. 11.3.3.Использование микроматриц ДНК в фундаментальных и прикладных исследованияхОпределение первичной структуры и картирование ДНК являются основными направлениями использования микроматриц олигонуклеотидов в настоящее время. Прямое секвенирование генов с помощью олигонуклеотидных микрочипов сдерживается необходимостью применения мягких условий гибридизации, при которых происходит внутреннее спаривание нуклеотидов как в зондах, так и в анализируемых частях генов, что часто является причиной неправильной интерпретации получаемых данных. Тем не менее, на основании результатов гибридизации продуктов ПЦР-амплификации частей клонов геномных библиотек с микроматрицами олигонуклеотидов удается осуществлять достаточно эффективное упорядочивание клонов друг относительно друга. Продемонстрирована возможность осуществления биохимических манипуляций с ДНК, иммобилизованных на микрочипах, с использованием ДНК-полимераз и эндонуклеаз рестрикции. Такие воздействия применяют параллельно с гибридизацией для получения дополнительной информации об анализируемых ДНК. Исследование генетического полиморфизма ДНК. Более информативными оказываются результаты использования микроматриц ДНК для оценки генетического полиморфизма родственных геномов. Способность зондов гибридизоваться с ДНК микроматриц сильно изменяется при наличии даже единственного неспаренного нуклеотида в гибридах зонд–мишень. Это позволяет с высокой эффективностью осуществлять поиск полиморфизмов в сравниваемых геномах даже на уровне различий в отдельных нуклеотидах. Например, путем гибридизации геномной ДНК двух штаммов дрожжей с микроматрицами олигонуклеотидов удалось картировать на участке ДНК длиной в 57 т.п.о. полиморфные локусы, детерминирующие множественную лекарственную устойчивость. Детальное сравнение экзона 11 гена BRCA1 человека с гомологичными последовательностями семи других биологических видов позволило обнаружить отдельные полиморфные нуклеотиды с замечательной точностью (99,5–99,9%). Такого рода результаты дали возможность разработки на основе микроматриц ДНК нескольких ДНК-диагностикумов, с помощью которых обнаруживают полиморфизмы на уровне отдельных нуклеотидов в геноме вирусов, бактерий, дрожжей и высших эукариот. С применением этого подхода были идентифицированы мутации в геноме человека, ассоциированные с различными заболеваниями, включая рак молочной железы, муковисцидоз, -талассемию, а также диагностирована ВИЧ-инфекция. В недавно проведенном исследовании участка генома человека длиной в 2,3·106 п.о. было обнаружено 2000 полиморфизмов на уровне отдельных нуклеотидов, что позволяет представить себе масштабы генетической изменчивости в популяциях человека. Исследование экспрессии генов с использованием микроматриц ДНК. Технология микрочипов ДНК позволяет осуществлять одновременный мониторинг за экспрессией большого числа генов (expression profiling). С этой целью для генов с известными последовательностями нуклеотидов создается микроматрица сегментов кДНК длиной 0,5–1,0 т.п.о. Из анализируемых образцов (например опухоли и здоровой ткани) выделяют суммарную мРНК, которую с помощью обратной транскрипции превращают в кДНК, метят флуоресцентными красителями и используют для последующей конкурентной гибридизации с зондами, нанесенными на микроматрицу. Интенсивность флуоресценции отдельных элементов микроматрицы после образования гибридов позволяют качественно характеризовать различия в уровнях экспрессии конкретных генов в анализируемых образцах. Например, отсутствие конкуренции за образование гибридов со стороны кДНК нормальной ткани может говорить о транскрипции в опухоли новых генов, не экспрессирующихся в нормальных клетках. Такой подход успешно использовали для характеристики ответа клеток в культуре или in vivo по изменению уровней экспрессии генов на различные внешние стимулы, включая тепловой шок, воспалительные реакции и канцерогенные воздействия. Помимо известных генов в мониторинг иногда включают и случайные клоны кДНК, что позволяет идентифицировать новые гены, экспрессия которых ассоциирована с патологическими состояниями органов и тканей. С использованием микроматриц кДНК в современный анализ могут быть одновременно включены до 10000 экспрессирующихся генов. Микроматрицы олигонуклеотидов также применяют для определения профилей экспрессии генов. В этом случае для повышения эффективности мониторинга одновременно в разных элементах матрицы используют несколько олигонуклеотидов, комплементарных различным частям анализируемых кДНК. С помощью этого подхода недавно был определен профиль экспрессии 6800 генов в культивируемых клетках фибросаркомы в присутствии -интерферона. Функциональная геномика. Эффективное использование результатов мониторинга за экспрессией большого числа генов требует лучшего понимания функций анализируемых генов. Решением проблемы определения функций новых генов занимается раздел генетики, получивший название функциональной геномики. Лишь немногие заболевания возникают в результате повреждения отдельных конкретных генов. В большинстве случаев приходится говорить о предрасположенности к заболеванию в связи с наличием в геноме конкретной мутации. Сопоставление генетической информации, получаемой при использовании микроматриц ДНК, с результатами статистического анализа возникновения, протекания и исхода заболеваний может дать ключ к правильной интерпретации результатов генетического скрининга генома человека обсуждаемыми методами. Возможность одновременного наблюдения за изменением экспрессии очень большого числа генов в строго контролируемых условиях открывает новые перспективы функционального исследования генома как единого целого. В заключение можно сказать, что микроматрицы ДНК уже сегодня находят применение в фундаментальных исследованиях, промышленности и клинике в качестве инструментов анализа экспрессии большого числа генов, определения генетической предрасположенности организма к различным патологическим состояниям, скрининга новых фармакологических препаратов. Критическими моментами, препятствующими широкому распространению этих технологий, являются ограниченные чувствительность обнаружения гибридизационных сигналов и специфичность гибридизации, трудности в количественной оценке сигналов и обработке большого количества получаемых данных с целью их интерпретации, а также высокая стоимость микрочипов ДНК. Однако микроматрицы ДНК даже в современном виде успешно используются и будут применяться для решения многих задач биологии и медицины. |
