Решение Ni(OH) 2 2hno 3 Ni(no 3 ) 2 2H 2 o гидроксид никеля (ІІ) азотная кислота нитрат никеля (ІІ) вода
 Скачать 29.03 Kb. Скачать 29.03 Kb.
|
|
ВАРИАНТ №14 Составьте уравнения реакций между соответствующими кислотами и основаниями, приводящих к образованию следующих солей, дайте названия всем соединениям: Ni(NO3)2, NаНSiО3, Fe2(SO4)3. Решение: Ni(OH)2 + 2HNO3 = Ni(NO3)2 + 2H2O гидроксид никеля (ІІ) азотная кислота нитрат никеля (ІІ) вода NaOH + H2SiO3 = NaHSiO3 + H2O гидроксид натрия силикатная кислота гидросиликат натрия вода 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O гидроксид железа (ІІІ) серная кислота сульфат железа (ІІІ) вода Строение ядра атома. Как изменяются массовое число и заряд атома изотопа: а) при последовательном испускании α-частицы и двух β-частиц; б) при поглощении ядром двух протонов и испускании двух нейтронов; в) при поглощении одной α-частицы и выбрасывании двух дейтронов? Энергия ионизации атомов фтора и хлора составляет соответственно 17,4 и 13,0 эВ, а энергия сродства к электрону – 3,45 и 3,61 эВ. Для какого из этих элементов более характерно образование ионных соединений? Указать знак заряда ионов галогенов в этих соединениях/ В момент установления равновесия в системе N2(г) + 3Н2(г) 2NН3(г) равновесные концентрации азота, водорода и аммиака соответственно равны 2,5; 1,8 и 3,6 моль/дм3. Вычислите константу химического равновесия этой реакции (K) и начальные концентрации азота и водорода. Решение: Выражение константы равновесия данной газофазной реакции: 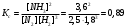 Согласно уравнению реакции, 2 моль аммиака образуются из 1 моль азота и 3 моль водорода, следовательно, 3,6 моль аммиака образуются из 1,8 моль азота и 5,4 моль водорода. Начальные концентрации азота и водорода: [N2]исх = [N2] + 1,8 = 2,5+1,8 = 4,3 моль/л [Н2]исх = [Н2] + 5,4 = 1,8+5,4 = 7,2 моль/л Ответ: Кс = 0,89; [N2]исх 4,3 моль/л; [Н2]исх 7,2 моль/л Сколько граммов азотной кислоты содержится в 200 см3 0,1 М раствора? Решение: Исходя из значения молярной концентрации кислоты определяем количество вещества кислоты в растворе: n(HNO3) = V(HNO3)C(HNO3) = 200 cм30,1М = 20 ммоль Маса такого количества кислоты: m(HNO3) = n(HNO3)M(HNO3) =20 ммоль63 г/моль = 1260 мг = 1,26 г Ответ: 1,26 г Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений: а) Na2S+H2SO4; б) FeS+HCl; в) HCOOK+HNO3; Решение: а) Na2S + H2SO4 = Na2SO4 + H2S 2Na+ + S2- + 2H+ + SO42- = 2Na+ + SO42- + H2S S2- + 2H+ = H2S б) FeS + 2HCl = FeCl2 + H2S FeS + 2H+ + 2Cl- = Fe2+ + 2Cl- + H2S FeS + 2H+ = Fe2+ + H2S в) HCOOK + HNO3 = KNO3 + HCOOH HCOO- + K+ + H+ + NO3- = K+ + NO3- + HCOOH HCOO- + H+ = HCOOH Какие из солей NaBr, Na2S, K2CO3, CoCl2 подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН имеют растворы этих солей. NaBr – соль сильного основания и слабой кислоты, гидролизу не подвергается, рН = 7. Na2S – соль сильного основания и слабой кислоты, поэтому гидролиз протекает по аниону. Первая стадия гидролиза: Na2S + H2O ⇄ NaOH + NaHS 2Na+ + S2- + H2O ⇄ Na+ + OH- + Na+ + HS- S2- + H2O ⇄ HS- + OH- Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор будет иметь щелочную среду (pH > 7). K2CO3 – соль сильного основания и слабой кислоты, поэтому гидролиз протекает по аниону. Первая стадия гидролиза: K2CO3 + H2O ⇄ KHCO3 + KOH 2K+ + CO32- + H2O ⇄ K+ + HCO3- + K+ + OH- CO32- + H2O ⇄ HCO3- + OH- Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор имеет щелочную среду (pH > 7). CoCl2 – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. Первая стадия гидролиза: CoCl2 + H2O ⇄ CoOHCl + HCl Co2+ + 2Cl- + H2O ⇄ CoOH+ + Cl- + H+ + Cl- Co2+ + H2O ⇄ CoOH+ + H+ Т.к. в результате гидролиза образовались ионы водорода (H+), то раствор будет иметь кислую среду (pH < 7). Исходя из степени окисления хлора в соединениях HCl, НClO3, НСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? Допишите уравнение реакции и подберите коэффициенты методом электронного баланса и ионно-электронного баланса (методом полуреакций): KBr + К2SО3 + H2SO4 Вr2 +. Решение: HCl проявляет только восстановительные свойства, т. к. в данном соединении хлор имеет минимальную степень окисления -1. HClO3 проявляет окислительные и восстановительные свойства, т. к. в данном соединении хлор имеет промежуточную степень окисления +5. HClO4 проявляет только окислительные свойства, т. к. в данном соединении хлор имеет максимальную степень окисления +7. KBr-1 + K2S+4O3 + H2SO4 Br20 + Составим окислительно-восстановительную реакцию методом электронного баланса. Для этого сначала нужно дописать продукты реакции. Т.к. бром восстановитель, сера в сульфите будет окислителем, восстанавливаясь до S2-. Получаем схему: KBr + K2SO3 + H2SO4 Br2 + K2S + H2O + K2SO4
6KBr + K2SO3 + 3H2SO4 = 3Br2 + K2S + 3H2O + 3K2SO4 Подберем продукты реакции и коэффициенты методом полуреакций: KBr-1 + K2S+4O3 + H2SO4 Br20 +
SO32- + 6H+ + 6Br - → S2- + 3H2O + 3Br20 6KBr + K2SO3 + 3H2SO4 = 3Br2 + K2S + 3H2O + 3K2SO4 Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении цельности покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях? Решение: Железное изделие покрыли свинцом – это покрытие катодное, т.к. свинец имеет больший (-0,13 В) потенциал, чем железо (-0,44 В), поэтому в гальваническом элементе свинец будет катодом, железо – анодом. При нарушении покрытия корродировать будет железо. Во влажном воздухе образуется гальванический элемент: (-) Fe H2O, O2 Pb (+) анод: Fe – 2e- = Fe2+ катод: 2H2O + O2 + 4e- = 4OH- 2Fe + 2H2O + O2 = 4Fe(OH)2 Продукт коррозии – гидроксид железа, который далее окисляется на воздухе: 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 Fe(OH)3 = FeOOH + H2O Во соляной кислоте образуется гальванический элемент: (-) Fe HCl Pb (+) анод: Fe – 2e- = Fe2+ катод: 2H+ + 2e- = H2 Fe + 2H+ = Fe2+ + H2 Fe + 2HCl = FeCl2 + H2 Продукты коррозии – хлорид железа (ІІ) и водород. Кислородсодержащие органические соединения. Спирты, альдегиды, кетоны, карбоновые кислоты – физические и химические свойства. Производные углеводородов, содержащие в своих молекулах кислород, называют кислородсодержащими органическими соединениями. Представителями кислородсодержащих органических соединений являются: спирты, альдегиды, кетоны, карбоновые кислоты и некоторые другие вещества. Спиртами называются производные углеводородов, в молекулах которых один или несколько атомов водорода замещены функциональными гидроксогруппами –OH. Альдегидами называются производные углеводородов, содержащие альдегидную функциональную группу –СОН. Кетонами называются производные углеводородов, содержащие карбонильную группу >С=О. Карбоновыми кислотами называются производные углеводородов, содержащие карбоксильную функциональную группу –CООН. Кроме того, большую группу составляют гетерофункциональные соединения, содержащие различные функциональные группы: гидроксиальдегиды HO–R–CHO, гидроксикетоны HO–R–CO–R', гидроксикислоты HO–R–COOH и т.п. Даже низшие спирты – метанол и этанол являются жидкостями при нормальных условиях, в то время как соответствующие углеводороды представляют собой газы. Низшие альдегиды, кетоны и кислоты также являются жидкостями за исключением метаналя, который кипит при –21 °С. Такое агрегатное состояние кислородсодержащих органических соединений объясняется наличием водородных связей между молекулами веществ, объединяющих эти молекулы в одно единое целое. Полярностью и образованием водородных связей обусловлена хорошая растворимость кислородсодержащих органических веществ в воде. Строение и, следовательно, свойства соединений кислорода определяются характером его химических связей и типом гибридизации, влияющей на форму молекулы. За счет двух одноэлектронных АО кислород способен к образованию двух ковалентных связей с другими атомами по обменному механизму. В этом случае кислород проявляет валентность 2 и имеет две неподеленные электронные пары. Такой атом кислорода может выступать донором пары электронов, образуя третью связь по донорно-акцепторному механизму. Электроотрицательности кислорода, водорода, углерода, соответственно, равны 3,5, 2,1 и 2,5. Поэтому связи кислорода с Н или С являются ковалентными полярными. Распределение электронной плотности на атомах молекулы определяет ее реакционную способность: полярный характер связей кислорода с водородом и углеродом способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. Спирты, альдегиды, кетоны и карбоновые кислоты являются весьма реакционноспособными соединениями. Они вступают во многие реакции присоединения, отщепления, замещения, конденсации, окисления-восстановления и др., проявляют более выраженные кислотные свойства. |
