|
|
Лекции биохимия 2. Резюме по модульной единице 4
7.5. Изменение активности ферментов
в зависимости от условий среды.
На каталитические свойства ферментных белков оказывают влияние многие химические и физические факторы, способные воздействовать на структуру активного центра, скорость образования и распада фермент- субстратного комплекса, состояние ионизации молекул субстрата и определенных группировок фермента: температура, рН и ионный состав среды, присутствие активаторов и ингибиторов, окислительно-восстановительный потенциал среды, концентрация субстрата и фермента, влияние внешнего электрического поля и др. Действие этих факторов оказывается возможным благодаря тому, что ферменты являются белками, которые довольно легко перестраивают пространственную структуру молекулы под влиянием условий внешней среды и, следовательно, проявляют высокую лабильность в изменении своих физико-химических свойств. При оценке влияния факторов внешней среды на каталитические свойства ферментов следует также учитывать, что в каждом конкретном случае определяется активность того набора изоферментов, которые определяют специфичность обмена веществ в исследуемом биологическом объекте.
Влияние температуры. Ферментативные реакции могут происходить в интервале температур от 0оС (точка замерзания воды) до 70-80оС (тепловая денатурация белков высших организмов). При повышении температуры увеличиваются скорости химических реакций, в том числе и скорость образования фермент–субстратных комплексов, поэтому активность ферментов возрастает, вследствие чего происходит интенсификация процессов жизнедеятельности растений.
Ускорение реакций под воздействием повышенной температуры обу-словлено тем, что снижается энергия активации как субстрата, так и фер-мента. В интервале температур 0-40оС повышение температуры на 10оС увеличивает скорость ферментативных реакций в 1,4 – 2 раза. Наиболее высокая активность ферментов наблюдается при температурах 40-50оС. При температурах свыше 50оС активность ферментов понижается, так как начинается процесс тепловой денатурации ферментных белков, вызывающий необратимое разрушение четвертичной, третичной и вторичной структур белковых молекул. Полная денатурация растительных белков в растворе, как указывалось ранее, происходит при температурах 70-80оС.
Однако в негидратированном (сухом) состоянии белки способны сохранять нативные свойства и при более высокой температуре, что используется в технологиях быстрого высушивания зерна и семян, без снижения их всхожести. Не происходит необратимой инактивации ферментов также и при замораживании растительных тканей. При понижении температуры ниже точки замерзания физиологической среды прекращается действие ферментов, однако при повышении температуры их каталитическая активность восстанавливается.
Влияние рН среды. Каждая молекулярная форма фермента (изофермент) проявляет каталитическую активность в узком интервале рН среды, в связи с тем, что от концентрации водородных ионов зависит состояние ионизации молекулы субстрата и активных группировок в активном центре ферментного белка, которое обеспечивает каталитическое действие фермента. Кроме того, концентрация ионов водорода влияет на конформацию активного центра. Поэтому даже небольшой сдвиг реакции среды от оптимального значения изменяет заряд кислотных и основных групп фермента и субстрата и конформацию активного центра фермента, вследствие чего резко понижается каталитическая активность ферментной молекулы. Однако ферменты в клетках растений представлены наборами изоферментов, каждый из которых проявляет каталитическую активность при разных значениях рН среды и в результате действия всего набора изоферментов обеспечивается ход катализируемой реакции в широком диапазоне изменения рН среды. Зависимость активности фермента от рН среды показана на рис. 22.
Влияние концентрации фермента и субстрата. Если в физиологической среде содержится много субстрата и мало ферментного белка, то скорость превращения субстрата в продукты реакции будет низкой, так как каждая молекула фермента способна катализировать превращение определенного количества субстрата в единицу времени. При увеличении числа ферментных молекул (т.е. концентрации фермента) в среде скорость ферментативной реакции будет возрастать до тех пор, пока достаточно субстрата для полной реализации молярной активности фермента. При дальнейшем увеличении концентрации фермента скорость реакции уже не возрастает. Следовательно, скорость ферментативной реакции пропорционально зависит от количества фермента в среде только при высокой концентрации субстрата.
Скорость реакции, катализируемой ферментом, также зависит от концентрации субстрата в физиологической среде при условии, когда количество фермента остается неизменным. Если в среде находится определенное количество фермента и в нее добавляется субстрат, то вначале скорость ферментативной реакции будет возрастать пропорционально увеличению концентрации субстрата. Однако в дальнейшем по мере увеличения концентрации субстрата темпы нарастания скорости реакции замедляются и при определенном количестве субстрата в среде скорость реакции достигает максимального уровня, при котором полностью реализуется молярная активность фермента (рис. 23). С этого момента скорость реакции уже не будет возрастать при увеличении количества субстрата в среде, так как лимитирующим фактором, определяющим дальнейший ход реакции, уже становится концентрация фермента.
Зависимость скорости ферментативной реакции (V) от концентрации субстрата может быть выражена уравнением:
[ S]
V = Vmax ×¾¾¾¾
Km +[S ]
В этом уравнении [S] - концентрация субстрата; Vmax – максимальная скорость реакции при высокой концентрации субстрата, когда в каждый момент времени все молекулы фермента находятся в соединении с субстратом (насыщение фермента субстратом). Кm – константа Михаэлиса, названная именем Л. Михаэлиса, который внес большой вклад в разработку теории ферментативной кинетики.
Константа Михаэлиса выражает сродство фермента к субстрату и является важной характеристикой ферментного белка. Чем меньше константа Михаэлиса, тем выше молярная активность фермента и тем интенсивней происходит ферментативный катализ. Из приведенного выше уравнения можно определить значение константы Михаэлиса:
Vmax Vmax
Km = [S] ( ¾¾ – 1); при V = ¾¾ Km = [S]
V 2
Следовательно константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции, катализируемой ферментом, достигает половину от максимальной.
Для определения константы Михаэлиса экспериментальным путем с использованием чистого фермента находят скорость катализируемой реакции при разных значениях концентрации субстрата, включая максимальную скорость реакции. Затем изменение скорости ферментативной реакции в зависимости от концентрации субстрата выражают в виде графика, как показано на рис. 23. Если на этом графике отметить скорость, равную половине от максимальной, и опустить перпендикуляр на ось абсцисс, то он укажет концентрацию субстрата, численно равную константе Михаэлиса.
Активаторы ферментов. Для поддержания молекулы фермента в активном состоянии необходимо наличие в среде определенных ионов и некоторых других соединений, называемых активаторами ферментов. Роль активаторов заключается в том, что они способны переводить в активное состояние определенные группировки в каталитическом центре молекулы фермента и таким образом участвовать в каталитическом действии ферментного белка. Так, например, протеолитические ферменты, катализирующие гидролитическое расщепление белков, активируются HCN, H2S, а также веществами, содержащими сульфгидрильные группы (восстановленный глютатион, цистеин).
Многие активаторы выполняют роль дополнительного субстрата, который взаимодействуя с истинным субстратом, переводит его в активное состояние и тем самым ускоряет образование фермент-субстратного комплекса. Примером такого взаимодействия могут служить ферментативные реакции с участием АТФ и ионов магния, в которых основной субстрат АТФ переводится в активное состояние путем образования комплекса с катионом магния (Мg АТФ2–, см. стр. 199).
На каталитическую активность ферментов оказывает влияние ионный состав среды, способствующий формированию молекулами фермента и субстрата специфической пространственной структуры, которая позволяет этим молекулам активно взаимодействовать, в результате увеличивается скорость образования фермент-субстратного комплекса и в целом происходит ускорение ферментативной реакции.
Многие ферменты активируются в присутствии ионов металлов. Так, катионы магния (Mg2+) являются активаторами фермента фосфопируватгидратазы, катализирующей отщепление молекулы воды от 2-фосфогли-цериновой кислоты в процессе дыхания, а также ферментов, катализирующих реакции фосфорилирования, в которых происходит перенос остатков ортофосфорной кислоты от АТФ на различные субстраты. Катионы кальция (Са2+) активируют растительные липазы, катализирующие гидролиз ацилглицеринов, и a-амилазы, ускоряющие распад крахмала. Катионы калия (К+) активируют многие ферменты углеводного обмена. Фермент аргиназа, катализирующий гидролитическое расщепление аргинина на цитруллин и мочевину, повышает свою активность в присутствии катионов Со2+, Мn2+, Ni2+.
Известны также ферменты, активность которых повышается в присутствии неорганических анионов: Cl‾, Br‾, I‾, H2PO4‾, НСО3‾ и др. Так, активаторами амилаз, катализирующих гидролиз крахмала, являются ионы галогенов.
При изучении влияния активаторов на активность ферментов было выяснено, что максимальная каталитическая активность ферментных молекул наблюдается при определенной концентрации активатора, при ее уменьшении или увеличении по сравнению с оптимальным уровнем каталитические свойства фермента ослабляются.
Таким образом, для проявления максимальной активности ферментов необходимо наличие в физиологической среде, в которой функционирует фермент, определенного набора специфических активаторов, содержащихся в оптимальной концентрации.
Ингибиторы ферментов. Это вещества, которые подавляют действие ферментов. Под влиянием ингибитора скорость ферментативной реакции замедляется или ферментативное превращение полностью прекращается. Процесс воздействия ингибитора на ферментные белки называют ингибированием ферментов. Различают обратимое и необратимое ингибирование и соответственно ингибиторы обратимого и необратимого действия.
При обратимом ингибировании не происходит безвозвратной потери каталитической активности фермента, так как ингибитор не разрушает пространственной структуры ферментного белка и после отделения ингибитора от фермента активность последнего восстанавливается. Различают два вида ингибиторов, вызывающих обратимое ингибирование, -конкурентные и неконкурентные ингибиторы.
Конкурентные ингибиторы – вещества структурно родственные субстрату, вследствие чего они, как и молекулы субстрата, способны связываться с одним из участков в активном центре фермента, но при этом не могут подвергаться превращению под действием фермента. Молекулы фермента, связанные с ингибитором, не могут катализировать превращение субстрата, поэтому скорость ферментативной реакции замедляется. Чем выше концентрация ингибитора, тем больше молекул фермента в каждый момент времени связаны с ингибитором и тем сильнее происходит ингибирование. Поскольку субстрат и ингибитор – структурные аналоги, то в ходе реакций между ними происходит конкуренция за связывание с активным центром фермента, поэтому степень игибирования ферментативного превращения зависит от соотношения концентраций субстрата и ингибитора. Если концентрация субстрата во много раз превышает концентрацию ингибитора, то в каждый момент времени лишь небольшое число молекул фермента связано с ингибитором и действие ингибитора почти не проявляется.
Следует отметить, что конкурентные ингибиторы не являются полными структурными аналогами субстрата, так как для связывания с ферментным белком ингибитору вполне достаточно, если он будет структурно совместим хотя бы с одним из участков связывания субстрата в активном центре фермента, а другая часть молекулы ингибитора может существенно отличаться от молекулы субстрата.
Хорошо изученный пример конкурентного ингибирования – действие малоновой кислоты на фермент сукцинатдегидрогеназу, катализирующий отщепление водорода от янтарной кислоты в цикле ди- и трикарбоновых кислот:
СООН
СН2СООН сукцинатдегидрогеназа СНСООН ½
½ ¾¾¾¾¾¾¾¾¾® || СН2
СН2СООН СНСООН ½
СООН
янтарная кислота фумаровая кислота малоновая кислота
Малоновая кислота – структурный аналог субстрата - янтарной кислоты, поэтому способна связываться вместо субстрата с активным центром сукцинатдегидрогеназы, но подвергаться окислению с образованием фумаровой кислоты малоновая кислота не может, вследствие чего молекулы фермента, связанные с малоновой кислотой, не участвуют в каталитическом действии и скорость превращения янтарной кислоты в фумаровую понижается. Однако если в реакционную среду добавить большое количество субстрата, то есть янтарной кислоты, то ингибирование фермента прекращается.
Фермент рибулозодифосфаткарбоксилаза, катализирующий присоединение СО2 к первичному акцептору в цикле Кальвина (см. стр…), подвергается конкурентному ингибированию повышенной концентрацией О2. Кислород представляет собой структурный аналог СО2, поэтому может связываться с активным центром рибулозодифосфаткарбоксилазы и действует в этом случае как конкурентный ингибитор.
На основе конкурентного ингибирования производится подбор и синтез многих лекарственных препаратов, действие которых направлено на подавление активности ферментов инфекционной микрофлоры. Использование химических препаратов в качестве ингибиторов ферментных систем возбудителей различных заболеваний получило название химиотерапии. Для химиотерапии подбирают такие конкурентные ингибиторы, которые по структуре наиболее полно соответствуют участкам связывания субстрата в активном центре ферментов и поэтому обладают очень сильным ингибиторным действием.
Неконкурентные ингибиторы не имеют структурной аналогии с субстратами и поэтому взаимодействуют не с участком связывания субстрата в активном центре фермента, а с другим участком ферментной молекулы, вызывая инактивацию каталитического центра. При этом ингибитор не вступает в конкурентное взаимодействие с субстратом и не препятствует связыванию субстрата в активном центре фермента, однако молекула субстрата не подвергается превращению, так как под влиянием ингибитора становятся неактивными группировки фермента, которые активируют субстрат. Поскольку при неконкурентном ингибировании субстрат и ингибитор связываются с разными участками молекулы фермента, действие такого ингибитора не ослабляется при увеличении концентрации субстрата в физиологической среде.
По механизму неконкурентного ингибирования действуют цианиды, которые подавляют активность ферментов, содержащих атомы Fe или Cu (цитохромоксидазы, фенолоксидазы и др.). Ингибитор, содержащий цианидные группировки (CN‾), образует комплексное соединение с металлом, входящим в состав фермента, в результате чего атом металла становится не способным участвовать в каталитическом действии фермента и скорость ферментативной реакции понижается. А в состоянии насыщения фермента ингибитором она практически полностью прекращается. При удалении цианида из реакционной среды каталитическая активность фермента восстанавливается. Неконкурентное ингибирование могут вызывать также катионы водорода, которые вследствие малых размеров не препятствуют связыванию субстрата, но при соединении с некоторыми группировками в активном центре фермента изменяют их электрический заряд и тем самым инактивируют каталитический центр.
В процессе необратимого ингибирования молекула ингибитора образует прочную ковалентную связь с одной из группировок в активном центре фермента, в результате чего становится невозможным его каталитическое действие. В связи с тем, что образовавшееся соединение ингибитора с ферментом не разрушается и не диссоциирует в условиях физиологической среды, в которой функционирует фермент, то каталитическая активность фермента подавляется необратимо.
Многие ингибиторы, вызывающие необратимое ингибирование, обладают строго избирательным действием, так как способны взаимодействовать только с определенными группировками в активном центре фермента. Так, например, многие галогенопроизводные органических веществ являются специфическими ингибиторами ферментов, содержащих в актив-ном центре сульфгидрильные группы (HS – группы). Взаимодействие таких ингибиторов с молекулой фермента происходит по следующей схеме:
Фермент–SH + X–R ¾® фермент–S–R + HX,
где Х – атомы галогенов (Cl, I, Br, F).
Фосфорорганические соединения необратимо ингибируют ферменты, имеющие в активном центре гидроксильные группы аминокислоты серина. Взаимодействие одного из таких ингибиторов диизопропилфторфосфата с ферментом можно представить в виде следующей реакции:
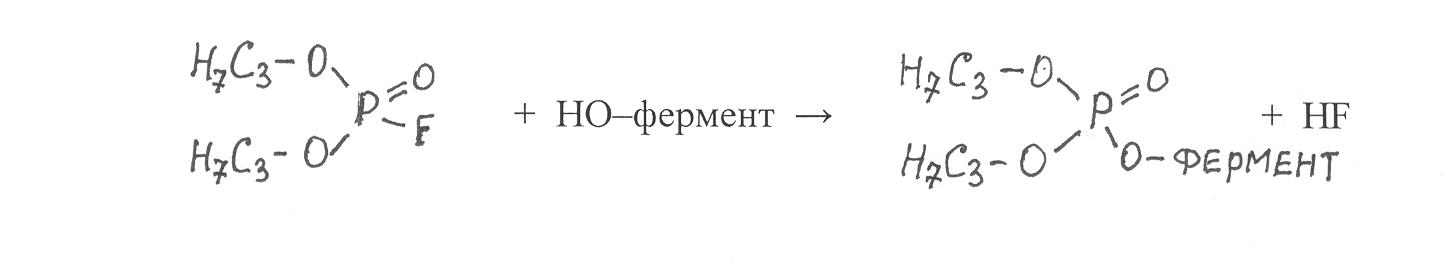
В результате присоединения к молекуле фермента фосфорорганического радикала происходит блокирование активного центра фермента и очень сильное подавление его каталитической активности.
Фосфорорганические ингибиторы – сильные яды, необратимо ингибирующие ферменты, которые катализируют гидролиз сложных эфиров холина (холинэстеразы), а также белков (сериновые протеиназы). Одним из ферментов, чувствительных к указанным ингибиторам, является ацетилхолинэстераза, которая катализирует гидролиз ацетилхолина, образующегося в клетках нервных тканей при передаче нервных импульсов. В результате блокирования активного центра ацетилхолинэстеразы фосфорорганическим ингибитором прекращается гидролиз ацетилхолина и он накапливается в нервных клетках, нарушая передачу нервных импульсов, что вызывает паралич и смерть организма. Такие ингибиторы используют в сельском хозяйстве в качестве инсектицидов нервно-паралитического действия.
Все ферменты необратимо ингибируются катионами тяжелых металлов (Hg2+, Pb2+, Ag+, и мышьяка As+), а также галогенопроизводными уксусной кислоты (трихлоруксусная, иодуксусная кислоты и др.), которые при соединении с сульфгидрильными группами (-SH) ферментного белка образуют нерастворимые соединения. Следует отметить, что все факторы, вызывающие денатурацию белков, неспецифически подавляют действие любого фермента, так как основу его составляет молекула белка.
В семенах, клубнях, листьях и других органах растений выявлены специфические белки с молекулярными массами от 5000 до 60000, которые образуют с ферментами неактивные комплексы, в результате чего происходит ингибирование ферментативных реакций. Такие белки называют белковыми ингибиторами ферментов. В зависимости от особеннос-тей взаимодействия с ферментами различают белковые ингибиторы эндогенного и экзогенного действия.
Белковые ингибиторы эндогенные действия образуют неактивные комплексы с ферментами собственного организма и таким образом участвуют в регулировании определенных биохимических процессов в тканях и органах растений. Так, например, в процессе созревания зерновок злаковых растений в них усиливается синтез белковых ингибиторов амилаз и протеаз, катализирующих соответственно гидролиз крахмала и запасных белков, вследствие чего к концу созревания зерновок большая часть указанных ферментов связывается с белками – ингибиторами. Благодаря такому действию ингибиторов происходит накопление в зерне крахмала и запасных белков.
Белковые ингибиторы экзогенного действия подавляют каталитическую активность ферментов чужеродного организма. Выяснено, что некоторые растительные белки образуют неактивные комплексы с пищеварительными ферментами насекомых, животных и птиц, вызывая задержку их роста. К таким ингибиторам относятся некоторые альбумины, содержащиеся в зерновках злаковых и семенах бобовых растений. Они специфически подавляют активность a-амилаз, трипсина и химотрипсина. А белок зерна пшеницы пуротионин обладает бактерицидным и фунгицидным действием.
7. 6. Локализация ферментов.
В клетках растений одновременно протекают несколько тысяч биохимических превращений, каждое из которых катализируется одним и даже несколькими ферментами. При этом вещество, образующееся с участием одного фермента, служит субстратом для другого, а синтезированный продукт вновь подвергается действию третьего фермента и т.д. В результате формируется довольно сложная система взаимосвязанных биохимических превращений, в которой ферменты подвержены определенной структурной и пространственной организации, обеспечивающей согласованное осуществление реакций в соответствии с реализуемой генетической программой развития данного органа или клетки. При этом различают три типа мультиферментных систем (рис. 25).
К первому типу относятся ферментные системы, включающие не связанные друг с другом молекулы ферментов, которые находятся в растворенном состоянии в жидкой фазе клетки и катализируют главным образом одноэтапные биохимические реакции. В этом случае субстраты и образующиеся из них продукты реакций представляют собой низкомолекулярные вещества, имеющие высокие скорости диффузии, поэтому они относительно легко перемещаются от одной молекулы фермента к другой и т. д., обеспечивая достаточно быстрое превращение внутриклеточных метаболитов.
Второй тип мультиферментных систем объединяет набор ферментов, катализирующих серию последовательных биохимических реакций и образующих высокомолекулярный комплекс, растворимый в жидкой фазе клетки. Каждый из ферментов в составе этого комплекса катализирует определенный этап превращений в ходе синтеза конечного биохимического продукта, а образующиеся промежуточные соединения подвергаются действию ферментов, не выходя из ферментного комплекса. В ходе многоэтапного превращения продукт реакции, катализируемой первым ферментом, связывается с белком – переносчиком и последовательно подвергается изменениям под действием всех ферментов данного мультиферментного комплекса. Примерами таких мультиферментных систем могут служить комплексы ферментов, катализирующих окислительное декарбоксилирование пировиноградной и a-кетоглутаровой кислот или синтез жирных кислот.
Третий тип - это мультиферментные системы, связанные с мембранами внутриклеточных структур. Отдельные ферменты этой системы являются структурными элементами клеточной мембраны и, занимая в ней упорядоченное положение, они могут катализировать последовательные биохимические превращения, происходящие на поверхности мембран, или участвовать в процессах трансмембранного переноса веществ и ионов. К такого типа системам относятся ферментные системы, связанные с мембранами метохондрий и хлоропластов и катализирующие соответственно процессы окислительного и фотосинтетического фосфорилирования.
Как видно из характера построения, ферментные системы третьего типа строго локализованы, так как связаны с мембранами различных клеточных структур. Однако в ходе исследований установлено, что ферменты, образующие системы первого и второго типа, также локализованы в клетке, так как находятся в межмембранных отсеках (компартментах) эндоплазматического ретикула или внутриклеточных органелл, в вакуолях, микротельцах, лизосомах. Поступление субстратов в указанные компартменты и выход из них продуктов реакций происходит через мембраны, проницаемость которых регулируется гормонами и рецепторными белками. Сами же ферменты, являясь крупными белковыми молекулами, не могут диффундировать через мембраны, поэтому их действие строго ограничено пространством конкретного компартмента.
7.7. Регуляция ферментативных реакций
Одновременно в каждой растительной клетке и во всем организме в целом происходят многие тысячи биохимических реакций, которые осуществляются строго согласованно в соответствии с генетической программой развития организма и функционированием механизмов адаптации растений к изменениям условий окружающей среды. При этом растения и другие высшие организмы представляют собой очень хорошо сбалансированные и эффективно действующие саморегулирующиеся системы. Это оказывается возможным благодаря тому, что в любых живых организмах имеются системы регуляции биохимических процессов, связанные прежде всего с воздействием на синтез и каталитическую активность ферментов.
В зависимости от особенностей синтеза все ферменты подразделяют на 2 группы – конститутивные и индуцируемые. Конститутивные ферменты постоянно синтезируются в клетках организма независимо от их состояния и условий окружающей среды. Они катализируют жизненно важные и постоянно протекающие в организме биохимические реакции, например, реакции дыхания. Однако синтез многих других ферментов почти все время подавлен специфическими белками-репрессорами. Но действие белка репрессора, ингибирующего синтез фермента, прекращается при появлении в клетке определенного вещества, превращение которого катализирует данный фермент, или под воздействием какого-либо другого фактора, способного понижать ингибиторную активность белка- репрессора, при этом инициируется синтез белка – фермента, образующиеся при этом ферментные белки получили название индуцируемых ферментов.
Регуляция скорости реакций, катализируемых конститутивными ферментами, осуществляется с помощью аллостерических активаторов и ингибиторов, называемых аллостерическими эффекторами. Они способны связываться с определенным участком молекулы фермента, который пространственно удалён от каталитического центра, при этом происходит изменение конформации ферментного белка, вызывающее усиление или ослабление его каталитических свойств. Участок связывания аллостетического эффектора называют аллостетичеким центром фермента, а сами ферментные белки, имеющие аллостерический центр, получили название аллостерических ферментов. Связывание эффектора с аллостерическим центром фермента происходит на основе такой же специфической реакции, как и связывание субстрата с каталитическим центром ферментного белка.
Аллостерические ферменты чаще всего представляют собой олигомерные белки, в каждой субъединице которых имеются центры связывания для субстрата, ингибитора и активатора. Такой белок может находиться в двух конформациях, между которыми существует подвижное равновесие. В одной из них он связывает молекулы активатора, которые вызывают перестройку пространственной структуры ферментного белка и оптимизацию структуры каталитического центра (рис. 26). В другой конформации субъединицы аллостерического фермента связывают молекулы ингибитора, под действием которого ферментный белок переходит в неактивное состояние.
Общее число молекул фермента, находящихся в каталитически активной конформации, зависит от соотношения концентраций активатора, ингибитора и субстрата. При достаточно высокой концентрации ингибитора аллостерический фермент находится преимущественно в каталитически неактивной конформации и скорость ферментативной реакции очень сильно замедляется. А если в физиологической среде создаётся высокая концентрация активатора, то аллостерический фермент переходит в каталитически активную конформацию, обеспечивая ускорение катализируемой реакции. Роль активаторов и ингибиторов аллостерических ферментов выполняют биохимические метаболиты, образующиеся в ходе жизнедеятельности организма.
Так, например, связывание СО2 с рибулозо-1,5-дифосфатом в ходе фотосинтеза катализирует аллостеричесий фермент рибулозодифосфаткарбоксилаза (см. гл. «Фотосинтез»). Аллостерическим активатором этого фермента служит фруктозо-6-фосфат, образующийся в процессе превращения и взаимодействия продуктов данной реакции, тогда как другой продукт реакций фотосинтеза фруктозо-1,6-дифосфат действует как аллостерический ингибитор фермента рибулозодифосфаткарбоксилазы. Если в хлоропластах в результате каких-либо нарушений прекращается превращение фруктозо-1,6-дифосфата во фруктозо-6-фосфат, то происходит накопление этого продукта и он аллостерически подавляет действие фермента рибулозодифосфаткарбоксилазы, вследствие чего скорость включения СО2 в углеводные продукты фотосинтеза резко замедляется.
Активность дыхательного фермента фосфофруктокиназы, катализирующего фосфорилирование от АТФ фруктозо-6-фосфата с образованием фруктозо-1,6-дифосфата аллостерически активируется АДФ и ингибируется повышенной концентрацией АТФ. В процессе дыхательных реакций происходит окисление углеводов и др. органических веществ и образование биоэнергетических продуктов, в том числе АТФ. Если в ходе биосинтетических реакций АТФ подвергается гидролизу с образованием АДФ, то вследствие повышения концентрации АДФ аллостерически активируется фермент фосфофруктокиназа, под действием которого происходит активное включение в реакции дыхания фруктозо-6-фосфата, что через последующие этапы превращений приводит к образованию АТФ и таким образом концентрация этого биоэнергетического продукта поддерживается на определенном уровне. Если же потребление АТФ уменьшается и создается его высокая концентрация, то он начинает действовать как аллостерический ингибитор фермента фосфофруктокиназы, вследствие чего понижается скорость включения в реакции дыхания фруктозо-6-фосфата, что в свою очередь в целом понижает скорость дыхательных реакций и сопряженных с ними реакций синтеза АТФ.
У целого ряда аллостерических ферментов центры связывания активатора и ингибитора находятся в специальной субъединице ферментного белка, получившей название регуляторной субъединицы. Присоединяя к аллостерическому центру активатор или ингибитор, регуляторная субъединица претерпевает соответствующее конформационное изменение, вызывая перестройку пространственной структуры всей молекулы фермента, в том числе и тех субъединиц, в которых находятся каталитические центры.
Аллостерической регуляции, как правило, подвержены так называемые ключевые ферменты, которые катализируют лимитирующие стадии биохимических превращений, в ходе которых происходит сильное уменьшение свободной энергии. Ферменты, катализирующие другие этапы в данной цепи превращений, чаще всего не обладают аллостерическими свойствами, поэтому их действие в основном определяется концентрациями субстратов и образующихся продуктов. Почти всегда к лимитирующим стадиям, которые катализируют аллостерические ферменты, относятся первые реакции в цепях последовательных биохимических превращений и реакции, приводящие к ветвлению метаболических путей.
Наиболее распространены два вида аллостерических механизмов регуляции: ингибирование по типу отрицательной обратной связи и активация предшественником. Ингибирование по типу отрицательной обратной связи происходит в том случае, когда наблюдается накопление конечного продукта в цепи последовательных биохимических превращений, что может вызвать нарушение обмена веществ. Этот метаболит действует как аллостерический ингибитор, понижая активность ферментов, катализирующих лимитирующие стадии данного метаболического пути и в первую очередь фермента, который катализирует начальный этап превращений. По указанному механизму в рассмотренных ранее примерах аллостерически подавляется активность фермента фотосинтеза рибулозодифосфаткарбоксилазы при накоплении фруктозо-1,6-дифосфата или дыхательного фермента фосфофрукто-зокиназы высокой концентрацией АТФ. Причем необходимо отметить, что при высокой концентрации АТФ происходит одновременное аллостерическое ингибирование многих дыхательных ферментов (см. гл. «Дыхание»).
В ряде других реакций осуществляется регуляция опережающего типа (активация предшественником), когда образовавшийся метаболит аллостерически активирует фермент, катализирующий его превращение, или другой фермент в цепи последующих превращений. Так, например, осуществляется аллостерическая активация 3-фосфоглицериновой кислотой, возникающей в процессе фотосинтеза, фермента, катализирующего образование АДФ-глюкозы, необходимой для синтеза крахмала. Лимонная кислота, которая образуется в первой реакции цикла Кребса, действует как аллостерический активатор фермента изоцитратдегидрогеназы, катализирующей один из последующих этапов превращения лимонной кислоты. В настоящее время известно довольно много примеров опережающей аллостерической активации ферментов метаболическими предшественниками.
Биохимические продукты, образующиеся в ходе реакций одного метаболического пути, могут участвовать в аллостерической регуляции ферментов другого метаболического пути и благодаря этому формируется довольно сложная и хорошо сбалансированная система регуляции всех биохимических превращений, из которых складывается в целом обмен веществ организма. В результате существования такой перекрестной системы регуляции оказывается возможным переключение биохимических превращений с одного метаболического пути на другой. Так установлено, что продукт пентозофосфатного пути окисления глюкозо-6-фосфата 6-фос-фоглюконовая кислота аллостерически ингибирует фермент анаэробной стадии дыхания фосфофруктокиназу и, таким образом, переводит дыхательные реакции на пентозофосфатный путь окисления углеводов.
При рассмотрении схем регуляции ферментативных реакций следует отметить очень важную особенность. Если фермент представлен в организме набором изоферментов, то активность каждого изофермента регулируется разными метаболитами, что делает систему аллостерической регуляции метаболических реакций более лабильной и эффективной.
На рис. 27 показана схема возможной аллостерической регуляции синтеза двух биохимичеких продуктов из одного метаболического предшественника (А). Если по какой-либо причине увеличивается концентрация продукта Р1, то он аллостерически ингибирует фермент Фсд и действует как аллостерический активатор на фермент Фск, переводя таким образом метаболические реакции на синтез продукта Р2. Если же продукт Р2 также будет накапливаться, то он аллостерически игибирует фермент Фск, а образующийся продукт С уже действует как аллостерический ингибитор фермента ФАВ, катализирующего начальную стадию превращений. В цепи превращений С→ Р1 продукт Д алостерически активирует действие фермента ФEF, обеспечивая сдвиг равновесия в реакции ДD Е для образования продукта Е.
На примере рассмотренной схемы аллостерической активации показано лишь одно из звеньев довольно сложной общей системы метаболических взаимодействий в организме, включающей элементы множественной регуляции, когда один и тот же метаболит может аллостерически воздействовать на целую группу ферментов, катализирующих биохимические превращения в разных метаболических путях, объединяя их в единую регуляторную систему.
Быстрый перевод фермента в активную или неактивную форму может происходить также путем ковалентной модификации его молекул в результате присоединения фосфатных групп или нуклеотидных радикалов. В свою очередь ферменты, катализирующие ковалентную модификацию, регулируются по аллостерическому механизму.
Регуляция активности индуцируемых ферментов осуществляется как в процессе их синтеза, так и с участием аллостерических механизмов. Синтез ферментов, как и других белков, представляет собой довольно сложный биохимический процесс, который включает синтез рибосомной, транспортной и матричной РНК, называемый транскрипцией.
С участием рибосомной РНК происходит образование рибосом, которые при взаимодействии с матричной и транспортной РНК осуществляют синтез ферментных и других белков. Этот процесс называют трансляцией (см. гл. «Нуклеиновые кислоты»). Установлено, что у высших организмов регуляция синтеза ферментов может происходить как в процессе транскрипции, так и в процессе трансляции. Однако значительно лучше изучен механизм регуляции синтеза ферментов на уровне транскрипции. Принципиальная схема такого процесса представлена на рис. 28.
Основной регулируемый этап на этой схеме – это синтез матричной РНК (mРНК), катализируемый ферментом РНК-полимеразой. РНК-полимераза в результате специфического взаимодействия связывается с определенным участком молекулы ДНК – промотором, после чего фермент способен катализировать синтез mРНК. Однако действие РНК-полимеразы блокирует белок-репрессор, который имеет сильное химическое сродство к ДНК и прочно связывается с ней в акцепторной зоне, выключая таким образом процесс транскрипции (т.е. синтез mРНК).
Белок-репрессор относится к аллостерическим белкам. Аллостерическими эффекторами, воздействующими на белки-репрессоры в системе синтеза ферментов, являются или сами субстраты, которые должны превращаться с участием синтезируемых ферментов, или вещества, активируемые субстратами. И в том, и в другом случаях при поступлении в организм соответствующих субстратов происходит аллостерическая перестройка структуры белка-репрессора, вследствие чего уменьшается сродство этого белка к акцепторной зоне ДНК и он уже не препятствует действию фермента РНК-полимеразы, катализирующей синтез mРНК. И далее уже с участием mРНК синтезируются молекулы ферментного белка, который необходим для превращения поступившего субстрата. После того как произойдет полное превращение субстрата, его воздействие на белок-репрессор прекращается, вследствие чего восстанавливается сродство этого белка к ДНК и синтез mРНК снова блокируется.
Очень хорошо регуляция синтеза ферментов изучена у бактерий. У растений также известны индуцируемые ферменты, к ним относятся a-амилаза семян, нитратредуктаза и многие другие ферменты азотного обмена, некоторые протеолитические ферменты.
В ходе жизнедеятельности организмов синтез некоторых ферментов может ингибироваться конечными продуктами биохимических превращений по механизму отрицательной обратной связи. В этом случае накапливающийся конечный продукт взаимодействуя с аллостерическим центром белка-репрессора, усиливает его сродство к ДНК, в результате чего белок- репрессор связывается с ДНК в акцепторной зоне и останавливает транскрипцию генов, кодирующих структуру полипептидов данного ферментного белка. Вследствие понижения концентрации фермента уменьшается скорость катализируемой им биохимической реакции и выход образующихся продуктов, что в свою очередь окажет соответствующие влияние на всю цепочку последовательных биохимических превращений в соответствии с принципами смещения равновесия в химических реакциях и, как следствие, понизит концентрацию конечного продукта.
Эффективность регуляции ферментативных реакций путём воздействия на синтез ферментов в значительной степени определяется периодом полужизни ферментов. Чем дольше сохраняется активность фермента после прекращения его синтеза, тем менее эффективна регуляция ферментативной реакции и потребуется достаточно много времени, чтобы полностью её остановить (несколько часов или даже дней). В свою очередь период полужизни фермента зависит от скорости его инактивации в клетке и гидролитического расщепления протеолитическими ферментами.
Таким образом, синтез и деградация ферментов находятся в динамическом равновесии и регуляция активности ферментов на этом уровне проходит сравнительно медленно. Более быстрое регулирование происходит с участием аллостерических ферментов и посредством механизма ковалентной модификации ферментных белков. В этом случае регуляторное воздействие направлено непосредственно на ферменты.
Некоторые ферменты синтезируются в виде проферментов (зимогенов), представляющих собой каталитически неактивные белки, которые могут переходить в каталитически активную форму в результате отщепления от их молекул определенных полипептидов, восстановления дисульфидных группировок (-S-S-) в тиоловые группы (-SH), ковалентной модификации молекулы путем фосфорилирования и др. Синтезированные на рибосомах эндоплазматического ретикулума проферменты очень часто упаковываются в зимогенные гранулы, которые могут перемещаться к поверхности клетки или даже секретироваться в окружающую среду. В виде зимогенных форм синтезируются многие пищеварительные ферменты человека и животных (пепсин, трипсин, химотрипсин, карбоксипептидазы), растительный фермент папаин, некоторые гидролитические ферменты семян растений (амилазы и протеазы).
Важными компонентами регуляторной системы растений являются фитогормоны. Благодаря тому, что они легко переносятся по сосудам флоэмы, эти физиологически активные соединения могут выполнять функцию переноса регуляторных сигналов от одних тканей или органов растения к другим, вызывая активацию и синтез определенных ферментов.
Действие гормонов на активацию биохимических процессов может осуществляться двумя путями. Первый путь - это быстрое регуляторное воздействие, связанное с активацией ферментов путем ковалентной модификации. В этом случае гормон соединяется с определенным белком в составе клеточной мембраны, который называют рецепторным белком. Характер взаимодействия гормона с белком-рецептором примерно такой же, как и специфичность связывания эффектора с аллостерическим центром фермента. Под действием гормона происходит конформационное изменение рецепторного белка в составе мембраны, которое инициирует перестройку всей мембранной структуры, вызывая активацию связанных с мембраной ферментов. В свою очередь с участием этих ферментов приводится в действие рассмотренный выше механизм ковалентной модификации ферментных белков, катализирующих различные метаболические реакции в клетке.
Другой путь связан с воздействием гормонов на регуляторную систему синтеза ферментных белков. На основе специфической реакции гормон соединяется с цитоплазматическим белком–рецептором. Затем образовавшийся гормон–рецепторный комплекс перемещается в ядро и взаимодействует там с регуляторным белком, инициируя или замедляя процесс транскрипции соответствующего гена. В опытах по изучению действия фиторегуляторов выяснено, что ауксины, цитокинины и гибберелловая кислота усиливают синтез многих белков и всех форм РНК в цитоплазме, тогда как абсцизовая кислота оказывает на указанные процессы противоположное действие. В других экспериментах также показано, что ауксины могут активировать в цитоплазме синтез кислых гидролаз, цитокинины - фермента нитратредуктазы, гиббереллины - образование в прорастающих зерновках злаков a-амилаз, катализирующих гидролитическое расщепление молекул крахмала.
В растениях как фитотрофных организмах многие биохимические процессы регулируются светом, который воспринимают в качестве регуляторного сигнала рецепторные белки – фитохром и флавопротеиды, способные при поглощении света определенной длины волны переходить в активную конформацию и вызывать активацию или даже синтез ферментов.
Фитохром представляет собой белок с молекулярной массой 120000, состоящий из двух полипептидных субъединиц и включающий светочувствительную группировку – хромофор, который образуется из четырех линейно соединенных пиррольных группировок с определенным набором боковых радикалов. При поглощении красного света (660 нм) в структуре одной из пиррольных группировок происходит изомеризация двойных связей, вызывающая конформационную перестройку молекулы белка.
Активированный светом белок связывается с клеточной мембраной и вызывает регуляторное действие примерно по такому же механизму, как и гормоны. Если же активная форма фитохрома поглощает свет с длиной волны 730 нм, то инициируется фотоизомеризация хромофора в обратном направлении, вследствие чего фитохром превращается в неактивную форму. В ряде опытов установлено, что фитохром регулирует активность ферментов, катализирующих реакции фотосинтеза (фруктозо-1,6-дифосфатаза, глицеральдегидфосфатдегидрогеназа), проницаемость клеточных мембран в листьях, синтез гормонов.
Другая группа фотосенсорных белков представлена флавопротеидами. У них хромофором служит флавиновая группировка, способная подвергаться фотохимическому превращению под воздействием синего света.
7.8. Классификация ферментов
В соответствии с принятой номенклатурой классификация ферментов проводится в зависимости от типа катализируемых ими реакций, кроме того, учитывается природа субстратов, акцепторов и расщепляемых связей, а также особенности строения отщепляемых, присоединяемых или переносимых групп. По типу катализируемых реакций все ферменты подразделяют на шесть классов.
1. Оксидоредуктазы – окислительно-восстановительные ферменты.
2. Трансферазы – катализируют реакции переноса атомных группировок от молекулы донора к молекуле акцептора.
3. Гидролазы – катализируют гидролитическое расщепление веществ с участием молекул воды.
4. Лиазы – катализируют отщепление групп от органических субстратов с образованием двойных связей или присоединение определенных группировок за счет разрыва двойных связей.
5. Изомеразы – ферменты изомеризации.
6. Лигазы (синтетазы) – катализируют реакции синтеза веществ, которые сопряжены с гидролизом АТФ или превращениями других макроэргических соединений.
В каждом из шести классов ферментов проводится их разделение на подклассы, а в подклассе выделяют группы ферментов, называемые подподклассами. В каждом подподклассе отдельные ферменты записываются в определенной нумерации. Согласно такой группировке каждый фермент имеет классификационный номер, который записывается в виде четырех чисел, разделенных точками. Первое число (записанное слева) указывает принадлежность фермента к одному из шести классов, следующее за ним число обозначает подкласс, третье число – подподкласс, а четвертое - порядковый номер фермента в конкретном подподклассе. Так, например, фермент малатдегидрогеназа, катализирующий превращение яблочной кислоты в щавелевоуксусную, имеет классификационный номер 1.1.1.37, который показывает, что этот фермент относится к первому подклассу оксидоредуктаз, катализирующих окисление спиртовых групп, на что указывают первые два числа (1.1.). Третье число (1.1.1.) выражает принадлежность данного фермента к первому подподклассу, который объединяет группу каталитически активных белков, имеющих в качестве кофермента НАД. Четвертое число (37) определяет порядковый номер фермента в указанном подподклассе.
|
|
|
 Скачать 2.84 Mb.
Скачать 2.84 Mb.