Лекции биохимия 2. Резюме по модульной единице 4
 Скачать 2.84 Mb. Скачать 2.84 Mb.
|
|
Вопросы для повторения.
Резюме по модульной единице 6. Совокупность всех биоэнергетических превращений в организме, обеспечивающих его нормальную жизнедеятельность в изменяющихся условиях окружающей среды, изучает раздел биохимии, называемый биохимической энергетикой. Для оценки энергетических параметров биохимических реакций используются термодинамические функции – внутренняя энергия системы, энтальпия, энтропия, свободная энергия Гиббса и др. Биохимические реакции осуществляются в открытых системах, которые обмениваются веществами и энергией с окружающей средой. Простейшая биохимическая система включает реагирующие вещества, продукты реакции, а также фермент, катализирующий данную реакцию. В связи с тем, что биохимические реакции протекают с очень высокой скоростью, а изменения внешней среды проходят относительно медленно, в биохимической энергетике принимается, что все процессы в организме осуществляются при постоянном давлении и постоянной температуре. Изменение внутренней энергии системы определяется как алгебраическая сумма всех входящих в систему и выходящих из неё энергий. По изменению энтальпии определяются тепловые эффекты биохимических реакций (при Н<О реакция экзотермическая, при Н>О – эндотермическая). Изменение энтропии в ходе биохимических превращений используется для расчёта изменения свободной энергии. При самопроизвольных реакциях свободная энергия системы уменьшается (G<О), такие реакции называют экзергоническими. В ходе эндергонических реакций свободная энергия системы увеличивается (G>О). Эндергонические реакции могут осуществляться самопроизвольно за счёт поглощения энергии, которая высвобождается в экзергонической реакции, при условии прохождения этих реакций в одной биохимической системе. Такие реакции называют сопряжёнными реакциями синтеза веществ. Коэффициент использования энергии при сопряжённом синтезе веществ составляет 40-60%. В сопряжённой экзергонической реакции превращению подвергаются вещества, называемые макроэргическими соединениями. В ходе превращения этих веществ высвобождается большое количество свободной энергии (при стандартных условиях –30-60 кДж/моль). К макроэргическим соединениям относятся нуклеозидполифосфаты (АТФ, ГТФ, ЦТФ, УТФ идр.), ацилфосфаты (1,3-дифосфоглицериновая кислота, ацетилфосфат), енолфосфаты (фосфоенолпировиноградная кислота), тиоэфиры (ацетилкофермент А, пропионил-кофермент А и др.), амидинфосфаты, имидазолы. Макроэргические соединения синтезируются в ходе реакций распада веществ, называемых катаболическими реакциями, а используются для синтеза веществ в ходе анаболических реакций. Универсальным макроэргическим соединением является аденозинтрифосфорная кислота (АТФ), которая синтезируется в процессах субстратного, фотосинтетического и окислительного фосфорилирования. Концентрация АТФ в клетках организма поддерживается на определённом уровне с помощью регуляторных систем. Тестовые задания к лекции 3. Тесты № 67-80. Лекция 4. Ферменты. Аннотация. Излагаются строение, свойства и механизм действия ферментов. Указываются основные показатели, выражающие их каталитическую активность, а также активаторы и ингибиторы ферментов. Даются сведения об изоферментах, локализации ферментов и особеностях функционирования ферментных систем. Рассматриваются механизмы регуляции конститутивных ииндуцибельных ферментов. Объясняются принципы классификации ферментов и зависимость их активности от различных физиологических условий. Ключевые слова: ферменты, каталитический (активный) центр фермента, гипотеза замка и ключа, гипотеза индуцированного соответствия, коферменты, железо-серные белки, катал, удельная и молярная активность ферментов, период полужизни фермента, изоферменты, константа Михаэлиса, активаторы и ингибиторы ферментов, конкурентные и неконкурентные ингибиторы, белковые ингибиторы ферментов, мультиферментные системы, конститутивные и индуцибельные ферменты, аллостерические ферменты, зимогены (проферменты), гормональная регуляция активности ферментов, оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). Рассматриваемые вопросы.
Модульная единица 7. Ферменты. Цели и задачи изучения модульной единицы. Изучить строение, свойства и механизм действия ферментов, особенности регуляции ферментативных реакций и функционирования ферментных систем. Научить студентов использовать сведения о ферментах для прогнозирования интенсивности и направленности биохимических процессов в растениях при обосновании технологий выращивания сельскохо-зяйственных культур. 7.1. Механизм действия ферментов. В живых клетках самопроизвольно и с очень высокой скоростью происходят химические реакции, обеспечивающие жизнедеятельность организмов. Эти реакции довольно легко протекают при атмосферном давлении, сравнительно невысоких температурах и концентрациях веществ. Они проходят строго согласованно в пространстве и времени и в соответствии с потребностями живого организма. Для их осуществления вне организма потребовалось бы создание высокой температуры или давления, сильно кислой или щелочной среды, воздействие каких-либо других жестких факторов, которые не совместимы с функционированием живых клеток. Нормальное осуществление биохимических реакций в живых организмах оказывается возможным благодаря тому, что в их клетках имеются биологические катализаторы, называемые ферментами. Название ферменты происходит от латинского слова fermentum (закваска). В научной литературе для ферментов очень часто используют также другое название – энзимы, а учение о ферментах называют энзимологией. Подавляющие большинство ферментов представляют собой специализированные формы белковых молекул, способные катализировать химические превращения в живых организмах. Однако, как установлено, каталитической активностью могут обладать и структурные белки, входящие в состав клеточных мембран, а также некоторые формы РНК, которые рассматриваются как эволюционные предшественники белковых катализаторов. По современным представлениям почти все химические реакции в живых организмах происходят с участием ферментов, которые способны ускорять биохимические превращения в тысячи и даже в миллионы раз. Ферменты характеризуются высокой степенью избирательности и направленности действия, что обеспечивает чистый выход продуктов реакции практически без примесей. Как и любые катализаторы, ферментные белки участвуют в биохимических реакциях, но не входят в состав образующихся продуктов. В ходе реакции они ускоряют взаимодействие реагирующих веществ. В обратимом превращении фермент ускоряет как прямую, так и обратную реакцию, не смещая химического равновесия. Одно и то же химическое вещество в каждой конкретной реакции имеет совершенно определённую энергию активации. Чем выше энергия активации, тем труднее вещество вступает в химическую реакцию, поэтому скорость реакции будет очень низкой. В таких условиях для ускорения химического превращения реагирующих веществ в продукты реакции применяют катализаторы. В биохимических превращениях роль катализаторов выполняют ферментные белки. С участием фермента биохимическая реакция направляется обходным путём, через промежуточные стадии, для осуществления которых требуется значительно меньшая энергия активации, вследствие чего такие превращения проходят с очень высокой скоростью. Так, например, происходит реакция: А + Б ® АБ, в ходе которой из реагирующих веществ А и Б образуется продукт АБ. В этой реакции и реагент А, и реагент Б характеризуются высокой энергией активации, поэтому данная реакция происходит медленно. Но если включается в действие фермент (Ф), то он образует промежуточное соединение с одним из реагирующих веществ: А + Ф ® АФ. При этом энергия активации вещества А в данной реакции значительно ниже, чем в первой, которая осуществляется без участия фермента, вследствие чего синтез промежуточного продукта АФ будет проходить с высокой скоростью (рис. 15). В ходе превращения промежуточное соединение АФ взаимодействует с веществом Б, образуя продукт АБ, а фермент регенерируется в неизменном виде: АФ + Б ® АБ + Ф. В рассматриваемой промежуточной реакции энергия активации вещества Б намного меньше, чем в первой реакции, поэтому образование продукта АБ будет идти с высокой скоростью. Таким образом, синтез продукта АБ с участием фермента осуществляется в две стадии, но они проходят намного быстрее, чем взаимодействие веществ А и Б без участия фермента. В биохимии принято называть вещества, подвергающиеся превращению с участием ферментов, субстратами. В ходе ферментативной реакции субстрат взаимодействует с молекулой фермента, образуя активированный комплекс, который называют фермент–субстратным комплексом. Поскольку ферменты являются белковыми молекулами, имеющими высокую молекулярную массу и сравнительно крупные размеры, а субстраты – чаще всего низкомолекулярные вещества, при образовании фермент–субстратного комплекса субстрат реагирует с определённым участком белковой молекулы фермента, называемым каталитическим или активным центром. В процессе образования фермент–субстратного комплекса фермент оказывает активирующее воздействие на молекулу субстрата, в результате чего возрастает его реакционная способность и он легко превращается в продукты реакции. При этом молекула фермента высвобождается и затем может вновь реагировать с новой молекулой субстрата. Образование и распад фермент–субстратного комплекса происходит очень быстро, обеспечивая высокую скорость ферментактивного превращения. В разных опытах было определено, что одна молекула фермента способна катализировать превращение десятков и даже сотен тысяч молекул субстрата за 1 секунду. Активный центр фермента обычно включает от 3 до 12 аминокислотных остатков, находящихся в разных участках аминокислотной последовательности первичной структуры ферментного белка, но сближающихся в пространстве при формировании третичной структуры белковых полипептидов (рис. 16). Однако строгой границы, отделяющей активный центр от остальной части молекулы фермента не существует, так как образующие его аминокислотные остатки являются неотъемлемой частью общей структуры белка–фермента. В активном центре фермента имеются группировки, ответственные за связывание субстрата, и образование фермент–субстратного комплекса, но вместе с тем они также обеспечивают правильную пространственную ориентацию молекулы субстрата по отношению к другим группировкам активного центра, участвующим в превращении субстрата. При этом происходит совместное и кооперативное действие на субстрат всех функциональных группировок активного центра. В процессе образования фермент–субстратного комплекса происходит очень точное распознование ферментом молекул субстрата вследствие того, что поверхности молекул субстрата и каталитического центра фермента комплементарны, то есть субстрат по своей пространственной конфигурации структурно совместим с каталитическим центром фермента. Такое структурное соответствие между ферментом и субстратом хорошо объясняется гипотезой замка и ключа, согласно которой субстрат по форме так подходит к активному центру фермента, как ключ к замку. При этом субстрат сравнивается с ключом, а фермент с замком. Из огромного разнообразия химических веществ, содержащихся в клетках живого организма, только субстрат способен связываться с активным центром фермента. Обычно фермент катализирует превращение группы структурно родственных соединений. Например, липаза катализирует гидролитическое расщепление различных сложных эфиров глицерина, входящих в состав жиров; пепсин - катализирует гидролиз различных белков, амилазы – гидролиз полисахаридов крахмала, нуклеотидазы - расщепление нуклеотидов. Однако известны ферменты, обладающие очень узкой специфичностью действия. Например, каталаза катализирует превращение только пероксида водорода, уреаза – гидролиз мочевины, сукцинатдегидрогеназа – отщепление водорода от молекул янтарной кислоты (сукцината). Очень важное свойство ферментов – их стереохимическая специфичность. В целом ряде опытов было чётко показано, что ферменты способны распознавать не только геометрию субстрата, но также правую и левую стороны его молекулы или даже атомы водорода в составе СН2 – группы, по-разному ориентированные в пространстве. Поэтому каждый фермент катализирует превращение только определённых стереоизомеров органических веществ. И это имеет важное биологическое значение. Как указывалось ранее, в организмах синтезируются преимущественно D– формы моносахаридов и L-формы аминокислот, в связи с чем именно эти стереоизомеры указанных соединений могут служить субстратами для ферментов, тогда как другие стереоизомеры не могут превращаться ферментами организма. Изучение ферментативных реакций показывает, что специфичность действия ферментов выражается не только в комплементарном связывании субстратов, но и направленном их превращении в определённые продукты реакции, так как из одного и того же субстрата могут быть получены разные вещества. Таким образом, в ходе превращения фермент специфически связывает субстрат и одновременно определяет направление биохимической реакции. В процессе образования фермент–субстратного комплекса активные радикалы аминокислотных остатков, находящиеся в каталитическом центре фермента, определенным образом воздействуют на молекулу субстрата. При этом возможна поляризация и растяжение связей, ионизация отдельных группировок и их смещение в пространстве, что создает напряжение в молекуле субстрата, вызывающее перестройку её структуры, в результате чего молекула субстрата переходит в активированное состояние и легко подвергается превращению. При этом образующиеся продукты уже не имеют структурного сродства с активным центром фермента и вытесняются новыми молекулами субстрата. Чаще всего между субстратом и группировками активного центра фермента происходят электростатические взаимодействия за счёт образования водородных связей и участия вандер-ваальсовых сил, поэтому образование фермент–субстратного комплекса представляет собой легкообратимый процесс, что способствует быстрому прохождению ферментативного превращения. Однако в ряде ферментативных реакций группировки активного центра образуют ковалентные связи с молекулами субстратов, переводя их в более реакционноспособное состояние. Так, например, действуют ферменты, катализирующие реакции нуклеофильного замещения, в ходе которых осуществляется перенос метильных, ацильных и фосфатных групп, остатков моносахаридов, аминокислот, нуклеотидов. В некоторых реакциях ведущим фактором перевода субстрата в активированное состояние является дегидратация, то есть создание в активном центре фермента такой внутренней среды, которая лишает субстрат контакта с молекулами воды, препятствующими прохождению данной ферментативной реакции. При взаимодействии фермента с субстратом происходят не только конформационные изменения молекулы субстрата, но и белка–фермента. Такой тип взаимодействия объясняется гипотезой индуцированного соответствия, согласно которой предполагается, что в ходе образования фермент–субстратного комплекса аминокислотные остатки в активном центре фермента приобретают такую пространственную ориентацию, которая позволяет ферменту наиболее эффективно выполнять каталитическую функцию. Очень часто в процессе такого взаимодействия аминокислотные радикалы фермента определенным образом укладываются вокруг молекулы субстрата, создавая в активном центре специфическую внутреннюю среду, способствующую активации субстрата и его превращению в продукты реакции. В состав каталитического центра ферментных белков входят радикалы аминокислот, имеющих реакционноспособные группировки, которые могут быть донорами или акцепторами протонов. С их участием инициируется отщепление и присоединение протонов к молекуле субстрата, или происходит перенос протонов, в результате чего изменяется состояние ионизации молекулы субстрата и её кислотно-основные свойства и таким образом усиливается реакционная способность субстрата. Донорами протонов в составе аминокислотных радикалов являются группировки, у которых атомы водорода соединены с электроотрицательными атомами (O, N, S), или группировки, присоединившие протон: –COOH, –CH2OH, –OH, –SH, –NH3+, >NH2+, ≥NH+. Акцепторами протонов могут служить следующие функциональные группы: –СОО‾, –NH2, > NH–, ≥N. Носителями указанных реакционноспособных групп в молекуле белка–фермента являются радикалы моноаминодикарбоновых и диаминомонокарбоновых кислот, серина, цистеина, тирозина, гистидина, триптофана. Для выяснения строения каталитического центра фермента необходимо установить последовательность соединения аминокислотных остатков в его пептидных цепях, степень олигомерности белковой молекулы и её пространственную структуру, а также определить аминокислотные радикалы, участвующие в каталитическом действии фермента. При этом показано, что некоторые олигомерные ферментные белки могут иметь каталитический центр в каждой полипептидной субъединице. В результате проведенных исследований расшифрована структура и изучено действие многих ферментов. В качестве примера рассмотрим строение активного центра и вероятный механизм действия фермента триозофасфатизомеразы, выделенного из клеток трипаносом (одна из форм одноклеточных животных). Этот фермент катализирует изомерные превращения фосфодиоксиацетона и 3-фосфоглицеринового альдегида. Молекула триозофосфатизомеразы образуется из двух одинаковых полипептидных субъединиц, включающих по 250 аминокислотных остатков. Каждый такой полипептид имеет на поверхности третичной структуры восемь a-спиралей, а во внутреннем пространстве систему из восьми b-структур, образующих внутреннюю полость (рис. 10). Активными группировками каталитического центра данного фермента являются радикал лизина, занимающий 13-тое положение в аминокислотной последовательности ферментного белка (считая от N-конца), остаток гистидина, находящийся в 95-ом положении, и остаток глутаминовой кислоты в положении 167. Однако в каталитическом действии также участвуют другие аминокислотные остатки, образующие внутреннее пространство молекулы фермента. Хотя активный центр формируется в структуре каждого полипептида, тем не менее, не ассоциированные в молекулу полипептидные субъединицы триозофосфатизомеразы каталитической активностью не обладают. Они способны катализировать биохимическое превращение только в том случае, когда соединяются в димеры, образующие молекулы фермента. Рассмотрим механизм ферментативного превращения фосфодиоксиацетона в 3-фосфоглицериновый альдегид: CH2O(Р) триозофосфатизомераза CH2O(P) ½ ¾¾¾¾¾¾¾¾¾® C = O H–COH ½ ½ CH2OH C=О ½ H В процессе образования фермент–субстратного комплекса фосфатная группа фосфодиоксиацетона образует водородные связи с электроотрицательными группировками активного центра фермента и электростатически взаимодействует с положительно заряженной аминогруппой аминокислотного остатка Lys13 (R-СН2NH3), при этом в 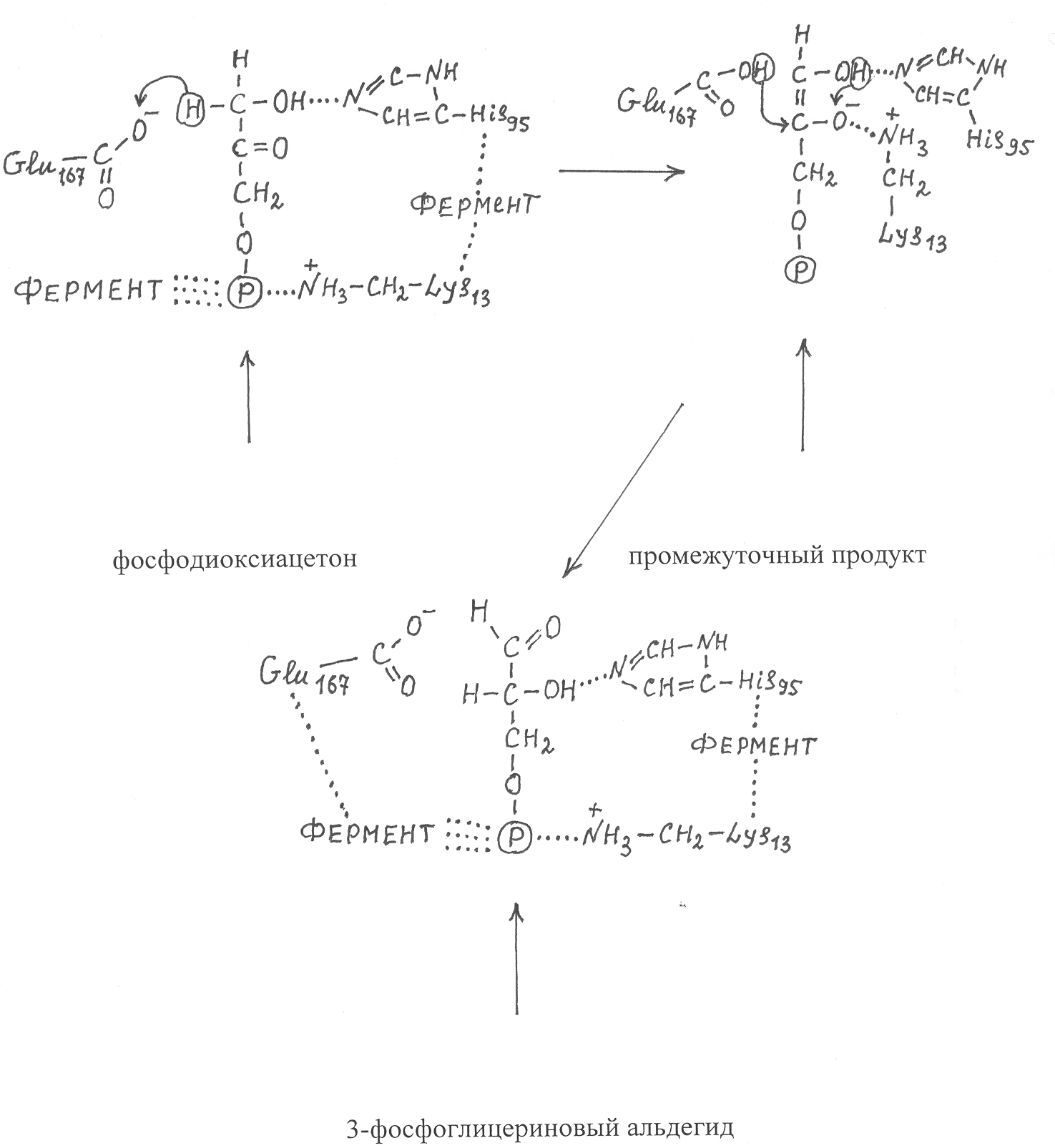 молекуле фермента происходит изменение пространственной структуры участка полипептидной цепи, включающего аминокислотные остатки в положениях 167®178 (показано на стр. 217). Такое изменение конформации активного центра приводит к замыканию внутренней полости в третичной структуре полипептида и защищает субстрат от воздействия на него молекул воды и других веществ из внешнего раствора. После образования фермент–субстратного комплекса молекула фосфодиоксиацетона в активном центре фермента оказывается в непосредственной близости от имеющей отрицательный заряд карбоксильной группы аминокислотного остатка глутаминовой кислоты Glu167, вследствие чего между ними происходит взаимодействие. В результате такого взаимодействия от первого углеродного атома фосфодиоксиацетона отщепляется протон и присоединяется к карбоксильной группе Glu167, а между первым и вторым углеродными атомами субстрата замыкается двойная связь. При этом одновременно происходит разрыв двойной связи в кетонной группировке и электростатическая стабилизация отрицательного заряда кислорода положительным зарядом аминной группировки остатка лизина Lys13. В стабилизации молекулы субстрата также важную роль играет атом азота гетероциклического радикала гистидина His95, образующего водородную связь с гидроксильной группой субстрата. В ходе указанной перегруппировки образуется неустойчивое промежуточное соединение, у которого углеродные атомы с двойной связью соединены с гидроксильными группами. Оно способно самопроизвольно превращаться в более устойчивую альдегидную форму, а двойная связь между первым и вторым углеродными атомами подвергается разрыву, инициируя перенос протонов к возникающим свободным связям. В ходе такой перегруппировки ко второму углеродному атому субстрата переходит протон от карбоксильной группы глутаминовой кислоты, а к соединенному с ним атому кислорода с участием гистидинового радикала фермента осуществляется перенос протона от гидроксильной группы первого углеродного атома и, таким образом, молекула фосфодиоксиацетона превращается в 3-фосфоглицериновый альдегид, который и является продуктом рассматриваемого биохимического превращения. Этот же фермент может катализировать обратную реакцию изомеризации 3-фосфоглицери-нового альдегида в фосфодиоксиацетон. Направленность реакции изомеризации, катализируемой триозофосфатизомеразой, определяется тем, какой из биохимических продуктов (кетонная или альдегидная форма) используется для дальнейших превращений, вследствие чего происходит соответствующий сдвиг химического равновесия. У многих ферментов в составе каталитического центра имеются не только реакционноспособные радикалы аминокислотных остатков, но и дополнительные активные группировки неаминокислотной природы, присутствие которых строго необходимо для выполнения ферментом его каталитической функции. В соответствии с наличием или отсутствием в активном центре фермента дополнительной активной группировки неаминокислотной природы молекулы фермента называют однокомпонентными или двухкомпонентными. У однокомпонентных ферментов каталитический центр образуется только из аминокислотных остатков белка и не содержит каких-либо других небелковых компонентов. У двухкомпонентных ферментов в структуре активного центра имеется небелковая группировка, которая или непосредственно взаимодействует с субстратом, или воздействует на структуру каталитического центра, переводя его в активное состояние. |
