Лекции биохимия 2. Резюме по модульной единице 4
 Скачать 2.84 Mb. Скачать 2.84 Mb.
|
|
7.2.Строение двухкомпонентных ферментов. Основой двухкомпонентного фермента, как и однокомпонентного, является молекула белка, которую в данном случае называют апоферментом, а небелковую часть фермента принято называть коферментом. Коферменты образуются из витаминов, нуклеотидов и других активных группировок, включающих атомы металлов, серы, а также различные органические соединения (гетероциклические радикалы пиррола и имидазола, хиноны, липоевая кислота, кетокислоты и др.). Известны многие ферменты, у которых атомы металлов соединены непосредственно с аминокислотными остатками, формирующими каталитический центр. Коферменты имеют разные формы соединения с белковой частью фермента. Одни из них довольно легко отделяются от фермента и могут самостоятельно участвовать в биохимических реакциях, другие связаны с ферментным белком очень прочно и не могут быть выделены без разрушения молекулы фермента. Коферменты, прочно связанные с ферментным белком, часто называют простетическими группами. К наиболее хорошо изученным простетическим группам относятся биотин, липоевая кислота, флавиновые коферменты и железосодержащие коферменты - гемы. Рассмотрим в качестве примеров флавиновые и железосодержащие коферменты. Флавиновые простетические группы представлены двумя видами соединений – флавинадениндинуклеотидом (ФАД) и флавинмононуклео-тидом (ФМН), которые ковалентно связаны с ферментными белками. Коферментная группировка ФМН представляет собой витамин рибофлавин, фосфорилированный по спиртовой группе пятого углеродного атома рибита, а в составе ФАД к ФМН путем взаимодействия фосфатных остатков присоединяется нуклеотидный радикал аденозин-монофосфата (АМФ). Чаще всего флавиновая простетическая группа соединяется с ферментным белком путем образования ковалентной связи между углеродом метильной группы, соединенной с восьмым углеродным атомом диметилизоаллоксазина, и азотом гетероциклического радикала гистидина или атомом серы цистеинового отатка в составе белка. Каталитическая активность указанных простетичеких групп проявляется в том, что они способны присоединять атомы водорода к атомам азота диметилизоаллоксазина в положениях 1 и 5 с последующей перегруппировкой двойных связей. В результате присоединения атомов водорода флавиновый кофермент превращается в восстановленную форму, которая сокращенно записывается ФАД·Н2 или ФМН·Н2, а окисленная форма соответственно - ФАД и ФМН. 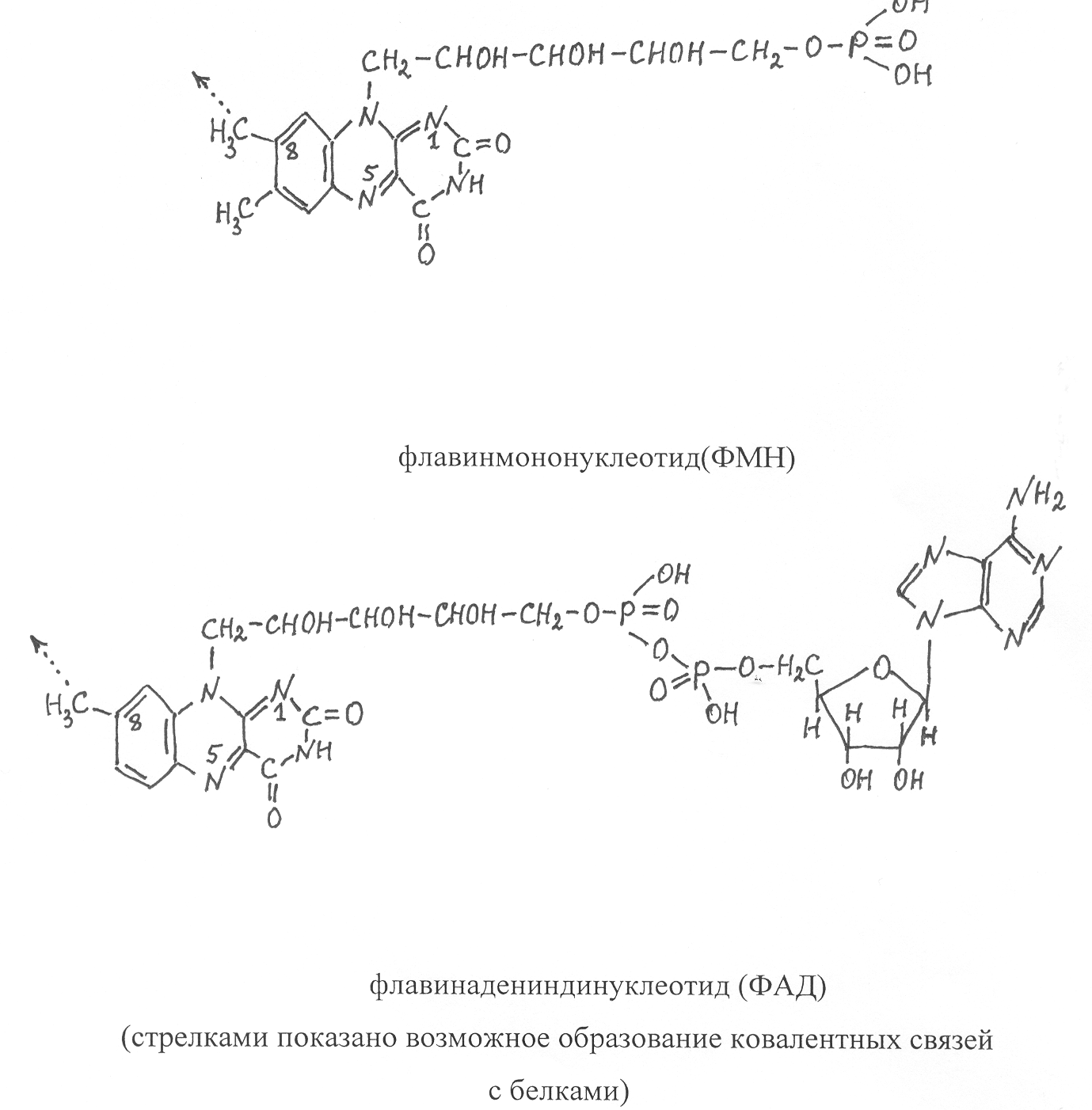 При этом считается, что один атом водорода отщепляется от субстрата в виде протона (Н+), а другой – в виде гидрид-иона (Н‾). В процессе взаимодействия с флавиновым коферментом протон присоединяется к атому азота диметилизоаллоксозина в положении 1, а гидрид-ион – к атому азота в положении 5. В виде таких же ионных форм происходит отщепление водорода и от восстановленного флавинового кофермента. В настоящее время известны несколько десятков ферментов, имеющих флавиновые коферменты. Они могут функционировать в качестве переносчиков водорода в дыхательных реакциях и катализируют многие реакции окисления: спиртов в альдегиды, дигидролипоевой в липоевую кислоту, гликолевой кислоты в глиоксиловую. С участием флавиновых ферментов происходит образование α,β-ненасыщенных производных жирных кислот и превращение янтарной кислоты в фумаровую. У 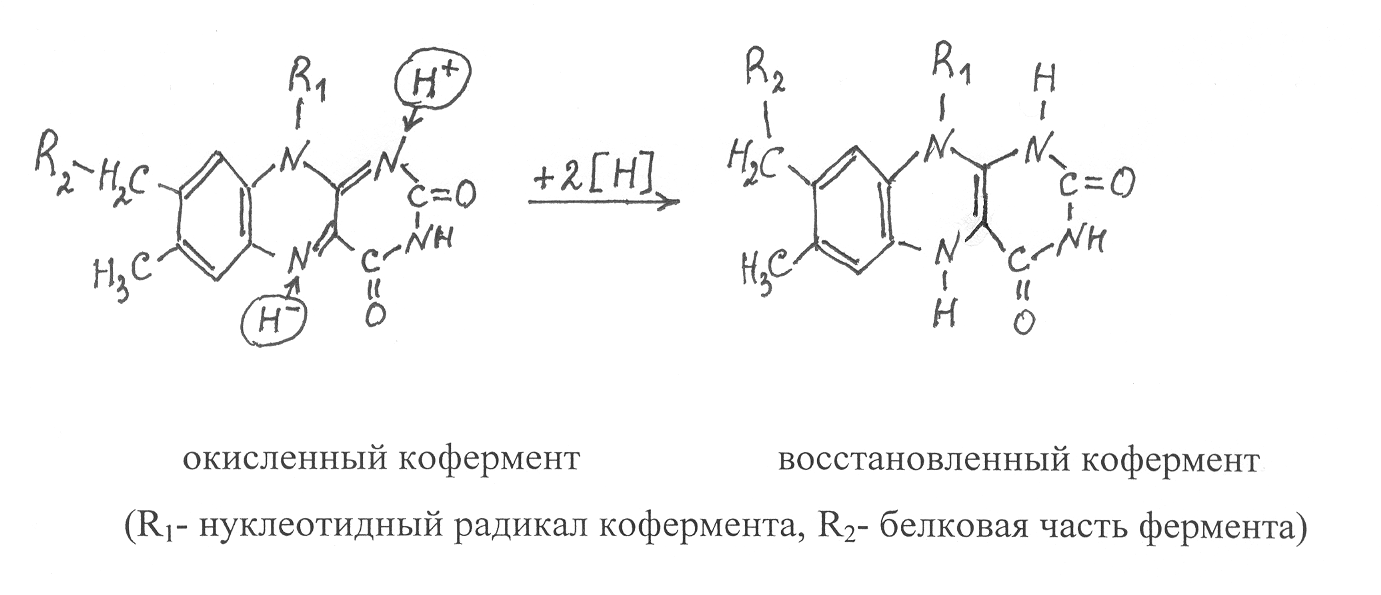 некоторых флавиновых ферментов в активном центре наряду с флавиновым коферментом имеются атомы металлов. Так, например, ксантиноксидаза некоторых микроорганизмов, являющаяся димерным белком, содержит в каждой субъединице флавиновый кофермент в виде ФАД, один атом Мо и 4 атома Fe. Важные функции в организмах выполняют ферменты, имеющие в своем составе простетические группы в виде гема. Гемы представляют собой устойчивые хелатные комплексы порфириновой группировки с атомом железа. Порфириновая группировка образуется из четырех гетероциклических структур пиррола (обозначаемых А, В, С, D), соединенных метеновыми радикалами (=СН-) в более крупную циклическую группировку, к которой присоединены еще восемь боковых радикалов. В зависимости от строения этих радикалов различают разные типы гемов (протогем, гем а, гем c и др.). При соединении со специфическим белком гем может выполнять роль переносчика электронов или кислорода, катализировать окислительно-восстановительные реакции с участием кислорода или пероксида водорода. Гемопротеиды, участвующие в переносе электронов, получили название цитохромов. Все они представляют собой сравнительно низкомолекулярные белки, имеющие в качестве простетической группы гем, прочно связанный с молекулой белка. Цитохромы, различающиеся строением гема и белковой молекулы, обычно обозначают латинскими буквами а, в, с, d, f. Активным компонентом в структуре гема, принимающим участие в переносе электронов, является атом железа. В окисленном цитохроме железо содержится в виде Fe3+, а после присоединения электрона оно превращается в восстановленную форму Fe2+ : цит (Fe3+) + `е ® цит ( Fe2+). Восстановленный цитохром передает электрон другому акцептору, превращаясь в окисленную форму, способную снова присоединять электрон от донора: цит (Fe2+) + акцептор ® цит (Fe3+) + восстановленный акцептор Наиболее хорошо изучено строение цитохрома c, который представляет собой водорастворимый белок, включающий 104 аминокислотных отатка. Как показали структурные исследования, при формировании третичной структуры цитохрома c пептидная цепь белка,укладывается вокруг гема и образует своеобразную оболочку, которая защищает его от воздействия внешнего раствора. В структуре фермента атом железа образует координационные связи с азотом гетероциклического радикала гистидина, находящегося в положении 18 первичной структуры белка, и атомом серы метионина в положении 80. К числу коферментов, которые связаны с белковой частью фермента лабильными связями, относятся никотинамидадениндинуклеотид (НАД), никотинамидадениндинуклеотидфосфат (НАДФ), кофермент А (КоА), а также коферментные формы витаминов В1, В6, В12, фолиевой кислоты. Эти коферменты удерживаются в активном центре ферментов водородными связями и силами электростатического взаимодействия заряженных группировок кофермента и функциональных групп аминокислотных остатков, образующих активный центр фермента. В связи с этим указанные коферменты легко отделяются от белковой части фермента. Большое число ферментов имеют в качестве кофермента динуклеотидную группировку НАД. Молекулы кофермента НАД образуются из витамина РР (амид никотиновой кислоты) и нуклеотида АМФ (аденозинмонофосфат), соединенных через остатки ортофосфорной кислоты и по химическому строению представляют собой динуклеотиды. НАДФ отличается от НАД только наличием дополнительной фосфатной группировки, присоединенной ко второму атому углерода рибозы в составе АМФ. Ферменты, имеющие в своем составе НАД и НАДФ, катализируют реакции отщепления водорода от восстановленных субстратов и перенос их на соответствующий акцептор. Очень часто таким акцептором является окисленный флавиновый кофермент. 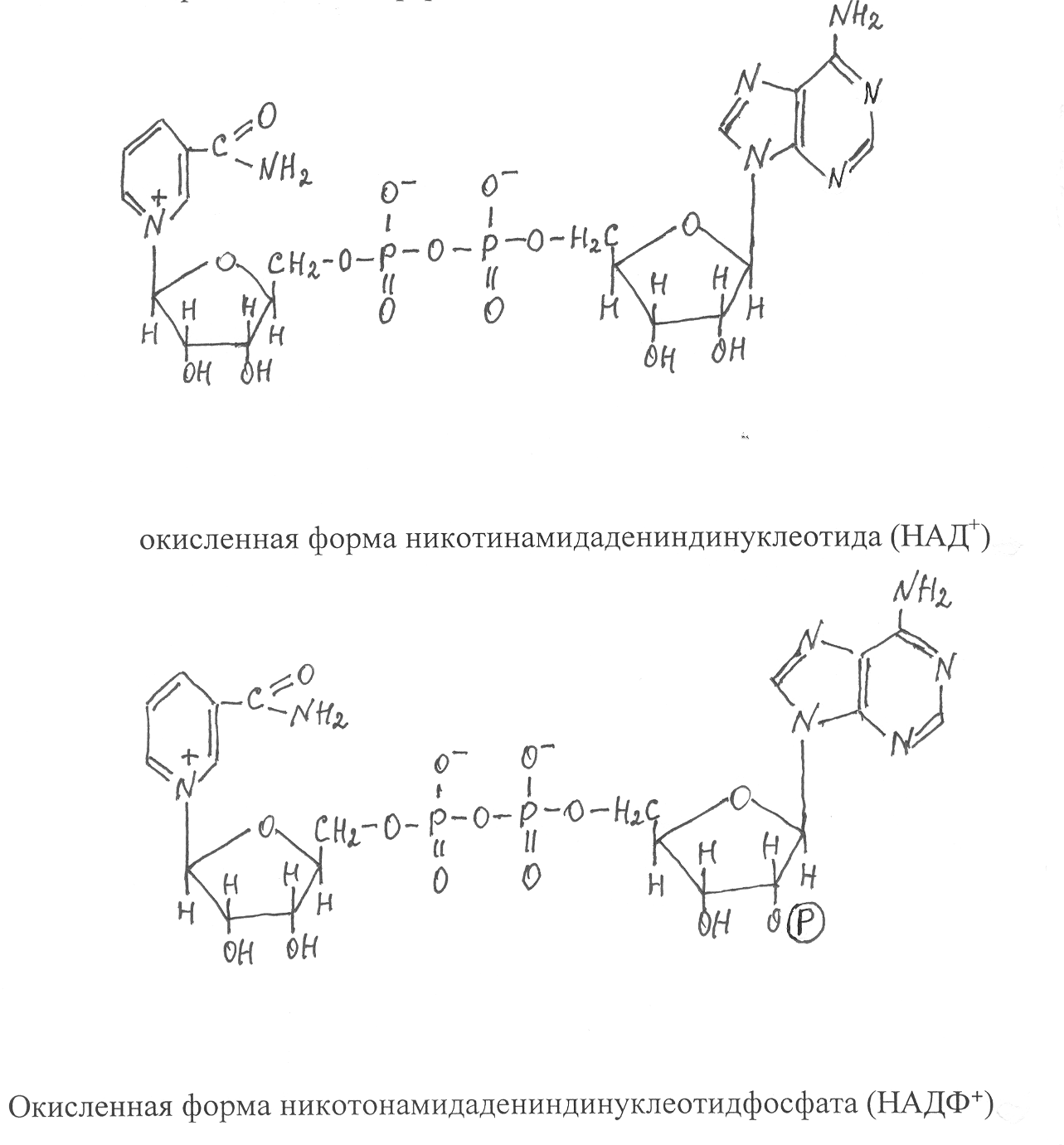 Активной группировкой, участвующей в отщеплении и переносе водорода, служит окисленная форма никотинамида. Исследователи считают, что от субстрата отщепляются два атома водорода в виде гидрид-иона (Нˉ) и протона (Н+), при этом гидрид-ион присоединяется к четвертому углеродному атому никотинамида в составе фермента, переводя его в восстановленную форму, а протон не связывается с коферментом и в дальнейшем непосредственно переходит на акцептор, с которым взаимодействует восстановленный кофермент, передавая на акцептор два электрона и водород в виде гидрид-иона (Нˉ). Окисленную форму НАД принято сокращенно записывать в виде НАД+, а восстановленную - НАД×Н. Соответственно окисленная форма НАДФ записывается НАДФ+, восстановленная - НАДФ×Н. Поскольку в 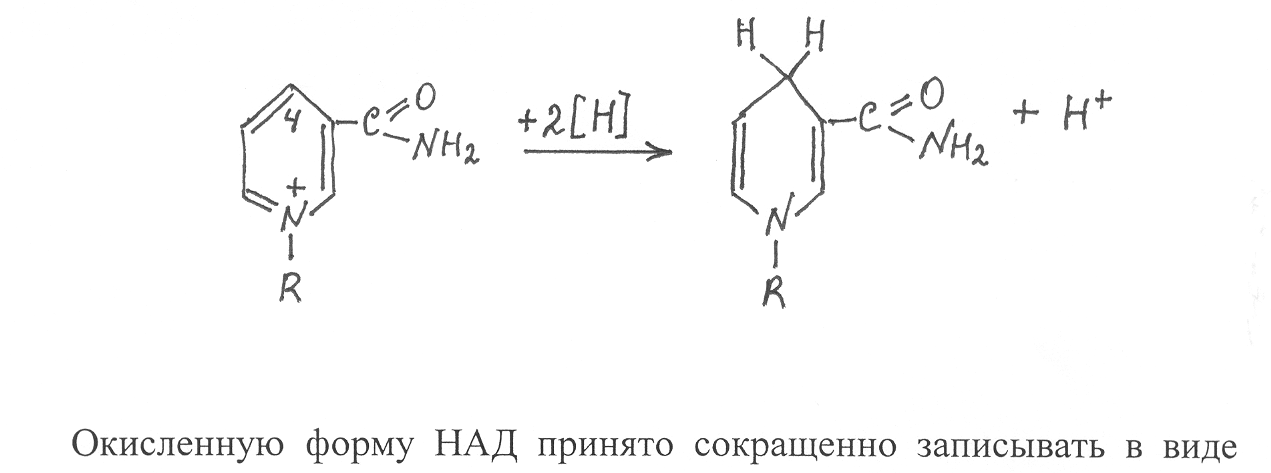 НАД⁺ НАД·Н₂ реакциях, катализируемых НАД- и НАДФ- содержащими ферментами, происходит отщепление водорода от субстратов, то такие ферменты называют дегидрогеназами. Схематически действие дегидрогеназы, имеющей кофермент НАД, можно представить следующим образом: субстрат-Н₂ + НАД+–фермент¾®субстратокисл + фермент–НАД×Н + Н+ фермент–НАД ×Н +Н+ + акцептор ¾® НАД+–фермент + акцептор–Н₂ НАД и НАДФ очень легко отделяются от ферментного белка и могут существовать в свободной форме, диффундируя от одного фермента к другому. Свободные формы этих коферментов могут также переноситься по флоэмной системе растений от донорных клеток и органов к акцепторным. НАД – зависимые ферменты наиболее активны в ускорении реакций, связанных с отщеплением водорода от субстратов, а ферменты, имеющие восстановленные коферменты НАДФ, чаще всего используются как сильные восстановители. 7.3. Каталитическая активность ферментов. Ферменты обнаруживают в клетках и тканях организмов по их способности катализировать биохимические реакции, которая выражается специальным показателем, называемым активностью фермента. Этот показатель можно определить по количеству прореагировавшего субстрата или по накоплению продуктов реакции в единицу времени. При этом создаются оптимальные условия для действия фермента (оптимальные температура, рН и ионный состав среды). Самая высокая скорость превращения в начальный момент времени, а затем скорость реакции уменьшается вследствие понижения концентрации субстрата и одновременного накопления образующихся продуктов, увеличивающих скорость обратной реакции. Исходя из указанных особенностей прохождения ферментативной реакции, активность ферментов рекомендуется определять по начальной скорости реакции и за возможно короткий промежуток времени. По рекомендации Международного биохимического союза за единицу каталитической активности фермента принят катал. (кат). Один катал – это каталитическая активность, способная катализировать превращение одного моля субстрата за 1 секунду при оптимальных условиях и в заданной системе определения активности. Очень часто для выражения активности ферментов используют также производные от катала единицы: микрокатал (мккат) = 10-6 кат, нанокатал (нкат) = 10-9 кат, пикокатал (пкт) = 10-12 кат. В каталах и производных от него единицах измеряют общую активность фермента, которая зависит как от каталитических свойств ферментного белка, так и количества фермента, участвующего в реакции. Для характеристики каталитической активности чистых ферментных препаратов используется показатель – удельная активность, который выражается в каталах в расчете на 1 кг ферментного препарата (кат× кг-1) или в других производных от кат и кг единицах. Если определяется удельная активность в тканях живого организма, то в этом случае данный показатель выражает содержание фермента в биологическом источнике. Каталитическая активность фермента наиболее точно может быть выражена с помощью показателя, называемого молярной активностью, которая измеряется в каталах в расчете на 1 моль фермента (кат×моль-1ф.). Этот показатель показывает, какое число молекул субстрата превращается за 1 секунду одной молекулой фермента. В отдельных случаях расчет активности фермента проводится с учетом числа активных центров в его молекуле и такой показатель называют числом оборотов или молекулярной активностью, он выражается в каталах в расчете на 1 моль активных центров фермента. Для многих ферментов показатель молярной активности имеет очень высокие значения (до 106), поэтому скорости реакций, катализируемых ферментами, в десятки и даже сотни тысяч раз превышают скорости реакций, происходящих без участия ферментов. Вследствие того, что в активном центре происходит активирование и сближение молекул реагирующих субстратов, ферментативные реакции протекают с высокой скоростью даже при низкой концентрации реагирующих веществ в физиологической среде. Так, например, фермент каталаза, участвующий в разложении пероксида водорода на воду и кислород, способен катализировать превращение 2×105 молекул субстрата за 1 секунду в расчете на активный центр фермента. В связи с тем, что активный центр фермента должен структурно соответствовать субстрату, изменение его конформации может снижать каталитические свойства ферментной молекулы. Поэтому любые воздействия на фермент, вызывающие изменение структуры активного центра, будут влиять на каталитическую способность фермента. В то же время изменение конформации молекулы, не затрагивающее активный центр, будет меньше влиять на каталитические свойства фермента. В физиологической среде, в которой находятся молекулы ферментов могут присутствовать химические компоненты, вызывающие инактивацию или даже разрушение молекул фермента. Поэтому каждый фермент может активно функционировать лишь определенное время, после чего его молекулы становятся неактивными. Продолжительность жизни фермента определяется его ролью в обмене веществ и генотипом организма. Для характеристики продолжительности жизни ферментов используют показатель – период полужизни ферментов, который для растительных объектов колеблется от нескольких часов до нескольких суток. В связи с инактивацией и распадом ферментов в клетках живого организма постоянно происходит процесс синтеза новых молекул ферментов. Такая особенность ферментов имеет важное биологическое значение для регуляции их синтеза и хода ферментативных превращений. Если бы ферменты не инактивировались, то однажды синтезированный фермент длительное время не прекращал бы своей деятельности и реакцию, катализируюемую этим ферментом, было бы трудно регулировать в соответствии с потребностями организма. 7.4. Изоферменты. Большинство ферментов представлены в клетках организма в виде множественных молекулярных форм, называемых изоферментами или изоэнзимами. Изоферменты – это сходные по структуре белковые молекулы, способные катализировать одну и ту же биохимическую реакцию, но различающиеся по первичной структуре входящих в их состав полипептидов. Они имеют одинаковую структуру каталитического центра, вследствие чего обладают одним типом субстратной специфичности. Изоферменты одного и того же фермента отличаются оптимумами рН, температуры, других условий внешней среды, по их молярной активности, но все они катализируют одну и ту же реакцию. Когда из клеток организма выделяют какой-либо фермент и определяют его активность, то всегда имеют дело с конкретными изоферментами данного фермента. Молекулы ферментов чаще всего представляют собой олигомеры, построенные из двух или нескольких полипептидов, которые в той или иной степени различаются первичными структурами, но имеют однотипную третичную структуру и поэтому при взаимодействии образуют функционально родственные белки. Как было показано ранее, различающиеся первичными структурами полипептиды в составе олигомерных молекул кодируются разными генами, в связи с чем природа и набор изоферментов определяются генотипом организма. Впервые механизм образования изоферментов был выяснен при изучении множественных молекулярных форм фермента лактатдегидрогеназы, катализирующего превращение молочной кислоты в пировиноградную в клетках человека и животных: -2Н СН3 – СН(ОН) – СООН ¾® СН3 – С – СООН || О В ходе исследований были выделены кристаллические препараты лактатдегидрогеназы из клеток печени, сердечной мышцы и скелетных мышц и подвергнуты разделению методом электрофореза в щелочной буферной системе (рН 8,8). В таких условиях молекулы фермента имеют отрицательный заряд и в зависимости от величины заряда проявляют разную подвижность в направлении к аноду. В процессе электрофоретического разделения было выделено пять белковых фракций, каждая из которых представляла собой тетрамерные молекулы с молекулярной массой около 140 тыс., образованные из различных комбинаций двух типов полипептидов, обозначаемых Н и М. Полипептиды Н наиболее активно синтезируются в сердечной мышце и печени и больше содержат в своем составе остатков моноаминодикарбоновых кислот. Второй тип полипептидов М преимущественно синтезируется в скелетных мышцах и они характеризуются меньшим содержанием дикарбоновых аминокислот. С участием указанных типов полипептидов образуется пять разновидностей ферментных молекул, являющихся изоферментами лактатдегидрогеназы: Н4, Н3М, Н2М2, НМ3, М4. Каждая молекула изофермента как тетрамер состоит из 4 полипептидов, которые могут быть идентичными (Н4 и М4) или разными (Н3М, Н2М2, НМ3). Количественное содержание каждого изофермента в данной ткани зависит от концентрации в ней полипептидов Н и М. Вследствие того, что полипептиды Н содержат больше в своем составе остатков дикарбоновых аминокислот, тетрамер Н4 при рН среды 8,8 имеет наибольший отрицательный заряд, вследствие чего быстрее движется к аноду в процессе электрофореза (рис. 19) Тетрамер М4 характеризуется наименьшей подвижностью к аноду, так как его молекулы построены из полипептидов с меньшим содержанием дикарбоновых аминокислот. Другие изоферменты распределяются при электрофорезе между фракциями Н4 и М4 в зависимости от числа полипептидов Н и М в их молекулах. На примере лактатдегидрогиназы мы видим, если молекула фермента - тетрамер, образованный из двух типов полипептидов, то возникают пять изоферментов. Но если молекулы тетрамерного фермента формируются из трех типов полипептидов, например А, Б и В, тогда возникают следующие комбинации полипептидов в молекуле: А4, Б4, В4, А3Б, А3В, А2Б2, А2В2, А2БВ, АБ3, АВ3, АБ2В, АБВ2, Б3В, В3Б, Б2В2. На этом примере видно, что набор изоферментов заметно возрастает при увеличении числа разных полипептидов, из которых строятся молекулы белка–фермента. Набор изоферментов также увеличивается при возрастании степени олигомерности молекулы фермента. Так, у лактатдегидрогиназы из двух разных полипептидов строятся тетрамерные молекулы и возникают 5 изоферментов, а у гексамерного белка из двух типов полипептидов образуются уже семь изоферментов, у октамерного белка – 9 и т.д. Таким образом, общий набор изоферментов данного ферментного белка определяется степенью олигомерности его молекулы и числом разных полипептидов, из которых образуются молекулы белка. Следует отметить, что к изоферментам не относятся молекулы фермента, измененные в результате повреждения структуры белка или модификации его молекул путем присоединения активных группировок (так называемая посттрансляционная модификация белков). Поскольку изоферменты – это определенный набор белковых молекул, способных катализировать превращение одного и того же субстрата, то для их выявления используют методы разделения, принятые для белков, с последующим определением каталитической активности. Наиболее часто для разделения изоферментов используют метод электрофореза в полиакриламидном геле, который по сравнению с другими методами имеет наиболее высокую разрешающую способность. При разделении этим методом можно выявить изоферменты, различающиеся по суммарному заряду молекулы, который определяется содержанием в белке остатков моноаминодикарбоновых кислот. Если же в составе организма имеются генетические варианты молекул фермента, у которых различия в аминокислотном составе не приводят к изменению заряда молекулы, то для их разделения используют модификации электрофореза, основанные на других принципах, например, изоэлектрофокусирование белков. Особенно большое разнообразие множественных молекулярных форм наблюдается у растительных ферментов. Практически каждый фермент представлен в растении в виде набора изоферментов, каждый из которых проявляет каталитическую активность в строго определенных условиях, зависящих от внутренней физиологической среды, что позволяет организму обеспечивать специфичность обмена веществ в данном органе, ткани или внутриклеточном компартменте (межклеточном отсеке). Так, например, в листьях и корнях растений разная физиологическая среда, но в них может проходить одна и та же реакция за счет того, что ее катализируют разные изоферменты данного фермента. В процессе роста и развития растений постоянно изменяется внутренняя физиологическая среда и внешние условия, в соответствии с этим изменяется и набор изоферментов каждого фермента. Особенно заметно наблюдаются качественные и количественные изменения состава изоферментов при созревании и прорастании семян. На рис. 21 показаны электрофореграммы изоферментов a-амилазы созревающего, зрелого и прорастающего зерна пшеницы, различающихся по их подвижности к аноду. При сравнении электорофореграмм видно, что в созревающем зерне пшеницы амилолитическую активность имеют четыре, изофермента с низкой подвижностью к аноду, а в прорастающем зерне также четыре, но уже других по электрофоретической подвижности изофермента. Вследствие того, что при созревании зерна происходит связывание амилаз белковыми ингибиторами в неактивный комплекс, в полностью созревшем зерне при благоприятных погодных условиях выявляется слабая амилолитическая активность только одного изофермента a-амилазы. Однако в зерновках, сформировавшихся при влажной погоде, активность большинства изоферментов a - амилаз, выявленных в созревающем зерне, сохраняется. Наличие в клетках организма множественных молекулярных форм одного и того же фермента, проявляющих каталитическую активность при разных физиологических условиях позволяет организму осуществлять с необходимой интенсивностью биохимические процессы при изменении условий внешней среды. Когда изменяются внешние условия, то они становятся неблагоприятными для проявления каталитической активности определенных изоферментов, но биохимическая реакция не прекращается, так как вступают в действие другие изоферменты, которые способны катализировать данное превращение в изменившихся условиях. Если появляется новый изофермент, то он расширяет диапазон выживаемости организма. Чем больше набор изоферментов, тем шире диапазон их действия и лабильнее происходит адаптация организма к неблагоприятным факторам внешней среды. Изучение ферментных систем растений показывает, что специфичность обмена веществ у разных генотипов обеспечивается характерным для каждого генотипа набором изоферментов. Чем ближе генотипы растений в систематическом отношении, тем меньше различается у них изоферментный состав ферментов. В связи с этим изоферментный анализ довольно успешно применяется для уточнения систематики живых организмов, выявления филогенетического родства между видами и сортами растений, а также проверки генетической чистоты или, наоборот, генетического разнообразия растительной популяции. |
