шпора по анату. билеты с ответами-3. Билет 1 Изоферменты. Понятие. Биологическая роль. Примеры. Диагностическое значение определения изоферментов плазмы крови
 Скачать 0.96 Mb. Скачать 0.96 Mb.
|
|
Билет № 1 Изоферменты. Понятие. Биологическая роль. Примеры. Диагностическое значение определения изоферментов плазмы крови. Некоторые двухкомпонентные ферменты имеют несколько молекулярных форм –изоферменты. ИЗОФЕРМЕНТЫ – это множественные формы одного и того же фермента, которые имеют одинаковые коферменты, но разные апоферменты. Изоферменты действуют на один и тот же субстрат, ускоряют одну и ту же реакцию с ним, но находятся в разных органах и тканях (обладают органоспецифичностью) и отличаются по молекулярной массе, величине заряда и другим физико-химическим свойствам, что позволяет их разделить при электрофорезе. Органоспецифичность изоферментов играет важную роль в органной диагностике болезней, так как при патологии того или иного органа в кровь выходит определенный изофермент. СТРОЕНИЕ: Четвертичная структура, образованная четным количеством субъединиц (2, 4, 6 и т.д.). Изоформы фермента образуются в результате различных комбинаций субъединиц. Биологическая роль:Существование изоформ повышает адаптационную возможность тканей, органов, организма в целом к меняющимся условиям. Диагностическое значение определения:По изменению изоферментного состава оценивают метаболическое состояние органов и тканей. Изменение в онтогенезе: На примере ЛДГ (окисляет лактат до ПВК). В процессе индивидуального развития организма в тканях происходит изменение содержания кислорода и изоформ ЛДГ. У зародыша преобладают ЛДГ4, ЛДГ5. После рождения в некоторых тканях происходит увеличение содержания ЛДГ1, ЛДГ2. Изменения при патологии органа:На примере ЛДГ. ЛДГ1,2 работают в миокарде. Если в миокард не будет поступать кислород, там увеличится количество анаэробных субъединиц – ЛДГ4,5, что свидетельствует о патологии органа. Диагностическое значение: ЛДГ – при увеличении активности ЛДГ в плазме крови можно предположить повреждение одной из тканей организма (сердце, мышцы, печень). (В норме 170-520 ЕД/л) КК – (катализируют превращение кретина в креатинфосфат); определяют активность КК в плазме крови. В норме – 90 МЕ/л. Повышение ММ – травма мышц, ВВ – в крови не определяется даже при инсультах, т.к. не может проникнуть в кровь. Лактатдегидрогеназа – фермент, ускоряющий обратимую реакцию дегидрирования лактата (молочной кислоты) – реакцию см. в учебнике по алфавитному каталогу на «Лактат». Различают 5 изоферментов ЛДГ: ЛДГ1 – в сердце и почках; ЛДГ2 – преимущественно в почках, немного меньше в сердце; ЛДГ3 – в основном в почках; ЛДГ4 – в печени и мышцах; ЛДГ5 – в печени и мышцах (по сравнению с ЛДГ4 количество ЛДГ5 в печени и мышцах больше). Изоферменты ЛДГ отличаются друг от друга не только органоспецифичностью, но и строением апоферментов. Апофермент ЛДГ состоит из 4 субъединиц – в ЛДГ1 все 4 представлены легкими цепями (heart-цепи, от англ. сердце). В ЛДГ2 три цепи легкие, одна цепь – тяжелая (muscle-цепь, от англ. мышца). В ЛДГ3 2 цепи легкие, 2 цепи тяжелые. В ЛДГ4 – три цепи тяжелые, одна легкая, в ЛДГ5 – все 4 цепи тяжелые. Упрощенно можно считать, что ЛДГ1-3 – изоферменты сердца и почек; ЛДГ4-5 – изоферменты печени и мышц, причем ЛДГ4 в равной степени находится в печени и мышцах, а ЛДГ5 – преимущественно в мышцах. Переваривание липидов. Этапы. Промежуточные и конечные продукты гидролиза. Всасывание. Роль желчи. Нарушение процессов переваривания и всасывания липидов. Причины, проявления. Переваривание липидов. Поступающие с пищей ЛИПИДЫ в ротовой полости подвергаются только механической переработке. ЛИПОЛИТИЧЕСКИЕ ферменты в ротовой полости не образуются. Переваривание жиров у взрослого человека будет происходить в кишечнике, где для этого имеются все условия: 1. Наличие желчных кислот. 2. Наличие ферментов. 3. Оптимальная рН среды. У детей до 1 года в кишечнике выделяется ЛИПАЗА, рН оптимум находится в слабо кислой среде (рН = 5,0-5,5). Под влиянием этого фермента расщепляются только эмульгированные жиры молока. У взрослого человека желудочная липаза не активна, т.к. рН желудочного содержимого в норме лежит в резко- кислой среде (рН =1,5 - 2,5). Поэтому, переваривание жиров в желудке у взрослых людей не происходит. Основным местом переваривания липидов пищи в желудочно- кишечном тракте у взрослого человека служит тонкий отдел кишечника. В переваривании принимают участие желчные кислоты, образованные в печени, ЛИПОЛИТИЧЕСКИЕ ферменты, образованные в поджелудочной железе и слизистой оболочке кишечника. При поступлении пищи из желудка в двенадцатиперстную кишку в слизистой оболочке начинают выделяться регуляторы: СЕКРЕТИН, ХОЛЕЦИСТОКИНИН, ХИМОДЕНИН, ЭНТЕРОКРИНИН, которые обеспечивают: -образование желчи в печени, -сокращение желчного пузыря, -выделение панкреатического сока, -секрецию желез тонкого отдела кишечника. Важную роль в переваривании липидов в пищи играют желчные кислоты. Все они образуются в печени и являются конечным продуктом окисления холестерина в организме. В основе их строения лежит структура циклопентанпергидрофенантрена. Холевая кислота является источником образования желчных кислот. Всасывание триглицеридов и продуктов их расщепления. Всасывание происходит в проксимальной части тонкой кишки. Тонкоэмульгированныежиры (величина жировых капель эмульсии не должна превышать 0,5 мкм) частично могут всасываться через стенки кишечника без предварительногогидролиза. Основная часть жира всасывается лишь после расщепления его панкреатической липазой на жирные кислоты, моноглицериды иглицерин. Жирные кислоты с короткой углеродной цепью (менее 10 атомов углерода) и глицерин, будучи хорошо растворимыми в воде, свободно всасываются в кишечнике и поступают в кровь воротной вены, оттуда в печень, минуя какие-либо превращения в кишечной стенке. Более сложно происходит всасывание жирных кислот с длинной углеродной цепью и моноглицеридов. Этот процесс осуществляется при участиижелчи и главным образом желчных кислот, входящих в ее состав. В желчи соли желчных кислот, фосфолипиды и холестерин содержатся в соотношении 12,5:2,5:1,0. Жирные кислоты с длинной цепью и моноглицериды в просвете кишечника образуют с этими соединениями устойчивые в водной среде мицеллы. Структура мицелл такова, что их гидрофобное ядро (жирные кислоты, моноглицериды и др.) оказывается окруженным снаружи гидрофильной оболочкой из желчных кислот и фосфолипидов. Мицеллы примерно в 100 раз меньше самых мелких эмульгированных жировых капель. 3. Больной находится в стационаре по поводу перелома нижней челюсти. Ваша задача - ускорить образование костной мозоли. Назначьте этому больному соответствующие препараты. Препараты содержащие хондроитинсульфат, вит А(он влияет на образование хс, витС- процесс образования коллагена (гидроксилирование ПРО и ЛИЗ, коллаген. Рекомендованы продукты с содержанием Са, вит Д (он связывает Са) Сроки восстановления целостности кости напрямую зависят от гормонов, ответственных за образование кальция, и факторов роста организма. Следовательно, любые нарушения обмена веществ и гормональной системы могут ускорить или замедлить процесс регенерации костных тканей. Способность к образованию костной мозоли уменьшается с возрастом. У женщин за 35 и мужчин после 50 заметно снижается регенерация. У пожилых людей в костях заметны незаполненные пустоты. У некоторых пациентов могут появиться участки нежизнеспособной или денервированной кости. Это является признаком отсутствия регенерации в костных тканях. Значительно замедляют выздоровление гематомы в месте перелома, механическая нагрузка на поврежденный участок, недостаток мышечной ткани в больной области становится препятствием для полноценного кровообращения. При повреждении надкостницы и костного мозга скорость регенерации снижается, потому как именно эти элементы кости наращивают новую соединительную ткань для восстановления Билет № 2 Окислительно-восстановительные ферменты. Классификация. Строение коферментов. Биологическая роль оксидоредуктаз. Оксидоредуктазы - ферменты катализирующие окислительно-восстановительные реакции. При их участии протекают такие важнейшие физиологические процессы как дыхание и фотосинтез, происходят превращения жирных кислот, фенольных соединений, витаминов и других веществ. Окислительно-восстановительные реакции в живых организмах осуществляются за счет переноса протонов, электронов или присоединения кислорода. Оксидоредуктазы, катализирующие перенос водорода, имеют тривиальное название дегидрогеназы. Систематические названия ферментов этого класса составляют по схеме: донор водорода : акцептор водорода - оксидоредуктаза. В тех случаях, когда донор водорода точно не установлен, используют термин редуктаза. Реакции прямого присоединения кислорода к субстрату катализируют ферменты оксигеназы. Все ферментативные ОВР обратимы. Класс оксидоредуктазы подразделяется на подклассы в зависимости от того, какие группировки подвергаются окислению. В основу деленния на подподклассы положен химизм акцептора водорода (таблица 1). Ферменты класса Оксидоредуктазы
К этой группе ферментов относятся: 1) дегидрогеназы, отнимающие водород от окисляемого субстрата, 2) каталазы, расщепляющие перекись водорода, 3) пероксидазы, использующие перекиси для окисления различных соединений. Окисление субстрата путем дегидрирования представляет собой самый распространенный в живой природе способ окисления. Схематически реакция дегидрирования может быть показана уравнением: Субстрат (S), отдающий водород, называется донатором, или донором, а фермент, принимающий водород,— его акцептором. Фермент, принявший водород, передает его другим акцепторам: соответствующим ферментам—дегидрогеназам, различным органическим веществам или кислороду воздуха. В любом случае окисление субстрата непременно сопровождается сопряженным восстановлением какого-либо соединения, т. е. реакция является окислительно-восстановительной. Дегидрогеназы, как все ферменты, специфичны и называются по имени окисляемого субстрата: дегидрирующие этиловый спирт—алкогольдегидрогеназой, изолимонную кислоту—изоцитратдегидрогеназой и т. д. Все известные дегидрогеназы делятся на две большие группы: анаэробные, не способные использовать в качестве акцептора водорода кислород воздуха, и аэробные, способные передавать водород кислороду воздуха. Анаэробные дегидрогеназы представляют собой двухкомпонентные ферменты. Их кофермент обладает высокой реакционной способностью. Он отнимает водород от окисляемого субстрата и превращается в восстановленную форму НАД·Н2. Кофермент других анаэробных дегидрогеназ отличается от НАД тем, что имеет на один остаток фосфорной кислоты больше. В соответствии с этим он называется никотинамидадениндинуклеотидфосфат или сокращенно НАДФ. Так же, как НАД, НАДФ отнимает водород от окисляемого субстрата и превращается в восстановленную форму НАДФ·Н2. Свой водород анаэробные дегидрогеназы передают аэробным дегидрогеназам или различным органическим соединениям. НАД·Н2, например, способен передать водород уксусному альдегиду, который при этом превращается в этиловый спирт, а фермент переходит в окисленную форму и снова может вступить в реакцию с субстратом. Анаэробные дегидрогеназы, отнимающие водород от окисляемого субстрата, называются первичными деги-дрогеназами. Первичные дегидрогеназы НАД и НАДФ в клетке находятся в состоянии динамического равновесия. Под влиянием специального фермента они способны превращаться друг в друга: К аэробным дегидрогеназам в числе других относятся ферменты, содержащие в своей активной группе рибофлавин, витамин В2. Эти ферменты называются флавопротеидами (флавус—желтый). В окисленной форме они имеют желтый цвет, в восстановленной—бесцветны. Среди флавиновых коферментов наибольшее распространение имеют флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). ФМН входит в состав очень широко распространенного и хорошо изученного желтого дыхательного фермента, который играет важную роль в окислении углеводов. Субстратом для желтого фермента служит исключительно анаэробная дегидрогеназа и поэтому он называется дегидрогеназой восстановленного НАДФ. Он стоит вторым в последовательной цепочке дегидрогеыаз. ФАД—это активная группа ферментов, катализирующих окисление аминокислот. Восстановленные формы некоторых флавиновых ферментов способны передавать водород кислороду воздуха, но большинство передает его другим аэробным дегидрогеназам. Аэробные дегидрогеназы, которые в качестве акцептора водорода используют исключительно кислород, называются оксидазами. При восстановлении оксидазами кислорода образуются вода или перекись водорода. Субстратом для оксидаз служат восстановленные формы анаэробных и аэробных дегидрогеназ, а также различные органические соединения. Среди оксидаз особенно большое значение имеют полифенолоксидаза—компонент полифенольной системы и цитохромоксидаза, образующая вместе с цитохромами цитохромную систему. Полифенольная система состоит из хинона, полифенола и полифенолоксидазы. Хинон может служить акцептором водорода для дегидрогеназ. При этом он восстанавливается в полифенол. Полифенолоксидаза отнимает водород от полифенола и передает его кислороду воздуха. Полифенол при этом превращается в хинон и снова воспринимает водород от дегидрогеназы, Путь атомов водорода в полифенольной системе можно представить следующей схемой: 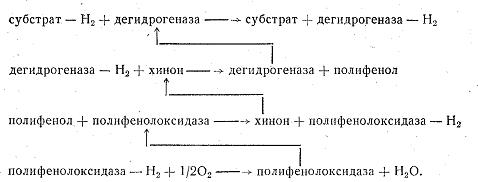 Полифенолоксидаза обнаружена в грибах, высших растениях и некоторых бактериях. Она способна окислять моно-, ди- и трифенолы. Полифенольная система имеет важное значение в процессах дыхания растений. Цитохромной системе принадлежит основная роль в передаче водорода от анаэробных и флавиновых дегидрогеназ молекулярному кислороду воздуха. В состав цитохромной системы входят убихиноны (жирорастворимые хиноны) и четыре цитохрома, представляющие собой протеиды, простетическая группа которых содержит железо. Железо цитохромов легко принимает и отдает электроны, т. е. легко переходит из окисной формы в закисную и обратно. Суть окислительно-восстановительных реакций, осуществляемых цитохромами, заключается в том, что один из них отнимает электрон от атома водорода, удерживаемого восстановленными формами анаэробных или флавиновых дегидрогеназ, и передает его другим цитохромам. Последний в цепочке цитохромов—фермент цитохромоксидаза. Он передает электрон кислороду воздуха и тем самым активирует его. Такой активированный кислород вступает в реакцию с ионизированным атомом водорода, образуя воду или перекись водорода. Таким образом, цитохромы не участвуют в переносе атомов водорода, а передают только электроны, меняя при этом свою валентность. Роль цитохромов в окислительных процессах иллюстрируется следующей схемой: 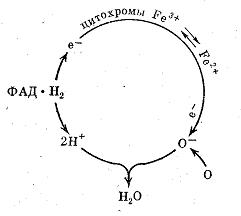 Цитохромы, по-видимому, являются универсальной ферментативной системой. Они обнаружены в клетках животных, растений и бактерий. Они участвуют в процессах дыхания, фотосинтеза и хемосинтеза. На рис. 21 показаны возможные пути переноса атомов водорода, осуществляемые дегидрогеназами. Как видно из схемы, путь атома водорода от субстрата до кислорода воздуха может быть различным. Рассматривая схему, следует иметь в виду специфичность ферментов и что один и тот же субстрат не всегда окисляется всеми представленными на схеме ферментами. Из схемы видно, что конечным акцептором водорода может быть не только кислород воздуха, но и органические соединения. Следует обратить внимание также на то, что даже в аэробных процессах первая стадия окисления может осуществляться анаэробными дегидрогеназами. Этот путь окисления у большинства микроорганизмов преобладает над всеми другими. Помимо дегидрогеназ к оксиредуктазам относятся ферменты пероксидаза и каталаза. Обе они представляют собой двухкомпонентные ферменты, в активную группу которых входит трехвалентное железо. Различия в их каталитической функции связаны с особенностями белков-носителей. Пероксидаза способна окислять различные органические соединения, используя кислород перекиси водорода или органических перекисей. Пероксидаза окисляет полифенолы, ароматические амины и играет важную роль в окислительных процессах, 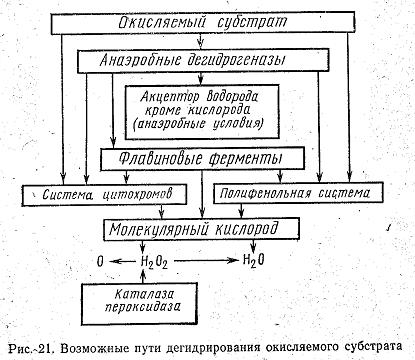 протекающих в организме. Каталаза расщепляет перекись водорода на воду и молекулярный кислород: препятствуя накоплению в организме ядовитой перекиси водорода и тем самым предохраняя клетки от отравления. Строение коферментов Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами: - ковалентными связями; - ионными связями; - гидрофобными взаимодействиями и т.д. Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента. Все коферменты делят на две большие группы: витаминные и невитаминные. Коферменты витаминной природы – производные витаминов или химические модификации витаминов. 1 группа: тиаминовые – производные витамина В1. Сюда относят: - тиаминмонофосфат (ТМФ); - тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза; - тиаминтрифосфат (ТТФ). -кетоглутаровая кислота. Этот фермент катализирует отщепление СОТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, . Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла. 2 группа: флавиновые коферменты, производные витамина В2. Сюда относят: - флавинмононуклеотид (ФМН); - флавинадениндинуклеотид (ФАД). Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД. [рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ] 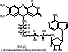 ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2 (над стрелкой – СДГ, под – ФАД и ФАДН-COOH2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах. 3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую. 4 группа: никотинамидные, производные витамина РР - никотинамида: Представители: - никотинамидадениндинуклеотид (НАД); - никотинамидадениндинуклеотидфосфат (НАДФ). Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2. Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н+] 5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат] - пиридоксин; - пиридоксаль; - пиридоксамин. Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ). ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК. Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма. 1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза). 2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д. 3) Пептиды(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH 4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ - амилазы, Mg2+ - АТФ-азы (например, миозиновой АТФ-азы). Могут участвовать в: -присоединении субстратного комплекса фермента; -в катализе; -стабилизация оптимальной конформации активного центра фермента; -стабилизация четвертичной структуры. Окислительно-Восстановительные ферменты: 1 класс: оксидоредуктазы: отдают или присоединяют электроны (или протоны). Делятся на 1)Дегидрогеназы 2)Оксидазы 3)Гидроксипероксидазы 4) Оксигеназы 1)Дегидрогеназы: аэробные – переносят протоны и электроны на кислород, катализируют отщепление водорода от S c использованием кислорода. Продукт: Н2О2, а не вода Кофермент: ФАД или ФМН H2S+ ФАД + O2 = ФАДН2+S+ О2 = S+ ФАД+Н2О2 Анаэробные –участвуют в процессах- 1)энергетический обмен клетки: ЦТК, ТД, 2)р-ии синтеза ВЖК, ХС. Анаэробные – НАД+ и ФАД зависимые Пример: а) АДГ: Этанол + НАД+ (фермент АДГ)= ацетальдегид +НАДН2 Б) ЛДГ ПВК+ НАДН2 (фермент ЛДГ)= лактат + НАД В) сукцинат + ФАД (фермент – сукцинатдегидрогеназа) = фумарат + ФАДН2 Коферменты дегидрогеназ- динуклеотиды: НАД+, НАДФ, ФАД, ФМН. 2)Оксидазы - отщепляют Н2 от субстрата - используют О2, но в отличие от аэроб ДГ их продуктом является Н2О - обязательно содержит медь или железо (металл с переменной валентностью), благодаря этому они легко связывают электроны и приносят их на кислород - во внутренней мембране митохондрий. Цитохромы и цитохромоксидазы – содержат гем, в котором железо может переходить Fe +2 = Fe +3 = переносят электроны на кислород. Цитохром в=цит с1=цит с=цит а= цит а3= кислород 4Н+ + 2О-2= 2Н2О 3)Гидроксипероксидазы - используют в качестве субстрата перекись водорода или органические перекиси - обезвреживают перекиси Четырехэлектронное восстановление килорода до эндогенной воды. Участвуют в нейтрализации АФК: 2Н2О =(неталаза)= Fe+2 + 2Н2О+О2 Н2О2 + 2Г-SH =(Se-глутатионпероксидаза) = 2Н2О+ ГS-SГ аООН + 2Г-SH = аОН+Н2О + ГS-SГ Г-SH – глутатион, трипептид, содержит цистеин Ферменты антиоксидантной защиты 4)Оксигеназа -катализируют прямое введение кислорода в молекулу субстрата - не участвует в образовании энергии, но участвует в синтезе и деградации многих типов метаболитов: гормонов, нейромедиаторов, биогенных аминов - участвует в обезвреживании многих токсических вещ-в. *Гидроксилазы ФЕН (фенилаланин-гидроксилаза) + ½ О2= тирозин +1/2 О2=ДОФА=Дофамин +1/2О2= НА+СН3=адреналин Оксигеназы выполняют обезвреживающую ф-ию: система микросомального окисления ксенобиотиков. - ферменты нуждаются в О2 и НАДФН - неспецифичны в отношении субстрата - использ 1 молекулу О2 для оксил молекулы ксенобиотиков. О2=О+субстрат и О+Н2=Н2О Система цитохром Р450 участвует: - в окислении эндогенных и экзогенных вещ-в - в обмене стероидов, желчных кислот, неспецефических ЖК - в нейтрализации ксенобиотиков: лекарств, ядов Токсин(R-H) + НАДФН2 +О2= (цитохром Р450)= R-OH +Н2О + НАДФ - окисленное вещ-во становится растворимым = вывод почками - образование группы –ОН затрядняет проникнов токсина обратно в ткани - в таком виде в-во легко образует парные соединения с серой (ФАФС) или глюкуронов (УДФГК) в печени = снижение токсичности Белки эмали. Классификация. Представители. Биологические функции. Эмаль – наиболее твердая, резистентная к изнашиванию минерализированная ткань, которая снаружи покрывает коронку зуба. По прочности она не уступает мягкой стали. Главная функция эмали, состоит в защите расположенных глубже тканей дентина и пульпы от воздействия внешних раздражителей, а также в сохранении зуба при захвате, откусывании, пережевывании жесткой пищи. Эмаль располагается поверх дентина и тесно с ним связана структурно и функционально, как в процессе развития зуба, так и после завершения его формирования. Толщина слоя эмали максимальна в области жевательных бугров, где она достигает 2,3 мм, на латеральных поверхностях она 1– 1,3 мм и ее практически нет у шейки, в месте соединения с цементом. МИНЕРАЛЬНЫЕ КОМПОНЕНТЫ ЭМАЛИ 1) гидроксиапатит – Са8(РО4)6(ОН)2 в эмали зуба 75% ГАП – самый распространенный в минерализованных тканях 2) карбонатный апатит – КАП – 19% Са10(РО4)5(СО3)2OH – мягкий, легко растворимый в слабых кислотах, целочах, легко разрушается 3) хлорапатит 4,4% мягкий 4) стронцевый апатит (САП) Са8Sr2(PO4)6(OH)2 - 0,9% не распространен в минеральных тканях и распространен в неживой природе. Соотношение Са/Р – 1,67 соответствует идеальному соотношению, но ионы Са могут замещаться на близкие по свойству химические элементы Ва, Сr, Mg. При этом снижается соотношение Са к Р, оно уменьшается до 1,33%, изменяются свойства этого апатита, уменьшается резистентность эмали к неблагоприятным условиям. В результате замещения гидроксильных групп на фтор, образуется фторапатит, который превосходит и по прочности и по кислотоустойчивости ГАП. СаF - он прочный, твердый, легко выщелачивается. Если рн сдвигается в щелочную сторону, происходит разрушение эмали зуба, крапчатость эмали, флюороз. Стронцевый апатит – в костях и зубах животных и людей, живущих в регионах с повышенным содержанием радиоактивного стронция, они обладают повышенной хрупкостью. Кости и зубы становятся ломкими, развивается стронцевый рахит, беспричинный, множественный перелом костей. В отличие от обычного рахита, стронцевый не лечится витамином Д. БЕЛКИ ЭМАЛИ Выделяют 3 группы белков эмали: 1) Нерастворимые в НСl, 2) Растворимые в НСl кальций связывающие белки эмали, 3) Водорастворимые белки. На белки, нерастворимые в ЭДТА и НCl приходится ¼ всех белков эмали. Это β-складчатые белки гликофосфопротеины. Они содержат глюкозамины, галактозамины, сиаловые кислоты. Эти белки проявляют высокое сродство к кол¬лагену и эластину и играют роль ложа кристалла. Они формируют сетчатую структуру и на них крепится кальций связывающие белки эмали. Этот белок является функциональной единицей белко¬вой матрицы. Белки растворимые вНСl составляют ¾ белков эмали. Большинство из этих белков - кальций связывающие белки. Они имеют небольшую массу, но образуют олигомерную структуру, связываясь с ионами кальция. белок – Са – белок – Са - белок I Ca Кроме кальциевых мостиков кальций связывающие белки связывается с кристаллами гидроксиапатитов и фибрилярным белком. С белками связаны фосфолипиды, участвующие в кальцефикации ткани. Кальций связывающий белок способен связать 8-10 ионов Са2+. При этом часть это¬го кальция используется на создание белковой трехмерной матричной сетки, а другая - на взаимодействие этой сетки с гидроксиапатитом эмали. Кроме того, в образовании агрегатов с кальций связывающими белками большую роль играют фосфолипиды, которые составляют мостик - связь между белками и минеральной фазой. Субъединицы белка образуют особую трехмерную сетку из длинных перегородок, которые связаны между собой через одинаковые интервалы поперечными Са-мостиками. Центрами нуклеации являются именно эти перегородки благодаря наличию функциональных групп (фосфатных гоуппфосфосе¬рина и фосфолипидов и карбоксильных групп аспарагиновой и глутаминовой кислот и др.) Кристаллы формируются на перегородках с обеих сторон. Это обеспечивает их строго упорядоченное расположение, ре¬гулярность строения, прочность и другие свойства эмали. РОЛЬ БЕЛКОВ ЭМАЛИ По мере завершения минерализации белковые перегородки все больше погружаются в кристаллы. Таким образом, кальций связывающий белок и, возможно, белок, нерастворимый в НCl, ориентируют ход кристаллизации, обеспечивая упорядоченность эмали. Важную роль играют адгезивные белки связывают различные составные компоненты межклеточного матрикса. Наиболее важными представителями являются ламинин и фибронектин. Белки эмали играют еще одну очень важную роль. Белковая сеть, окружающая апатиты, предотвращает контакт апатитов с кислотами, смягчая их влияние, защищая кристаллы апатита от раство¬рения. С возрастом увеличивается уровень белка в наружном слое эмали и при этом увеличивается устойчивость твёрдых тканей зуба к кариесу. Представьте себе, что Вы зимой в лесу нашли голодного и полузамерзшего человека. Из художественной литературы Вы знаете, что в таких случаях принято давать выпить некоторое количество спирта, что Вы и сделали. Через некоторое время человек окончательно потерял сознание. В чем Ваша ошибка? С чем связано ухудшение состояния? Коллапс - тяжелая форма сосудистой недостаточности, угрожающая жизни и развивающаяся в результате угнетения сосудодвигательного центра, который находится в головном мозгу. При этом снижается артериальное давление, происходит перераспределение крови в сосудах - в органах брюшной полости она скапливается в гораздо большем количестве, чем в головном мозгу. Таким образом, наступает кислородное голодание тканей и органов мозга и сердца. Коллапс может наступить при резкой кровопотере, кислородном голодании, нарушении питания, травмах, отравлениях Первая помощь при коллапсе Срочно вызывают врача. Больного укладывают в горизонтальное положение без подушки, нижнюю часть туловища и конечности несколько приподнимают. На ватке дают нюхать нашатырный спирт. Делают обильную ингаляцию кислорода. К ногам прикладывают горячие грелки. Дают горячее питье. После нормализации состояния больного госпитализируют в отделение (палату) интенсивной терапии. Алкоголь расширяет сосуды, поверхностные капилляры кожи. При этом всё тепло вашей крови начинает обогревать воздух вокруг вас. Температура тела снижается - и внутренние органы охлаждаются. Заведующий кафедрой медицинской химии, д.б.н., доцент Д.В.Суменкова Государственное бюджетное образовательное учреждение высшего профессионального образования Билет № 3 Окислительное фосфорилирование. Понятие. Хемоосмотическая теория сопряжения. Значение разности электрохимического потенциала. Разобщители. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. Поскольку АТФ необходим для осуществления мн. процессов, требующих затраты энергии (биосинтез, совершение мех. работы, транспорт в-в и др.), Окислительное фосфорилирование играет важнейшую роль в жизнедеятельности аэробных организмов. Образование АТФ в клетке происходит также благодаря др. процессам, напр. в ходе гликолиза и разл. типов брожения, протекающих без участия кислорода. Их вклад в синтез АТФ в условиях аэробного дыхания составляет незначит. часть от вклада окислительного фосфорилирования (ок. 5%). биохимика П. Митчелла (1961). Он высказал предположение, что поток электронов через систему молекул-переносчиков сопровождается транспортом ионов Н+ через внутреннюю мембрану митохондрий. В результате на мембране создается электрохимический потенциал ионов Н + , включающий химический, или осмотический, градиент (АрН) и электрический градиент (мембранный потенциал). Согласно хемиосмотической теории электрохимический трансмембранный потенциал ионов Н+ и является источником энергии для синтеза АТР за счет обращения транспорта ионов Н+ через протонный канал мембранной Н + -АТРазы. Разобщители — липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс(его протонный канал). Разобщители: Естественные — продукты перекисного окисления липидов, жирных кислот с длинной цепью; большие дозы тиреоидных гормонов. Искусственные — динитрофенол, эфир, производные витамина К, анестетики. Кетоновые тела. Образование. Биологическая роль. Причины и последствия кетоза. Кетоновые тела (синоним ацетоновые тела) — группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. К кетоновым телам относят b-оксимасляную и ацетоуксусную кислоты и ацетон, имеющие сходное строение и способные к взаимопревращениям. Появление повышенных количеств К. т. в крови и моче является важным диагностическим признаком, свидетельствующим о нарушении углеводного и жирового обменов. Главным путем синтеза К. т., происходящего в основном в печени, считается реакция конденсации между двумя молекулами ацетил-КоА (см. Коферменты), образовавшегося при b-окислении жирных кислот (см. Жировой обмен) или при окислительном декарбоксилировании пирувата (пировиноградной кислоты) в процессе обмена глюкозы и ряда аминокислот. Этот путь синтеза К. т. более других зависит от характера питания и в большей степени страдает при патологических нарушениях обмена веществ. Из печени К. т. поступают в кровь и с нею во все остальные органы и ткани, где они включаются в универсальный энергообразующий цикл — цикл трикарбоновых кислот, в котором окисляются до углекислоты и воды. К. т. используются также для синтеза холестерина, высших жирных кислот, фосфолипидов (см. Липиды)изаменимых аминокислот. При голодании, однообразном безуглеводистом питании и при недостаточной секреции инсулина использование ацетил-КоА в цикле трикарбоновых кислот подавляется, т.к. все метаболически доступные ресурсы организма превращаются в глюкозу крови. В этих условиях увеличивается синтез К. т. При повышении содержания К. т. в крови они начинают выводиться с мочой, а также с выдыхаемым воздухом в виде ацетона. Наиболее значительное повышение концентрации К. т. в крови (гиперкетонемия) наблюдается при диабетической (кетоацидотической) коме (см. Диабет сахарный). Интенсивное образование К. т. происходит при приеме с пищей так называемых кетогенных аминокислот (лейцина, тирозина, фенилаланина, изолейцина), некоторых белков и большого количества жиров (при усиленной мобилизации жира из жировых депо). Щелочные соли также проявляют кетогенный эффект, который обусловлен вызываемым ими нарушением функционирования цикла трикарбоновых кислот. Введение с пищей углеводов тормозит образование К. т. Инсулин стимулирует синтез жирных кислот из ацетил-КоА и активирует использование последнего в цикле трикарбоновых кислот, в результате чего снижается интенсивность синтеза К. т. У здорового взрослого человека в сыворотке крови содержится 34,4—430,5 мкмоль/л (0,2—2,5 мг/100 мл) кетоновых тел (в пересчете на ацетон), в эритроцитах концентрация К. т. меньше; с мочой за сутки выделяется 20—54 мг кетоновых тел. Такие концентрации К. т. не могут быть определены обычными методами, используемыми в клинике, поэтому принято считать, что в норме в крови к моче К. т. нет. Кетонемию и кетонурию наблюдают при сахарном диабете, углеводном голодании, лихорадочных состояниях, общем голодании и истощении (повышен кетогенез), приеме богатой кетогенными веществами пищи (усилен кетогенез), при приеме значительных количеств щелочных веществ, при состояниях после операций, гликогенозах I, II и VI типа (нарушен кетолиз), гиперинсулинизме, тиреотоксикозе, выраженной глюкозурии, акромегалии, гиперпродукции глюкокортикоидов, инфекционных болезнях (скарлатине, гриппе, туберкулезном менингите и др.) и тяжелых интоксикациях (например, при отравлении свинцом) и др. Следствием кетонемии являются метаболический ацидоз, или кетоацидоз, и ацетоновое отравление (ацетон растворяет структурные липиды клеток), при которых нарушается транспорт глюкозы через биологические мембраны и резко угнетается деятельность ц.н.с. У больного остеомаляция нижней челюсти, осложненная тяжелым заболеванием печени. Почему лечение витамином D может оказаться неэффективным? Дайте биохимическое обоснование этому явлению. Остеомаляция возникает из-за дефицита одного из двух важнейших минералов: кальция и фосфора. Кальципения возникает вследствие дефицита витамина D и его метаболитов Нарушенный метаболизм витамина D3. Т.к. активная форма его, 24,25 диоксихолекальциферол, образуется в печени.  Заведующий кафедрой медицинской химии, д.б.н., доцент Д.В.Суменкова Билет № 4 Транскрипция. Процессинг. Основные этапы. Регуляция. Значение. Транскрипция – синтез РНК на базе ДНК. Процесс катализируют РНК-полимеразы, которые образуют полирибонуклеотиды в соответствии с принципом комплементарности к матричной нити ДНК. Все РНК-полимеразы осуществляют рост новых цепей РНК в направлении от 5'-→3'-концу. Транскрипция,как и репликация, — эндэргонический процесс, в котором используются НТФ: АТФ, ГТФ, ЦТФ, УТФ как субстраты синтеза и источники энергии. РНК- полимераза I – катализирует образование рРНК РНК-полимераза II – катализирует образование мРНК РНК-полимераза III – катализирует образование тРНК Этапы транскрипции: Инициация РНК-полимераза узнает место начала транскрипции — промотор, имеющий специфическую последовательность нуклеотидов: –ТАТА. На стадии инициации к –ТАТА-последовательности присоединяется белок ТАТА-фактор, который стимулирует связывание с ДНК РНК-полимеразы и факторов инициации транскрипции. Образующийся комплекс вызывает расплетение двойной нити ДНК длиной в один виток спирали (около 10 нуклеотидных пар). Элонгация Происходит синтез РНК в соответствии с информацией, содержащейся в гене ДНК, при этом факторы инициации удаляются, а фактор элонгации присоединяется. Терминация Этап терминации начинается, когда РНК-полимераза достигает специфической последовательности нуклеотидов — сайта терминации, расположенного на конце гена. Фактор элонгации отделяется от РНК-полимеразы, а при- соединяется фактор терминации, который облегчает отделение РНК-продукта и фермента от матрицы ДНК. Процессинг- совокупность событий, связанных с претрансляционным преобразованием первичного РНК транскрипта (преРНК превращается в зрелые мРНК). К 5 концу РНК добавляется кэп (метилированный гуаниновый нуклеотид- 7-метил-ГТФ.).Кэп защищает 5 конец мРНК от действия нуклеаз и узнается рибосомами в ходе инициации трансляции. К 3 концу РНК присоединяется поли А хвост(последовательность из 100-200 остатков адениловый кислоты, которая участвует в транспорте РНК из ядра в цитоплазму.) Сплайсинг- процесс формирования зрелой иРНК путем удаления внутренних частей молекулы – интронов. Интрон- некодирующий участок гена, который переписывается а РНК. Экзон-значащий участок гена, на котором записана информация о порядке аминокислот в молекуле белков. Энхансер- регуляционный участок ДНК, усиливающий транскрипции с ближайшего к нему промотора. Особенности метаболизма лейкоцитов. Кислородозависимые и кислородонезависимые механизмы бактерицидного действия нейтрофильных лейкоцитов. Роль в воспалительных заболеваниях тканей ротовой полости. Особенности биохимии моноцитов. Лейкоциты: 1. Лейкоциты являются полноценными клетками с большим ядром, митохондриями и высоким содержанием нуклеиновых кислот. 2. В лейкоцитах активно протекают процессы биосинтеза нуклеиновых кислот и белков. 3. Основной путь получения энергии – аэробный гликолиз. АТФ образуется также в реакциях β-окисления жирных кислот. 4. В лейкоцитах сосредоточен весь гликоген крови, который является источником энергии при недостаточном её поступлении. 5. В лизосомах лейкоцитов локализована мощная система протеолитических ферментов – протеазы, фосфатазы, эстеразы, ДНК-азы, РНК-азы, что обеспечивает участие этих клеток в защитных реакциях организма. В результате действия этих ферментов разрушаются полимерные молекулы микроорганизмов и образуются мономеры (моносахариды, аминокислоты, нуклеотиды), которые поступают в цитозоль и могут использоваться клеткой. 6. Поглощение бактерий лейкоцитами в процессе фагоцитоза сопровождаются резким увеличением потребления кислорода с образованием супероксидного аниона и пероксида водорода (см. лекцию № 11), которые оказывают бактерицидное действие. Это явление называется «распираторным взрывом». Назначьте биохимическое обследование больному, у которого Вы подозреваете наличие патологического процесса в поджелудочной железе. Нарушения пищеварения при расстройствах экскреторной функции pancreas определяются ролью ее ферментов в пищеварительном процессе. Панкреатический сок содержит три фермента: амилазу - фермент, воздействующий на углеводы; трипсиноген - протеолитический фермент; липазу - фермент, расщепляющий жиры.Получется что если активность этих ферментов в крови понижена то и экскреторная функция поджелудочной тоже снижена.Вот. Для определения экскреторной активности поджелудочной железы нужно определить активность пищеварительных ферментов, которые она секретирует: амилазы, панкреатической липазы, трипсина и химотрипсина. биохимический анализ крови (амилаза панкреатическая, липаза, глюкоза, холестерин, трипсин, для оценки внешнесекреторной недостаточности поджелудочной железы - копрограмму и определение панкреатической эластазы в кале Заведующий кафедрой медицинской химии, д.б.н., доцент Д.В.Суменкова |
