шпора по анату. билеты с ответами-3. Билет 1 Изоферменты. Понятие. Биологическая роль. Примеры. Диагностическое значение определения изоферментов плазмы крови
 Скачать 0.96 Mb. Скачать 0.96 Mb.
|
Билет № 61. Превращение глюкозы в пентозном цикле. Ход процесса. Регуляция. Значение. Это сложный процесс, протекающий в цитоплазме с участием многочисленных ферментов. Этот процесс протекает в анаэробных условиях, в реакции вступают 6 молекул глюкозо-6-монофосфата, окисление сопровождается образованием 6 молекул СО2, 12 НАДФН2 и промежуточных продуктов, таких как фруктозо-6-фосфат, ФГА, пентозы. Различают 3 этапа пентозного цикла, каждый этап включает несколько реакций. 1 этап – окислительная фаза – осуществляется дегидрогеназно-декарбоксилазной системой. Эта фаза начинается с дегидрирования 6 молекул гл-6-ф с помощью гл-6-фДГ (НАДФ). При этом образуются восстановленные НАДФН2 и фосфоглюконолактон, который снова дегидрируется НАДФ-зависимым ферментом и декарбоксилируется и через ряд промежуточных реакций превращается в пентозо-5-фосфат. 2 этап – катализируется изомеразами. На этом этапе происходит изомеризация пентозофосфатов. 3 этап – участвуют ферменты структурной перестройки углеводов. Образуются углеводы с различным количеством углеродов, в этих реакциях участвуют транскетолазы (Ко – вит В1). В качестве промежуточных продуктов ПФЦ образуются 2 молекулы ФГА и 4 молекулы фр-6-ф. Эти продукты могут включаться в гликолиз, а в основном 2 ФГА образуют фр-6-ф, и количество фр-6-ф увеличивается до 5. 5 молекул фр-6-ф изомеризуются до гл-6-ф. Гл-6-ф может снова включиться в ПФЦ, для этого надо добавить еще одну молекулу гл-6-ф. Значение пентозофосфатного пути окисления глюкозы: За счет ПФЦ примерно 50% покрывается потребность организма в НАДФН2. НАДФН2, образованный в цикле может использоваться для следующих процессов – 1. В реакциях биосинтеза СЖК, ХС и КС, 2. В реакциях гидроксилирования при обезвреживании ксенобиотиков и некоторых эндогенных метаболитов, 3. В реакции восстановительного амминирования для обезвреживания аммиака и образование заменимых аминокислот. 4. Для восстановления окисленного глутатиона при участии ФАД-зависимого фермента ГР. 5. Для работы НАДФН-оксидазной системы клеток крови. 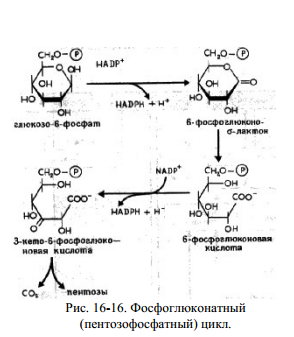 2. Строение ферментов. Ферменты-протеины и ферменты-протеиды. Понятие об активном центре. Коферменты, их функции. Примеры. Апоферменты, их роль. Ферменты – это специализированные белки, образуются в клетках и способны ускорять биохимические процессы, т.е. это биологические катализаторы. Многие ферменты для проявления каталитической активности нуждаются в присутствии некоторых веществ небелковой природы – кофакторов. Различают 2 группы кофакторов – ионы металлов (а также некоторые неорганические соединения) и коферменты, которые представляют собой органические вещества. В числе коферментов есть такие, которые содержат металлы (железо в геме, кобальт в кобаламиде). Фермент, содержащий кофермент, называется холофермент, его белковая часть называется апофермент (двухкомпонентные, или сложные ферменты). Кроме этого различают простые (однокомпонентые ферменты) – состоят только из белковой части. Сходства ферментов и неорганических катализаторов: катализируют только энергетически возможные реакции; не изменяют равновесия в обратимых реакциях; не изменяют направление реакции; не расходуются в результате реакции. Отличия между ферментами и неорганическими катализаторами (общие свойства ферментов): сложность строения; высокая мощность действия. За единицу фермента принимают такое его количество, которое катализирует превращение 1мкМ вещества за 1 минуту; специфичность; это вещества с регулируемой активностью; действуют в мягких условиях организма. В связи с этим различают 6 классов ферментов: Оксиредуктазы (ОР) – ускоряют окислительно-восстановительные реакции (ОВР); Трансферазы – ускоряют перенос различных групп атомов с одного вещества на другое; Гидролазы – ускоряют расщепление сложных веществ до простых с участием воды (т.е. путем гидролиза); Лиазы – ускоряют реакции распада веществ без участия воды или способствуют присоединению групп атомов по месту разрыва двойных связей; Изомеразы – ведут реакции изомеризации; Лигазы, или синтетазы – ускоряют синтез веществ за счет соединения молекул между собой. Номенклатура ферментов Каждый класс делится на несколько подклассов (от 4-13), подкласс делится на подподкласс, каждый подподкласс содержит представители. Поэтому для каждого фермента существует шифр, состоящий из 4 цифр – первая показывает номер класса, вторая – номер подкласса, третья – номер подподкласса, четвертая цифра указывает порядковый номер фермента в его подподклассе. Например, шифр для липазы поджелудочной железы (п/ж) – 3.1.1.3., это означает, что липаза п/ж относится к гидролазам, (третий класс, т.е. ускоряет гидролиз), к первому подклассу – эстеразам (т.е. ускоряет гидролиз сложно-эфирных связей), к первому подподклассу (т.е. ускоряет гидролиз сложно-эфирных связей, образованных карбоновыми кислотами), место в подподклассе – третье. Сложность строения Ферменты по химической природе – этот белки. В отличие от белков у ферментов имеется активный центр(АЦ). АЦ – это уникальная для каждого фермента совокупность функциональных групп аминокислотных остатков, строго ориентированных в пространстве за счет третичной или четвертичной структуры фермента. В АЦ различают субстратный и каталитический участки. Субстратный – это «руки» фермента. Он обуславливает субстратную специфичность фермента, т.е. сродство фермента к субстрату. Субстрат - это вещество, на которое действует фермент. Раньше считали, что взаимодействие фермента и субстрата происходит по типу «ключ к замку», т.е. АЦ фермента должен точно соответствовать субстрату, как ключ к замку. Сейчас считается, что точного соответствия между ферментом и субстратом нет, оно возникает в процессе взаимодействия фермента с субстратом (теория вынужденного соответствия). Второй участок в АЦ – каталитический. Он обуславливает специфичность действия фермента, т.е. тип ускоряемой реакции. По строению все ферменты можно разделить на однокомпонентные (простые, или ферменты-протеины) и двухкомпонентные (сложные, или ферменты-протеиды). Ферменты-протеины построены по типу простых белков – состоят только из аминокислот. Ферменты-протеиды состоят из белковой части –апоферментаи небелковой части – кофермента. Апофермент обуславливает субстратную специфичность, т.е. играет роль субстратного участка АЦ, а кофермент играет роль каталитического участка АЦ, т.е. обуславливает специфичность действия. Коферментами могут быть металлы, витамины и другие небелковые низкомолекулярные вещества. Некоторые ферменты, имеющие четвертичную структуру помимо АЦ могут иметь аллостерический центр.Он служит для регуляции активности ферментов. В составе фермента выделяют области, выполняющие различную функцию: 1. Активный центр– комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом могут располагаться аминокислоты, значительно удаленные друг от друга в линейной цепи. У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр. У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора. В свою очередь в активном центре выделяют два участка: якорный(контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре, каталитический – непосредственно отвечает за осуществление реакции. 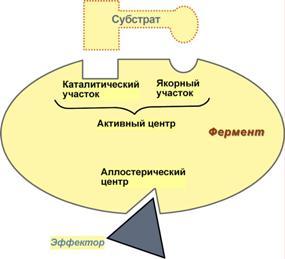 Схема строения ферментов 2. Аллостерический центр (allos– чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение пространственной конфигурации белка-фермента (активного центра) и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество. Аллостерические ферменты в большинстве случаев являются белками с четвертичной структурой, при этом активный и регуляторный центры могут находиться в разных субъединицах. КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы. Они чаще всего содержат в своём составе различные витамины, следовательно, их делят на две группы: 1.Витаминные. 2.Невитаминные. 1.ТИАМИНОВЫЕ в составе витамин В1 (ТИАМИН) - ТМФ – ТИАМИНМОНОФОСФАТ, ТДФ- ТИАМИНДИФОСФАТ, ТТФ - ТИАМИНТРИФОСФАТ. ТПФ связана с ферментами ДЕКАРБОКСИЛАЗАМИ альфа КЕТОКИСЛОТ (ПВК, альфа КГК) 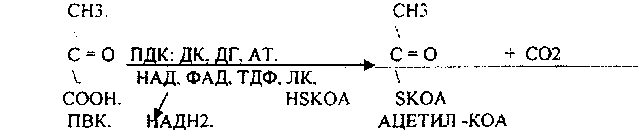 2.ФЛАВИНОВЫЕ содержат витамин В2 - ФМН – ФЛАВИНМОНОНУКЛЕОТИД, ФАД - ФЛАВИИАДЕНИНДИНУКЛЕОТИД. ФМН и ФАД связанны с ферментами ДЕГИДРОГЕНАЗАМИ. Участвуют в реакциях ДЕГИДРИРОВАНИЯ. 3. ПАНТОТЕИНОВЫЕ (витамин ВЗ) - KOF A (HS-KOA - HS КОЭНЗИМ А) - КОФЕРМЕНТ АЦИЛИРОВАНИЯ. 4. НИКОТИНАМИДНЫЕ содержат витамин РР (НИАЦИН)- НАД (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД), НАДФ (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ). Связаны с ДЕГИДРОГЕНАЗАМИ:  5.ПИРИДОКСИНОВЫЕ содержат витамин В6. ПАФ – ПИРИДОКСАМИНОФОСФАТ, ПФ - ПИРИДОКСАЛЬФОСФАТ.: 1.Реакции ПЕРЕАМИНИРОВАНИЯ (ТРАНСАМИНИРОВАНИЕ). Связан с ферментами АМИНОТРАНСФЕРАЗАМИ. 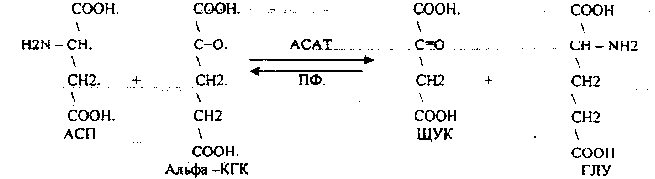 2.РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ АК. 3. С целью профилактики кариеса врачи-стоматологи рекомендуют ограничить в рационе сладости, а также применять зубные пасты, содержащие кальций и фтор. Обоснуйте с биохимических позиций эти рекомендации. Фтор – участвует в начальных этапах минерализации, обладает высоким сродством к белку матрикса эмали. Фтор придает кристалла фтораппатита большую упорядоченность, снижая тем самым их растворимость при физиологическом значении рН. Экзогенный фтор замещает гидроксил-ион в уже образованных ранее кристаллах гидроксиаппатита, это замещение происходит в первую очередь в наружных слоях эмали, что снижает их растворимость. Фтор облегчает процессы реминерализации эмали и обладает антибактериальным действием благодаря изменению термодинамических характеристик эмали. Кальций – структурно- опорная функция (гидроксиаппатит) Сладости – зубной налет содержит микроорганизмы, которые легко и быстро превращают углеводы в кислоты (молочную, уксусную, пропионовую). Общая совокупность кислых продуктов зубной бляшки повреждают минеральные компоненты эмали. Заведующий кафедрой медицинской химии, д.б.н., доцент Д.В.Суменкова Билет № 7 Катаболизм гемоглобина. Этапы. Свойства гем- и холебилирубина. Желтухи, формы, причины. Изменения со стороны биохимического состава крови, мочи, содержимого кишечника. Нb состоит из 4-х гемсодержащих белковых субъединиц (протомеров) соединенных гидрофобными, ионными, водородными связями по принципу комплементарности. За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов. Эритроциты живут 90-120 дней, после чего лизируются в кровеносном русле или в селезенке. 1-й этап – внутриэртроцитарный . Гемоглобин при разрушении эритроцитов в кровеносном русле образует комплекс с белком-переносчиком гаптоглобином, который захватывается клетками ретикуло-эндотелиальной системы (РЭС) (селезенка, печень и костный мозг). 2-й этап – эритрофагальный…Весь эритроцит фагоцитируется эритрофагами - клетками ретикуло-эндотелиальной системы (РЭС) селезенки, печени и костного мозга. 3-й этап – гепато-целлюлярный.. ( две формы билирубина: - гембилирубин (свободный), попадающий сюда из клеток РЭС (около 80% общего билирубина),- холебилирубин (связанный), попадающий из желчных протоков (до 20% общего билирубина).))) 4-й этап – энтенральный…Всосавшийся (10%) в кровоток мезобилиноген попадает в печень, где окисляется до ди- и трипирролов. В норме мезобилиногена (уробилиногена) в крови и моче нет, он полностью окисляется в гепатоцитах до ди-, трипирролов и выводится с мочой. В толстом кишечнике: мезобилиноген восстанавливается до стеркобилиногена и выделяется из организма, окрашивая кал. Часть стеркобилиногена попадает в большой круг кровообращения и выделяется с мочой. На воздухе стеркобилиноген превращаются, соответственно, в стеркобилин (в кале) и уробилин (в моче). Увеличение образования билирубина (гемолитическая желтуха) Поражение печени - угнетение конъюгационных или выделительных механизмов печени (паренхиматозная желтуха) Нарушение нормального пассажа желчи (механическая желтуха) Гемолитическая или надпеченочная желтуха – причина - внутрисосудистый гемолиз. Кровь: увеличение гембилирубина, холебилирубин в норме,Кал: увеличение стеркобилина,Моча: увеличение уробилина, пирролов. Гембилирубин отсутствует Перенхиматозная или печеночная желтуха – причина – патология печени Кровь: увеличение холебилирубина, увеличение гембилирубина,Кал: снижение или норма стеркобилина,Моча: появление холебилирубина, появление мезобилиногена Обтурационная или подпеченочная желтуха – причина – патология желчных путейКровь: резкое увеличение холебилирубина, увеличение гембилирубина, Кал: снижение стеркобилина (обесцвечен),Моча: появление холебилирубина, нет мезобилиногена, нет пирролов. Физиологическая (транзиторная) желтуха новорожденных Причины: относительное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина, абсолютное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни,дефицит лигандина, слабая активность желчевыводящих путей. Ферменты класса трансфераз. Характеристика. Представители. Биологическая роль. Диагностическое значение определения трансаминазной активности сыворотки крови. Диагностическое значение определения аспартатаминотрансферазы в ротовой жидкости. Ферменты – это специализированные белки, образуются в клетках и способны ускорять биохимические процессы, т.е. это биологические катализаторы. Многие ферменты для проявления каталитической активности нуждаются в присутствии некоторых веществ небелковой природы – кофакторов. Различают 2 группы кофакторов – ионы металлов (а также некоторые неорганические соединения) и коферменты, которые представляют собой органические вещества. В числе коферментов есть такие, которые содержат металлы (железо в геме, кобальт в кобаламиде). Фермент, содержащий кофермент, называется холофермент, его белковая часть называется апофермент (двухкомпонентные, или сложные ферменты). Кроме этого различают простые (однокомпонентые ферменты) – состоят только из белковой части. Сходства ферментов и неорганических катализаторов: катализируют только энергетически возможные реакции; не изменяют равновесия в обратимых реакциях; не изменяют направление реакции; не расходуются в результате реакции. Отличия между ферментами и неорганическими катализаторами (общие свойства ферментов): сложность строения; высокая мощность действия. За единицу фермента принимают такое его количество, которое катализирует превращение 1мкМ вещества за 1 минуту; специфичность; это вещества с регулируемой активностью; действуют в мягких условиях организма. В связи с этим различают 6 классов ферментов: Оксиредуктазы (ОР) – ускоряют окислительно-восстановительные реакции (ОВР); Трансферазы – ускоряют перенос различных групп атомов с одного вещества на другое; Гидролазы – ускоряют расщепление сложных веществ до простых с участием воды (т.е. путем гидролиза); Лиазы – ускоряют реакции распада веществ без участия воды или способствуют присоединению групп атомов по месту разрыва двойных связей; Изомеразы – ведут реакции изомеризации; Лигазы, или синтетазы – ускоряют синтез веществ за счет соединения молекул между собой. Трансферазы - катализируют реакции переноса каких-либо функциональных групп с одного субстрата на другой, либо реакции обмена субстратов между собой этими группами. В этих реакциях участвуют 2 субстрата: S-G + S' ==== S'-G + S Трансферазы — ферменты, катализирующие реакции переноса отдельных органических радикалов, атомных групп и частей молекул от одних соединений на другие. Такой перенос атомных группировок значительно облегчает и ускоряет течение биохимических реакций, особенно синтетических. Класс трансфераз подразделяется на несколько подклассов. Различные подклассы имеют неодинаковые коферменты. Ацилтрансферазы — ферменты, катализирующие реакции переноса ацилов на другие соединения. Кофермент ацилтрансфераз называют ацилкоэнзимом А и обозначают сокращенно в виде HS-KoA. Аминотрансферазы катализируют реакции переноса аминных групп кетокислотами, в результате возникают новые аминокислоты. Эти реакции очень важны для обеспечения преобразования аминокислот в организме животного. Различные аминотрансферазы отличаются апоферментом, но все в качестве кофермента содержат витамин В2. Перенос остатков фосфорной кислоты от одного соединения к другому катализируют фосфотрансфер а з ы. Этот процесс очень важен для жизнедеятельности организма, так как обеспечивает превращение ряда органических веществ в фосфорные эфиры, обладающие повышенной химической активностью и легко вступающие в последующие реакции. Перенос фосфатных остатков происходит на спиртовые, кислотные и другие группировки органических соединений. В зависимости от характера переносимых групп, трансферазы в свою очередь подразделяются на подклассы: 1) МЕТИЛТРАНСФЕРАЗЫ - Трансферазы, которые переносят одноуглеродные группы (CH3, COOH, CH2OH и т.д.Эти трансферазы участвуют в обмене АК, адреналина и др. 2) Очень важный подкласс трансфераз - ферменты, переносящие аминогруппы - АМИНОТРАНСФЕРАЗЫ. Эти ферменты играют огромную роль в обмене АК, обезвреживании аммиака. Кроме того, определение их активности в крови используют в диагностике многих заболеваний, о чем мы еще будем говорить подробно. 3) Чрезвычайно важный подкласс - трансферазы, переносящие остатки фосфорной кислоты - фосфотрансферазы или КИНАЗЫ. Без этих ферментов не могут начаться очень многие метаболические циклы в организме. Они берут остаток фосфорной кислоты от аденозинтрифосфорной кислоты - важнейшее макроэргическое соединение- и переносят его на какой-либо субстрат, например на глюкозу. Тем самым этот субстрат активируется и дальше способен вступать в реакции: Глюкоза + АТФ ----- Гл-6-Ф + АДФ Остаток фосфорной кислоты может присоединяться к молекуле ферментного белка. При этом совершенно меняются свойства и активность фермента, о чем мы уже говорили. 4) ГЛИКОЗИЛТРАНСФЕРАЗЫ - ферменты, переносящие гликозильный с одного вещества на другое: R-гликозил + R"-OH ===== R-OH + R"-гликозил К ним, например, относятся глюкозилтрансфераза - фосфорилаза, глюкуронилтрансфераза - очень важный фермент, участвующий в обезвреживании многих токсических продуктов. 5) АЦИЛТРАНСФЕРАЗЫ - переносят ацильный остаток. Ацил - часть жирной кислота, у которой в карбоксильной группе нет гидроксила: R-COOH - жирная кислота R-CO- - ацилжирной кислоты 5 Ферменты класса гидролаз 3. Гидролазы. Эти ферменты катализируют реакции распада субстрата с присоединением воды. При этом образуется два продукта: A-B + H2O =====A-OH + B-H Почему при введении адреналина гипергликемия наступает быстро, а при введении глюкокортикоидов медленнее? Ведущим фактором в развитии гипергликемии является нарушение гормональной регуляции обмена углеводов. Нарушение обусловлено изменением соотношения между активностью инсулина и контринсулярных гормонов, как следствие ряда причин: Нарушение центральных механизмов регуляции деятельности соответствующих эндокринных желез. Патологии эндокринных желез. Нарушение периферических механизмов действия гормонов. Преобладанте контринсулярных гормонов: глюкагона (У больных акромегалией с пониженной толерантностью к углеводам наблюдается повышенный уровень глюкагона в крови); адреналина (феохромацитома); тироксина (гипертириоз) глюкокортикоидов (Гликокортикоиды принимают участие в механизме возникновения гипергликемии при сахарном диабете и болезни Иценко—Кушинга); самототропина (Повышенная продукция гормон роста наблюдается, например, при акромегалии, сопровождается пониженной толерантностью к углеводам и гипергликемией. Существует представление о том, что соматотропин вызывает гиперплазию α-клеток панкреатических островков и увеличивает секрецию глюкагона) Данные гормоны усиливают процессы глюконеогенза, гликогенолиза в печени и приводят к повышению гликемии Адреналин – вторичный посредник быстрой регуляции, гликогенез. Глюкокортикоиды – медленной регуляции сахара в крови, глюконеогенез. Заведующий кафедрой медицинской химии, д.б.н., доцент Д.В.Суменкова |
