Аритмии сердца. Кушаковский М.С.. Руководство для врачей СанктПетербург гиппократ 1992 Глава 1 система образования и проведения импульса в сердце (проводящая система сердца)
 Скачать 7.14 Mb. Скачать 7.14 Mb.
|
|
45 докардиального ЭФИ являются: а) регистрация ЭПГ; б) измерения скорости антеро (АВ)- и ретроградного (ВА) проведения импульсов, а также продолжительности рефракторных периодов некоторых отделов сердца; в) эндо- и эпикардиальное картографирование (mapping) с записью большого числа предсердных и желудочковых ЭГ. Важнейшую часть ЭФИ — программированную (программируемую) электрическую стимуляцию различных отделов сердца и их частую или нарастающую по частоте стимуляцию можно проводить как внутрисердечпым, так и чреспище-водным методом. Впервые ЭГ правого предсердия и правого желудочка записали у человека J. Lenegre, P. Maurice (1945). ЭГ коронарного синуса удалось зарегистрировать в 1950 г. Н. Levine и W. Goodale, ЭГ в левой половине упоминали, В. Scherlag и соавт. (1950). Конец 60-х годов рассматривают как переломный в развитии ЭФИ в кардиологии. Как мы уже упоминали, В. Schelrag и соавт. (1969) разработали метод регистрации ЭПГ у больных, что позволило судить о скорости движения импульса в отдельных отрезках АВ проводящей системы. В нашей стране подробный анализ клинического значения Гис-электрографйй был представлен уже через 6 лет [Кушаков-ский М. С., 1975а, б]. Первое сообщение о записи ЭПГ сделали Ю. Руге-нюс, С. Корабликов, Р. Хает (1976). Еще одна веха, завершившая формирование методического комплекса ЭФИ, — создание метода программированной диагностической эндокар-диальной стимуляции [Durrer D. et al., 1967; Coumel P. et al., 1967; Wel-lens H., 1978]. Разновидность этого метода — неинвазивная чреспище-водная программированная или нарастающая по частоте стимуляция сердца получила распространение в 70—80-х годах [Бредикис Ю. Ю. и др., 1981, 1983; Римша Э. Д., 1981, 1983, 1987; Григоров С. С. и др., 1983; Киркутис А., 1983—1988; Лу- кошяиичюте А. И. и др., 1983, 1985; Гросу А., 1984, 1986; Сулимов В. А. и др., 1984, 1988; Жданов А. М., 1984; Пучков А. Ю., 1984; Бутаев Т. Д., 1985; Гришкин Ю. Н., 1985; Чирейкин Л. В. и др., 1985, 1986; Шубин Ю. В., 1988; Stopczyk M. et al., 1972; Bruneto J. et al., 1979]. Электрофизиологические диагностические исследования обычно проводят не раньше, чем через 48 ч (5 периодов полувыведения) после отмены противоаритмических препаратов, а в случае приема больным кордарона — не раньше, чем через 10 сут. Внутрисердечные ЭФИ. Запись эн-докардиальных ЭГ. Большинство клиницистов придерживаются разработанных М. Scheinmann, F. Morady (1983) критериев для отбора больных к инвазивному ЭФИ (табл. 1). Методика введения электродов. Внутрисердечное ЭФИ осуществляют в рентгенооперационной, в условиях тщательной асептики. Для доступа к правым полостям сердца используют периферические вены: одну или две бедренные вены, а при необходимости — подключичные или локтевые вены. В подключичную вену (предпочтительнее правую) обычно вводят непосредственно через просвет иглы электрод-катетер, наружный диаметр которого меньше 1,5 мм (типа ПАМС-1, 2, 3 или ЭПВП-1 и др.). Чрескожную пункцию бедренной вены, введение электродов-катетеров с наружным диаметром 2,5 мм проводят по методике Сельдингера. Вену пунктируют иглой со стилетом, из иглы вытягивают стилет и вводят в нее металлическую струну; затем удаляют иглу и узким скальпелем рассекают кожу по ходу струны (5— 6 мм), чтобы облегчить вход в полость вены «вводного устройства для электродов». Применяют, в частности, вводные устройства типа desilots-Hoffman, состоящие из металлической струны, расширителя и пластиковой трубки. На металлическую струну надевают расширитель вместе с трубкой и продвигают их по Таблица ] Клинические показания к инвазивному (зндокардиалыюму) ЭФИ Показание к ЭФИ Нарушение ЭФИ всегда полезно: тахикардия с широкими комплексами QRS устойчивые ЖТ; остановка сердца вне больничных условий паджелудочковые тахикардии Разграничение ЖТ и наджелудочковой тахикардии с аберрантными QRS * Электрофармакологическое тестирование * Оценка лечения кардиостимулятором * Оценка автоматического имплантировапного дефиб-риллятора * Оценка результатов электрохирургического лечения * WPW и фибрилляция предсердий Оценка противотахикардического пейсмекера * Оценка результатов электрохирургического лечения ЭФИ бывает полезным: паджелудочковые тахикардии повторные обмороки АВ блокады При тяжелой, связанной с аритмией, симптоматике * Если не найдены причины при неврологической или пеипвазивной кардиологической оценке * Бессимптомная АВ блокада неизвестного уровня Возможность того, что скрытые экстрасистолы вызывают АВ блокаду Обмороки с неустановленной причиной * блокады ножек ЭФИ редко бывает полезным: дисфункции СА узла Преходящие неврологические симптомы и электрокардиографические признаки дисфункции СА узла беи ясной связи. Оценка лекарств, которые могут усиливать дисфункции СА узла * * Указание на то, что ЭФИ включает метод программированной электрической стимуляции. струне в полость вены. После этого вытягивают из вены металлическую струну и расширитель. Трубка остается в вене, перед введением электрода-катетера трубку необходимо промыть гепарином. Контроль за продвижением электрода и за его положением в сердце осуществляют с помощью рентгеноскопии, а также путем регистрации внутриполостной ЭГ [Роузен М. и др., 1986]. Для процедуры используют электроды-катетеры отечественного производства типов ПЭДМ-2, 4, 6, 9 (провод-электрод диагностический много- контактный; цифры указывают число контактов-полюсов) либо типов USGI (США). Количество электродов-катетеров, вводимых в полости сердца, зависит от программы намечаемого ЭФИ. Трехполюсный либо 6—9-по-люсный электрод-катетер (1 см — межнолюсное расстояние) вводят через правую бедренную вену и устанавливают в отверстии трехстворчатого клапана поперек его медиальной створки, что позволяет записать 3 элемента ЭПГ (нижний отдел правого предсердия — LRA, Н-потенциал и V-возбуждение желудочков). Через 47 то же отверстии к правой бедренной вонс вводят второй, четырохполюс-ный, электрод-катетер и помещают его в высоком боковом отделе прапо-го предсердия, вблизи СА узла. Два верхних полюса используют для электрической стимуляции предсердия, два нижних полюса — для биполярной регистрации ЭГ высокого отдела правого предсердия (HRA). Если есть необходимость, то третий электрод-катетер проводят через правую подключичную вену в правое предсердие и затем проникают в устье коронарного синуса. Регистрируя проксимальную и дистальыую ЭГ коронарного синуса, получают представление об электрической активности левого предсердия. Легче удается проникнуть в коронарный синус с помощью электрода-катетера, имеющего загнутый конец («J»). Прямая запись ЭГ левого предсердия возможна у больных с открытым овальным отверстием либо с дефектом меж-предсердной перегородки; ее осуществляют и путем прокола межпред-сердной перегородки. Наконец, четвертый, четырехполюсный, электрод-катетер через одну из бедренных вен проводят в полость правого желудочка для регистрации ЭГ и стимуляции (рис. 19). При использовании 6— 9-полюсных электродов-катетеров их число может быть уменьшено до 2-3. Внутрисердечные ЭГ записывают через частотные фильтры, поскольку удовлетворительные ЭПГ, предсерд-ные и желудочковые кривые можно получить при частотных характеристиках приборов, превышающих 200 Гц и срезающих низкие частоты в пределах 40—60 Гц (низкочастотные осцилляции в желудочковых комплексах и др.). Универсальный усилитель ЕМТ-12В, используемый в нашей электрофизиологической лаборатории, способен воспринимать частоты до 700 Гц. ЭГ вместе с ЭКГ (лучше I, II, Vi и Ve отведения) регистрируют на приборе типа Elema-Mingograph при скорости движения бумаги 100 и 250 мм/с. 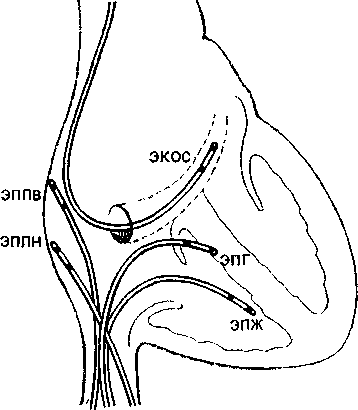 Рис. 19. Положенно катотеров-алектродов при внутрисердечных рсгистрациях ЭГ. ЭППВ — высокого отдела правого предсердия; ЭППН — нижнего отдела правого предсердия; ЭКОС— коронарного синуса; ЭПГ; ЭШК — правого желудочка. ЭГ предсердий. Двухфазная ЭГ правого предсердия при синусовом ритме имеет неустойчивую амплитуду (от 5 до 12 мВ), меняющуюся в зависимости от того, где находится электрод. Положительная осцилляция ЭГ отражает движение фронта возбуждения по направлению к электроду, отрицательная осцилляция указывает на то, что ход возбуждения имеет противоположное направление. На рис. 20, а, б, показаны ЭГ высокого (ЭППВ),среднего (ЭППС), нижнего (ЭППН) отделов правого предсердия, ЭГ коронарного синуса (ЭКОС), ЭПГ. (ЭГ СА узла —см. в главе 14). Электрограмма правого желудочка (ЭПЖ). Ее амплитуда может превышать 40 мВ, форма желудочкового комплекса зависит от положения электрода-катетера: во входном или выходном трактах, у межжелудочковой перегородки и т. д. (см. рис. 20. а, б). Гис-электрограмма. На рис. 21, а, б, показано положение электрода-катетера в момент записи ЭПГ при ого  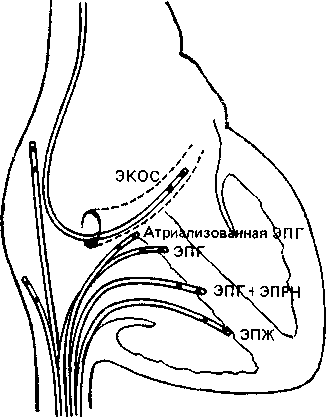 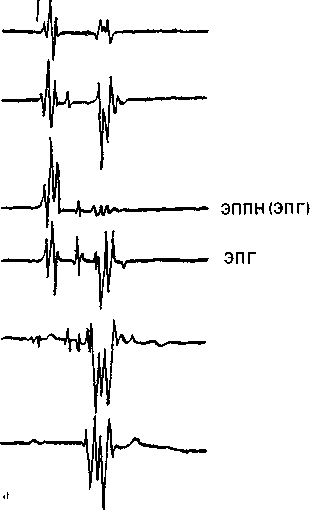 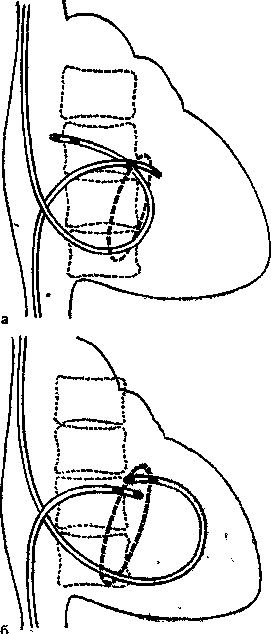 —j|i—*^vW ЭППВ ЭППВ ЭППС экое ЭППС ЭПЖ (ЭПГ + ЭПРН) эпж 1'ис. 20. Биполярные ЭГ, записанные и разных отделах правого предсердия и желудочка (а, б). ЭГШВ — высокий отдел правого предсердия; ЭППС — средний отдел правого предсердия; ЭКОС — коронарный синус; ЭППН — нижний отдел правого предсердия; ЭПГ — пучок Гиса; ЭПГ 1- ЭПРН — пучок Гиса + правая ножка; ЭПЖ — правый желудочек. Показано положение соответствующих катетеров-электродов в сердце. введении по В. Scherlag и соавт. (1969) через бедренную вену и при его введении по О. Narula и соавт. (1973) через локтевую вену. Запись ЭПГ через подключичную или яремную вену осуществить труднее: при этих «верхних» доступах требуются более сложные повороты и движения электрода-катетера, прежде Рис. 21. Введение катетеров-электродов в правое предсердие. а—через локтевую вену; б — через бедренную вену 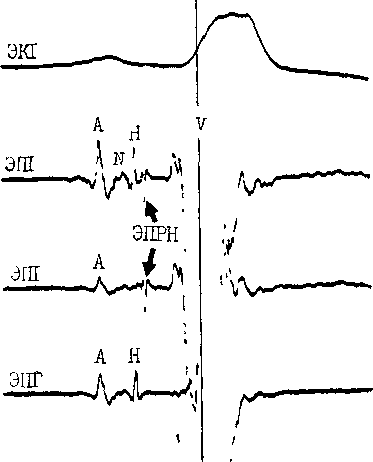 Рис. 22. Одновременная регистрация АВ узлового (N) потенциала, потенциала пучка Гиса (Н) и потенциала правой ножки (ЭПРН) у больного с блокадой левой ножки с помощью трехполюсного электрода-катетера. А — ЭППН; V — начало возбуждения желудочков; ЭКГ — П отв. (по A. Damato и S. Lau). чем удается установить его в нужной позиции. Нельзя не упомянуть, что опытный кардиолог-электрофизиолог способен вводить электрод-катетер в сердце и регистрировать ЭПГ, не прибегая к рентгенологическому контролю. Гис-(Н)-потенциал — это двух-, трехфазный спайк (осцилляция) продолжительностью 15—20 мс, расположенный между предсердной и желудочковой ЭГ (приходится на сегмент ST синхронно записанной ЭКГ), (рис. 22). Он отражает возбуждение ствола пучка Гиса, т. е. участка ниже АВ узла, но выше места разделения общего ствола на ножки. В ЭПГ выделяют три интервала (рис. 23), первый из которых, интервал Р—А, измеряют от на- чала волны А ЭПГ (А — потенциал нижней части правого предсердия -т-ЭППН, примерно приходится на терминальную фазу зубца Р синхронно записанной ЭКГ). Этот интервал соответствует времени, затрачиваемому синусовым импульсом на прохождение расстояния от СА узла до нижнего отдела правого предсердия (в норме от 25 до 45 мс). Второй, интервал А—Н, отражает время движения импульса в участке от нижне-перегородочного отдела правого предсердия через АВ узел к месту регистрации в стволе потенциала Н. Нормальные колебания интервала Л—Н лежат в пределах 50—130 мс (короткие интервалы, в частности у младенцев и детей, связаны с более быстрым проведением в АВ узле). Интервал Н—Vхарактеризует время прохождения импульсом участка от места регистрации Н-потенциала до места самого раннего возбуждения сократительного миокарда желудочков (межжелудочковая перегородка) — начала волны V на ЭПГ либо зубца Q(R) на ЭКГ. Он равен у здоровых людей 30—55 мс. При этом ножки пучка Гиса возбуждаются через 10—15 мс после осцилляции Н, основная же часть интервала Н—V связана с замедленным проведением в области соединения клеток Пур-кинье с сократительными миокарди-альными клетками. Изменения тонуса вегетативных нервов могут влиять на частоту ритма, скорость проведения импульсов и, следовательно, на длину интервалов ЭПГ. Надо подчеркнуть, что при катетеризации сердца и во время ЭФИ эти влияния выражены нерезко [Jewell G. et al., 1980]. Тис-потенциал при ретроградном проведении импульса от желудочков к предсердиям. Его распознавание очень затруднено, поскольку Н-спайк располагается вблизи многофазного желудочкового комплекса V. Принимают во внимание последовательность расположения волн: V—Н—А вместо А—Н—V, а также появление отрицательных зубцов Р в отведени- 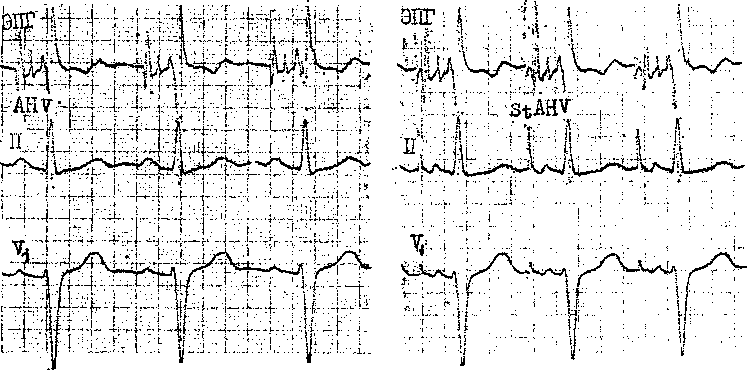 Рис. 23. Электрограмма пучка Гиса (ЭПГ). Слева — в период синусового ритма с частотой 107 в. 1 мин (интервалы Р—А=30 мс, А—Н = В5 мс, Н—V=45 мс, Р—R=140 мс); справа — в период стимуляции правого предсердия с частотой 120 в 1 мин (St—Н=65 мс, Н—V=45 мс). 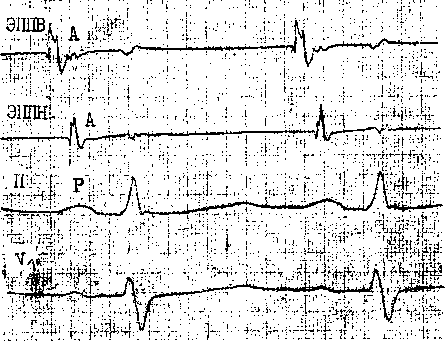 ях II, III, aVF и ретроградных зубцов Р на пищеводной ЭКГ. Расщепление Гис-потенциала. Образование двух разделенных интервалом спайков hi и h£ отражает продольную диссоциацию общего ствола пучка Гиса либо чаще — формирование стволовой АВ блокады. Неоднократно делались попытки записать ЭПГ с поверхности тела человека [Flowers N. et al., 1974; Waj-szczuk W. et al., 1978]. А. И. Луко-шявичюте и соавт. (1981, 1984) это удалось у 89 % здоровых людей с помощью метода когерентного накопления сигналов и их фильтрации. Кроме того, В. Р. Улозене (1983) по- Рис. 24. Одновременная запись ЭГ высокого (ЭППВ) и нижнего (ЭППН) отделов правого предсердия; запаздывание возбуждения нижнего отдела на 50 мс (скорость бумаги 100 мм с). лучила ЭПГ у 73% здоровых людей, расположив пищеводный электрод на уровне левого предсердия, а второй электрод — на грудине. Однако метод когерентного накопления не может быть использован при таких динамических процессах, как нарушения сердечного ритма и проводимости. Оценка состояния проводимости в предсердиях. О скорости проведения импульса в стенках правого предсердия судят по величине интервалов (в мс) Р—А и HRA—LRA, или ЭППВ — ЭППН (высокий — нижний отделы правого предсердия) (рис. 24). В здоровом сердце при стимуля-  щж :^|1т|:-гг^;^1т"7-Г:-;; -^ ;:|^.^,.j^^;^:>;.r|^ n|I Рис. 25. Оценка АВ узловой проводимости. Чреспищеводная стимуляция с частотой 214 в 1 мин вызывает АВ узловую блокаду II степени типа 13:2 (высокая «точка Венкебаха»); интервал St — Р = 40 мс, межпредсердная блокада I ст. (Р —Р' =45 мс). ции правого предсердия с нарастающей частотой интервал Р—А не меняется либо удлиняется не больше чем на 15 мс. Это удлинение обычно наступает при еще умеренной частоте стимуляции и не имеет клинического значения. Другой признак, характеризующий состояние проводимости в мышце правого предсердия,— величина латентного периода между экстрастимулом (артефактом) и началом предсердного ответа, т. е. пред-сердной ЭГ (в норме 15—20 мс). Выраженное удлинение периода латен-ции служит указанием на угнетение проводимости в каком-либо участке правого предсердия. Что же касается времени межпредсердного проведения, то, согласно измерениям нашего сотрудника А. Ю. Пучкова (1985), оно в среднем равняется 50 мс. Э. Римша и соавт. (1987) приводят величину 75 ±45 мс; А. А. Киркутис (1988) — 74,1 ±3 мс (интервал между ЭППВ и ЭГ дистальной части коронарного синуса). Проведение в АВ узле. У здоровых людей в период физической нагрузки происходит небольшое укорочение интервала А—Н (Р—R). Во время нарастающей по частоте электрической стимуляции предсердий интервал А—Н (Р—R) удлиняется с формированием АВ узловой блокады I степени (рис. 25). Стимуляцию осуществляют короткими сериями длительностью в 10—15 с с увеличением частоты в каждой серии на 10 имп/мин. Для каждого человека существует «критическая» частота предсердной стимуляции, при которой АВ блокада I степени переходит в АВ узловую блокаду II степени типа I («точка Венкебаха»). У 70% здоровых людей «точка Венкебаха» соответствует частоте предсердной стимуляции ниже 190 в 1 мин, обычно 140—150 стимулам в 1 мин. У детей без заболеваний сердца «точка Венкебаха» смещена до уровня выше 200 стимулов в 1 мин (рис. 26). Слишком раннее возникновение периодики Венкебаха (<130 в 1 мин) отражает ухудшение проводимости в АВ узле (рис. 27, 28). Однако окончательное заключение об этом можно сделать 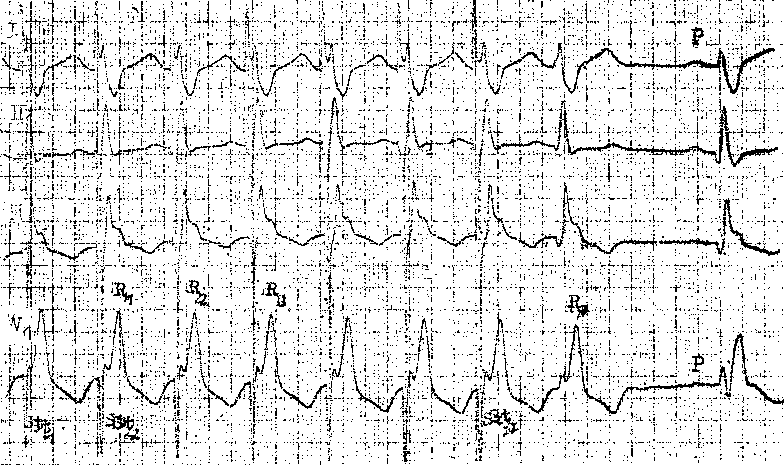 Рис. 26. Оценка АВ узловой проводимости. Чреспищеводная стимуляция предсердий с частотой 176 в 1 мин вызывает АВ уаловую илонаду [ степени; интервалы St — R = 350 мс, зубцы Р погружены в соседние комплексы QHS («перепрыгивающие» Р); блокада правой ножки, неполная блокада задненижнего разветвления леиой ножки. лишь в том случае, если низкое значение «точки Венкебаха» сохраняется и после внутривенного введения 1 мг атропина сульфата. При увеличении частоты предсердной стимуляции периодика Венкебаха сменяется АВ узловой блокадой 2:1; иногда можно наблюдать чередование АВ блокад 3:2 и 2:1. Интервал А—Н проведенного импульса при блокаде 2: 1 длиннее интервала А—Н при проведении 1:1, что связано с влиянием скрытого АВ узлового проведения блокированного импульса. Способность АВ узла проводить импульсы в ретроградном направлении. Ее проверяют с помощью нарастающей по частоте стимуляции желудочков (через электрод, помещенный в правом желудочке). Интервал V—А (фактически, Н—А) (рис. 29) постепенно удлиняется с переходом в ретроградную ВА узловую периодику Венкебаха. Она возникает у лиц с нормальным узловым проведением при стимуляции правого желудочка с частотой от 80 до 150 в 1 мин [Akh-tar M. et al., 1986]. Проведение в ножках пучка Тиса. В норме при нарастающей по частоте стимуляции предсердий интервал Н—V остается неизменным. Он обычно не удлиняется и во время программированной стимуляции предсердий. Удлинение в этих условиях интервала Н—V указывает на развитие тахи-зависимой внутрижелудочковой блокады. О состоянии ретроградной проводимости в системе Гиса—Пуркинье нельзя судить по ее антероградной проводимости: при блокаде ножки может сохраниться ретроградное движение по этой ножке (однонаправленная блокада ножки). Программированная электрическая стимуляция. С помощью этой важнейшей части ЭФИ решается ряд задач: 1) измерение длительности периодов рефрактерности в различных участках специализированной системы сердца и миокарда; 2) диагностика тахикардии путем их воспроизведения; 3) прямое лечение некоторых аритмических форм; 4) определение показаний к хирургическому лечению тахиаритмий и к вживлению 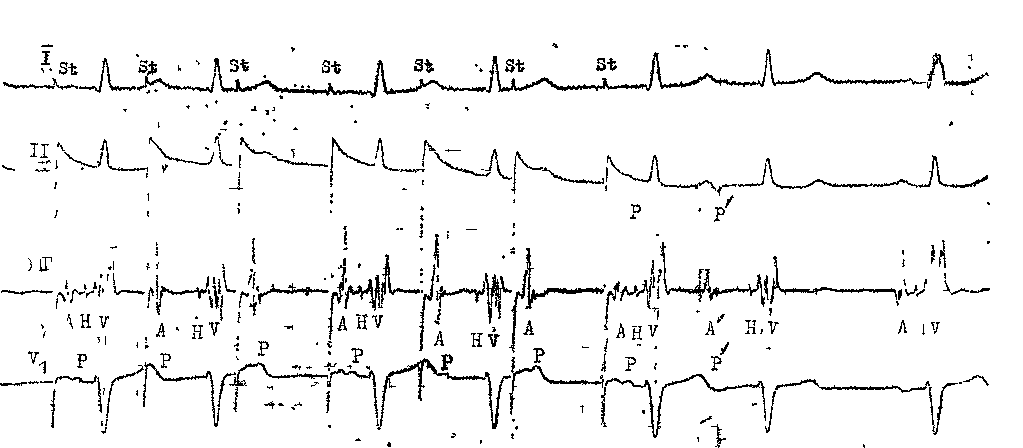 Рис 27. Оценка АВ узловой проводимости. Эндокардиальная стим\ ляция правого предсердия с частотой 130 в 1 мин вызывает АВ \зловл ю блокаду II степени типа 13:2 (низкая «точка Венкебаха>) Интервалы А — Н в периодиьах 105 и 215 мс, интервалы Н — V = 45 мс, реципрокный АВ комплекс (инвертированный зл бец Р' в отв II, интервалы V — А' = 300 мс, А' — V = 280 мс), посте паузы синусовый комтеьс (интервалы А — Н = 100 мс, Н — V = 45 мс) 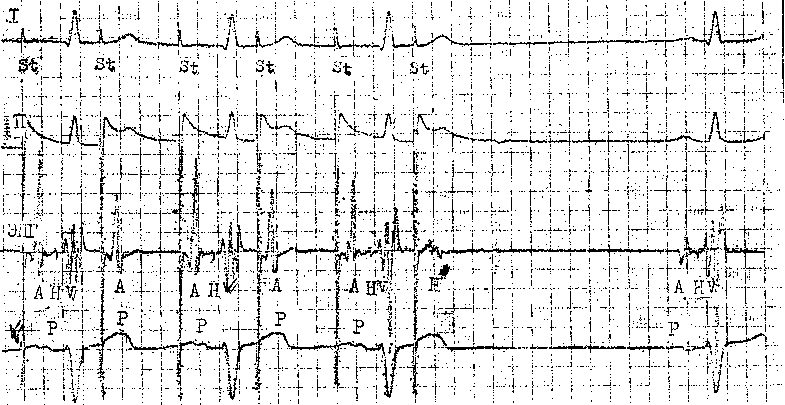 Рис. 28. Оценка АВ узловой проводимости. Эндокардиальная стимуляция правого предсердия с частотой 150 в 1 мин вызывает АВ узловую блокаду •>• 1 Интервалы А — Н = 115 мс, Н — V = 45 мс; каждый 2-й стимул прерывается после волны А; в конце*стимуляции -стволовая экстрасистола (Н') с полной антеро- и ретроградной блокадой- постГжстрасистолическая пауза (Р - Р) = 1750 мс, в синусовом комплексе интервалы А — Н = 9(1 мс, Н — V = 45 мс.  кардиостимулятора; 5) подбор для больных эффективных лечебных и профилактических противоаритми-ческих препаратов (разделы 2—5 рассматриваются ниже в соответствующих главах). Не существует общепринятого протокола программированной электрической стимуляции и оспаривается необходимость в нем [Anderson J., Mason J., 1986; Prystowsky E. et al., 1986; Bigger J. et al., 1986]. Сущность этого метода состоит в том, что на фоне основного ритма (синусового или навязанного) наносят экстрастимулы по специальной программе, предусматривающей серию преждевременных возбуждений сердца или его отдела в течение сердечного цикла. Первый экстрастимул обычно подается в поздней фазе диастолы, затем через каждые 8 (или больше) основных комплексов его повторяют с укорачивающимся «интервалом сцепления» (ИС), т. е. с нарастающей преждевременностью. В последние годы часто используют не 1, а 2—3 и даже 4 экстрастимула, следующих друг за другом («агрессивный протокол»). Кроме того, меняют частоту основного, навязанного, ритма и проводят экстрастимуляцию в нескольких зонах, например в верхушке правого желудочка и в путях оттока из него. Чтобы обеспечить полноценный «захват» (активацию) миокарда, сила тока эндокардиальных экстрастимулов (стимулов) должна не менее чем в 2 раза и не более чем в 4 раза превышать диастолический порог возбуждения, под которым понимают минимальную силу электрического тока (или напряжения), обеспечивающую возбуждение (сокращение) миокарда в период диастолы. Обычно напряжение эндокардиальных стимулов составляет 0,5—1 В, сила тока до 1—2 мА, длительность — 2 мс. Чрезмерные электрические стимулы (экстрастимулы) повышают риск возникновения «неклинической» тахикардии (фибрилляции) в каком-либо отделе сердца. Для осуществления программиро- ванной или нарастающей по частоте электрической кардиостимуляции (ЭКС) созданы приборы — программируемые эндокардиальные кардио-стимуляторы (ЭКСК-04 со специальным устройством, аппарат „Medtronic" и др.). В 50-х годах стало очевидно, что и через электрод, помещенный в пищевод, можно осуществлять диагностическую и лечебную стимуляцию сердца [Zoll P., 1952; Shapiroff В., binder J., 1957]. За последнее десятилетие этот метод получил широкое распространение как в нашей стране, так и за рубежом. Аппараты для биполярной чреспи-щеводной стимуляции (ЭКСП, ЭКС-НП, ЭКСП-Дидр.) обладают способностью вырабатывать электрические импульсы достаточного напряжения, поскольку передача стимулов от пищевода к сердцу осуществляется без непосредственного контакта между электродом и миокардом. Тканям, отделяющим пищевод от эпикарда, присуще устойчиво высокое электрическое сопротивление около 2000 Ом. Чтобы обеспечить силу тока импульсов, необходимую для возбуждения предсердий (18—30 мА) или желудочков (40—70 мА), их напряжение должно быть не менее 30—60 В и 80—140 В соответственно. Стимулы ^3=26 мА уже часто вызывают у больных неприятные ощущения (жжение, покалывание, боль за грудиной, сокращения диафрагмы и грудных мышц и др.). Поэтому важнейшим условием успешной чреспи-щеводной стимуляции (диагностической или лечебной) является выбор минимальной силы тока, обеспечивающей навязывание искусственного ритма, т. е. определение оптимального электрического порога стимуляции. Установлено, что его величина зависит от трех основных параметров: длительности стимула, места стимуляции, расстояния между катодом и анодом. У большинства больных самый низкий порог стимуляции отмечается при ширине стимулов 10 мс [Gallag- her J. et al., 1982]. Однако в части случаев понижение порога стимуляции достигается лишь при удлинении стимулов до 15—20 мс и улучшении контакта электрода со слизистой оболочкой пищевода [Benson D., 1984]. Надо подчеркнуть, что соотношение между длительностью пищеводных стимулов и порогом стимуляции предсердий не зависит от возраста и размеров тела человека. Место стимуляции, т. е. уровень расположения пищеводного электрода, при котором достигается минимальный порог стимуляции, обычно соответствует зоне регистрации максимального по амплитуде предсерд-ного зубца. Расстояние между катодом и анодом (межэлектродный промежуток) тоже подбирают с таким расчетом, чтобы получить наиболее низкую величину порога стимуляции. В исследованиях J. Gallagher и соавт. (1982) оптимальное расстояние равнялось 2,9 см. Однако D. Benson (1987) пришел к выводу, что межэлектродное расстояние в пределах от 1,5 до 2,8 см не имеет «критического» значения для достижения самого низкого порога стимуляции. А. А. Киркутис (1988) обратил внимание на то, что минимальная сила тока, необходимая для навязывания искусственного ритма предсердиям, была ниже, когда к дистально-му контакту пищеводного электрода подключали анод, а к проксимально-му — катод электрокардиостимулято-ра. Конкретные примеры диагностической (программированной) электрической стимуляции сердца приведены в главах, посвященных описанию тахикардии. Измерение продолжительности ре-фрактерных периодов. Рефрактерное состояние миокарда можно характеризовать тремя понятиями: эффективным рефрактерным периодом (ЭРП), функциональным рефрактерным периодом (ФРП) и относительным рефрактерным периодом (ОРП). Ниже дается характеристика периодам рефрактерности в предсердиях, АВ узле, желудочках. Что же касается рефрактерности в добавочных путях при синдроме WPW, а также в СА узле, то эти вопросы рассматриваются в соответствующих главах. Если больному навязать искусственный базисный регулярный пред-сердный ритм в физиологических пределах от 80 до 100 в 1 мин, то обозначения Sti, ai, hi и Vi будут соответственно отражать искусственный стимул и ответные возбуждения предсердия, ствола пучка Гиса и желудочка. Обозначения St2, аз, Нз и уз относятся соответственно к преждевременному предсердному экстрастимулу и возбуждению предсердия, ствола, желудочка, вызванному этим экстрастимулом. Как уже упоминалось, повторение экстрастимулов с нарастающей преждевременностью обычно осуществляют через каждые восемь навязанных регулярных комплексов. Аналогичным образом, но только с помощью базисного желудочкового ритма и повторных одиночных желудочковых экстрастимулов измеряют рефрактерные периоды в ретроградном направлении. Иногда программированную стимуляцию проводят на фоне синусового ритма, что менее надежно, поскольку на рефрактерность могут оказывать влияние спонтанные колебания синусового ритма. ЭРП правого предсердия — наиболее длинный отрезок времени (интервал Sti—812), в течение которого St2 не способен вызвать ответное возбуждение предсердия (отсутствует А2) (рис. 30). ФРП правого предсердия — самый короткий отрезок времени (интервал ai—Аз), достигаемый при возбуждении предсердия Sti и St2. ЭРП АВ узла — наиболее длинный отрезок времени (интервал aj—аз), в течение которого импульс аз не способен преодолеть АВ узел и вызвать возбуждение ствола пучка Гиса (отсутствует Нз) (рис. 31). ФРП АВ узла — самый короткий отрезок времени (интервал hi—Нз), который достигается при проведении 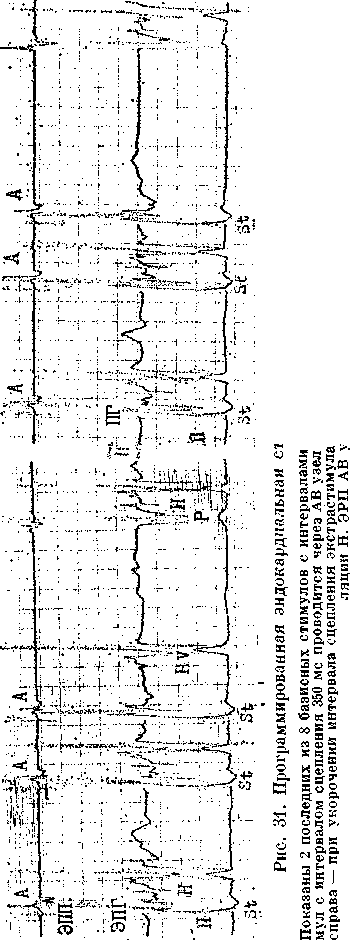 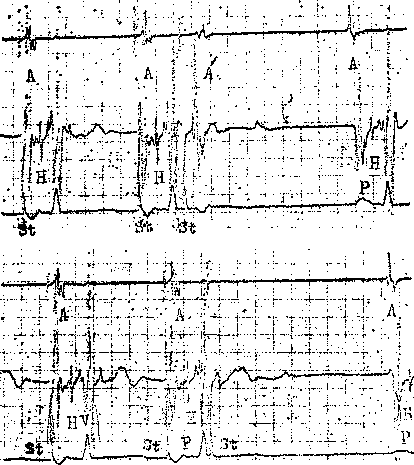
и 640 со до зл Рис. 30. Программированная эидокар- диальная стимуляция для определо- ния ЭРП правого предсердия. Показаны 2 последних из 8 базисных стимулов с интервалами 640 мс (к 94 в 1 мин). Сверху — предсердный экстрастимул с интервалом сцепления 250 мс еще вызывает возбуждение предсердия (интервал St = А' = 70 мс). Внизу — предсердный экстрастимул с интервалом сцепления 240 мс встречаетоя с рефрак-терностью предсердия (отсутствует А'). ЭРП правого предсердия в участке экстрастимуляции = 240 мс. через АВ узел двух предсердных импульсов ai и аз. ЭРП АВ узла (ретроградный) — наиболее длинный отрезок времени (интервал Vi—Vs), в течение которого импульс уз не способен преодолеть АВ узел и вызвать возбуждение предсердия (за ретроградным потенциалом Нз нет аз) . ФРП АВ узла (ретроградный) — самый короткий отрезок времени (интервал ai—аз), который достигается при проведении через АВ узел двух последовательных стволовых ретроградных импульсов. ЭРП правого желудочка — наиболее длинный отрезок времени (интервал Stvi—Stvs), в течение которого StV2 не способен вызвать ответное возбуждение желудочка (отсутствует V2) (рис.32). ФРП правого желудочка — самый короткий отрезок времени (интервал Vi—уз), который достигается при возбуждении желудочка Stvi и Stv2. ФРП ВА проводящей системы (ретроградный) — самый короткий отрезок времени (интервал ai—аз), который достигается при проведении 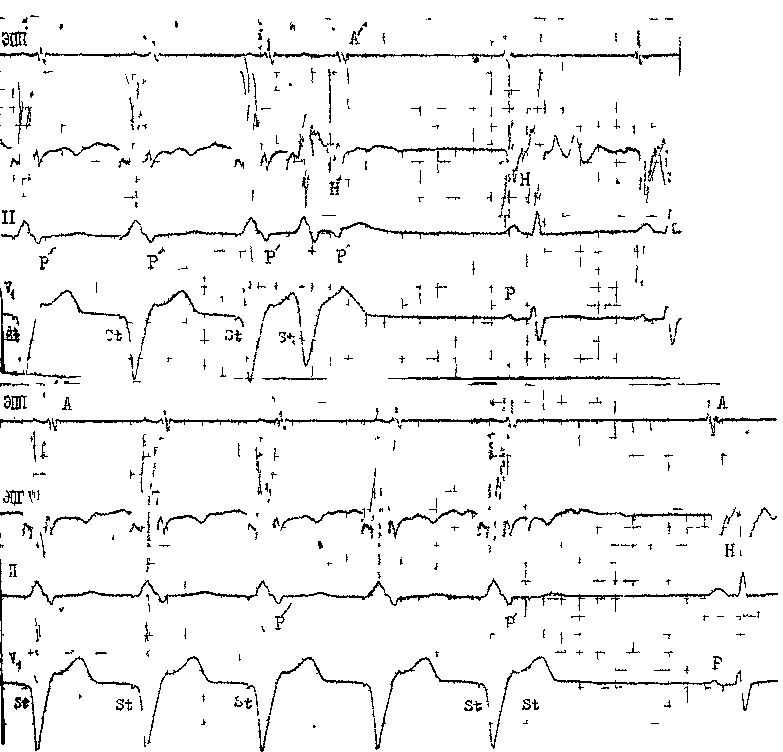 Рис 32 Программирования щдокардиальная стимуляция для определения ЭРП правого желудочка (в верхушке) Показаны базисные правожелудочковые стимулы с интервалами 640 мс (» 94 в 1 мин) Сверху — правожелудочковый экстрастимул с интервалом сцепления 290 мс еще вызывает возбуждения желудочка за каждым желудочковым комплексом следует ретроградный зубец Р', инвертированный в отв П, экстрастимул проводится к предсердиям с замедлением (R — р = 230 мс), виден ретроградный потенциал Н (интервал Н — А =40 мс) Внизу — правожелудочковый экстрастимул с интервалом сцепления 280 мс не возбуждает желудочки ЭРП в области верхушки право! о желудочка — 280 мс к предсердиям через АВ узел двух последовательных желудочковых импульсов (Vi—Vs). Его величина в среднем составляет 400 мс с колебаниями от 320 до 580 мс [Гришкин Ю Н, 1990] Итак, ЭРП измеряют от стимула до экстрастимула, тогда как ФРП — от ответа на стимул до ответа на эк страстимул. К этому можно добавить, что ОРП — это отрезок времени, в течение которого ответ на преждевре- менный экстрастимул возникает медленнее, чем на обычный стимул, хотя интенсивность этих стимулов одинакова. Например, ОРП АВ узла — отрезок времени (максимальный интервал ai—А2), при котором начинает удлиняться интервал А2—Н2 (Н,-Н2) По данным нашего сотрудника Ю Н. Гришкина (1988), ЭРП правого предсердия в норме равняется 222 ±23 мс, ФРП правого предсер- Таблица 2 ЭРП и ФРП правого предсердия и ЛВ узла (е мс)*
* Указаны средние величины и колебания (Wu D., Narula О.). дня—277 ±34 мс, ЭРП АВ узла — 305 + 52 мс, ФРП АВ узла-390± + 61 мс, ЭРП правого желудочка — 227 + 30 мс, ФРП правого желудочка — 264+30 мс. Эти величины были получены у людей в возрасте от 15 до 66 лет (средний возраст — 42 года). Согласно измерениям A. Micheluc-chi и соавт. (1988), у здоровых молодых людей ЭРП в верхнем отделе правого предсердия в среднем равен 264+21 мс, в нижнем отделе правого предсердия —249 + 28 мс; ФРП равняется соответственно 286 + 22 и 269+18 мс. Дисперсия (различия) праеопредсердной рефрактерности для ЭРП составляет в среднем 24 ± ±16 мс, для ФРП— 19 + 13 мс. D. Wu и соавт. (1977), О. Narula (1977) приводят нормативы ЭРП и ФРП для правого предсердия и АВ узла, измеренные на двух базисных частотах стимуляции (табл. 2). По данным J. Fisher (1981), ЭРП правой ножки у здоровых людей равен 443 + 42 мс для длины цикла 850—600 мс и 367 + 28 мс —для длины цикла 599—460 мс. ЭРП левой ножки для таких же циклов равен 434+59 мс и 365 мс соответственно (везде указаны сигмы). Как недавно установили W. Miles и Е. Prystowsky (1986), укорочение ЭРП правой нож- ки при частой стимуляции предсердий зависит не только от длины цикла стимуляции, но и от ее длительности. Минимальный ЭРП достигался, например, после 32-го стимула (комплекса), тогда как при рутинных ЭФИ для измерения ЭРП используют 8 базисных комплексов. Наиболее вероятный механизм уменьшения ЭРП при удлинении периода стимуляции — нарастающее укорочение ПД. По наблюдениям P. Tchou и соавт. (1986), рефрактер-ность в системе Гиса — Пуркинье укорачивается (в ответ на внезапное учащение ритма) в осцилляторной манере прежде, чем она достигает самого низкого значения. Эти данные могут объяснить причину быстрого исчезновения функциональной блокады правой ножки, возникающей нередко в начале приступа наджелу-дочковой тахикардии. Итак, ЭРП предсердий, желудочков, системы Гиса — Пуркинье укорачивается при уменьшении длины цикла, т. е. при учащении ритма. Аналогичные изменения претерпевает ФРП АВ узла, однако его ЭРП удлиняется (!). Существует прямая зависимость между ЭРП АВ узла и интервалом А—Н на ЭПГ. Отчетливое удлинение ЭРП наблюдается при старении человека, оно выражено резче в АВ узле, чем в других участках проводящей системы. Увеличение продолжительности ЭРП является причиной более часто встречающихся у пожилых людей в период брадикардии функциональных блокад ножек и внутрипредсерд-ных блокад. Надо также указать, что рефрактерность, как и другие электрические свойства миокарда, претерпевает циркадные (суточные) колебания: например, самый длинный ЭРП в предсердиях, АВ узле и правом желудочке отмечается в отрезке времени от 12 ч ночи до 7 ч утра [Cinca J. et al., 1986]. Необходимо, наконец, хотя бы кратко рассмотреть вопрос о дисперсии желудочковой рефрактерности. т. е. о различиях в продолжительно- сти рефрактерных периодов в разных участках миокарда левого и правого желудочков. J. Luck и соавт. (1985) измеряли ЭРП и ФРП в трех участках правого желудочка. При частоте ритма 72 ±12 в 1 мин дисперсия ЭРП составила 37 ±12 мс, ФРП— 36 ±20 мс. При стимуляции желудочков с частотой 120 в 1 мин дисперсия рефрактерности сокращалась. J. Schlechter и соавт. (1983) указывают для эндокардиальной поверхности правого желудочка дисперсию ЭРП = 54±16 мс. R. Spielman и соавт. (1982) находили у здоровых людей среднюю дисперсию ЭРП для эндокардиальной поверхности левого желудочка, равную 43 мс (от 35 до 60 мс). Эти показатели следует учитывать при ЭФИ больных с повреждениями миокарда. Различия в рефрактерности на разных уровнях АВ проводящей системы создают электрофизиологическую основу для явления, получившего название «щель» (окно) в проведении (gap) [Wu D. et el., 1974; Akhtar M. et al., 1978]. Этим термином обозначают период в сердечном цикле, во время которого проведение преждевременного импульса становится невозможным, хотя импульсы с меньшей преждевременностью проводятся. Например, во время экстрастимуляции правого предсердия в определенный момент возникает АВ блокада проведения экстрастимула. Однако дальнейшее укорочение интервала сцепления экстрастимула сопровождается неожиданным восстановлением АВ проводимости. «Щель» (окно) в проведении (мы полагаем, что на русском языке это наиболее подходящее обозначение) наблюдается в тех случаях, когда ЭРП дистального участка проводящей системы оказывается более продолжительным, чем ФРП ее проксимального участка. В литературе описаны по меньшей мере 9 типов gap в АВ проводящей системе: 6 — при антероградном проведении, 2 — при ретроградном и 1 тип — в правом предсердии; среди них чаще встречаются типы I и II [Мое G. el al., 1965; Damato A. el aJ., 1976; Han J., Fabregas E., 1977; Lil-iman L., Tenczer J., 1987]. TunIgap: ЭРП в системе Гиса — Пуркинье длиннее, чем ФРП в АВ узле. Более ранний предсердный экстрастимул (экстрасистола) встречается с относительной рефрактерно-стью в клетках АВ узла и, преодолевая его медленно, попадает в систему Гиса — Пуркинье в тот момент, когда в ней уже восстановилась возбудимость. Более поздний предсердный экстрастимул (экстрасистола) быстрее преодолевает АВ узел, вышедший из состояния рефрактерности, но встречается с еще сохранившейся рефрактерностью в системе Гиса — Пуркинье и поэтому блокируется (рис. 33). Тип IIgapреализуется при аналогичном соотношении между ФРП и ЭРП в двух участках системы Гиса — Пуркинье. Ранний предсердный экст -растимул (экстрасистола) проводится к желудочкам, поскольку он сначала задерживается в проксимальном участке этой системы (общий ствол) и поступает в ее дистальный участок к моменту окончания в нем рефрактерности. Предсердный экстрастимул (экстрасистола) с более длинным интервалом сцепления быстрее продвигается по вышедшему из рефрактерности проксимальному участку, но блокируется в дистальном, где еще не восстановилась возбудимость (рис. 34). Ю. Н. Гришкин (1991) показал возможность сочетания нескольких вариантов феномена gap у одного и того же больного, а также выдвинул понятие о зоне gap, т. е. о ширине окна, в котором осуществляется проведение более раннего экстрастимула. Феномен «щели» может усиливаться или исчезать при изменениях длины сердечного цикла и связанных с ними колебаниях рефрактерности. «Щель» в проведении в дис-тальных участках системы Гиса — Пуркинье чаще наблюдается при длинных циклах. «Щель» в проведении в дисталыюп зоне А В узла, ско- 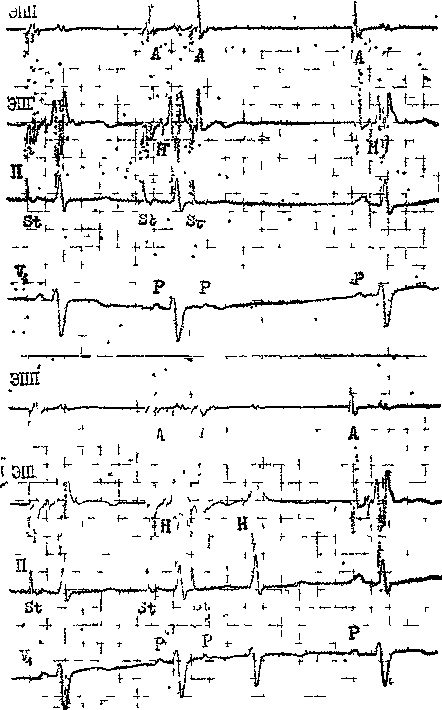 Рис. 33 Феномен «щели» в АН проведении (gap) — тип I Сверху—предсердный оьстрастимлл < интервалом сцепления 280 мс блокир v етс я в АВ узле (волна А без последующе! о Н) Внизу—предсердный эьстрастимул с интервалом сцепления 250 мс проводится через АВ \зел с интервалом St—R = 310 мс (А—Н=250 мс, Н— V=-45 ml) Предше-ствмощие окстрастим\ лам интервалы равны pee, возникает при коротких сердечных циклах. Недавно Т. Mazgalev и соавт. 1989) предложили новое объяснение феномену АВ узлового gap, учитывающее преходящие вагусные воздействия на АВ узел. Осложнения и смертность при ЭФИ. По сводным данным L. Ного-witz (1986), на 8545 эндокардиаль-ных ЭФИ, выполненных у 4015 больных, было 5 смертей (0,06%), в основном за счет того, что исследование было предпринято у больных, находившихся in extremis (ЖТ с остановкой сердца). Для сравнения напомним, что смертность при процедуре катетеризации сердца достигает 0,23%. Перфорация стенок при ЭФИ произошла в 19 случаях (0,22%), местом перфорации были верхушка правого желудочка (выпот в перикарде), коронарный синус Для 14 из этих 19 больных не потребовалось какое-либо специальное лечение. Тромбоз бедренных вен возник у 20 больных, в 9 случаях он осложнился эмболией легочной артерии. Другие осложнения ЭФИ: пневмоторакс (0,25%), повреждение бедренной артерии (0,2%). Электрическая кардиоверсия понадобилась 30—60% больным (по разным данным), у которых исследование проводилось для изучения желудочковых тахиарит-мий; при воспроизведении наджелу-дочковых тахиаритмий кардиоверсия потребовалась лишь в 1—2% случаев. В общем, осложнения редко встречаются при внутрисердечном ЭФИ, однако для его осуществления требуются обученные кардиологи и, конеч- 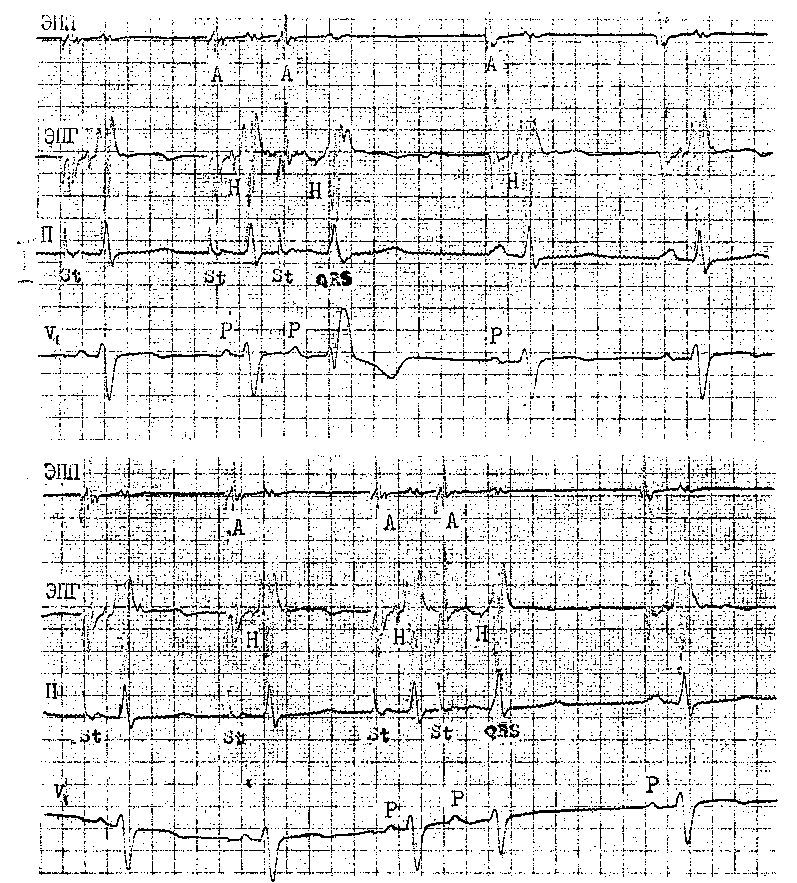 Рис. 34. Феномен «щели» в проведении в системе Гиса—Пуркинье (gap) — тип II. Сверху — предсердный экстрастимул с интервалом сцепления 310 мс блокируется в правой ножке; ВНИЗу — предсердный экстрастимул с интервалом сцепления 280 мс проводится оез блокирования в правой ножке. Предшествующие экстрастимулам интервалы равны. но, соответствующие условия. Осложнения при чреспищеводном ЭФИ еще более редки, но и его проводить должны только обладающие опытом специалисты в оборудованных электрофизиологических лабораториях. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
