Полушин Ю.С Руководство. Руководство по анестезиологии и реаниматологии под редакцией профессора Ю. С. Полушина
 Скачать 4.32 Mb. Скачать 4.32 Mb.
|
5.2. Мышечные релаксантыМиорелаксанты являются химическими соединениями, обладающими н-холинолитическими свойствами и избирательно блокирующими передачу в нервно-мышечном синапсе, что ведет к расслаблению поперечно-полосатой мускулатуры. Наличие одного или двух четвертичных атомов азота у всех блокаторов нейро-мышечной передачи делает эти препараты плохо растворимыми в липидах, что предотвращает их попадание в ЦНС. Все блокаторы нервно-мышечной передачи высокополярны и неактивны при пероральном приеме. Их вводят только внутривенно. Миорелаксанты могут быть классифицированы по химической структуре (табл. 5.1) и по механизму действия (табл. 5.2). Характерным свойством дериватов изохинолина является способность провоцировать гистаминолиберацию с соответствующими клиническими проявлениями в виде крапивницы, снижения артериального давления, бронхоспазма. Кроме того, производные изохинолина в значительной степени подвергаются в организме биотрансформации. Напротив, дериваты стероидов не высвобождают гистамин и в большинстве своем мало метаболизируются, преимущественно выделяясь из организма почками и/или печенью. Для производных стероидов характерна зависимость длительности действия от введенной дозы. Для современных производных изохинолина более свойственно дозонезависимое прекращение действия препарата. Таблица 5.1 Классификация миорелаксантов по химической структуре
Таблица 5.2 Классификация миорелаксантов по механизму и длительности действия
Механизм действия. Чтобы понять разницу в механизме действия миорелаксантов, необходимо четко представлять структуру нервно-мышечного синапса и механизм передачи импульсов в нем (рис.5.1). На подходе к мышечному волокну аксон теряет миелиновую оболочку и разветвляется на множество конечных веточек (терминалей). Поверхность каждой такой веточки, непосредственно прилежащая к мышце, называется пресинаптической мембраной. Вместе с так называемой концевой пластинкой (участком мышечного волокна в месте контакта с нервным окончанием) она образует нейро-мышечный синапс. Терминаль нерва содержит большое количество митохондрий и везикул с медиатором ацетилхолином. Между пре- и постсинаптическими мембранами находится пространство, заполненное гелем, которое называется синаптической щелью. Мембрана концевой пластинки (постсинаптическая мембрана) образует множественные складки. На постсинаптической мембране находятся н-холинорецепторы. Постсинаптическая мембрана в покое поляризована. Разница потенциалов наружной и внутренней поверхности мембраны (потенциал покоя) составляет 90 мВ. 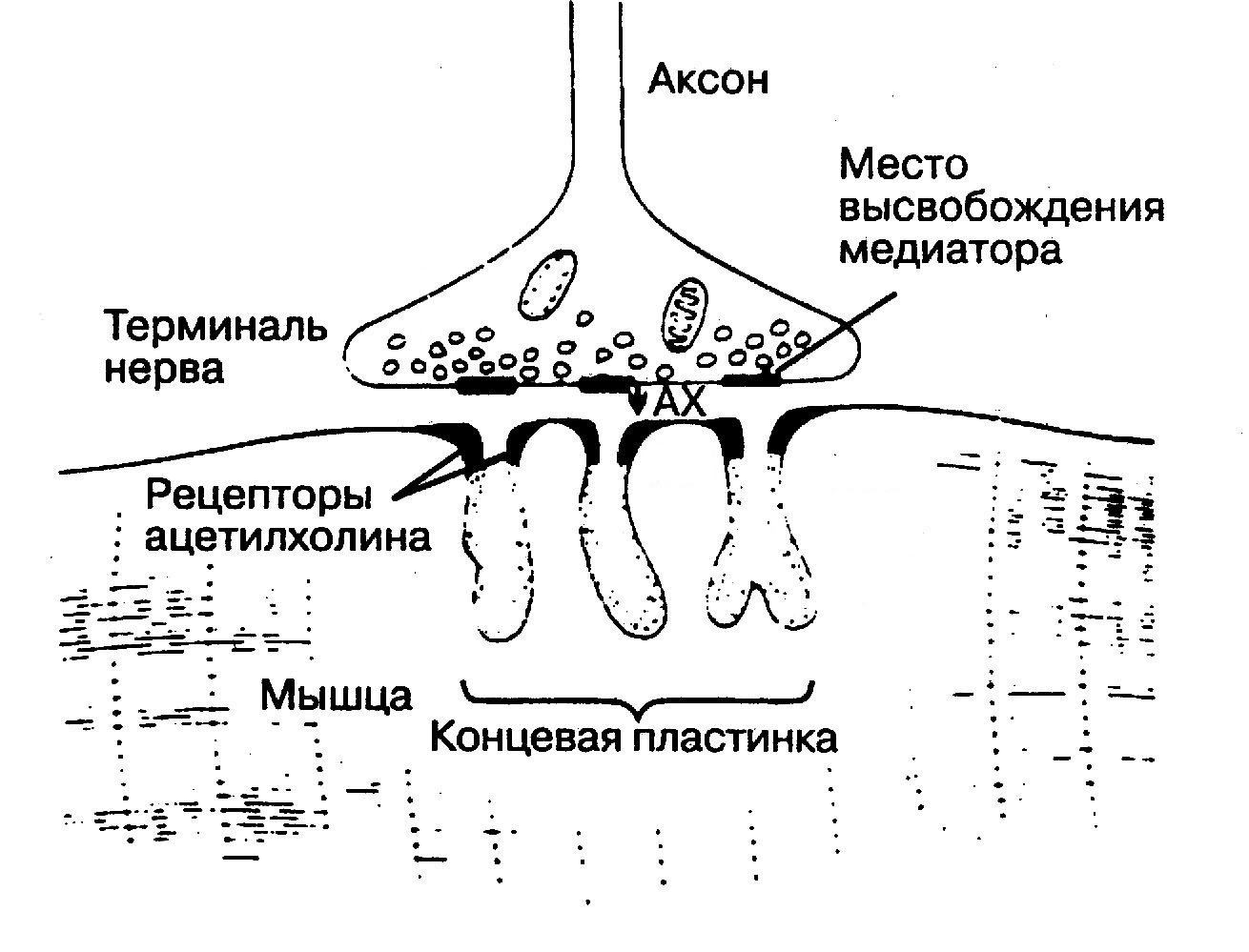 Рис.5.1. Строение нейро-мышечного синапса Процесс нервно-мышечной передачи выглядит следующим образом. Приходящее по аксону возбуждение в виде потенциала действия активирует кальциевые каналы, способствуя вхождению кальция внутрь нервного волокна. Повышение концентрации кальция внутри терминали нерва приводит к слиянию везикулярных мембран с мембраной нервного окончания и выбросу ацетилхолина из везикул в синаптическую щель. Далее ацетилхолин связывается с холинорецепторами постсинаптической мембраны, что приводит к открытию ионных каналов и переходу по градиенту концентрации Na+ и Ca2+ внутрь клетки и выходу К+ из клетки. Быстрое перемещение Na+ внутрь клетки вызывает деполяризацию мембраны (за счет уменьшения отрицательного заряда внутренней поверхности мембраны), а возникший потенциал концевой пластинки при определенном количестве связанных с ацетилхолином рецепторов достигает такой величины, что распространяется на соседние участки мышечного волокна в виде потенциала действия, приводя к сокращению мышцы. Ацетилхолин же быстро гидролизуется специфическим ферментом ацетилхолинэстеразой на холин и уксусную кислоту. Молекулы фермента фиксированы в концевой пластинке в непосредственной близости от холинорецепторов. Освобожденная от ацетилхолина концевая пластинка переходит в свое прежнее состояние. Каналы закрываются, электролиты возвращаются к своим прежним уровням за счет активного транспорта. Мышца расслабляется. После кратковременного рефрактерного периода, во время которого восстанавливается потенциал покоя, мембрана вновь становится готова реагировать на поступление в синаптическую щель очередной порции ацетилхолина, а мышца - реагировать на приходящий потенциал действия сокращением. Недеполяризующие релаксанты действуют как конкурентные антагонисты ацетилхолина. Они экранируют н-холинорецепторы от взаимодействия с медиатором. Причем полагают, что одна молекула недеполяризующего миорелаксанта может перекрывать собой несколько рецепторов. Кроме того, недеполяризующие миорелаксанты могут блокировать пресинаптические каналы, затрудняя транспорт ацетилхолина из нервных окончаний в синаптическую щель. Важным следствием конкурентности их действия является способность ингибиторов холинэстеразы уменьшать или даже полностью прекращать блокаду за счет накопления медиатора в синаптических щелях. Конкуренция за рецепторы между недеполяризующими релаксантами и ацетилхолином проявляется и в том, что все вещества, прямо или косвенно тормозящие высвобождение ацетилхолина (ионы магния, новокаин, аминогликозиды и др.), а также углубление общей анестезии, приводящее к уменьшению потока импульсов, усиливают блок, в то время как стимуляторы ЦНС, а также неадекватность анестезии – уменьшают его. Деполяризующие миорелаксанты действуют в 2 этапа. На первом этапе - деполяризующем, проявляется действие сукцинилхолина, аналогичное ацетилхолину, сопровождающееся деполяризацией концевой пластинки. При этом клинически наблюдаются миофасцикуляции (судороги, особенно заметные в дистальных участках конечностей). Для поддержания мышечного сокращения необходимо продолжающееся поступление потенциалов концевой пластинки с формированием серии потенциалов действия на миоците. Для формирования очередного потенциала концевой пластинки она должна сначала реполяризоваться, а затем вновь деполяризоваться. Поскольку сукцинилхолин не гидролизуется в синапсе быстро, рецепторы остаются блокированными, повторные импульсы с концевой пластинки не поступают, мышечное волокно реполяризуется, развивается миорелаксация (второй этап). Этому же способствует и проникновение препарата непосредственно в ионные каналы. Применение антихолинэстеразных препаратов и повышение тем самым уровня ацетилхолина в синапсе не только не способствует восстановлению нервно-мышечной проводимости, но может привести к удлинению релаксации. Иногда, спустя 15-30 мин после окончания типичного деполяризующего блока, наблюдается так называемая 2-я фаза блока, проявляющаяся появлением мышечной слабости, вплоть до выраженной. Эта фаза может длиться несколько часов. Блок при этом имеет характеристики недеполяризующего, существенно уменьшаясь при применении антихолинэстеразных препаратов. Данное явление не получило пока достаточно убедительного объяснения. Согласно существующей гипотезе, на мембране миоцита вокруг концевой пластинки возникает невозбудимая зона, что препятствует распространению возбуждения даже при поступлении импульсов с холинорецепторов. Влияние миорелаксантов на основные функциональные системы организма. Современные недеполяризующие миорелаксанты практически не влияют на функции основных систем организма, за исключением кровообращения. Вследствие гистаминолиберации, присущей производным изохинолина (особенно тракриум и мивакрон), возможно снижение артериального давления при их быстром введении. Именно поэтому мивакрон рекомендуют вводить очень медленно или даже разделять его первую болюсную дозу на две части. Кроме того, более старым недеполяризующим релаксантам, таким как, например, тубарин, свойственно ганглиоблокирующее действие, также проявляющееся артериальной гипотензией. Ряд недеполяризующих миорелаксантов обладает ваголитическими свойствами. Так, павулон обычно вызывает умеренные тахикардию и артериальную гипертензию, благодаря чему этот препарат считается наиболее безопасным при травматическом шоке. Эсмерон также может вызвать тахикардию, особенно при скрытой или явной гиповолемии. Отдельно следует рассмотреть деполяризующий миорелаксант сукцинилхолин, поскольку его побочные действия отличаются разноплановостью и выраженностью проявлений, что обусловлено неселективностью стимулирующего действия данного препарата на н- и м-холинорецепторы. Сукцинилхолин может приводить к заметному изменению частоты сердечных сокращений и повышению или понижению артериального давления. Это обусловлено тем, что в малых дозах он имеет отрицательные хроно- и инотропные эффекты, в больших – положительные. При повторном введении способен привести к выраженной брадикардии вплоть до асистолии. Поэтому премедикация атропином обязательна, если предполагается использовать для интубации трахеи сукцинилхолин. Сукцинилхолин может приводить к выраженной гиперкалиемии, что особенно часто наблюдается у пациентов с заболеваниями и травмами нервной системы, почечной недостаточностью, ожогами, перитонитом. Сукцинилхолин повышает внутриглазное (не рекомендуется его использование при офтальмологических операциях, особенно сопровождающихся вскрытием передней камеры глаза), внутричерепное (нежелательно его применение при внутричерепной гипертензии любого происхождения и при черепно-мозговой травме) и внутрижелудочное давление (повышенная вероятность рвоты или регургитации). Сукцинилхолин может привести к бронхоспазму и повышенной саливации. После применения сукцинилхолина у большинства больных наблюдаются мышечные боли, что связывают прежде всего с повреждением мышц при миофасцикуляциях. Это объективно подтверждается миоглобинурией после использования препарата. Применение основных миорелаксантов. Сукцинилхолин (дитилин,миорелаксин, листенон) – единственный деполяризующий миорелаксант, находящий широкое применение. Несмотря на выраженность побочных эффектов его используют, когда необходима быстрая интубация трахеи (например, у неподготовленного пациента с потенциально полным желудком при неотложной операции) или когда анестезиолог не уверен в успешности предстоящей интубации трахеи (здесь играет роль уникально короткая продолжительность миорелаксации при использовании дитилина). Хотя и в этих двух случаях многие анестезиологи избегают введения деполяризующих релаксантов. Для интубации трахеи используют дозу 1 – 2 мг/кг. При этом интубация возможна через 1 мин. Длительность миорелаксации при однократном введении не превышает 10 мин. Для поддержания миоплегии применяют повторные болюсные введения по 1 мг/кг. Для предупреждения отрицательных эффектов дитилина, связанных с фибриллярным сокращением мышц, следует осуществлять «прекураризацию», т. е. до инъекции дитилина ввести внутривенно 1/4 расчетной дозы недеполяризующего миорелаксанта. При этом, учитывая антагонистическое взаимодействие недеполяризующих и деполяризующих релаксантов, дозу дитилина для интубации трахеи следует увеличить в 1,5 – 2 раза (2 – 3 мг/кг). Дитилин в организме подвергается двойному гидролизу с помощью псевдохолинэстеразы плазмы крови сначала до сукцинилмонохолина, а затем до холина и янтарной кислоты. Если больной имеет генетический дефект псевдохолинэстеразы (это наблюдается с частотой 1:8000 – 1:9000), дитилиновый блок может длиться до 2 ч и более. В этом случае для прекращения действия дитилина показана трансфузия свежезамороженной плазмы или даже свежестабилизированной крови. Замедление инактивации дитилина и удлинение блока могут также наблюдаться при отравлении антихолинэстеразными препаратами, при массивной кровопотере, гиперкапнии, нарушении кровообращения в мышцах. Павулон позволяет интубировать трахею через 4 мин после введения в дозе 0,08 – 0,12 мг/кг. При этом продолжительность блока составляет 50 – 90 мин. Повторно вводится по 0,02 мг/кг с продолжительностью действия от 25 до 60 мин. Препарат подвергается деацетилированию в печени, кроме того, основная часть препарата выводится почками. Почечная, печеночная недостаточность, цирроз печени, нарушение оттока желчи удлиняют действие препарата (вплоть до двукратного). Ардуан используется в первоначальной дозе 0,04 – 0,08 мг/кг. При этом удовлетворительные условия для интубации трахеи возникают через 4 мин, а блок длится 45 – 70 мин. Повторно вводится по 0,01 - 0,02 мг/кг через 30 – 60 мин. Метаболизм незначителен. Элиминация определяется экскрецией через почки (70%) и с желчью (20%), поэтому его действие удлиняется при почечной недостаточности. Норкурон – один из наиболее широко применяемых в мире недеполяризующих миорелаксантов. Это связано с его хорошей управляемостью и практическим отсутствием побочных эффектов. Препарат рассматривается как оптимальный с позиций соотношения стоимость/эффективность для операций средней продолжительности и длительных. Для интубации трахеи вводят в дозе 0,1 мг/кг. Хорошие условия для интубации трахеи возникают при этом через 2 мин, а эффективный блок продолжается 20 – 40 мин. Препарат обладает выраженной зависимостью длительности действия от дозы. Однократного введения 0,15 – 0,2 мг/кг достаточно для обеспечения большинства операций продолжительностью около 1 ч. Если ввести 0,4 – 0,5 мг/кг, то длительность релаксации составит 100 – 110 мин, но интубировать трахею можно будет уже через 60 – 80 с. Повторно вводится болюсно по 0,01 – 0,03 мг/кг каждые 15 – 30 мин или инфузионно со скоростью 1 – 2 мкг/кг/мин. Элиминация из организма происходит, главным образом, с желчью. При печеночной недостаточности блок будет более длительным. Эсмерон – препарат, считающийся максимально близким по своим свойствам к идеальному. Обладает управляемым, средним по продолжительности действием, позволяет обеспечивать быструю (в пределах 1 мин) интубацию трахеи, оставаясь в то же время классическим недеполяризующим миорелаксантом. Для интубации трахеи используется доза 0,6 мг/кг. Хорошие условия для интубации создаются через 60 – 90 с. Продолжительность эффективной блокады при этом составляет 30 – 40 мин. Увеличение дозы до 0,9 мг/кг создает хорошие условия для интубации гарантированно в пределах 60 с, миорелаксация же удлиняется до 40 – 50 мин. Повторно вводится по 0,15 мг/кг каждые 15 – 25 мин или 10 – 12 мкг/кг/мин путем инфузии. Выводится из организма, как и норкурон, желчью. Мивакрон подобно сукцинилхолину подвергается гидролизу с помощью псевдохолинэстеразы. Хотя при наличии даже минимально восстановленного мышечного тонуса эффективны в плане декураризации антихолинэстеразные препараты. При печеночной недостаточности снижается концентрация псевдохолинэстеразы, увеличивая тем самым продолжительность действия мивакрона. Для проведения интубации трахеи необходима доза 0,25 мг/кг, разделенная на 2 части (0,15 и 0,10 мг/кг), вводимые с интервалом 30 с, что позволяет избежать гистаминолиберации. Интубация трахеи возможна через 2 мин. Действие препарата в этом случае продолжается 15 – 20 мин. В дальнейшем рекомендуется поддерживать миорелаксацию инфузией со скоростью 4 – 10 мкг/кг/мин или дробным введением по 0,1 мг/кг каждые 10 – 15 мин. Мивакрон в целом считается препаратом выбора при коротких операциях, особенно в стационаре одного дня, кроме того, он снижает внутриглазное давление, поэтому рекомендуется для офтальмологических операций. Тракриум. Несомненным достоинством препарата является его способность подвергаться спонтанному разрушению в организме за счет двух процессов – гидролиза эфирной связи (катализируется неспецифическими эстеразами без участия ацетилхолин- и псевдохолинэстеразы), и элиминации Хоффмана (спонтанное неферментативное разрушение при физиологических значениях рН и температуры тела). С мочой и желчью выводится не более 10% препарата. Для интубации трахеи необходима доза 0,5 мг/кг. Эффективный блок развивается через 1,5 – 2,5 мин. Продолжительность блока при этом составляет 20-30 мин. Поддерживающая доза – 0,1 мг/кг каждые 10-20 мин, может применяться инфузия 5-9 мкг/кг/мин. Высвобождение гистамина при быстром введении препарата может быть ощутимым и проявляться гипотензией и/или бронхоспазмом. Кроме того, продукт метаболизма тракриума лауданозин может вызывать возбуждение и судороги, поскольку является токсичным для ЦНС. Необходимо помнить, что гипотермия и ацидоз, затрудняя элиминацию Хоффмана, удлиняют действие препарата. В целом, тракриум считается особенно показанным при почечной недостаточности. Нимбекс. Этот препарат является изомером тракриума. Он также подвергается элиминации Хоффмана, однако, в отличие от тракриума, не разрушается неспецифическими эстеразами. Печеночная и почечная недостаточность не влияют на метаболизм нимбекса. Доза для интубации составляет 0,15 мг/кг. Интубировать можно через 2 – 3 мин после введения препарата. Продолжительность блока составляет 40 – 60 мин. Для поддержания релаксации используются инфузия со скоростью 1-2 мкг/кг/мин или повторные болюсные дозы 0,03 мг/кг. Повторные болюсные дозы обеспечивают клинически эффективную миоплегию в течение 20 – 25 мин. В отличие от тракриума препарат значительно меньше повышает уровень гистамина в плазме и, соответственно, значительно реже вызывает побочные эффекты. Токсичность лауданозина, образующегося при элиминации Хоффмана, и чувствительность к температуре и рН аналогичны таковым у тракриума. Как и тракриум, нимбекс наиболее показан при наличии у больного почечной недостаточности. Выбор миорелаксанта в конкретной ситуации определяется предполагаемой длительностью операции и состоянием больного. При кратковременных (до 30 мин) вмешательствах наиболее оправдано применение мивакрона, при операциях средней продолжительности (от 30 мин до 1,5 ч) целесообразнее всего использовать норкурон или эсмерон. У больных с сопутствующей печеночно-почечной недостаточностью наиболее оправданы тракриум и нимбекс. Если требуется длительная миорелаксация (например, для проведения длительной ИВЛ) наиболее выгодно применение ардуана или павулона, учитывая их небольшую стоимость. Декураризация и методика ее проведения. Зачастую возникает необходимость ускорить восстановление нейромышечной проводимости по окончании общей анестезии. Искусственное прекращение действия недеполяризующих миорелаксантов называется декураризацией. Ее рекомендуется проводить при наличии хотя бы минимально восстановленного мышечного тонуса. В противном случае риск рекураризации (то есть возобновления действия миорелаксанта) чрезвычайно высок. Для декураризации используются ингибиторы ацетилхолинэстеразы (прозерин и др.), приводящие к накоплению в синапсе ацетилхолина, его конкуренции с недеполяризующим релаксантом и облегчению нейромышечной проводимости. Механизм действия ингибиторов ацетилхолинэстеразы сводится к следующему. Препарат связывается с активным центром фермента, блокирует его, не давая возможность реагировать с ацетилхолином. Причем сам антихолинэстеразный препарат при этом подвергается гидролизу, как и ацетилхолин. Только если при взаимодействии ацетилхолина с ацетилхолинэстеразой гидролиз завершается за 150 мкс, то для гидролиза прозерина требуется более 30 мин. Учитывая развивающийся при введении антихолинэстеразных препаратов выраженный м-холиномиметический эффект (брадикардия, саливация, бронхорея, ларингоспазм), необходимо предварять их введение инъекцией атропина (порядка 0,01 мг/кг). Прозерин вводится в дозе 40-80 мкг/кг (но не более 5 мг) под контролем частоты сердечных сокращений. При необходимости повторяют инъекцию атропина. При недостаточном эффекте допускается повторное введение анихолинэстеразных препаратов (суммарная доза не должна превышать 5 мг). Эффект развивается через 5-10 мин после инъекции. О восстановлении достаточного мышечною тонуса свидетельствует способность больного по просьбе изменять частоту и глубину дыхания, удерживать в вертикальном положении выпрямленную руку, поднимать голову oт поверхности стола и удерживать ее. Осложнения, связанные с применением миорелаксантов. При применении миорелаксантов возможен ряд осложнений, степень опасности которых для жизни больных различна. К ним относятся нарушения функции сердечно-сосудистой системы и дыхания, пролонгированное действие миорелаксанта, рекураризация, синдром злокачественной гипертермии и др. Пролонгированное действие миорелаксантов и апноэ. Пролонгированное действие миорелаксантов может проявляться угнетением дыхания вплоть до апноэ. Продленная миорелаксация может быть следствием многих причин. В частности, гиповолемия и нарушение микроциркуляции удлиняют действие как деполяризующих, так и недеполяризующих миорелаксантов вследствие нарушения кровообращения в тканях и связывания миорелаксантов с неспецифическими рецепторами, а также замедления инактивации в тканях и выведения их из организма почками. Расстройства электролитного обмена, особенно гипокалиемия и гипермагниемия, удлиняют действие недеполяризующих миорелаксантов. Ацидоз удлиняет эффекты как деполяризующих (замедление щелочного гидролиза), так и недеполяризующих (замедление выведения почками) релаксантов. Возможно суммирование остаточного действия недеполяризующих миорелаксантов с курареподобным эффектом некоторых антибиотиков (аминогликозиды). Пролонгированный эффект дитилина и его аналогов может быть обусловлен второй фазой его действия, дефицитом псевдохолинэстеразы. Следует иметь в виду, что апноэ после применения миорелаксантов может быть следствием искусственной гипервентиляции легких. Меры профилактики и лечения этих осложнений сводятся к устранению причин, обусловливающих их появление. Рекураризация. Она проявляется тем, что непосредственно после пробуждения больного восстанавливаются мышечный тонус и эффективное дыхание, а затем через некоторое время опять появляются миорелаксация и угнетение самостоятельного дыхания вплоть до полной его остановки. Различают рекураризацию истинную, которая возникает после проведенной декураризации, и ложную, развивающуюся повторно у больного, которому декураризацию не проводили. В возникновении истинной рекураризации может иметь значение ослабление с течением времени эффекта прозерина, когда миорелаксант не успел еще разрушиться в организме или выделиться. После восстановления активности холинэстеразы снижается повышенная на фоне действия прозерина концентрация ацетилхолина, поэтому из-за конкурентного взаимодействия с ним недеполяризующего миорелаксанта вновь блокируется передача в синапсах. Причиной ложной рекураризации может быть снижение двигательной активности больного после доставки его в палату, где он успокаивается и засыпает. В это время могут угнетаться дыхание, возникать гиперкапния, которая потенцирует эффект остаточной миорелаксации. Профилактикой рекураризации служит постоянное наблюдение за больным, особенно в течение первых 2-х часов после экстубации, и, при необходимости, повторное проведение декураризации. При явных признаках дыхательной недостаточности показан перевод больного на искусственную или вспомогательную вентиляцию легких. Синдром злокачественной гипертермии. Злокачественная гипертермия – самое опасное осложнение, встречаемое при использовании сукцинилхолина. Оно проявляется в виде гиперметаболического ответа на пусковое воздействие некоторых лекарственных средств или стресса. Это осложнение встречается достаточно редко (по разным данным, порядка 1:100000 анестезий). Однако в некоторых регионах (например, Канада) бывает значительно чаще (до 1:1500) в связи с генетической природой синдрома. Наиболее часто встречается у лиц от 3 до 30 лет. У мужчин распространен более часто, учитывая их большую мышечную массу. Летальность превышает 70%, однако она может быть значительно снижена при своевременной диагностике. Специфическое лечение дантроленом с 1979 г. позволило повысить выживаемость до 90%. Синдром может развиться как во время вводной анестезии, так и спустя несколько часов после ее окончания. Самые частые триггеры – сукцинилхолин и фторотан, хотя ими могут быть и другие препараты (калипсол, лидокаин и проч.). Выраженность злокачественной гипертермии может усиливаться при использовании адреналина, сердечных гликозидов, препаратов кальция, дериватов теофиллина. Она может возникать и без применения каких-либо лекарств, в ответ на эмоциональную реакцию (предполагается участие эндогенного норадреналина). Злокачественная гипертермия – функциональные нарушения обмена кальция при патологических отклонениях в физиологии мышц (дисфункция саркоплазматического ретикулума), хотя повреждаются при этом и другие структуры, связанные с кальцием (миокард, нервы, тромбоциты, лимфоциты и др.). Клинические признаки злокачественной гипертермии во время общей анестезии: тахикардия, тахипноэ, нестабильность АД, нарушения ритма сердца, цианоз, влажность кожи, повышение температуры тела на 2º в час или свыше 42ºС, фасцикуляции, генерализованная ригидность, спазм жевательной мускулатуры, изменение окраски мочи, потемнение крови в ране. Инструментальные и лабораторные признаки: гипоксемия, гиперкапния, метаболический или смешанный ацидоз, гиперкалиемия, миоглобинемия, миоглобинурия, повышения КФК. Терапия синдрома злокачественной гипертермии. Прекратить операцию (по возможности), прекратить введение газообразных анестетиков, гипервентиляция 100% кислородом, дантролен 2,5 мг/кг в/в с последующей инфузией до общей дозы 10 мг/кг, физическое охлаждение больного, купирование нарушений ритма, коррекция ацидоза (гидрокарбонат натрия 1-2 ммоль/л первоначально, далее под контролем анализов крови), поддержание диуреза выше 2 мл/кг/ч, купирование гиперкалиемии (глюкоза с инсулином). |
