Исаева,Хадашева Общая химия 1 курс экз. S Что изучает химическая термодинамика
 Скачать 497.5 Kb. Скачать 497.5 Kb.
|
|
-: -: +: I: S: Формула нахождения концентрации гидроксид-ионов для буферов, образованных слабым основанием и его солью выглядит -: -: +: -: I: S: Формула для вычисления рН буферных систем называется уравнением -: Ампера-Оствальда -: Аррениуса-Энштейна +: Гендерсона-Хассельбаха -: Бренстеда-Лоури I: S: Численное совпадение рН и рК кислоты есть +: силовой показатель кислоты -: показатель основания -: показатель соли -: силовой регулятор напряжения I: S: Совпадающее, при равенстве концентраций основания и соли (составляющих буферную систему), с рН раствора значение отрицательного десятичного логарифма константы ионизации основания называют +: силовой показатель основания -: показатель кислоты -: показатель буфера -: силовой трансформатор I: S: Формула для вычисления рН буфера, образованного слабой кислотой и ее солью, будет -: +: -: -: I: S: рОН буфера, образованного слабым основанием и его солью находится по формуле -: -: -: +: I: S: рН аммиачного буфера находится по формуле +: -: -: -: I: S: Буферные системы поддерживают в организме равновесия +: кислотно-основные -: окислительно-восстановительные -: гетерогенные -: лигандообменные I: S: Фосфатная буферная система содержит в организме кислотно-основные сопряженные пары -: Н3РО4 – кислота, Н2РО4- - сопряженное основание +: Н2РО4- - кислота, НРО42- - сопряженное основание -: НРО42- - кислота, РО43- - сопряженное основание -: Н3РО4 – кислота, РО43- - сопряженное основание I: S: Комплексные соединения – это -: сложные устойчивые химические образования -: вещества, состоящие из комплексообразователя и лигандов -: соединения, состоящие из внутренней и внешней среды +: сложные устойчивые химические соединения, в которых обязательно присутствует связь, образованная по донорно-акцепторному механизму I: S: Комплексообразователи – это -: только атомы, доноры электронных пар -: только ионы, акцепторы электронных пар -: только d-элементы, доноры электронных пар +: атомы или ионы, акцепторы электронных пар I: S: Наименьшей комплексообразующей способностью обладают -: d-элементы +: s-элементы -: p-элементы -: f-элементы I: S: Лучшим комплексообразователем из: Na, Mg, Co, Al является -: Na -: Mg +: Co -: Al I: S: Назовите комплексообразователь в гемоглобине -: Cu0 -: Fe3+ +: Fe2+ -: Fe0 I: S: Лиганды – это -: молекулы, доноры электронных пар -: ионы, акцепторы электронных пар -: молекулы и ионы - акцепторы электронных пар +: молекулы и ионы - доноры электронных пар I: S: При образовании комплекса лиганды являются +: донором электронной пары -: акцептором электронной пары -: и донором, и акцептором электронной пары -: ковалентная связь в комплексе образуется по обменному механизму I: S: Какая связь между комплексообразователем и лигандами +: ковалентная по донорно-акцепторному механизму -: ковалентная по обменному механизму -: ионная -: водородная I: S: Дентатность –это -: число связей между комплексообразователем и лигандами +: число электродонорных атомов в лиганде -: число электродонорных атомов в комплексообразователе -: число электроакцепторных атомов в комплексообразователе I: S: В хелатные соединения входят -: монодентатные лиганды -: полидентатные лиганды -: бидентатные лиганды +: би- и полидентатные лиганды I: S: Из перечисленных лигандов выберите бидентатные а)CN-; б)H2O; в)CO3 2-; г)C2O4 2-; д)NO3- +: в, г -: а, б, г -: б, в, г -: все I: S: По дентатности этиленаминтетраацетат является лигандом -: монодентатным +: полидентатным -: бидентатным -: тетрадентатным I: S: Какова дентатность лиганда OH- +: моно- -: би- -: поли- -: тетра- I: S: Из перечисленных лигандов выберите монодентатные а)CN-; б)OH-; в)CO32-; г)C2O42-; д)NO2- +: а, б, д -: а, б, в -: в, г, д -: б, г, д I: S: Какой лиганд является бидентатным +: CO32- -: OH- -: H2O -: NH3 I: S: Выберите ряд монодентатных лигандов -: Cl-,CO32-, NH3, CO2- -: F-, NO2-, CNS-, C2O42- +: H2O, NO-, OH-, CN- -: H2O, CO32-, CN-, NH3 I: S: Для ионов щелочных металлов комплексообразование мало характерно вследствие: а) устойчивой электронной структуры; б) больших размеров; в) малого заряда ядра; г) слабого поляризующего действия +: а, б, в, г -: а, б -: б, в, г -: а, б, г I: S: В каком качестве галогены входят в состав комплексных соединений: а) лигандов; б) комплексообразователей; в) лигандов и комплексообразователей; г) внешней среды +: а, г -: б, г -: в, г -: а, в, г I: S: Унитиол – это: а) антидот, образующий комплексное соединение с тяжелыми металлами; б) лекарственный препарат, применяемый для улучшения кроветворения; в) противоядие при отравлении селеном; г) хорошо растворимая соль, содержащая SN-группы -: а -: б +: а, г -: в I: S: Что собой представляет гемоглобин (Hb)по химической природе +: Hb - сложный белок, содержащий хелатный микроцикл гем с железом в степени окисления +2 -: Hb - кислый белок, содержащий небелковую часть - гем с железом в степени окисления +3 -: Hb - транспортная форма кислорода, содержащая атом железа в нейтральном состоянии -: Hb - резервная форма кислорода, содержащая атом железа в степени окисления +2 I: S: Через атомы каких элементов, как правило, идет координация лигандов с металлами в биокомплексах +: O, N -: O, S, N -: H, O, P -: H, P, S I: S: Что такое координационное число +: число связей комплексообразователя -: число центральных атомов -: число полидентатных лигандов -: заряд внутренней сферы I: S: Укажите координационное число центрального атома и его заряд в соединении [Cr(NH3)2Cl2] +: 4, +2 -: 6, +3 -: 2, +2 -: 6, +2 I: S: Укажите координационное число центрального атома и его заряд в соединении [Co(NH3)3Cl3] +: 6, +3 -: 4, +3 -: 6, +2 -: 4, +3 I: S: Для платины в степени окисления +4 характерно координационное число -: 2 -: 4 +: 6 -: 3 I: S: Для цинка в бионеорганических комплексах характерно координационное число +: 4 -: 6 -: 4, 6 -: 2 I: S: Чем меньше Кн, тем комплекс более +: устойчивый -: устойчивость не определяется величиной Кн -: неустойчивый -: растворимый I: S: Устойчивость комплекса с увеличением числа донорных атомов в полидентатном лиганде +: увеличивается -: уменьшается -: не изменяется -: может и увеличиваться, и уменьшаться I: S: Расположите соединения по увеличению прочности, если: а) Кн[Zn(NH3)4]2+ = 8,3*10-12; б) Кн[Ni(NH3)4]2+ = 3,4*10-8; в) Кн[Cd(NH3)4]2+ = 2,8*10-7; г) Кн[Cu(NH3)4]2+ = 1,1*10-12 -: а, б, в, г -: б, г, в, а +: в, б, а, г -: в, г, б, а I: S: Расположите соединения по уменьшению прочности, если: а)Кн[Zn(NH3)4]2+ = 8,3*10-12; б) Кн[Ni(NH3)4]2+ = 3,4*10-8; в) Кн[Cd(NH3)4]2+ = 2,8*10-7; г) Кн[Cu(NH3)4]2+ = 1,1*10-12 -: а, г, б, в +: г, а, б, в -: б, г, в, а -: а, б, в, г I: S: Какой комплекс наиболее прочный, если -: Кн[Zn(OH)4]2-= 1,99*10-18 +: Кн[Zn(CN)4]2-= 2,4*10-20 -: Кн[Zn(NH3)4]2+-= 8,3*10-12 -: Кн[Zn(H2O)4]2+-= 2,1*10-10 I: S: Противоопухолевым действием обладают комплексные соединения +: Pt -: Zn -: Mg -: Os I: S: Определите заряд внутренней сферы в соединении K4[Fe(CN)6] -: +4 +: -4 -: -3 -: -2 I: S: Какое комплексное соединение не имеет первичной диссоциации -: K2[PtCl6] -: [Co(NH3)6]Cl3 +: [Pt(NH3)2Cl2] -: [Ag(NH3)2]OH I: S: Определите степень окисления центрального атома в соединении [Pt(NH3)2Cl2] -: +4 +: +2 -: 0 -: +6 I: S: Определите степень окисления центрального атома в соединении [Co(NH3)6]Cl3 -: +2 +: +3 -: +6 -: 0 I: S: Определите заряд внутренней сферы в комплексном соединении K3[Al(OH)6] +: -3 -: +3 -: +4 -: -6 I: S: Каков заряд внутренней сферы и комплексообразователя в соединении K4[FeF6] -: -4, +3 +: -4, +2 -: +3, -2 -: -2, +6 I: S: Какое координационное число характерно для платиновых металлов в комплексных соединениях -: 4 -: 6 -: 2 +: 4 и 6 I: S: Какой элемент является комплексообразователем в хлорофилле -: Co -: Fe +: Mg -: Mn I: S: Назовите элемент – комплексообразователь в молекуле витамина В12 -: Fe +: Co -: Ni -: Mg I: S: В состав полости биокластера металлоферментов цитохромов входит катион металла -: Mo+3 -: Zn+2 +: Fe+3 -: Cu+2 I: S: Нарушение метало-лигандного баланса возможно при: а) поступлении ионов-токсикантов из окружающей среды; б) повышенном поступлении микроэлементов; в) недостаточном поступлении микроэлементов; г) поступлении токсичных лигандов или образовании «фальшивых» лигандов -: а, г -: а, б -: в, г +: а, б, в, г I: S: Основные физиологические формы гемоглобина: а) оксигемоглобин, гем- Fe2+ - O2 б) карбаминогемоглобин, [глобин- CO2]-; в) карбаминогемоглобин, гем- Fe2+ - CO2 г) карбоксигемоглобин, гем- Fe2+ - CO; д) метгемоглобин, гем- Fe2+ - OH -: все -: а, в, д -: а, б, г +: а, б I: S: При гидролизе анионом молярную концентрацию ионов водорода находят по формуле -: 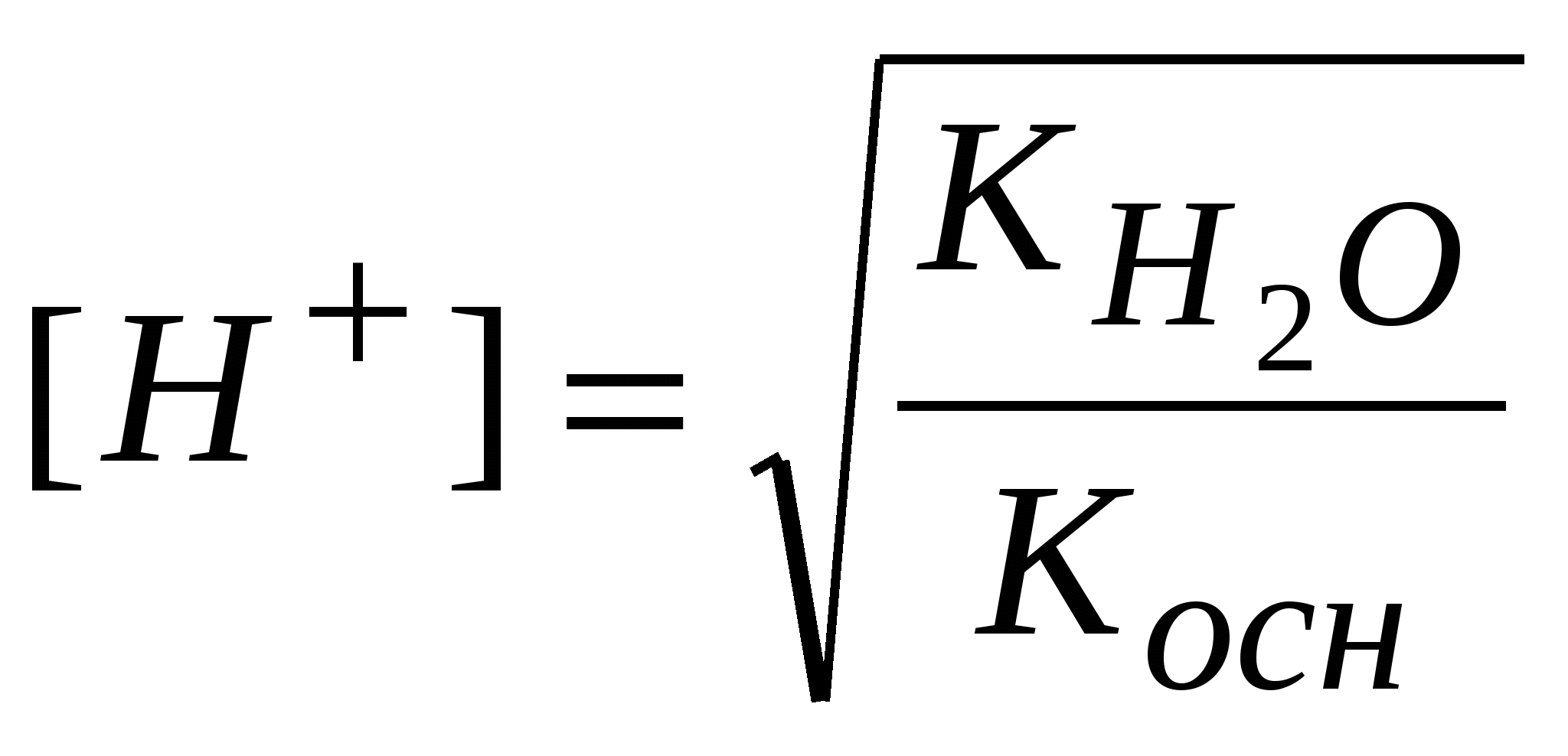 -: 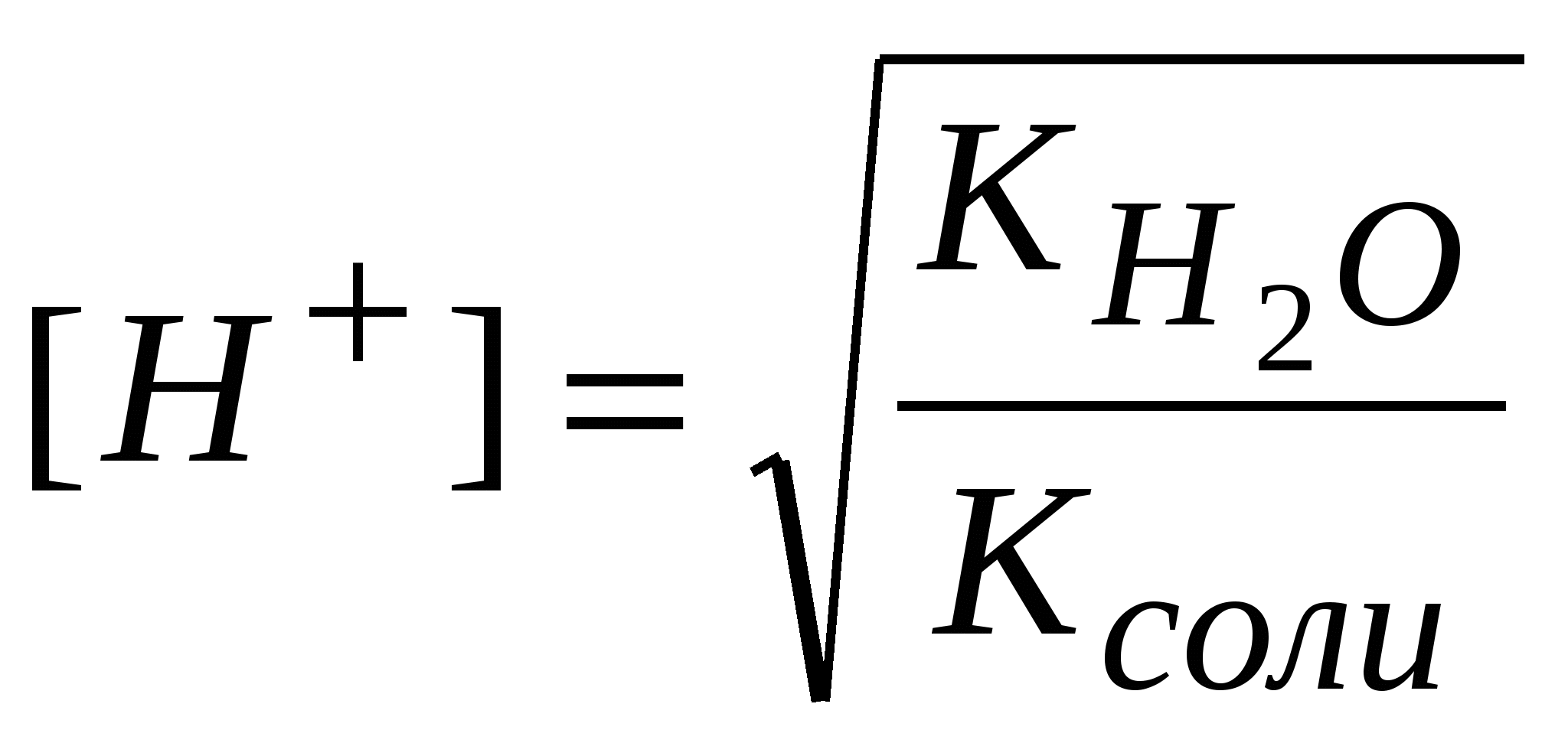 -: +: 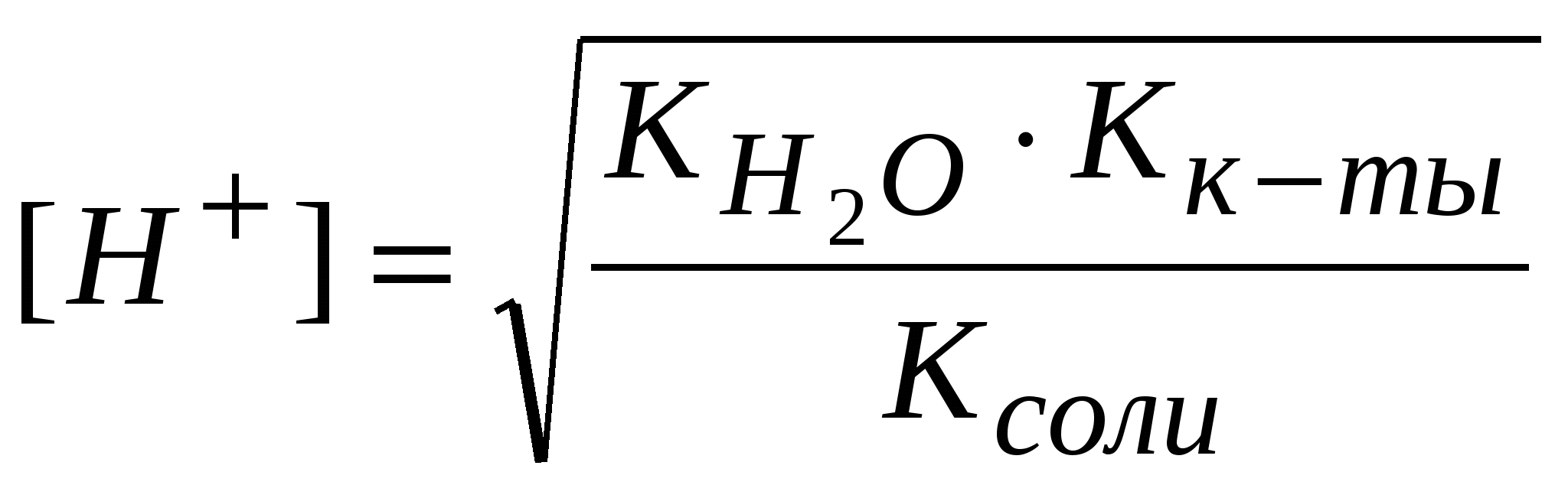 I: S: Если гидролиз осуществляется катионом и анионом одновременно, то концентрацию ионов водорода вычисляют по формуле -: 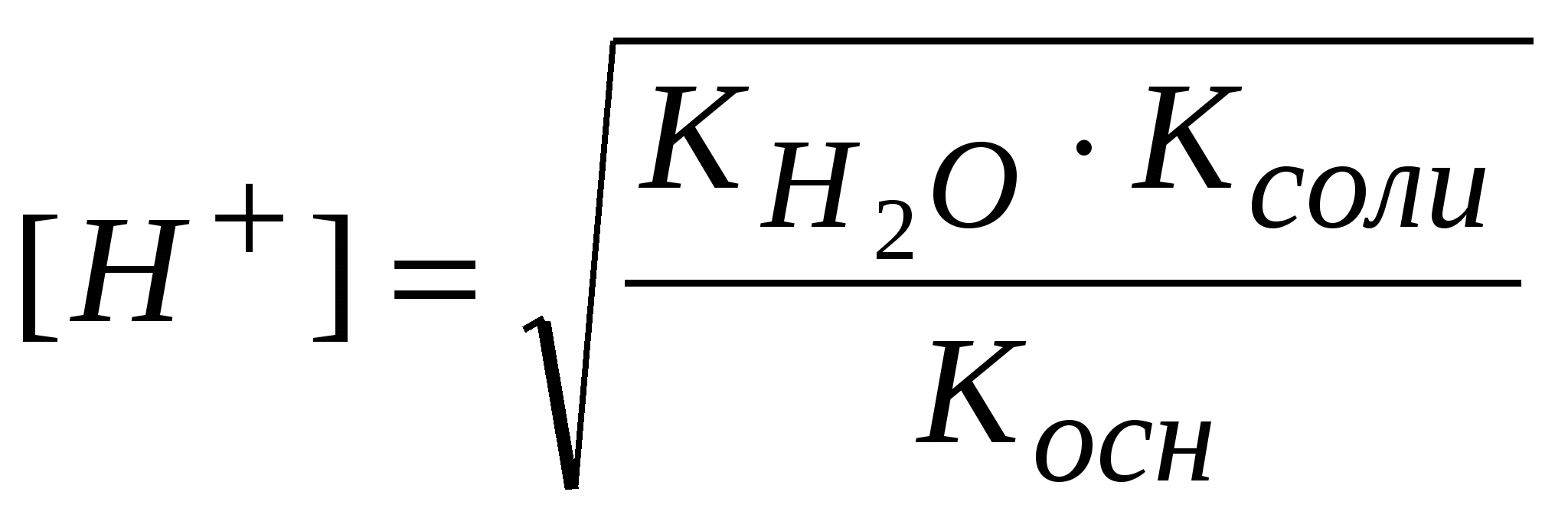 -: -: +: 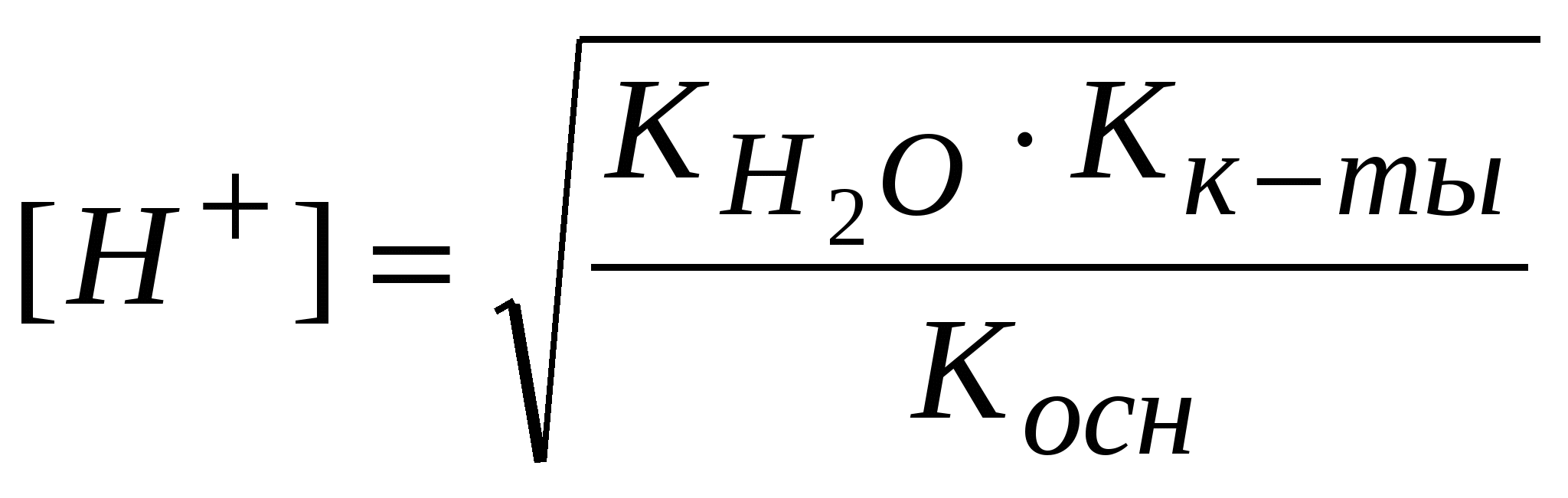 I: S: Для вычисления рН растворов солей типа NH4Cl используют формулу -: -: +: -: I: S: рН растворов солей типа CH3COONa определяют по формуле -: -: -: рН=7 +: I: S: При нахождении рН растворов солей типа NH4CN используют формулу -: -: -: +: I: S: В растворах солей KCl, Na2SO4, NaNO3 и CuCl2 гидролиз протекает -: в растворе KCl -: в растворе NaNO3 -: в растворе Na2SO4 +: в растворе CuCl2 I: S: В растворах солей: NaCN, NH4Cl, Na2CO3 и NaCl гидролиз не протекает +: в растворе NaCl -: в растворе NaCN -: в растворе NH4Cl -: в растворе Na2CO3 I: S: Ступенчатый гидролиз протекает в растворе -: CH3COONa -: NaCl -: NH4Cl +: Na2CO3 I: S: Для соотношения |
