Исаева,Хадашева Общая химия 1 курс экз. S Что изучает химическая термодинамика
 Скачать 497.5 Kb. Скачать 497.5 Kb.
|
|
-: -: -: I: S: Если электролиз в кулонометрической ячейке проводится при постоянной силе тока, то ее называют +: гальваностатической кулонометрией -: выпрямлением -: амперометрией -: иодометрией I: S: Если электролиз проводится при постоянном потенциале, то такую кулонометрию называют +: потенциостатической -: серебрением -: хромированием -: никелированием I: S: В серебряном кулонометре электрохимическая ячейка состоит из платинового катода и серебряного анода, погруженных в раствор -: NaCl -: KNO3 -: K2SO4 +: AgNO3 I: S: Медный кулонометр включает электрохимическую ячейку с платиновыми катодом и анодом, погруженных в подкисленный серной кислотой раствор -: Na2SO4 -: K2SO4 -: NaNO3 +: CuSO4 I: S: Число Фарадея, показывающее, что для выделения одного моля любого вещества необходимо затратить одно и то же количество электричества равно -: 9650 Кл -: 10000 Кл -: 85800 Кл +: 96487 Кл I: S: Кондуктометрический метод анализа основан на измерении +: удельной электропроводности анализируемого раствора -: напряжения -: силы тока -: температуры I: S: Электропроводность – это величина обратная -: напряжению -: силе тока -: напряженности +: электрическому сопротивлению I: S: Удельная теплопроводность численно равная току (вА), проходящему через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1 В на единицу длины – есть величина обратная -: силе тока -: напряжению -: потенциалу +: удельному сопротивлению I: S: Эквивалентная ионная электропроводность (подвижность) равна произведению абсолютной скорости движения иона на константу -: Михаэлиса -: равновесия +: Фарадея -: гидролиза I: S: Электропроводность раствора зависит от температуры и увеличивается на 1 – 2% при повышении температуры на -: 10 градусов по Цельсию -: 5 градусов по Цельсию -: 100 градусов по Цельсию +: 1 градус по Цельсию I: S: Согласно протолитической теории вода является -: кислотой -: основанием +: амфолитом -: оксидом I: S: По теории Бренстеда – Лоури гидросульфит-анион является -: солью -: кислотой -: основанием +: амфолитом I: S: Константа автопротолиза воды выглядит -: +: 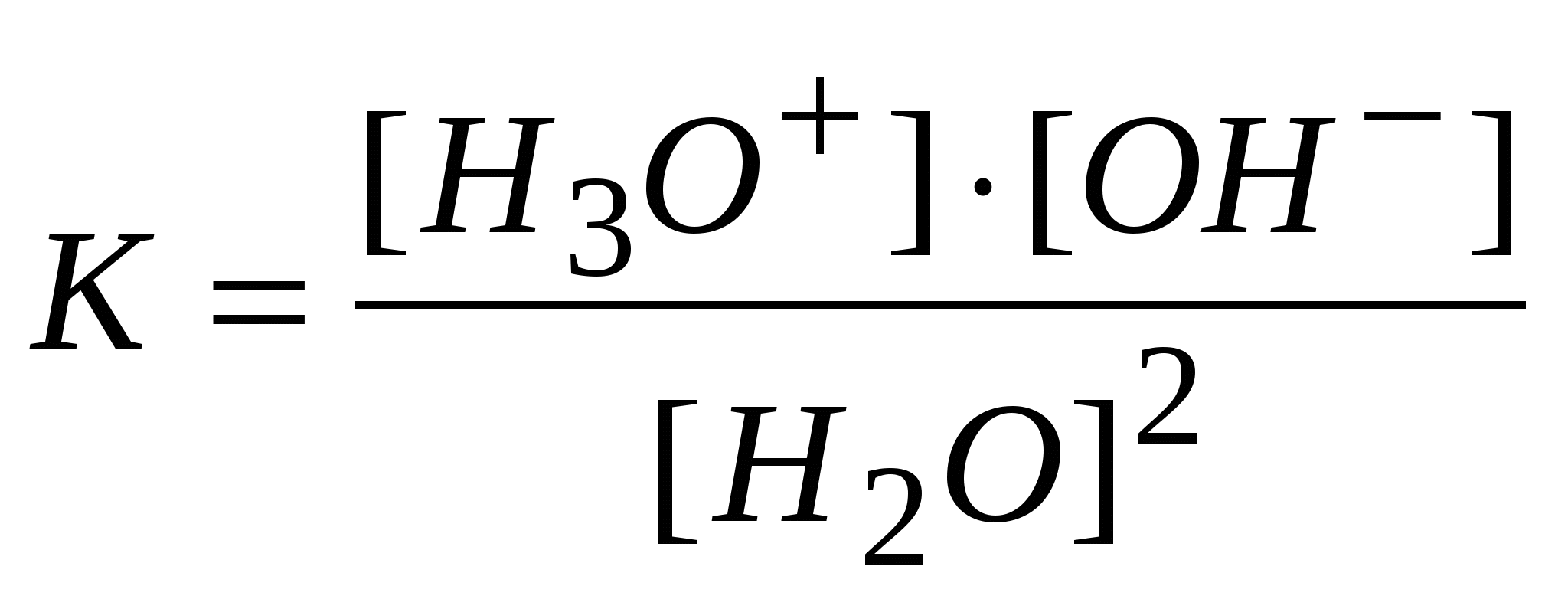 -:  -: I: S: Константа самоионизации аммиака выглядит +: 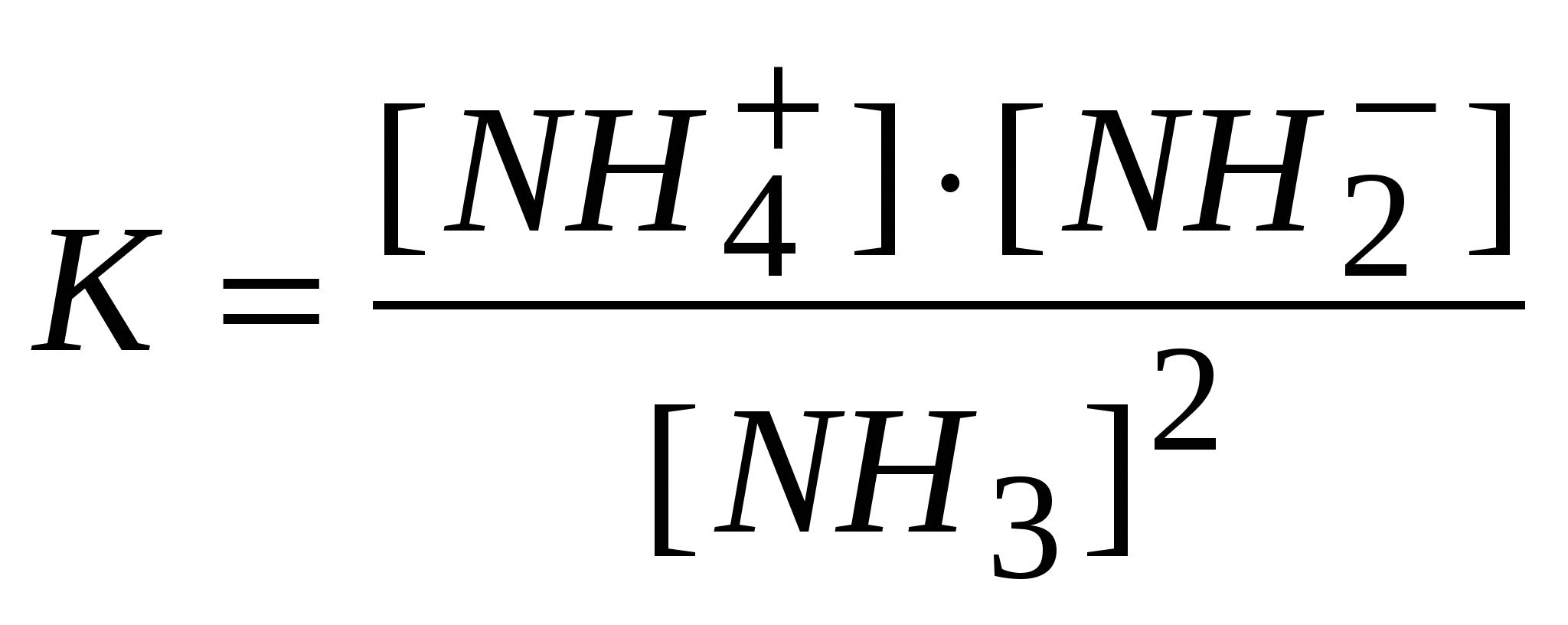 -:  -: 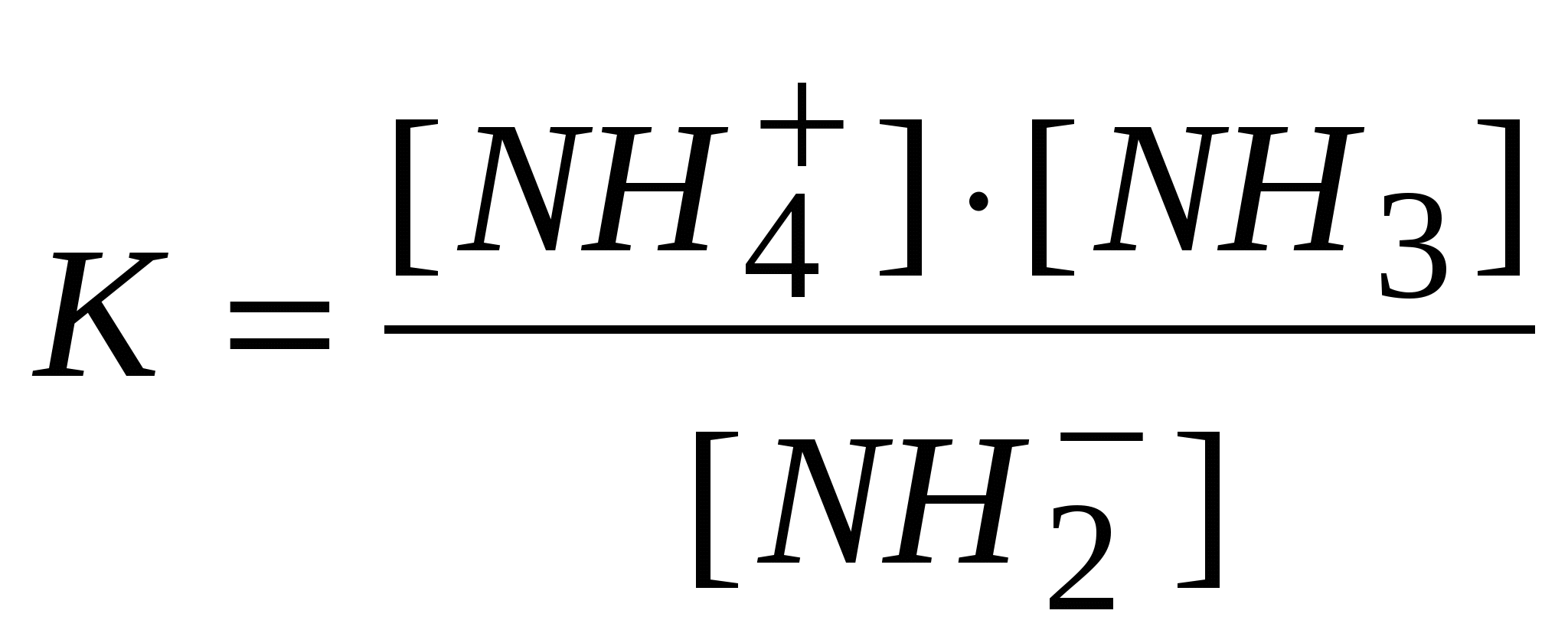 -: I: S: Амфолитом считается то, что -: принимает ион водорода -: отдает ион водорода +: может как принять, так и отдать ион водорода -: принимает Н2О I: S: Константа автопротолиза сернистой кислоты выглядит -: +: 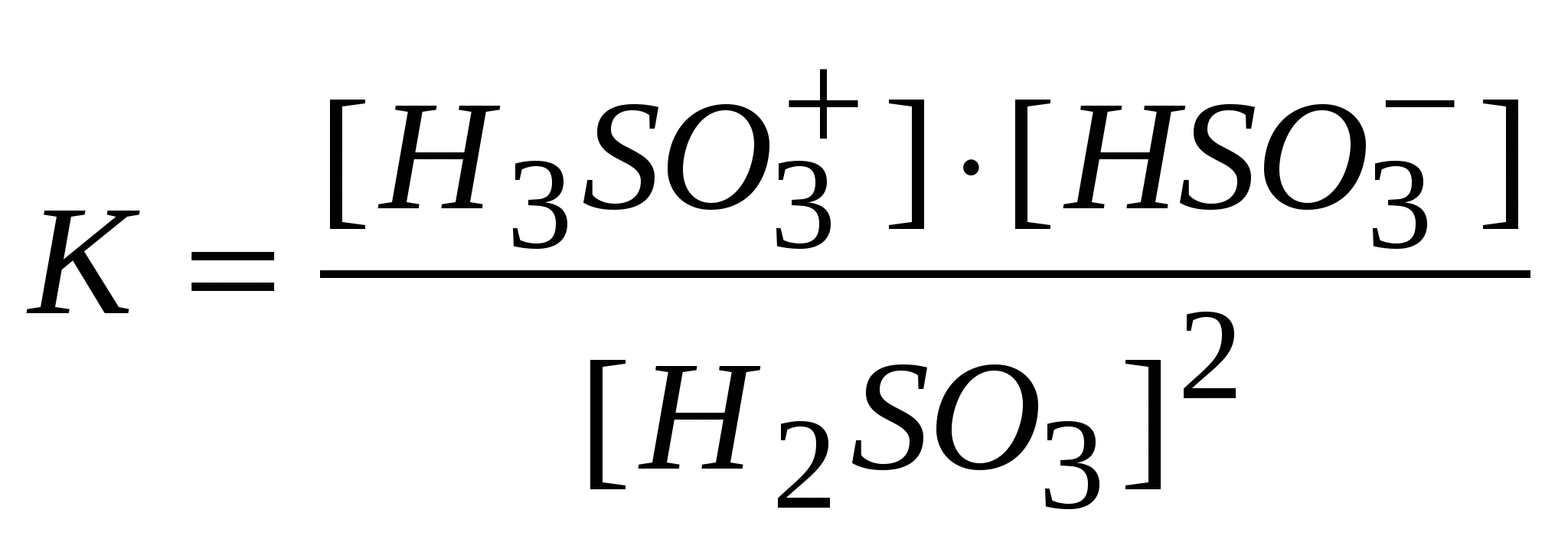 -: 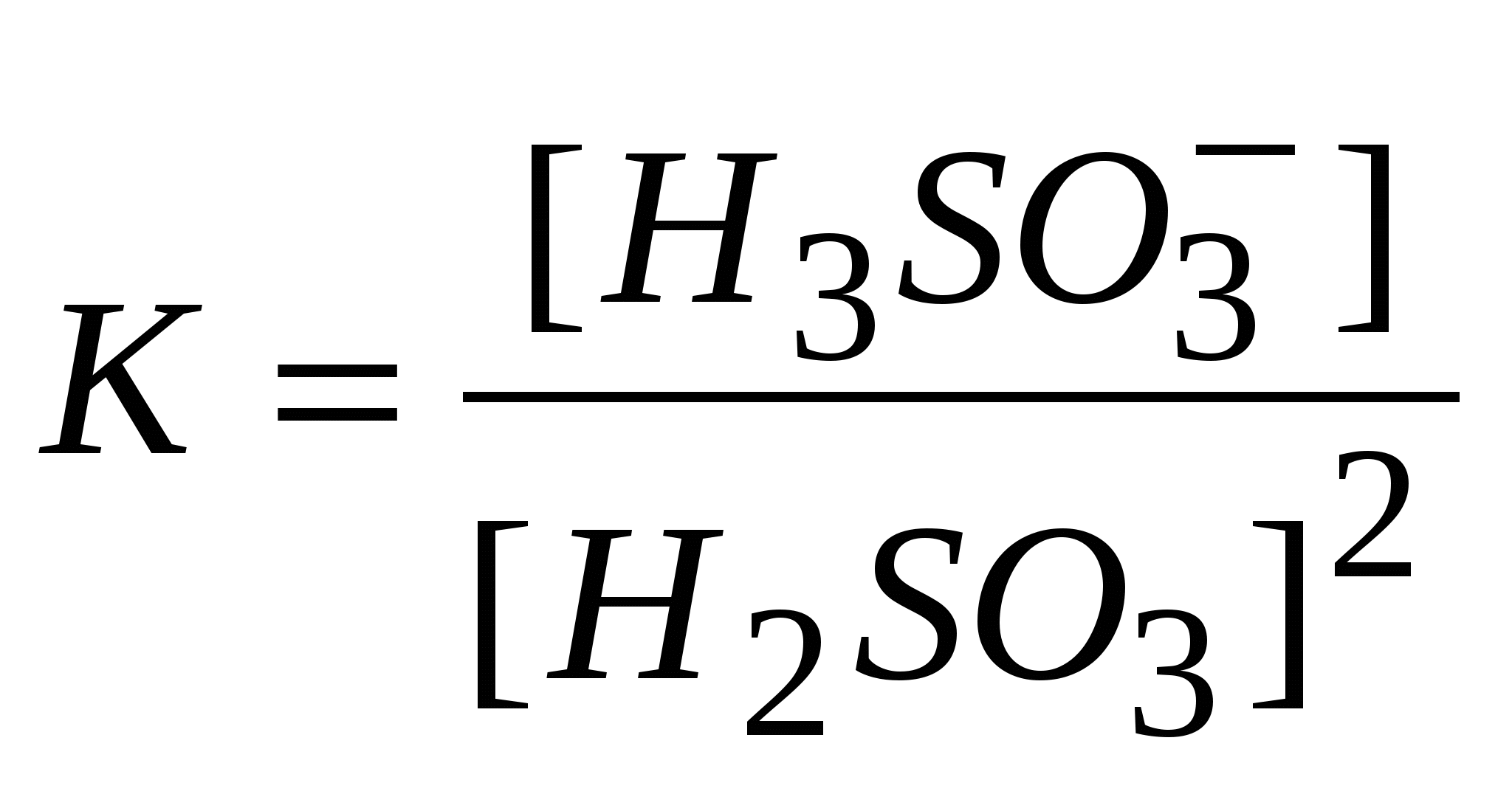 -: I: S: Введение в раствор слабого электролита «одноименного» иона приводит -: к повышению степени диссоциации +: к понижению степени диссоциации -: не влияет -: повышает давление I: S: «Солевой эффект» заключается -: в повышении силы электролита -: в изменении скорости +: в понижении силы электролита -: в разбавлении электролита I: S: Увеличение концентрации слабого электролита приводит к -: увеличению степени диссоциации +: понижению степени диссоциации -: не влияет на диссоциацию -: разбавлению I: S: Уменьшение концентрации слабого электролита способствует +: увеличению степени диссоциации -: не изменяет степень диссоциации -: понижению степени диссоциации -: уменьшению числа диссоциированных молекул I: S: Основоположником ТЭД является лауреат Нобелевской премии -: Майкл Фарадей +: Сванте Аррениус -: Джеймс Максвелл -: Энрико Ферми I: S: Процесс распада электролита на ионы называется -: ассоциацией +: диссоциацией -: сульфатацией -: гидратацией I: S: Процесс обратный диссоциации называется -: электролиз +: ассоциация -: гидратация -: ионизация I: S: Процесс образования ионов под действием диполей воды в полярных молекулах называется -: диссипация +: ионизацией -: протолизом -: сольволизом I: S: Взаимодействие молекул воды с ионами, образующимися при диссоциации, называют -: поляризацией +: гидратацией -: диссоциацией -: молизацией I: S: Если энергия гидратация больше энергии разрыва ионной связи, то растворение -: понижает температуру +: повышает температуру -: не изменяет температуру -: не влияет на температуру I: S: Если энергия гидратация меньше энергии разрыва ионной связи, то растворение +: понижает температуру -: повышает температуру -: не изменяет температуру -: не зависит от температуры I: S: Вещества растворы или расплавы которых проводят электрический ток называются -: проводниками +: электролитами -: изоляторами -: полупроводниками I: S: По степени диссоциации можно судить -: количестве электролита +: силе электролита -: о массе электролита -: о формуле электролита I: S: Степень диссоциации не может быть больше -: 0,4 +: 1 -: 0,2 -: 0,7 I: S: Если разбавить электролит, то степень диссоциации -: понизится +: повысится -: не изменится -: исчезнет I: S: Если концентрировать электролит, то степень диссоциации +: понизится -: повысится -: не изменится -: исчезнет I: S: Если в растворе преобладают ионы гидроксония то среда -: щелочная +: кислая -: нейтральная -: слабощелочная I: S: Если в растворе преобладают гидроксид- анионы то среда +: щелочная -: кислая -: нейтральная -: слабокислая I: S: Если в растворе концентрация гидроксид- анионов равна концентрации ионов гидроксония, то среда +: нейтральная -: кислая -: щелочная -: слабокислая I: S: По Аррениусу кислота это вещество, способное к диссоциации с образованием ионов -: гидроксида +: водорода -: калия -: натрия I: S: По Аррениусу основание это вещество, способное к диссоциации с образованием ионов +: гидроксида -: водорода -: хлора -: брома I: S: Аррениусовские понятия «кислота» и «основание» применимы -: к любым растворам +: к водным растворам -: к неводным растворам -: к газам I: S: Современная теория кислот и оснований, развитая Дж. Бренстедом, Т. Лоури., Н. Бьерумом в 1923г., называется -: нейтронная +: протолитическая (протонная) -: молекулярной -: атомно-молекулярной I: S: Протолитическая теория кислот и оснований охватывает растворы веществ -: только водные +: водные и неводные -: только неводные -: твердые I: S: По протолитической теории кислот и оснований, кислота это то, что -: присоединяет протоны +: отдает протоны -: отдает атомы -: отдает молекулы I: S: По протолитической теории кислот и оснований, основание это то, что +: присоединяет протоны -: отдает протоны -: отдает атомы -: отдает молекулы I: S: По Льюису кислоты – вещества, которые -: отдают электронную пару +: принимают электронную пару -: присоединяет протоны -: отдает протоны I: S: По Льюису основания – вещества, которые +: отдают электронную пару -: принимают электронную пару -: присоединяет протоны -: отдает протоны I: S: По теории Бренстеда кислоты и основания называются -: сапрофитами +: протолитами -: электролитами -: паразитами I: S: Если вещества, (ионы) способны быть и донором, и акцептором протона, их называют -: паразитами +: амфолитами -: ионитами -: катионитами I: S: По теории Бренстеда азотная кислота -: анионная кислота +: нейтральная кислота -: катионная кислота -: амфолит I: S: Гидросульфит-анион, являющийся амфолитом, согласно протонной теории -: катионная кислота +: анионная кислота -: нейтральная кислота -: электролит I: S: Катион аммония по Бренстеду это +: катионная кислота -: анионная кислота -: нейтральная кислота -: электролит I: S: Кислота и получившееся при отдаче протона основание составляют -: одинаковую пару +: сопряженную пару -: неразлучную пару -: связанную пару I: S:Взаимосвязь между степенью и константой диссоциации видна из формулы, являющейся математической формулировкой закона разведения -: Фарадея +: Оствальда -: Аррениуса -: Генри I: S:Согласно закона разбавления Оствальда диссоциация увеличивается, если электролит -: концентрировать +: разбавлять -: перемешивать -: упаривать I: S:диссоциация уменьшится если электролит +: концентрировать -: разбавлять -: разводить -: -:растворять I: S:Если разбавить электролит, то степень диссоциации -: понизится +: повысится -: не изменится -: станет равным 0 I: S:Если концентрировать электролит, то степень диссоциации +: понизится -: станет больше 1 -: не изменится -: станет равным 0 I: S:По Бренстеду к основанию следует отнести -: CuCl2 +: то,что присоединяет протон -: Ca2+ -: Н2 I: S: Формула ионного произведения воды выглядит +: [H+].[OH-] -: [H+] = [OH-] -: [H+] - [OH-] -: [H+] +[OH] I: S:Реакция среды нейтральная, если [H+ ] равна -: 10-9 +: 10-7 -: 10-5 -: 10-12 I: S: Ионное произведение воды К н2о =[H+] .[OH-] при 250C равно -: 10-9 +: 10-14 -: 2 / 10-5 -: 10-12 I: S: Реакция среды нейтральная, если [OH- ] равна -: 10-3 +: 10-7 -: 10-4 -: 10-1 I: S: Если [OH-] > 10-7 моль/ л +: среда щелочная -: среда кислая -: среда нейтральная -: среда красная I: S: В предложенном С.П. Зеренсеном водородным показателем рН, для характеристики реакции среды раствора, значок р является +: оператором отрицательного десятичного логарифмирования -: химическим знаком фосфора -: показателем давления -: показателем растворимости I: S: Реакция среды будет нейтральной, если [OH-] равна -: 10-13 +: 10-7 -: 10-40 -: 10-14 I: S: Ионное произведение воды К н2о =[H+] .[OH-] при 250C равна -: 10-9 +: 10-14 -: 2 / 10-5 -: 10 I: S: Гидроксильный показатель рОН показывает -: число гидроксильных групп -: наличие в растворе гидроксид-ионов -: ионную силу раствора +: реакцию среды раствора I: S: В водородном показателе рН, значок р является -: молярной концентрацией катионов водорода -: -lg [H+] -: -lg [OH -] +: оператором логарифмирования I: S: Гидролиз катионом проводится при взаимодействии с водой -: NH4OH +: CuCl2 -: Cu(OH)2 -: NaHCO3 I: S: Гидролизу анионом подвергается +: CH3COONa -: CuCl2 -: AlCl3 -: Na2SO4 I: S: Гидролиз анионом протекает в системе … + Н2О -: NaCl +: Na 2CO 3 -: H2SO4 -: Хлорид аммония I: S: Гидролизу катионом и анионом ,одновременно, подвергается +: (NH4)2S -: Na2CO3 -: CuSO4 -: Na 2S I: S: Гидролизу катионом и анионом, одновременно, подвергается -: HCl +: Pb(СH3COO)2 -: CuCl2 -: Na2SO4 I: S: Гидролиз катионом и анионом, одновременно, проводится в системе вода +… -: NH4Cl -: CH3COONa -: Na2CO3 +: Al2S3 I: S: Если рОН < 7, то среда будет -: электронейтральная -: нейтральная -: положительная +: щелочная I: S: Реакция среды нейтральная, если [H+ ] равна -: 10-9 +: 10-7 -: 10-5 -: 10-12 I: S: Ионное произведение воды равно -: 10-9 +: 10-14 -: 2 / 10-5 -: 10-12 I: S: Реакция среды щелочная, если концентрация ионов водорода равна (моль/л) -: 10 -2 -: 10-5 -: 10 -7 +: 10 -11 I: S: Гидролиз анионом протекает при взаимодействии с водой +: CH3COONa -: CuCl2 -: AlCl3 -: Na2SO4 I: S:если концентрация [OH-] ,больше 10-7,то -: среда кислая -: среда нейтральная -: среда красная +: среда щелочная I: S: Реакция среды будет нейтральной, если [H+] равна -: 10-13 +: 10-7 -: 10-40 -: 10 I: S: Гидроксильный показатель определяет -: мольная доля гидроксид-ионов -: активность ионов водорода +: реакцию среды раствора -: эквивалент гидроксид-ионо I: S: Гидролиз катионом протекает при взаимодействии с водой -: гидроксида аммония -: Сa(OH)2 -: СaCO3 +: AlCl3 I: S: Гидролиз анионом проводит -: аммония гидроксид -: Al(OH) 3 -: СН3СОCН 3 +: Na2SO3 I: S: Гидролиз катионом и анионом, одновременно, проводит в системе вода+ … -: СH3COOH -: Cu(OH)2 +: NH4NO2 -: сульфат натрия I: S: Согласно протолитической теории Бренстеда кислотой считается то -: что переносит кислород -: что переносит СО2 -: что отдает хлорид-ионы +: что отдает протоны I: S: если рОН меньше 7,то -: среда кислая -: среда нейтральная +: среда щелочная -: среда красная I: S: По Бренстеду к основанию следует отнести -: :молекулы брома -: молекулы кислорода -: хлорид натрия +: то,что присоединяет Н+ I: S:если концентрация [OH-] = 10-14 то -: среда кислая +: среда нейтральная -: среда красная -: среда щелочная |
