методичка. Методическое пособие по СД для студентов. Сахарный диабет является важнейшей медикосоциальной пробле
 Скачать 216.68 Kb. Скачать 216.68 Kb.
|
|
Инсулинотерапия Учитывая факт абсолютного отсутствия собственного инсулина у больных сахарным диабетом 1 типа, необходимо вводить инсулин из вне (инъекционно). В связи с этим основные требования к инсулинотерапии при СД 1 типа сводятся к максимальной имитации эндогенной секреции инсулина у здорового человека. Для достижения этого используются человеческие генноинженерные препараты инсулина: комбинация пролонгированного инсулина (ПИ) в 1 или 2–х инъекциях и короткого инсулина (КИ) не менее 3–х инъекций. Рекомендуется подобрать «базовую» дозу инсулина и проводить в дальнейшем ежедневный контроль дозы инсулина (по уровню гликемии) перед основными приемами пищи. Препараты инсулина по длительности действия можно разделить на три группы – инсулины короткого действия, пролонгированные препараты инсулина и комбинированные препараты. Только инсулины короткого действия при назначении их больным СД 1 типа имитируют эндогенную быструю секрецию инсулина в ответ на прием пищи. Только эти инсулиновые препараты могут обеспечить утилизацию принятых с пищей углеводов. Пролонгированные инсулины имитируют базальную секрецию инсулина и обеспечивают поддержание стабильной гликемии ночью и в периоды между приемами пищи. Комбинированные препараты состоят из комбинации инсулина короткого и пролонгированного действия и, соответственно, частично обладают их свойствами. При этом важно отметить, что действие каждой части соответствующего инсулина в комбинации не идентично таковому в отдельности. В лечении больных СД 1 типа они практически не используются. Фармакокинетика препаратов инсулина представлена на рисунке. Цифры в квадратиках обозначают комбинированные инсулины. Например: 40/60 - это в 1 мл инсулина содержится 40% КИ и 60% ПИ. Доза подбирается по короткому инсулину. Введя 10 ед инсулина, пациент получит 4 ед КИ и 6 ед ПИ. Если пациенту нужно ввести 8 ед КИ, то общая доза будет 20 ед (ПИ – 12 ед) 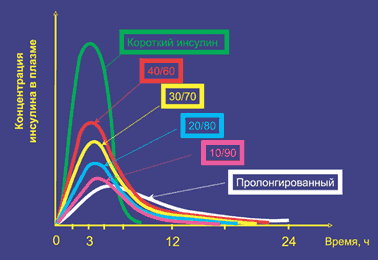 Рис. 2. Фармакокинетика препаратов инсулина Проблемы в заместительной инсулинотерапии при абсолютном дефиците инсулина сохраняются. К нерешенным проблемам относятся кардинально отличный от физиологического путь введения экзогенного инсулина. С этим связано позднее поступление и дефицит инсулина в печени, периферическая гиперинсулинемия, дефицит гликогена в печени, активация липолиза, глюконеогенеза, жировой гепатоз и высокий риск развития гипогликемий. Имеющиеся препараты инсулина обладают несоответствующим физиологическому ритму временем начала, пика и окончания действия. Короткие инсулины начинают действовать позже и действуют дольше необходимого времени, вводятся задолго до приема пищи и требуют «перекуса» между основными приемами пищи. 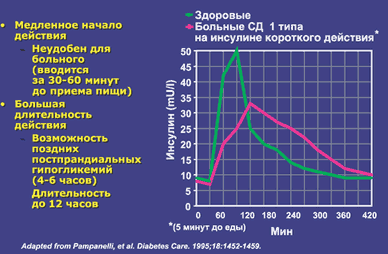 "Слабые" места человеческих инсулинов короткого действия С 1996 года в клинической практике используются аналоги человеческого инсулина, отличающиеся по химической структуре от естественного инсулина. Например: препарат с ультракороткой активностью – инсулин аспарт, у которого в 28 положении В–цепи аминокислота пролин была заменена отрицательно заряженной аспарагиновой кислотой. Длительность действия у препаратов ультракороткого действия или аналогов инсулина обусловлена ускорением их всасывания из места инъекции. Естественный человеческий инсулин, в растворе и в тех концентрациях и количествах, которые вводятся подкожно, образует ассоциации из шести молекул – гексамеры. Из–за этого введенный инсулин медленно всасывается. Большая часть молекул аналогов инсулина, введенного больному подкожно, находится в виде мономеров, чем и объясняется быстрое всасывание этих инсулиновых препаратов из места инъекции. При использовании этих препаратов инсулина облегчается возможность синхронизации пика действия парентерально введенного инсулина с пиком постпрандиальной гликемии. Но одно лишь назначение даже самых современных препаратов инсулина – аналогов инсулина не решает проблему достижения компенсации СД. Требования по самоконтролю гликемии и коррекции дозы вводимого инсулина остаются важнейшей составной частью лечения больного с СД 1 типа. Создание у больного мотивации на проведение самоконтроля – важнейшая задача лечащего врача. Необходимо ежедневно контролировать гликемию перед всеми основными приемами пищи, перед сном и не реже одного раза в неделю – в 03 часа утра. Обязателен подсчет планируемого к приему с пищей количества ХЕ. Обязательна коррекция количества вводимого перед едой инсулина в соответствии с полученными при самоконтроле цифрами гликемии. Только выполнение этих требований обеспечит эффективность терапии. Сначала проводится расчет базовой дозы инсулина. При планировании и расчете дозы инсулина, помимо диеты, физических нагрузок, необходимо учитывать физиологические, психологические и гормональные факторы, которые оказывают существенное влияние на потребность в инсулине. У растущего ребенка она может колебаться от 0,5 и достигать 2 ед/кг. Во время беременности потребность в инсулине меняется с течением беременности и в первом триместре составляет в среднем – 0,7 ед/кг/сут., во втором и третьем – 0,9–1,2 ед/кг/сут., к концу третьего триместра, в связи со стабилизацией и снижением активности фетоплацентарного комплекса, потребность в инсулине снижается и составляет в среднем 0,7–0,8 ед/кг/сут. В послеродовом периоде – 0,6 ед/кг/сут. Ориентировочно в среднем суточная доза инсулина рассчитывается в 1 год заболевания – 0,5 ед./кг/сут., в последующие годы – 0,7 ед./кг/сут., при активной физической работе – 0,5 ед/кг/сут., при сидячей работе – 0,7 ед/кг/сут., при стрессе – 1,0 ед/кг/сут., в пубертатном периоде – 1,0–2,0 ед/кг/сут., при кетоацидозе, приеме глюкокортикоидов – до 1,5–2 ед/кг/сут. Если взять суточную дозу инсулина за 100%, доля пролонгированного инсулина для обеспечения имитации базальной секреции инсулина составит 50%. Он назначается в два приема, соответственно по 25% от суточной дозы. Трудности обеспечения стабильной гликемии в ночное время частично связаны и с тем, что имеющиеся пролонгированные препараты инсулина не могут обеспечить в полной мере имитацию этих физиологических колебаний секреции инсулина. И даже, напротив, в момент физиологического ночного снижения потребности в инсулине сохраняется стабильной от 22.00 до полуночи, с полуночи до 4 часов утра уменьшается на 50% по сравнению с исходной базальной дозой инсулина, а с 4 до 10 часов утра увеличивается на 50% Базальная потребность в инсулине у больного, вводящего пролонгированный инсулин перед сном, увеличен риск ночной гипогликемии за счет некоторого роста активности пролонгированного инсулина. При постоянном мониторировании уровня глюкозы крови частота недиагностированных ночных гипогликемий составляет у больных с субкомпенсированным СД более 30%. В решении этой проблемы помогут новые, так называемые беспиковые пролонгированные препараты – гларгин и детимир, деглудек, туджео. Оставшуюся половину суточной дозы составит короткий инсулин, который распределяется на основные приемы пищи – завтрак, обед и ужин в зависимости от рассчитанного к приему количества ХЕ и индивидуальной чувствительности к инсулину в разное время суток. Инсулин можно вводить п/к, внутримышечно, внутривенно МЕТОДЫ КОНТРОЛЯ УРОВНЯ ГЛЮКОЗЫ Для самоконтроля уровня глюкозы крови рекомендуется применять глюкометры, предназначенные для индивидуального использования, в том числе с настройкой индивидуального целевого диапазона гликемии, а также передающие данные об уровне глюкозы на смартфон, откуда они могут быть использованы для удаленного мониторинга. Индивидуальные глюкометры должны соответствовать ГОСТ Р ИСО 15197-2015 по аналитической и клинической точности. Обучение и самоконтроль Самоконтроль гликемии в течение суток можно назвать составной частью лечения. Именно неудовлетворительный самоконтроль, отсутствие средств его осуществления – глюкометров и тест–полосок способствует развитию хронической декомпенсации СД 1 типа. Часто это связано с непониманием больными важности осуществления регулярного измерения гликемии и коррекции инсулинотерапии. Пациенты должны знать о таком важнейшем показателе, как гликированный гемоглобин (НвА1с) и также о необходимости контролировать данный показатель 1 раз в 3 месяца. Контроль этого показателя свидетельствует о состоянии углеводного обмена. Большой части госпитализаций, в состоянии острой декомпенсации СД, можно было бы избежать за счет выполнения требований по проведению самоконтроля гликемии в домашних условиях, так как это позволяет вовремя выявить рост потребности в инсулине и изменить лечение при присоединении каких–либо интеркуррентных заболеваний и при стрессах. Обучение пациентов с сахарным диабетом проводится в школах «Сахарного диабета». Школы организованы на базах эндокринологических отделений стационаров и на базах амбулаторных учреждений. Школы проводятся отдельно для пациентов СД тип 1 и СД тип 2. На школах диабета рассматриваются вопросы правильного физиологического питания. Для пациентов СД тип 1, объясняется понятие ХЕ. Пациенты учатся рассчитывать дозу инсулина в соответствии с количеством ХЕ в продуктах питания. Для пациентов СД тип 2 врач объясняет понятие суточного каллоража, пищевого рациона. Пациенты должны уметь сами составить для себя рацион питания. На школах, также рассматриваются вопросы терапии, инсулинотерапии или терапии таблетированными препаратами. Сахарный диабет тип 2 Сахарный диабет тип 2 (СД 2) составляет примерно 90% случаев всего диабета. Это заболевание имеет наследственную природу и несколько, изученных на сегодняшний день, патогенетических механизмов. Учитывая назначение данного пособия, мы не будем подробно останавливаться на всех известных сегодня механизмах, но подробно остановимся на основных, которые присутствуют у большинства пациентов с СД тип 2. Основной причиной развития СД тип 2 является неправильное питание и малоподвижный образ жизни. Два эти фактора приводят к развитию ожирения. Люди, имеющие генетическую предрасположенность, ведущие неправильный образ жизни входят в группу риска СД тип 2. Гомеостаз глюкозы, в организме человека, поддерживается работой трех уровней – это β-клетки островков Лангерганса, в которых может нарушаться секреция инсулина. Второй уровень – это печень, которая активно утилизирует глюкозу из крови, используя ее, как источник энергии, и кроме того синтезируя гликоген. И третий уровень – это периферические ткани, которым нужно постоянное поступление глюкозы, как источника энергии. Нарушение гомеостаза глюкозы, у больных СД тип 2, обусловлено нарушением функции какого-либо из этих уровней или сочетанием нарушений. У большинства пациентов с СД тип 2 имеет место инсулинорезистентность, нарушение функции β-клеток, повышение продукции глюкозы клетками печени на фоне снижения чувствительности к инсулину. Инсулинорезистентность (ИР) – это снижение чувствительности тканей (печень, мышца, жировая ткань) к эндогенному или к экзогенному инсулину и снижение биологических эффектов инсулина. При ИР β-клетки избыточно продуцируют инсулин, что способствует развитию гиперинсулинемии. Инсулин обладает выраженными анаболическими свойствами, что приводит к развитию гипертрофии миокарда и гипертрофии сосудистой стенки, эндотелиальной дисфункции, артериальной гипертензии, гиперлипидемии и другим метаболическим изменениям. ИР тесно связана с повышением целого ряда факторов сердечно-сосудистого риска таких как: артериальная гипертензия висцеральное ожирение дислипидемия гиперурикемия гиперкоагуляция ускорение и усиление атерогенеза ИР отводится центральное место в развитии метаболических нарушений, связанных с ожирением и СД тип 2. Чувствительность тканей к инсулину, у здорового человека, определяется количеством жира, распределением жировой ткани в организме человека, уровнем физической активности. Механизм ИР не до конца понятен. Выделяют четыре основных причины развития ИР. Это избыточное питание, низкая физическая активность, воспаление и стресс. Инсулин утилизирует глюкозу в мышечную и жировую ткани, активизируя глюкозный транспартер ГЛЮТ-4, тогда как в печени этот транспортер глюкозы отсутствует и поступление глюкозы в печень осуществляется через повышение активности ферментов гликолитического пути окисления глюкозы и ферментов гликогеногенеза. Печень не приспособлена к накоплению жиров (в том числе синтезированных из глюкозы), и транспортирует их в другие ткани с помощью липопротеидных частиц. Избыточное поступление липидов (жирных кислот) в печень, нарушает баланс, приводит к системному воспалению и ИР. Накопление липидов в печени (жировая эктопия, неалкогольная жировая болезнь печени, НЖБП), а Именно внутриклеточные липиды нарушают передачу сигнала от рецептора инсулина и снижают инсулин-зависимый захват глюкозы в клетках печени, вызывая ИР. Печень становится ИР раньше, чем другие инсулинзависимые ткани. Накопление липидов в печени, способствует активации изоформы протеинкиназы С (РКС) «ненормальной» РКС, которая нарушает проведение сигнала от инсулинового рецептора. ИР миоцитов происходит по аналогичной схеме. Роль РКС в жировой ткани не доказана. Жировая ткань приспособлена к накоплению липидов, возможно ИР объясняется высоким уровнем гормона (инсулина) в крови, а по закону обратной связи это приводит к снижению синтеза рецепторов на клеточной мембране адипоцитов. Большую роль в развитие ИР играет уровень цитокинов, в частности TNFa. По результатам исследований, уровень TNFa прямо коррелирует со степенью ИР и снижался при снижении массы тела. Вторым важным патогенетическим компонентом СД тип 2 является дисфункция β-клеток. Далеко не все пациенты с ожирением и ИР заболевают СД тип 2. Это связывают с функциональной несостоятельностью β-клеток данного индивидуума. Неспособность клеток ответить на прогрессирующую ИР связывают со многими причинами. Это может быть врожденная β-клеточная недостаточность, длительно существующая липотоксичность и глюкозотоксичность, могут влиять на функцию β-клеток. Рассматривают также роль амилина, белка, участвующего в синтезе инсулина в β-клетке. Накопление этого белка может приводить к снижению синтеза инсулина. И другие причины. Секреторная дисфункция β-клеток заключается в замедлении «раннего» секреторного выброса инсулина в ответ на увеличение уровня глюкозы в крови. При этом 1-я (быстрая) фаза секреции, которая заключается в выбросе инсулина из везикул фактически отсутствует; 2-я (медленная) фаза секреции осуществляется в ответ на стабилизирующуюся гипергликемию постоянно, в тоническом режиме, и, несмотря на избыточную секрецию инсулина, уровень гликемии на фоне инсулинорезистентности не нормализуется. Таким образом, происходит нарушение баланса чувствительности к инсулину и инсулиновой секреции. Это главный постулат патогенеза СД тип 2. Мы рассмотрели самые часто встречающиеся механизмы сахарного диабета 2 типа. Но необходимо сказать также о возможном развитие СД тип 2 в результате инкретиновой дисфункции. Инкретины — класс гормонов, которые синтезируются и секретируются клетками диффузной эндокринной системы, расположенными в желудочно-кишечном тракте. Гормоны – инкретины, непосредственно влияющие на функцию β-клеток – это глюкозозависимый инсулинотропный полипептид (ГИП) и энтероглюкагон (синоним глюкагоноподобный пептид-1; ГПП-1). Оба инкретина относятся к семейству глюкагоновых белков, имеющих близкую аминокислотную структуру. ГИП секретируется К-клетками, расположенными преимущественно в двенадцатиперстной и проксимальной части тощей кишки, в ответ на прием углеводов и жиров (пищи). Глюкагон является основным продуктом транскрипции и процессинга в эндокринной части поджелудочной железы. ГПП-1, ГПП-2 и глицентин (кишечная форма глюкагона) вырабатываются L-клетками эндокринной части преимущественно дистального отдела тонкой кишки. ГПП-1 также секретируется α-клетками поджелудочной железы, нейронами ряда отделов головного мозга. ГПП-1 секретируется L-клетками в виде двух биологически активных изоформ: ГПП-1 (7-37) и доминирующей формы ГПП-1 (6-37). Оба пептида обладают той же степенью выраженности биологической активности с одинаковым периодом полужизни и идентичной гомологичностью в отношении рецепторов. Несмотря на дистальное расположение L-клеток в желудочно-кишечном тракте, высвобождение ГПП-1 в циркулирующий кровоток осуществляется в течение нескольких минут от момента приема пищи. Концентрация инкретинов натощак в плазме крови крайне низка, в то время как после еды их концентрация значительно повышается. Большая часть инкретинов инактивируется еще до достижения кровотока портальной системы, что определяет достаточно короткий период полужизни биологически активных форм. Период полужизни интактной формы ГПП-1 составляет 1—2 минуты. В ответ на прием пищи (через нервную регуляцию, непосредственное влияние) повышается секреция инкретинов, которые оказывают следующие влияние: потенцируют глюкозозависимую секрецию инсулина Усиливают биосинтез инсулина Повышают экспрессию гена инсулина Повышают экспрессию генов, важных для функции β-клеток (глюкокиназы, GLUT-2) Оказывают митотическое действие на β-клетки Подавляют апоптоз β-клеток Подавляют секрецию глюкагона Контролируют скорость опорожнения желудка Замедляют панкреатическую и желудочную секрецию Анорексигенное действие До 70 % секреции инсулина после приема пищи у здоровых людей обусловлено именно эффектом инкретинов. У больных сахарным диабетом 2-го типа этот эффект значительно снижен. При СД тип 2 нарушенный «эффект инкретинов» является одним из патофизиологических механизмов, приводящих к неадекватной секреции инсулина. Клиническая картина 2 типа диабета не настолько ярка, как при 1 типе. Часто болезнь обнаруживается случайно, при обследовании по другому поводу. Сахарный диабет тип 2 чаще развивается в зрелом возрасте, но современные эпидемиологические данные свидетельствуют, что СД тип 2 все чаще диагностируется в молодом и даже в детском возрасте. При СД тип 2, чаще чем при СД тип 1, имеет место наследственная предрасположенность, среди родственников больных очень часто есть больные с СД тип 2. Неправильный образ жизни, ожирение частые признаки СД тип 2. Клиническая картина стертая. Может беспокоить сухость во рту, полиурия – клинические проявления гипергликемии, но они, как правило, не выражены. Клиническая картина в стертой форме может протекать многие годы (если пациент не проводит регулярное исследование крови) и пациент узнает о своем заболевании, когда клинически проявляются осложнения сахарного диабета. У многих больных удается установить наличие в течение длительного времени субклинических проявлений диабета: умеренно выраженной полиурии, чаще проявляющихся в ночное время, повышенной утомляемости, снижения работоспособности, повышения или необъяснимого уменьшения (у лиц с избыточной массой тела) массы тела при сохраненном аппетите, склонности к различным простудным и кожным заболеваниям, нарушения зрения. Диагностические критерии сахарного диабета общие для всех типов и классов диабета были описаны ранее. Это уровень гликемии и уровень гликированного гемоглобина (НвА1с). |
