Селезенка важный кроветворный и защитный орган, участвует в организации защитных реакций от антигенов, проникших в кровоток здесь разрушаются старые и поврежденные эритроциты и тромбоциты,
 Скачать 126 Kb. Скачать 126 Kb.
|
|
Воспаление и регенерация. При действии повреждающих агентов в тканях развивается сложная сосудисто-тканевая защитно-приспособительная реакция - воспаление. При воспалении наблюдаются общие и местные изменения. Местные проявления реакции организма в очаге воспаления включают несколько взаимосвязанных фаз: 1) повреждение тканей; 2) высвобождение медиаторов воспаления; 3) сосудистая реакция с экссудацией, включающая изменение кровотока в МЦР, повышение проницаемости сосудов; 4) резорбция продуктов распада тканей; 5) пролиферация клеток с образованием «грануляционной ткани» и последующей регенерацией тканей. Завершается воспаление образованием зрелой волокнистой СТ. Выделяют три фазы: лейкоцитарную, макро-фагическую и фибробластическую +Лейкоцитарная фаза воспаления характеризуется передвижением нейтрофильных гранулоцитов в очаг распада ткани на месте ее повреждения. Пусковым механизмом является выброс медиаторов и цитокинов (гистамина, серотонина, лизосомных гидролаз). Источники выделения медиаторов: тучные клетки, лейкоциты, кровяные пластинки, макрофаги и лимфоциты. Развивается комплекс сосудистых изменений: повышение проницаемости МЦР, экссудацию жидких составных частей плазмы, эмиграцию клеток крови. Через 6 ч от начала воспаления образуется лейкоцитарный инфильтрат. Нейтрофильные гранулоциты проявляют высокую фагоцитарную активность, поглощая микроорганизмы. Часть нейтрофилов распадаются, выделяя большое кол-во лизосомных гидролаз (очищению очага воспаления от поврежденных тканей). +Макрофагическая фаза воспаления протекает при явлениях активизации макрофагов гематогенных и гистиогенных (оседлых макрофагов - гистиоцитов). Макрофаги энергично фагоцитируют продукты тканевого распада, вырабатывают стимуляторы восстановительных процессов в очаге воспаления. +Фибробластическая фаза- завершающая, характеризуется пролиферацией клеток фибробластического ряда и их передвижением к воспалительному очагу. Поскольку к этому времени заканчивается очищение места повреждения от продуктов тканевого распада, фибробласты заполняют бывший дефект ткани. Они интенсивно вырабатывают межклеточное вещество. Вначале образуются тонкие аргирофильные, а позднее КВ (отграничивают воспалительный очаг от неповрежденной ткани). Разрастание фибробластов приводит к замещению воспалительного очага на СТ. При значительном дефекте формируется рубец. При наличии инородного тела вокруг него образуется СТ-капсула, отчетливо выраженная на 5-7-е сут от начала воспаления. ИММУННАЯ СИСТЕМА И КЛЕТОЧНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННЫХ РЕАКЦИЯХ Иммунная система объединяет органы и ткани, в которых происходит образование и взаимодействие иммуноцитов, выполняющих функцию распознавания генетически чужеродных субстанций (антигенов) и осуществляющих специфическую реакцию. Обеспечивает поддержание генетической целостности и постоянства внутренней среды организма, выполняя функцию распознавания «своего» и «чужого». В основе этого лежат неспецифические (врожденные) и специфические (приобретенные) реакции с вовлечением большого разнообразия клеточных дифферонов тканей внутренней среды. К неспецифической защите относят барьерные свойства кожи и слизистых оболочек, бактерицидность и уровень кислотности секретов ряда клеток, а также фагоцитоз чужеродных агентов. Ведущими клетками врожденного иммунитета явля- ются макрофаги, нейтрофилы, базофилы и тучные клетки (см. выше, воспаление и регенерация). В специфической защите против определенного возбудителя главными клетками являются специализированные лимфоциты, плазматические клетки, антигенпред-ставляющие макрофаги. Постоянно перемещающиеся лимфоциты осуществляют «иммунный надзор». Они способны «узнавать» чужие макромолекулы бактерий и клеток различных тканей многоклеточных организмов и осуществлять специфическую защитную реакцию. Для понимания роли отдельных клеток в иммунных реакциях необходимо прежде всего дать определение некоторым понятиям иммунитета. Иммунитет (от лат. immunitus - освобождение, избавление от чего-либо) - это защита организма от всего генетически чужеродного: микробов, вирусов, чужих клеток или генетически измененных собственных клеток. Антигены - это сложные органические вещества, способные при поступлении в организм человека и животных вызывать специфический иммунный ответ. Свойствами антигенов обладают бактерии, вирусы, паразиты, чужеродные клетки и ткани, мутационно изменившиеся собственные клетки тела (например, раковые), продукты жизнедеятельности чужеродных клеток - белки, полисахариды, полипептиды, а также искусственные высокополимерные соединения. Антитела - это сложные белки, синтезируемые В-лимфоцитами и плазмоцитами, способные специфически соединяться с соответствующими антигенами (например, с бактериальными) и обезвреживать их. Обнаружение антител в глобулиновой фракции белков крови обусловило их название - иммуноглобулины (Ig). Выявлено несколько классов иммуноглобулинов - IgG, IgM, IgA, IgD, IgE. Комплемент - группа белков, содержащихся в свежей сыворотке крови человека и животных, активизирующихся в тех случаях, когда антитело связывается с антигеном. Этот процесс приводит к лизису определенных типов клеток (лизис, опосредованный комплементом) или к образованию биологически активных веществ из белков комплемента, которые, прикрепляясь к бактериям, облегчают их фагоцитоз нейтрофилами. Эти вещества называют опсонинами. Молекулы гистосовместимости. Практически все тканевые клетки организма экспрессируют молекулы гистосовместимости, которые доступны для опознавания клетками иммунной системы. Это важный механизм для того, чтобы специализированные клетки иммунной системы (Т-лимфоциты) могли распознать «свои» и «чужие» клетки. В связи с тем, что молекула в составе клетки одного организма, будучи внесенная в другой, вызывает реакцию отторжения, она получила название антиген гистосовместимости, или главная молекула гистосовместимости (ГКГ). Последняя бывает двух классов - I и II. Молекула гистосовместимости I класса является гликопротеином. Она состоит из трех частей: а) трансмембранного белка (тяжелой цепи), который пронизывает плазмолемму клетки и имеет внутриклеточную, цитоплаз-матическую и внеклеточную части (домены); б) белка малой молекуляр- 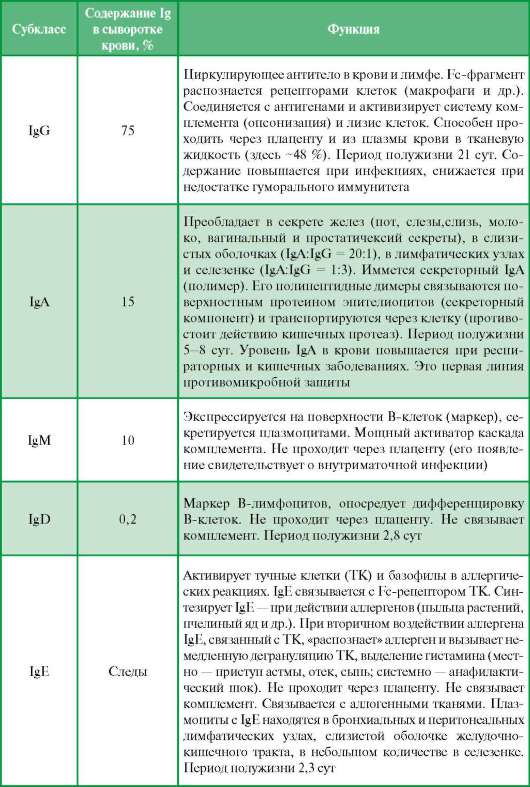 ной массы (эпитопа), расположенного между петлями внеклеточной части трансмембранного белка; в) периферического белка. Гены, кодирующие молекулярную организацию трансмембранного белка, расположены на 6-й хромосоме в области, которая получила название главный комплекс гистосов-местимости (англ. МНС - major histocompatibility complex). Основная биологическая роль молекулы гистосовместимости I класса - дать возможность Т-лимфоцитам с помощью своих Т-клеточных рецепторов распознать «свои» и «чужие» клетки. Информацию об этом несет разнообразный по составу и последовательности расположения аминокислот низкомолекулярный белок - эпитоп. Это фрагмент, возникший из белков, присутствующих внутри клетки. Среди них могут быть: а) фрагменты собственных белков, тогда они не вызывают ответной реакции со стороны специализированных Т-лимфоцитов; б) молекулы белка, кодируемые вирусом; в) молекулы белка, кодируемые мутантным геномом раковой клетки организма. В случае появления двух последних происходит реакция клетки, несущей чужеродный эпитоп, с Т-лимфоцитом, который называется цито-токсическим. Суть реакции заключается в следующем. Цитотоксические лимфоциты имеют рецепторы, с помощью которых осуществляется мониторинг практически всех клеток организма (за исключением тех, которые отделены от лимфоцитов специальными гематотканевыми барьерами). Они имеют специфические рецепторы - Т-клеточные, с помощью которых взаимодействуют с эпитопом тканевой клетки, и особые рецепторы, представленные поверхностными гликопротеинами, которые выявляются моно-клональными антителами CD8 (от англ. cluster of differentiation по номенклатуре, принятой в иммуноцитохимии рецепторов). Если Т-лимфоциты маркируются моноклональным антителом CD8, то они называются CD8+ Т-лимфоцитами, цитотоксическими, или киллерами. Последние связываются только с молекулой гистосовместимости I класса. В случае обнаружения чужеродного эпитопа происходит молекулярное взаимодействие в области контакта рецепторов, что является сигналом к запуску механизмов разрушения клетки, синтезирующей чужеродный белок. Это проявляется секрецией в межклеточное пространство белков - перфоринов, которые в виде трансмембранных белков встраиваются в плазмолемму чужеродной клетки, формируют поры, которые способствуют набуханию и распаду клетки. Кроме того, цитотоксические лимфоциты способны активизировать своими биологически активными веществами ферменты апопто-за через рецепторы чужеродной клетки. Существуют и другие механизмы цитотоксического действия данной субпопуляции лимфоцитов на мишени. Все это характеризует реакции клеточного иммунитета. Продукты (антигены) ГКГ I класса есть у всех соматических клеток кроме эритроцитов, нейронов, гистологических элементов трофобласта. Молекула гистосовместимости II класса состоит из двух трансмембранных белков, между петлями которых располагается фрагмент антигена - эпитоп, или антигенная детерминанта. В отличие от описанного выше процесса возникновения эпитопа в составе молекулы гистосовместимости I класса, во втором случае эпитоп появляется а) фагоцитоза антигена макрофагом (антигенпредставляющей клеткой), внутриклеточного взаимодействия антигена с лизосомами макрофага и возврата фрагмента антигена в виде эпитопа на клеточную поверхность; б) рецепторно-опосредованного эн-доцитоза В-лимфоцитами растворенного антигена, его модификации и возврата в виде эпитопа на клеточную поверхность. Следовательно, принципиальные отличия в организации молекулы гистосовместимости II класса заключаются в том, что эпитоп имеет внеклеточное происхождение, а данный класс молекул экспрессирует-ся не на всех клетках - только на антигенпредставляющих клетках (мак рофагах, дендритных клетках, В-лимфоцитах и активированных Т-лимфоцитах). С молекулой II класса могут взаимодействовать лимфоциты, которые имеют на своей поверхности другой - специальный - рецептор класса CD4. К ним относятся CD+4 Т-лимфоциты, или Т-хелперы. Последние вместе с анти-генпредставляющими клетками и В-лимфоцитами отвечают за формирование иммунной реакции, которая проявляется синтезом иммуноглобулинов, или антител, циркулирующих в крови и тканевой жидкости, что составляет суть гуморального иммунитета (см. ниже). 14.7.2. Характеристика иммунокомпетентных клеток Родоначальник всех клеток иммунной системы - стволовая кроветворная клетка. В эмбриональном периоде эти клетки локализуются в желточном мешке, печени, селезенке. В более поздний период эмбриогенеза они появляются в костном мозге и продолжают пролиферировать в пост-натальной жизни (рис. 14.12). Из СКК в костном мозге образуется клетка-предшественник лимфопоэза (лимфоидная мультипотентная родоначальная клетка), которая генерирует два типа клеток: пре-Т-клетки (предшественники Т-клеток) и пре-В-клетки (предшественники В-клеток) (рис. 14.13). Согласно клонально-селекционной теории иммунитета, в органах кроветворения формируются многочисленные группы (клоны) лимфоцитов, генетически запрограммированные реагировать на один или несколько антигенов. Поэтому каждый конкретный антиген оказывает избирательное действие, стимулируя только те лимфоциты, которые могут связываться с данным антигеном. При первой встрече с антигеном (первичный ответ) лимфоциты стимулируются и подвергаются трансформации в бласт-ные формы, которые способны к пролиферации и дифференцировке в иммуноциты (бласттрансформация лимфоцитов - явление, впервые описанное А. А. Максимовым). В лимфоците хроматин ядра становится менее плотным, появляется ядрышко, увеличивается объем цитоплазмы, начинается синтез новых РНК и белков. Так возникают лимфобласты, которые делятся 2-4 раза в сутки в течение 3-5 сут. Из одной клетки возникают до 1000 дочерних клеток той же специфичности. Для развития специфического иммунитета требуется от 4 до 7 сут. В результате бласттрансформа-ции Т-лимфоцитов появляются: 1) Т-клетки-киллеры (цитотоксические) - основные эффекторные клетки иммунитета, они разрушают чужеродные клетки-мишени и обеспечивают генетическое постоянство внутренней среды организма, защищая его от вторжения чужеродных клеток, новообразований, аутоиммунных заболеваний; 2) Т-клетки-хелперы, участвующие в процессах межклеточной кооперации с В-лимфоцитами, без чего невозможна трансформация В-лимфоцитов в плазмоциты; 3) Т-клетки-супрессоры, блокирующие антителообразование В-лимфоцитами при аутоиммунных реакциях; 4) клетки памяти - это лимфоциты, возвращающиеся в неактивное состояние, но несущие информацию (память) о встрече с конкретным антигеном. При повторном введении данного антигена они способны обеспечивать быстрый иммунный ответ большей интенсивности (вторичный ответ) вследствие усиленной пролиферации лимфоцитов и образования иммуноцитов. Эффекторные клетки имеют ограниченный срок жизни, и, когда антиген удален, большинство клеток подвергается апоптозу. Естественные киллерные клетки Среди лимфоцитов в крови, кроме Т-киллеров, имеются NK-клетки. Это большие лимфоциты диаметром 12-15 мкм, имеют дольчатое ядро и азурофильные гранулы (лизосомы) в цитоплазме. Клетки содержат гранулы с перфорином и гранзимами и убивают клетки-мишени сходным с Т-киллерами образом. Они распознают и уничтожают клетки, которые в данный момент не экспрессируют или содержат измененные молекулы ГКГ I. Мишенями для них являются зараженные вирусами, стареющие и опухолевые клетки, а также ткани трансплантата. Эти клетки образуют первую линию защиты против чужеродных клеток, действуют немедленно, быстро разрушая клетки. Т-киллеры образуют вторую линию защиты, так как для их развития из неактивных Т-лимфоцитов требуется время, поэтому они вступают в действие позже NK. Различают антигеннезависимую и антигензависимую дифференцировку и специализацию В- и Т-лимфоцитов. Антигеннезависимая пролиферация и дифференцировка генетически запрограммированы на образование клеток, способных давать специфический тип иммунного ответа при встрече с конкретным антигеном благодаря появлению на плазмолемме лимфоцитов особых «рецепторов». Она совершается в центральных органах иммунитета (тимус, костный мозг или фабрициева сумка у птиц) под влиянием специфических факторов, вырабатываемых клетками, формирующими микроокружение (ретикулярная строма или эпителиальные клетки в тимусе). В этом случае развитие завершается образованием клеток, готовых к распознаванию антигенов, но еще не встречавшихся с ними. Такие лимфоциты называют «наивными». Антигензависимая пролиферация и дифференцировка Т- и В-лимфоцитов происходят при встрече с антигенами в периферических лимфоидных органах, при этом образуются эффекторные клетки и клетки памяти. Образующиеся Т-лимфоциты составляют пул долгоживущих, рецирку-лирующих лимфоцитов, а В-лимфоциты - короткоживущих клеток. Взаимодействия клеток в гуморальном иммунном ответе. Гуморальный иммунный ответ обеспечивают макрофаги (антигенпрезентирующие клетки), Т-хелперы и В-лимфоциты. Попавший в организм антиген поглощается макрофагом. Макрофаг расщепляет его на фрагменты, которые в комплексе с молекулами ГКГ класса II появляются на поверхности клетки. Такая обработка антигена макрофагом называется процессированием антигена. Для дальнейшего развития иммунного ответа на антиген необходимо участие Т-хелпера (Тх), но прежде Тх должны быть активированы сами. Эта активация происходит тогда, когда антиген, обработанный макрофагом, распознается Тх. «Узнавание» Тх-клеткой комплекса «антиген + молекула ГКС II класса» на поверхности макрофага (т. е. специфичное взаимодействие рецептора этого Т-лимфоцита со своим лигандом) стимулирует секрецию интерлейкина-1 (ИЛ-1) макрофагом. Под воздействием ИЛ-1 активизируются синтез и секреция ИЛ-2 Тх-клеткой. Выделение Тх-клеткой ИЛ-2 стимулирует ее пролиферацию. Такой процесс может быть расценен как аутокринная стимуляция, так как клетка реагирует на тот агент, который сама синтезирует и секрети-рует. Увеличение численности Тх необходимо для реализации оптимального иммунного ответа. Тх активируют В-клетки путем секреции ИЛ-2. Активация В-лимфоцита происходит также при прямом взаимодействии антигена с иммуноглобулиновым рецептором В-клетки (рис. 14.14). В-лимфоцит сам процессирует антиген и представляет его фрагмент в комплексе с молекулой ГКС II класса на клеточной поверхности. Этот комплекс узнает уже задействованный в иммунной реакции Тх. Узнавание рецептором Тх-клетки комплекса антиген-молекула ГКГ II класса на поверхности В-лимфоцита приводит к секреции Тх-клеткой интерлейкинов - ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, γ-интерферона (γ-ИФН), под действием которых В-клетка размножается и дифференцируется с образованием плазматических клеток и В-клеток памяти. Так, ИЛ-4 инициирует активацию В-клетки, ИЛ-5 стимулирует пролиферацию активированных В-клеток, ИЛ-6 вызывает созревание активированных В-клеток и превращение их в плазматические клетки, секретирующие антитела. Интерферон привлекает и активирует макрофаги, которые начинают более активно фагоцитировать и разрушать внедрившиеся микроорганизмы. Передача большого кол-ва переработанных макрофагом антигенов обеспечивает пролиферацию и дифференцировку В-лимфоцитов в направлении образования плазматических клеток, вырабатывающих специфические антитела на конкретный вид антигена. Т-супрессоры (Тс) подавляют способность лимфоцитов участвовать в выработке антител и таким образом обеспечивают иммунную толерантность, т. е. нечувствительность к определенным антигенам. Они регулируют кол-во образующихся плазматических клеток и кол-во антител, синтезируемых этими клетками. Оказалось, что тормозить выработку антител может и особая субпопуляция В-лимфоцитов, которые получили название |
