УЧЕБНИК Клиническая иммунология. Соколов Е.И. 1998. УЧЕБНИК Клиническая иммунология. Соколов Е.И. Содержание 1 сокращения, часто встречающиеся в тексте 2
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
  Содержание 1 Содержание 1 СОКРАЩЕНИЯ, ЧАСТО ВСТРЕЧАЮЩИЕСЯ В ТЕКСТЕ 2 ПРЕДИСЛОВИЕ 3 ЧАСТЬ 1. ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ 3 ГЛАВА 1 3 ОБЩИЕ СВЕДЕНИЯ ОБ ИММУННОЙ СИСТЕМЕ 3 1.1.НЕКОТОРЫЕ ОПРЕДЕЛЕНИЯ 3 1.2. ЭЛЕМЕНТЫ ИММУННОЙ СИСТЕМЫ 5 ГЛАВА 2 5 ФОРМИРОВАНИЕ И РЕАЛИЗАЦИЯ ИММУННОГО ОТВЕТА 5 2.1. РАСПОЗНАВАНИЕ АНТИГЕНА 5 2.1.1. Основные постулаты 6 2.1.2. Молекулярный аппарат антигенного распознавания 6 2.1.3. Основные этапы процесса антигенного распознавания 9 2.2. ФОРМИРОВАНИЕ ЭФФЕКТОРНОГО ЗВЕНА ИММУННОГО ОТВЕТА 10 2.2.1. Антигензависимая дифференцировка клона В-лимфоцитов 10 2.2.2. Образование цитотоксических Т-лимфоцитов 11 2.3. ЭФФЕКТОРНОЕ ЗВЕНО ИММУННОГО ОТВЕТА 11 2.3.1. Защита от инфекции с помощью антител 11 2.3.2. РОЛЬ ОСТРОЙ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ В ЗАЩИТЕ ОРГАНИЗМА ОТ ИНФЕКЦИИ 12 2.3.3. Взаимодействие цитотоксического лимфоцита с клеткой-мишенью 14 ГЛАВА 3 15 МОРФОЛОГИЯ ИММУННОГО ОТВЕТА 15 3.1. ОРГАНЫ ИММУННОЙ СИСТЕМЫ 15 3.2. КЛЕТКИ, УЧАСТВУЮЩИЕ В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА 17 ГЛАВА 4 19 РЕГУЛЯЦИЯ ИММУННОГО ОТВЕТА 19 4.1. МЕХАНИЗМЫ ОГРАНИЧЕНИЯ ИММУННОГО ОТВЕТА 19 4.2. МЕХАНИЗМЫ НЕСПЕЦИФИЧЕСКОЙ РЕГУЛЯЦИИ ЗА СЧЕТ СИСТЕМЫ ЦИТОКИНОВ 21 4.3. РЕГУЛЯТОРНЫЕ ИММУНОНЕЙРОЭНДОКРИННЫЕ СЕТИ 24 ГЛАВА 5 25 ГЕНЕТИЧЕСКИЕ ОСНОВЫ ИММУННОГО ОТВЕТА 25 5.1. ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ 26 5.2. ПОЛИМОРФИЗМ АНТИГЕНОВ МНС 27 5.3. ГЕНЕТИЧЕСКАЯ ПРИРОДА РАЗНООБРАЗИЯ АНТИГЕНСВЯЗЫВАЮЩИХ РЕЦЕПТОРОВ И АНТИТЕЛ 27 5.4. ЭВОЛЮЦИЯ ИММУННОЙ СИСТЕМЫ С ТОЧКИ ЗРЕНИЯ ЭВОЛЮЦИИ МОЛЕКУЛ СУПЕРСЕМЕЙСТВА ИММУНОГЛОБУЛИНОВ 30 ЧАСТb II 31 КЛИНИЧЕСКАЯ ИММУНОЛОГИЯ 31 ГЛАВА 7 ОСНОВЫ ИММУНОДИАГНОСТИКИ 31 7.1. СБОР ИММУНОЛОГИЧЕСКОГО АНАМНЕЗА И ХАРАКТЕРИСТИКА ОСНОВНЫХ ИММУНОПАТОЛОГИЧЕСКИХ СИНДРОМОВ 31 7.2. ДИАГНОСТИЧЕСКИЕ ТЕСТЫ, ПРОВОДИМЫЕ НЕПОСРЕДСТВЕННО У БОЛbНОГО (ТЕСТЫ IN VIVO) 33 7.3. ОСНОВНЫЕ ТЕСТЫ ЛАБОРАТОРНОЙ ИММУНОДИАГНОСТИКИ 33 7.4. МЕТОДЫ ИССЛЕДОВАНИЯ ЛИМФОЦИТОВ 34 7.4.1. Методы, основанные на изучении поверхностных маркеров 35 7.4.2. Исследование функционального состояния лимфоцитов 37 7.4.3. Оценка гиперчувствительности замедленного типа 38 7.5. ОЦЕНКА ФУНКЦИОНАЛbНОГО СОСТОЯНИЯ ФАГОЦИТОВ 38 7.6. ОСНОВНЫЕ МЕТОДЫ ВЫЯВЛЕНИЯ АНТИТЕЛ И АНТИГЕНОВ 39 7.7. ОПРЕДЕЛЕНИЕ КОМПЛЕМЕНТА 41 ГЛАВА 14 43 ИММУНОМОДУЛИРУЮЩАЯ ТЕРАПИЯ 43 14.1. ИММУНОСТИМУЛИРУЮЩИЕ ПРЕПАРАТЫ 44 СОКРАЩЕНИЯ, ЧАСТО ВСТРЕЧАЮЩИЕСЯ В ТЕКСТЕ АКТГ — адренокортикотропный гормон АЛС — антилимфоцитарные сыворотки АНФ — антинуклеарные факторы АСЛО — антистрептолизин О АФК — активные формы кислорода БАВ — биологически активное вещество ГКС — глюкокортикостероиды ГЗТ — гиперчувствительность замедленного типа ГНТ — гиперчувствительность немедленного типа ДТЗ — диффузный токсический зоб ИФА — иммуноферментный анализ ИФН — интерферон Кон А — конканавалин А ЛАК — лимфокинактивированные киллеры МАК — мембраноатакующий комплекс НПВП — нестероидные противовоспалительные препараты ОБМ — основной белок миелина ОПГ — острый постинфекционный гломерулонефрит ПБЦ — первичный билиарный цирроз ПСС — прогрессирующий системный склероз ПЯЛ — палочкоядерный лейкоцит PA — ревматоидный артрит РБТЛ — реакция бласттрансформации лимфоцитов РСК — реакция связывания комплемента РТМЛ — реакция торможения миграции лейкоцитов РФ — ревматоидный фактор УП — узелковый периартериит СКВ — системная красная волчанка ТТГ — тиротропный гормон ФГА — фитогемагглютинин ФСГ — фолликулостимулирующий гормон ХПН — хроническая почечная недостаточность ЦИК — циркулирующие иммунные комплексы ЦМВ — цитомегаловирус ЦТЛ — цитотоксические лимфоциты ЭОП — эндогенные опиоидные пептиды HLA — главный комплекс гистосовместимости человека MALT — лимфоидная ткань, ассоциированная со слизистыми оболочками TNF — фактор некроза опухолей ПРЕДИСЛОВИЕ Представление о том, что иммунная система наряду с другими регуляторными системами организма, нервной и эндокринной системами играет важную роль в патогенезе многих (если не большинства) заболеваний, прочно вошло в сферу клинического мышления современного врача. К сожалению, из такого рода идей, когда они существуют в форме общих представлений и лишены конкретного наполнения, трудно извлечь практическую пользу. Недостатки отечественного медицинского образования и ряд других факторов ставят российского врача в достаточно трудное положение. Помимо причин чисто экономического характера, развитие клинической иммунологии в России тормозится в результате существования своеобразного порочного круга: врач не располагает необходимой информацией из-за «слабости» лабораторной базы; лаборатории не получают нужного для их развития импульса, так как нет соответствующих квалифицированных запросов со стороны клиницистов. Единственным способом «переломить» сложившуюся ситуацию является систематическая и настойчивая работа по распространению иммунологических знаний в среде практикующих врачей. В течение последних 10 лет работа в этом направлении проводится на факультете постдипломного образования Московского медицинского стоматологического института, а накопленный за этот период опыт авторы попытались обобщить в настоящем руководстве. Авторы стремились быть максимально лаконичными, понимая, что многим читателям будет трудно и не всегда интересно следить за цепью доказательств существования того или иного иммунологического феномена. Настоящее руководство является первым отечественным (не переводным) изданием по клинической иммунологии. Это обстоятельство наряду с естественными недостатками, присущими всякому первому опыту, имеет одно важное преимущество: авторы хорошо представляют себе условия работы российского практического врача, для которого, собственно, и написана эта книга. Все критические замечания и пожелания будут приняты с благодарностью. Академик РАМН Е. И. Соколов ЧАСТЬ 1. ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ Среди фундаментальных наук, составляющих основу современной теоретической медицины, самую короткую историю (всего около 100 лет) имеет иммунология. За это время из частного раздела бактериологии она превратилась в крупную самостоятельную дисциплину, наиболее логично объясняющую, каким образом организму высших животных удается сохранять свою биологическую индивидуальность и поддерживать постоянство внутренней среды. ГЛАВА 1 ОБЩИЕ СВЕДЕНИЯ ОБ ИММУННОЙ СИСТЕМЕ 1.1.НЕКОТОРЫЕ ОПРЕДЕЛЕНИЯ Термин «иммунитет» происходит от латинского слова «immunis» (так в древнем Риме называли гражданина, свободного от определенных государственных повинностей). Первоначально этот термин использовался для обозначения резистентности организма к инфекции, а иммунология составляла дисциплину, изучающую феномен иммунитета. В настоящее время это определение существенно расширено и касается множества реакций, направленных на элиминацию из организма любого чужеродного материала. К области иммунологии относятся также проблемы патологии, связанные с нарушением нормального хода иммунных реакций. Кроме того, наблюдается активное взаимопроникновение иммунологии и целого ряда ставших смежными дисциплин, таких как генетика, эмбриология, экология и др. Антигены — вещества, специфически реагирующие с антителами или клеточными рецепторами и способные индуцировать продукцию антител либо специфические клеточные реакции. Вещества, реагирующие с антителами, но неспособные При введении в организм вызвать продукцию антител, называются гаптенами. Участок молекулы антигена, обладающий способностью связываться с активным центром антитела или антигенсвязывающего рецептора лимфоцита, называется антигенной детерминантной. Антитела — вещества, продукция которых может быть вызвана введением в организм антигенов или гаптенов при условии, что последние химически связаны с носителем. Непременным свойством антител является их способность специфически связываться с антигенами или гаптенами. Иммунологическая память — способность организма отвечать на повторное введение антигена иммунной реакцией, характеризующейся большей силой и более быстрым развитием. Иммунная система, так же как и другие системы высших позвоночных (нервная, эндокринная), призвана обеспечивать наилучшую приспособляемость организма к условиям внешней среды. Если формализовать признаки, характерные для этих основных систем, то окажется, что иммунная система более всего напоминает нервную (табл. 1). Действительно, обе системы могут распознавать «свое» и «чужое», способствуя,, таким образом, самоидентификации организма в окружающей среде. Обе системы реагируют на внешние воздействия с исключительно высокой специфичностью. Обе системы обладают свойством памяти. В обоих случаях распространение сигнала внутри системы осуществляется по принципу сетей. Следует, однако, заметить, что в основе указанного сходства могут лежать совершенно различные механизмы. Помимо сходства, имеются и различия, главным из которых является способность клеток иммунной системы действовать в автономном режиме, что абсолютно исключено для клеток нервной системы. Такая автономность может быть наглядно проиллюстрирована с помощью следующего эксперимента. У мыши удаляют селезенку, лишая таким образом этот лимфоидный орган регуляторных сигналов со стороны нервной и эндокринной систем. Далее с помощью стеклянного гомогенизатора или металлических сит можно превратить селезенку во взвесь лимфоидных клеток, полностью разрушив сложную архитектонику органа и избавившись от элементов стромы. После многократных центрифугирований такой взвеси, при которых каждый раз удаляется надосадочная жидкость, можно быть вполне уверенным, что отмытые клетки селезенки больше не подвергаются каким-либо влиянием со стороны организма хозяина. Если затем данные клетки поместить в питательную среду, содержащую антиген, то через несколько дней в надосадочной жидкости такой клеточной культуры можно обнаружить специфические антитела против этого антигена даже в том случае, когда животное-донор никогда ранее с ним не контактировало (рис. 1). Таблица 1. Сравнение свойств нервной и иммунной систем
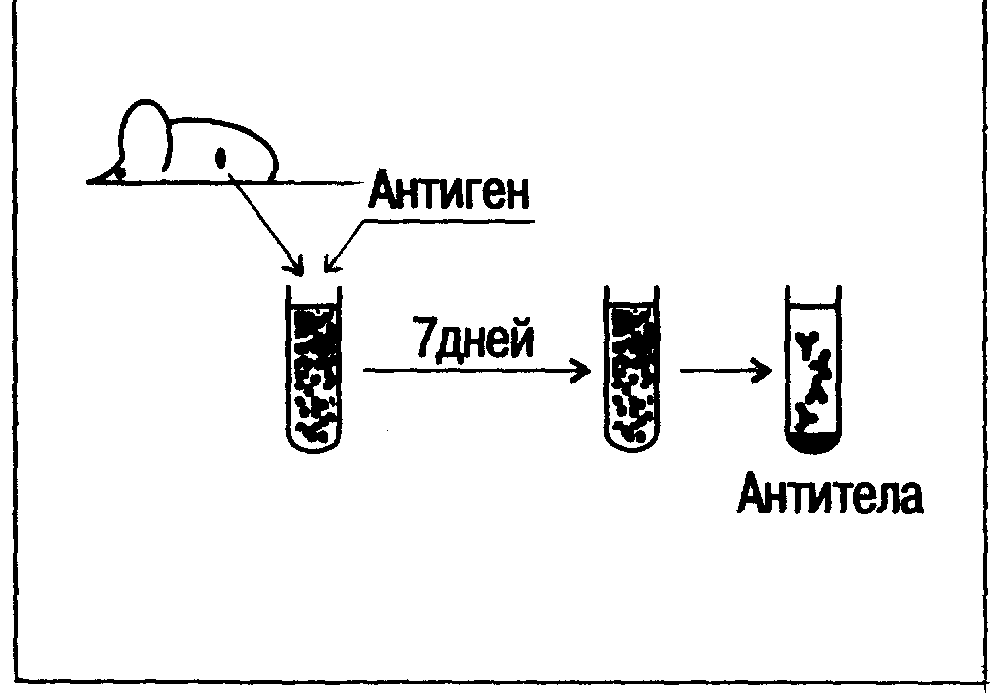 Рис. 1. Опыт, иллюстрирующий способность иммунокомпетентных клеток действовать в автономном режиме. У мыши удаляют селезенку, из которой путем разрушения органа получают взвесь лимфоидных клеток. К такой клеточной культуре добавляют антиген, и через 7 дней культивирования в надосадочной жидкости могут быть обнаружены специфические антитела. Синтез антител происходит несмотря на то, что организм донора с этим антигеном никогда не контактировал. 1.2. ЭЛЕМЕНТЫ ИММУННОЙ СИСТЕМЫ Клетки. Лимфоциты — клетки, ответственные за специфичность действия иммунной системы, а также за сохранение иммунологической памяти. С помощью специализированных популяций лимфоцитов организм способен различать «свое» и «чужое», распознавать чужеродные антигены, продуцировать антитела, а также осуществлять специфически направленные цитотоксические реакции. Макрофаги и моноциты— филогенетически наиболее древние клетки иммунной системы. Моноциты являются циркулирующими в периферической крови предшественниками макрофагов. Функции макрофагов разнообразны и не исчерпываются потребностями иммунной защиты организма. Впервые на защитную функцию макрофагов указал И. И. Мечников, открывший явление фагоцитоза (Нобелевская премия за 1908 г.). В настоящее время известна другая фундаментальная роль макрофагов — представление антигенов лимфоцитам. Без этой функции макрофагов невозможно специфическое распознавание чужеродного антигена. Кроме того, макрофаги являются продуцентами многочисленных медиаторов иммунных реакций (простагландины, интерлейкины), а также факторов комплемента. Клетки К и NK. К-клетки способны разрушать клетки-мишени, покрытые крайне малыми количествами IgG-антител. NК-клетки (естественные киллеры) также являются цитотоксическими клетками, осуществляющими цитотоксический эффект (главным образом против опухолевых клеток) без предварительной иммунизации и в отсутствие антител. Другие клетки. Следует отметить тучные клетки и базофилы, играющие важную роль в реакциях воспаления и анафилактических реакциях, а также полиморфноядерные нейтрофилы и базофилы, участвующие в неспецифических иммунных реакциях. Гепатоциты, которые наряду с макрофагами являются продуцентами факторов комплемента. Специфические медиаторы. Антитела представляют собой высокомолекулярные белки, относящиеся к семейству иммуноглобулинов (Ig). У человека и большинства млекопитающих различают 5 классов иммуноглобулинов: A, D, Е, G и М. Антигенсвязывающие рецепторы лимфоцитов представляют собой мембранные рецепторы иммуноглобулиновой (для В-лимфоцитов) или неиммуноглобулиновой (для Т-лимфоцитов) природы. С помощью этих рецепторов клетка специфически распознает антиген. Антигенспецифические медиаторы, продуцируемые Т-лимфоцитами. К этой группе веществ относятся усиливающие и супрессорные факторы, синтезируемые лимфоцитами в процессе иммунного ответа. Неспецифические медиаторы. К неспецифическим медиаторам иммунного ответа относятся лимфокины, монокины, фактор некроза опухоли, фактор торможения миграции макрофагов, медиаторы гиперчувствительности немедленного типа (гистамин, серотонин, фактор активации тромбоцитов), интерфероны, лизоцим, а также система комплемента. ГЛАВА 2 ФОРМИРОВАНИЕ И РЕАЛИЗАЦИЯ ИММУННОГО ОТВЕТА Иммунную реакцию от ее начала до завершения можно условно разделить на три блока.  2.1. РАСПОЗНАВАНИЕ АНТИГЕНА 2.1.1. Основные постулаты В основе современной теории специфического распознавания антигенов иммунной системой лежат следующие представления.
2.1.2. Молекулярный аппарат антигенного распознавания Антигены главного комплекса гистосовместимости. Эти антигены экспрессированы на поверхности всех ядерных клеток организма. Свое название они получили в связи со способностью вызывать сильную реакцию отторжения при пересадке тканей в пределах одного вида. У представителей разных видов система антигенов главного комплекса гистосовместимости, МНС (major hystocompatibility complex), имеет разные названия. У человека она называется HLA (human leukocyte antigens), у мышей — Н-2, у собак — DLA, у свиней — SLA и т.д. В антигенном распознавании участвуют антигены МНС классов I и II. 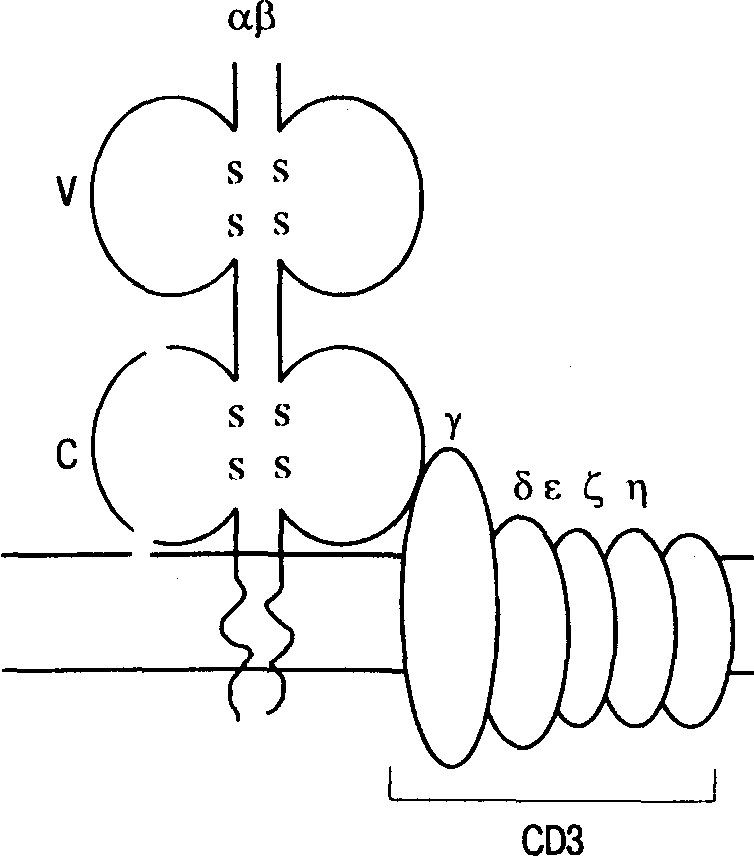 Рис. 2. Строение антигенсвязывающего рецептора Т-клетки. Трансмембранный гетеродитмер (- и -цепи, связанные между собой дисульфидными мостиками, на схеме не показаны) узнает номинальный антиген в комплексе с молекулами МНС. Гетеродимер прочно связан с комплексом CD3, состоящим из цепей , , , . Антигенсвязывающие рецепторы лимфоцитов. Эти молекулы представлены на поверхности В- и Т-лимфоцитов. В первом случае они представляют собой молекулы иммуноглобулинов, а во втором составляют самостоятельное семейство гликопротеидных молекул. Рецепторы Т-лимфоцитов существуют только в форме молекул, прочно связанных с клеточной мембраной. Этот рецептор представляет собой гетеродимер, состоящий из двух полипептидных цепей. Большая часть каждой из двух цепей рецептора находится вне клетки и свернута в виде двух доменов — вариабельного (V) и константного (С). Известно два типа Т-клеточных рецепторов. Большинство Т-лимфоцитов несет рецепторы I типа, состоящие из - и -цепей. Рецепторы некоторой части периферических лимфоцитов несут гетеродимеры, состоящие из - и -цепей (рецепторы II типа). У всех Т-лимфоцитов, несущих антигенсвязывающий рецептор (как /, так и /), последний нековалентно связан в единый комплекс с молекулой CD3 (рис. 2). Молекула CD3, состоящая из нескольких пептидных цепей (, , , ), участвует в передаче сигнала от распознающего антиген гетеродимера (, ) внутрь клетки. Таким образом, весь этот комплекс, состоящий из 7 пептидных цепей, следует рассматривать как единую функциональную структуру. Иммуноглобулины. Иммуноглобулины представляют собой группу сывороточных белков, обладающих рядом общих свойств и играющих важную роль в реализации иммунного ответа высших позвоночных. Все антитела являются иммуноглобулинами. Молекула иммуноглобулина состоит из двух тяжелых (Н) и двух легких (L) цепей, соединенных между собой дисульфидными связями (рис. 3). Н- и L-цепи одной молекулы полностью идентичны. Существует два класса легких цепей — и и 5 классов тяжелых цепей: , , , и . Два класса тяжелых цепей содержат субклассы: 1, 2 и 1, 2, 3, 4. С помощью протеолитических ферментов молекула иммуноглобулина может быть расщеплена в области так называемого шарнирного участка. Например, с помощью папаина из одной молекулы может быть получено три фрагмента: два одинаковых Fab-фрагмента (fragment antigen binding), каждый из которых обладает одним антигенсвязывающим центром, и Fc-фрагмент (fragment crystallizable). При обработке пепсином молекула расщепляется в другом месте. При этом из одной молекулы образуется два фрагмента — pFc' и Р(аb')2. В обозначении последнего отражена его бивалентность в отношении связывания антигена. Молекулы антител отличаются исключительным разнообразием. Это разнообразие в первую очередь связано с вариабельными областями, расположенными в N-концевых участках как легких, так и тяжелых цепей молекулы иммуноглобулина. Остальные участки относительно неизменны. Это позволяет выделить в молекуле иммуноглобулина вариабельные и константные области тяжелых и легких цепей. Отдельные участки вариабельных областей (так называемые гипервариабельные участки) отличаются особым разнообразием (табл. 2). 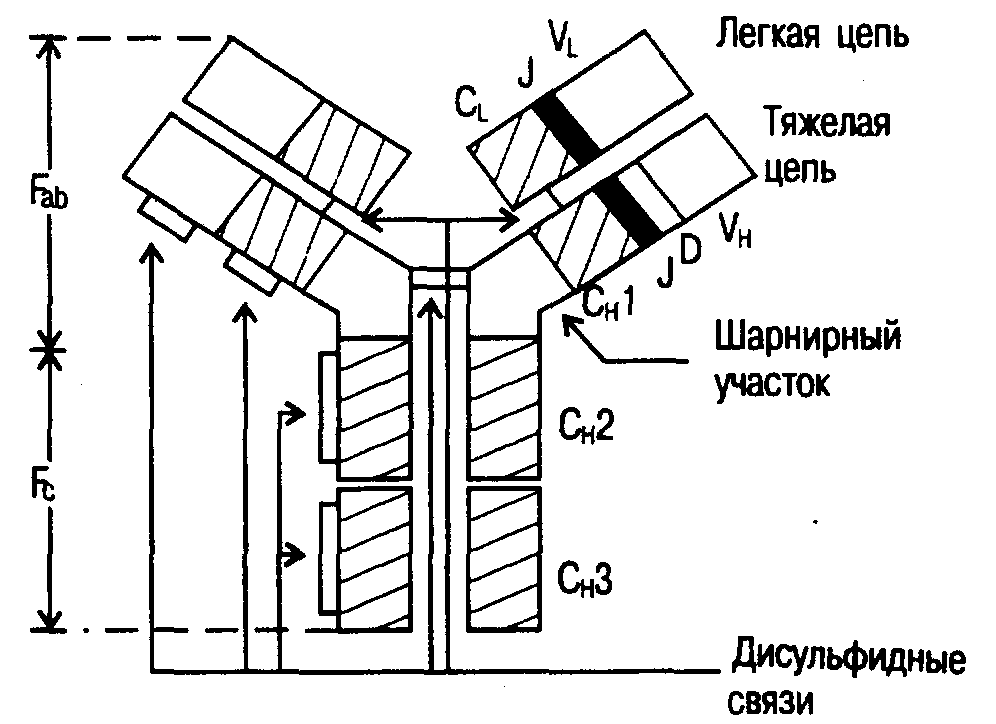 Рис. 3. Топология и функциональная архитектоника молекулы IgG. Иммуноглобулины могут быть классифицированы в зависимости от строения константных и вариабельных областей. Изотипы отражают разнообразие иммуноглобулинов на уровне биологического вида. При иммунизации животных одного вида сывороткой крови особи другого вида образуются антитела, распознающие изотипические специфичности молекулы иммуноглобулина. Каждый класс иммуноглобулинов имеет свою изотипическую специфичность, против которой могут быть получены специфические антитела, например кроличьи антитела против IgG мыши (препарат, широко применяемый в различных иммунодиагностических тестах). Характеристика основных классов иммуноглобулинов представлена в табл. 3. Таблица 2. Разнообразие иммуноглобулинов
Таблица 3. Характеристики основных классов иммуноглобулинов человека
Наличие аллотипов обусловлено генетическим разнообразием внутри вида и касается особенностей строения константных областей молекул иммуноглобулинов у отдельных лиц или семей. Это разнообразие имеет такую же природу, как и различия людей по группам крови системы АВО. 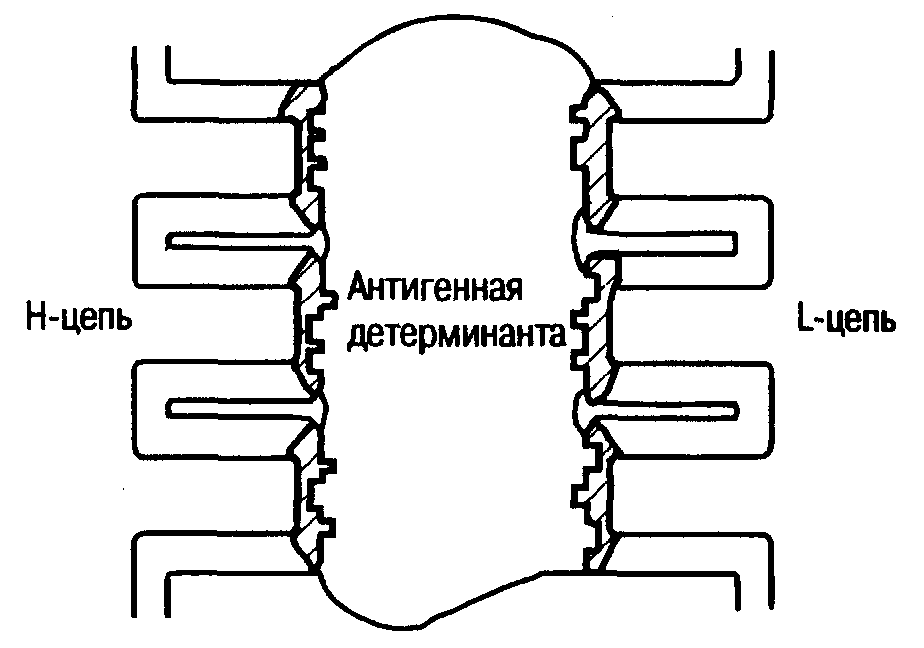 Рис. 4. Упрощенное изображение антигенсвязывающего центра. Этот участок вариабельного домена иммуноглобулина представляет собой полость, образованную пептидными петлями тяжелых и легких цепей. Гипервариабельные участки заштрихованы. Идиотипы представляют собой участки вариабельной части молекулы иммуноглобулина, которые сами являются антигенными детерминантами. Антитела, полученные против таких антигенных детерминант (антиидиотипические антитела), способны различать антитела разной специфичности. С помощью антиидиотипических сывороток можно обнаружить одну и ту же вариабельную область на разных тяжелых цепях и в разных клетках. Пространственная структура молекулы иммуноглобулина обеспечивается дисульфидными связями внутри цепей, существующими помимо дисульфидных мостиков, соединяющих Н- и L-цепи. В результате пептидная цепь образует компактно свернутые петли с характерной -складчатой структурой — так называемые глобулярные домены. Соответственно существуют вариабельные и константные домены. Гипервариабельные последовательности сосредоточены на одном конце вариабельной области, образуя часть -поворота пептидной цепи. Гипервариабельные области легких и тяжелых цепей совместно образуют антигенсвязывающий центр, «отвечая», таким образом, за специфичность антитела (рис. 4). Молекулы клеточной адгезии. Эти молекулы могут оказывать костимулирующее действие в процессах иммунного распознавания. Они представляют собой чрезвычайно разнообразную группу молекул, часть из которых филогенетически родственна иммуноглобулинам, антигенсвязывающим рецепторам Т-клеток и антигенам главного комплекса гистосовместимости. 2.1.3. Основные этапы процесса антигенного распознавания Неспецифический этап антигенного распознавания. На начальных этапах каскада событий, условно называемых антигенным распознаванием, этот процесс имеет неспецифический характер. Первой клеткой, вступающей во взаимодействие с антигеном, является макрофаг. Фагоцитоз, представляющий собой филогенетически наиболее древнюю иммунную реакцию, является также и первой реакцией иммунной системы на внедрение чужеродных антигенов. Антигены могут поступать в организм в составе бактериальной клетки или вирусной частицы, а также в виде высокомолекулярного белка или полисахарида (например, при вакцинации). И в том, и в другом случае антиген подвергается фагоцитозу и внутриклеточному перевариванию. Результатом переваривания является «разборка» крупных молекул на отдельные «блоки». Для обозначения этого процесса в иммунологии применяется специальный термин — «процессинг антигена». Такой процессированный антиген экспрессируется на поверхности макрофага в комплексе с собственным антигеном главного комплекса гистосовместимости. Распознавание антигена Т-клетками. Объектом распознавания для антигенсвязывающего рецептора Т-хелпера является комплекс чужеродного антигена (часто используется термин «номинальный антиген») и собственного антигена МНС. При этом распознаются не только антигенная детерминанта чужеродного антигена, но и структуры, относящиеся к антигенам МНС. В тех случаях, когда в условиях эксперимента антигенпрезентирующие клетки экспрессировали антигены МНС, не свойственные тому генотипу, к которому принадлежали Т-лимфоциты—носители антигенсвязывающего рецептора, распознавание оказывалось невозможным. Этот феномен, называемый ограничением, или рестрикцией по МНС, является важным свидетельством того, что для ответа на чужеродный антиген необходимо одновременное распознавание как номинального антигена, так и собственного антигена МНС. Распознавание антигена В-клетками. В-клетки распознают антигены с помощью своих иммуноглобулиновых рецепторов. В ходе взаимодействия В-клетки и антигена последний также может подвергаться процессингу. Такой процессированный антиген презентируется на поверхности В-клетки, где он доступен для распознавания активированным Т-хелпером. Следует заметить, что Т- и В-клетки распознают разные антигенные детерминанты одной и той же молекулы. В-клетка, как правило, не способна к самостоятельному ответу на антигенную стимуляцию. Для того чтобы В-клетка начала реагировать на антиген, ей необходимо получить второй сигнал от Т-хелпера. Антигены, иммунный ответ на которые невозможен без такого второго сигнала, называются тимусзависимыми. Важную роль во взаимодействии Т- и В-лимфоцитов играет ряд поверхностных рецепторов, обеспечивающих передачу костимулирующих сигналов. Так, на поверхности В-клеток экспрессируется дифференцировочный антиген CD40, относящийся к тому же семейству молекул, что и фактор роста нервов, TNF и Fas. Вскоре после активации на мембране Т-клетки начинает экспрессироваться лиганд для CD40 (контррецептор) — CD40L. Взаимодействие CD40— CD40L стимулирует В-клеточную пролиферацию, а также индуцированную интерлейкином 4 (ИЛ-4) дифференцировку В-клеток. Контактные взаимодействия между Т- и В-лимфоцитами могут также стимулировать пролиферацию Т-клеток. Такая стимуляция осуществляется за счет взаимодействия CD28 и В7/ВВ1 (CD80). В7/ВВ1 экспрессируется на поверхности активированных В-клеток, а CD28 присутствует на мембране большинства Т-клеток. Взаимодействие между CD28 и В7/ВВ1 усиливает пролиферацию Т-клеток, стимулирует продукцию цитокинов и образование цитотоксических Т-лимфоцитов, инициированных антигеном или митогеном. В некоторых случаях активация В-клеток возможна и без участия Т-клеток. Так, бактериальный липополисахарид в высоких концентрациях способен вызывать поликлональную активацию В-клеток. При этом антигенная специфичность иммуноглобулиновых рецепторов В-клетки не играет роли. При более низких концентрациях таких антигенов иммуноглобулиновые рецепторы пассивно концентрируют антиген на поверхности В-клетки, а собственная митогенная активность липополисахарида играет для В-клеток роль второго сигнала. Такие антигены получили название тимус-независимых антигенов типа I. Некоторые линейные антигены, медленно деградирующие в организме и имеющие часто повторяющуюся антигенную детерминанту (например, полисахариды пневмококков, Vi-антиген, поливинилпирролидон и некоторые другие), также способны стимулировать В-лимфоциты без участия Т-клеток. Эти антигены длительное время персистируют на мембране и в цитоплазме специализированных макрофагов краевого синуса лимфатического узла и маргинальной зоны селезенки. Эти антигены называются тимуснезависимыми антигенами типа II. Клональная селекция. Как уже отмечалось, наличие на поверхности лимфоцита специфического антигенсвязывающего рецептора не зависит от того, встречался ли ранее организм с данным антигеном или нет. Клетки, имеющие рецепторы одинаковой специфичности, являются представителями одного клона лимфоцитов. Такие клоны имеются как среди предшественников Т-хелперов, так и среди В-лимфоцитов. При попадании в организм чужеродного антигена происходит отбор (селекция) клонов, имеющих рецепторы, комплементарные детерминантам данного антигена. Только представители этих клонов получают «право» на дальнейшую дифференцировку. Такая дифференцировка получила название антигензависимой. 2.2. ФОРМИРОВАНИЕ ЭФФЕКТОРНОГО ЗВЕНА ИММУННОГО ОТВЕТА 2.2.1. Антигензависимая дифференцировка клона В-лимфоцитов Роль растворимых факторов в дифференцировке и пролиферации клона. Взаимодействие между клетками иммунной системы в процессе формирования ответа на антигенную стимуляцию осуществляется, в частности, за счет специальных растворимых медиаторов. В зависимости от того, какие клетки являются главными продуцентами этих медиаторов, они могут называться лимфокинами или монокинами. Те и другие объединяются общим термином — «цитокины». Антигензависимая дифференцировка Т-лимфоцитов контролируется главным образом ИЛ-1 и ИЛ-2. Источником ИЛ-1 служат макрофаги, которые, помимо презентации процессированного антигена (для чего необходим непосредственный контакт между макрофагом и лимфоцитом), дополнительно стимулируют предшественники Т-хелперов с помощью растворимых факторов. Такая стимуляция побуждает Т-клетки экспрессировать высокоаффинный рецептор для ИЛ-2. Эти клетки пролиферируют в ответ либо на собственный ИЛ-2, либо на ИЛ-2, продуцируемый другой субпопуляцией Т-хелперов. Субпопуляция Т-хелперов, продуцирующих ИЛ-2, обозначается Th1, а субпопуляция, не продуцирующая ИЛ-2, — Th2. Экспрессия рецептора для ИЛ-2 отмечена у клеток обеих субпопуляций. Важную роль в дифференцировке В-клеток играет ИЛ-6. Продуцентами этого растворимого фактора являются Т-лимфоциты, подвергшиеся мито генной стимуляции, и моноциты. На поверхности активированных В-клеток экспрессируется рецептор для ИЛ-6. Под воздействием ИЛ-6 происходит конечное созревание В-лимфоцитов в антителообразующие клетки. Дифференцировка В-лимфоцита в плазматическую клетку. Длительное время гистологи считали малый лимфоцит дифференцированной клеткой с не вполне ясной функцией. В настоящее время понятно, что под этой морфологической однородностью «скрываются» разнообразные клеточные популяции, судьба которых в процессе формирования иммунного ответа может быть совершенно различной. Показано, что под действием митогенных стимулов лимфоцит трансформируется в способные к митотическому делению и дальнейшей дифференцировке бластные клетки. Для В-лимфоцитов конечным этапом дифференцировки является плазматическая клетка, синтезирующая огромное количество антител. Специфичность синтезируемых антител, как правило, соответствует специфичности иммуноглобулинового рецептора В-лимфоцита-предшественника. Кинетика синтеза иммуноглобулинов разных классов при первичном и вторичном иммунном ответе различная (рис. 5). Так, после первого контакта организма с антигеном сначала удается обнаружить IgM-продуцируюшие клетки. Синтез IgG достигает своего максимума лишь спустя значительный промежуток времени. При вторичном иммунном ответе кинетика синтеза IgM не отличается от той, которая наблюдалась при первичном ответе, тогда как концентрация IgG в сыворотке крови быстро нарастает, достигая существенно более высоких значений. 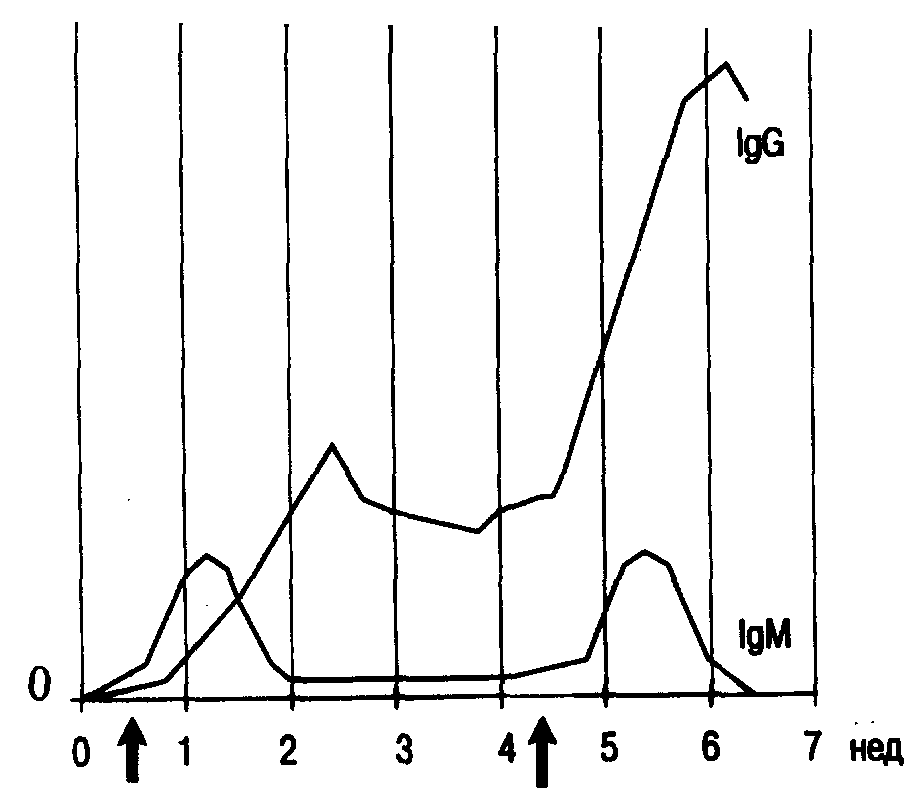 Рис. 5. Динамика синтеза IgM и IgG при первичном и вторичном иммунном ответе на антиген. По абсциссе — время после первой иммунизации. Стрелки — моменты введения антигена. Известно, что переключение синтеза иммуноглобулинов одного класса на синтез белков другого класса происходит в индивидуальных В-клетках. Это переключение осуществляется под контролем Т-клеток. При этом вариабельные последовательности VDJ, обусловливающие специфичность антитела, переносятся от генов к другому гену константного участка, например, к 1. Таким образом образуются антитела, имеющие другой изотип, но сохраняющие прежнюю специфичность. 2.2.2. Образование цитотоксических Т-лимфоцитов Впервые образование цитотоксических Т-лимфоцитов наблюдали в эксперименте при отторжении чужеродных трансплантатов, однако основное «назначение» этих клеток — борьба с вирусной инфекцией. Как известно, вирусы являются внутриклеточными паразитами, в связи с чем антитела и другие сывороточные факторы не могут обеспечить достаточную защиту. Внедрившись в клетку, вирус перестраивает клеточный аппарат белкового синтеза для собствен ной репликации. Этот процесс соответствует скрытому периоду вирусной инфекции, во время которого о присутствии вируса внутри клетки свидетельствует лишь экспрессия вирусного антигена на клеточной поверхности. Уничтожение инфицированной клетки предотвращает репликацию вируса. Как указывалось выше, распознавание чужеродного антигена возможно лишь в совокупности с собственными антигенами МНС. Однако если в Т-клеточном звене синтеза антител предшественники Т-хелперов распознают номинальный антиген на поверхности антигенпрезентирующей клетки в комплексе с антигеном МНС класса II, то при формировании противовирусного иммунитета предшественники Т-киллеров распознают комплекс вирусного антигена и антигена МНС класса I. Как и В-клетки, они нуждаются в помощи Т-хелперов, которые распознают антиген в комплексе с молекулой МНС класса II. Пролиферация и активация клеток-предшественников обеспечивается ИЛ-2. 2.3. ЭФФЕКТОРНОЕ ЗВЕНО ИММУННОГО ОТВЕТА 2.3.1. Защита от инфекции с помощью антител Наиболее ярким примером защитного действия антител является иммунная реакция организма на бактериальную инфекцию. Циркулирующие в крови антитела связываются с антигенными детерминантами поверхностных антигенов бактерий. Комплекс микроорганизма с антителом запускает каскад химических реакций, получивших название «классический путь активации комплемента». Конечным продуктом такой активации является образование мембраноатакующего комплекса (МАК), который наносит клеточной стенке бактерии множественные повреждения. Помимо непосредственного воздействия на бактериальную клетку, защитные свойства антител реализуются путем нейтрализации бактериальных токсинов. Молекула антитела присоединяется к молекуле токсина вблизи активного центра и стереохимически блокирует взаимодействие токсина с макромолекулярным субстратом. Потеря токсичности может также происходить за счет аллостерических конформационных изменений, когда антитело уже связалось с токсином на некотором расстоянии от активного центра молекулы токсина. Связывание антител с инкапсулированными бактериями облегчает фагоцитоз последних полиморфноядерными лейкоцитами и макрофагами. Этот феномен называется опсонизацией. Известно, что неопсонизированным бактериям, имеющим капсулу, как правило, удается избежать фагоцитоза. 2.3.2. РОЛЬ ОСТРОЙ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ В ЗАЩИТЕ ОРГАНИЗМА ОТ ИНФЕКЦИИ Классическая формула — rubor, tumor, calor, dolor et functio lesa symptomata inflammationis sunt — употребляется в медицине еще с античных времен. Однако только сегодня мы можем представить подробный «сценарий» этого симптомокомплекса, одно из центральных мест в котором занимает система комплемента. Активация комплемента. Комплемент представляет собой сложный белковый комплекс, состоящий примерно из 20 белков, который, подобно белкам свертывания крови, активируется за счет каскадного процесса, когда продукт предыдущей реакции выполняет роль катализатора следующей. Известно два пути активации комплемента: классический и альтернативный. Активация комплемента по классическому пути осуществляется, как правило, при агрегации молекул иммуноглобулина или при связывании иммуноглобулинов (антител) с соответствующим антигеном, причем последний может быть как растворимым, так и корпускулярным (бактерии, клетки). Важным моментом в процессе активации является конфигурация молекулы иммуноглобулина, которая может изменяться в ходе реакции антиген — антитело или неспецифической агрегации молекул иммуноглобулинов между собой. Непосредственно в активацию комплемента вовлечен домен СН2 Fc-фрагмента молекулы иммуноглобулина. Одним из условий для реализации этого процесса является расположение двух Н-цепей на определенном расстоянии одна от другой. В молекуле IgM это условие обеспечивается за счет собственной конфигурации молекулы, а в реакциях с IgG такое взаиморасположение Н-цепей возникает с частотой 1:800, в связи с чем способность IgG к связыванию комплемента существенно ниже, чем у IgM. На раннем этапе активации комплемента по классическому пути происходит активация С1. В присутствии Са2+ образуется тетрамер C1r2—Ca2+—C1s2, который связывается с одной молекулой C1q (рис. 6). Комплекс С1 обладает протеазной активностью. Его естественными субстратами являются С2 и С4. В плазме присутствует также ингибитор этого фермента (C1—1nh). На следующем этапе образуется активный С3-комплекс (С3-конвертаза). С4 состоит из трех полипептидных цепей (, и ), связанных между собой дисульфидными мостиками и нековалентными связям„и. Под действием C1s из -цепи образуется С4а — фермент с молекулярной массой 6000. В то же время C1-эстераза превращает С4 в С4b-форму, способную связываться с поверхностью клетки. К связанному с клеткой С4b присоединяется С2а (продукт расщепления С2 под действием С1). Активированный комплекс С4b—С2а представляет собой С3-конвертазу, способную расщеплять С3 на С3а и С3b,. Мембраносвязанный С3b взаимодействует с С5 и становится субстратом для С3-конвертазы, которая расщепляет С5 на С5а и С5b, причем последний остается связанным с мембраной. С5b последовательно связывает С6, С7 и С8, образуя комплекс, способствующий пространственной ориентации двух или более молекул С9. Проникая внутрь липидного слоя и полимеризуясь, они образуют кольцеобразный мембраноатакующий комплекс (МАК). Последний представляет собой трансмембранный канал, проницаемый для электронов и воды (рис. 7). За счет более высокого коллоидно-осмотического давления внутри клетки в нее начинают поступать Na+ и вода, в результате чего клетка набухает и лизируется. 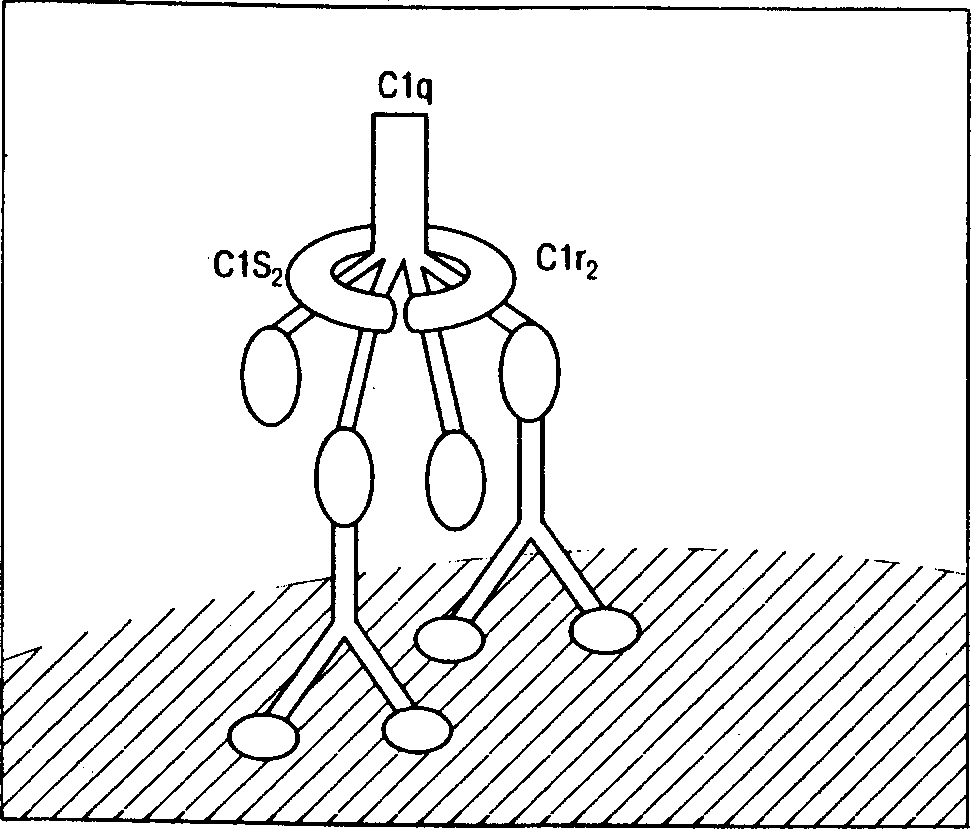 Рис. 6. Взаимодействие комплекса C1 (C1q, С1r2, C1s2) с двумя молекулами IgG, связавшими антиген. Другие биологические функции системы комплемента. Помимо лизиса клеток, происходящего за счет встраивания в мембрану МАК, белки системы комплемента облегчают адгезию микроорганизмов на поверхности фагоцитирующей клетки. Это осуществляется с помощью рецепторов для СЗb, которые имеются на поверхности фагоцитов. СЗа и С5а, образующиеся в процессе активации комплемента, могут действовать непосредственно на нейтрофилы и макрофаги, вызывая активизацию клеточного дыхания. Кроме того, являясь анафилотоксинами, они способствуют выбросу медиаторов воспаления из тучных клеток и циркулирующих в крови базофилов. Белки острой фазы. В ответ на инфекцию, повреждение тканей и стресс в крови резко повышается концентрация ряда белков, получивших общее название белков острой фазы. К ним относятся С-реактивный белок, сывороточный амилоидный А-белок, 1-кислый гликопротеин (орозомукоид), 1-антитрипсин, 2-макроглобулин, фибриноген, церулоплазмин, С9-компонент комплемента и фактор В. Микробные эндотоксины стимулируют выработку интерлейкина-1 и фактора некроза опухолей, являющихся эндогенными пирогенами. Интерлейкин-1 стимулирует клетки печени к продукции повышенного количества С-реактивного белка, концентрация которого в плазме может повышаться в 1000 раз и более. Этот белок представляет собой замкнутый пентамер, способный связываться с теми микроорганизмами, в состав мембраны- которых входит фосфорилхолин. Образовавшийся комплекс активирует систему комплемента по классическому пути, что приводит к связыванию С3b с поверхностью микроба, его опсонизации и фагоцитозу. 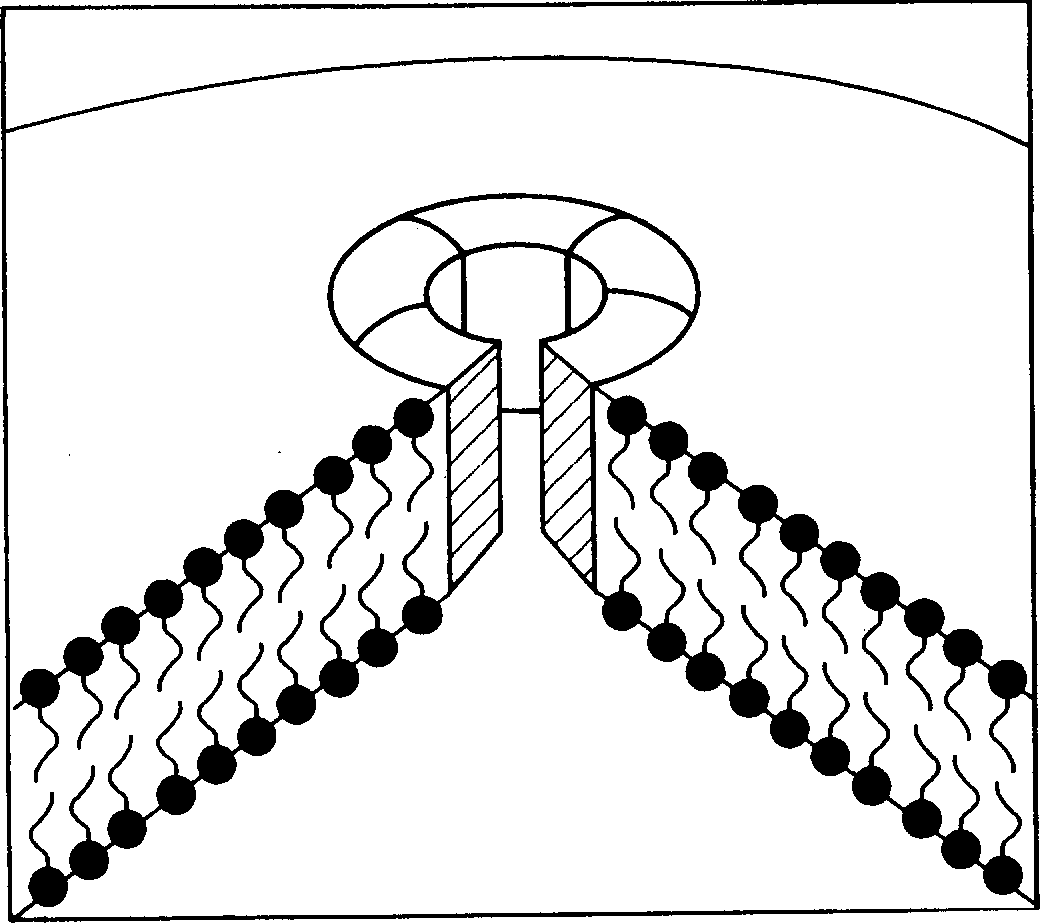 Рис. 7. Образование трансмембранного канала (мембраноатакующего комплекса) за счет полимеризации С9. Молекула С9 содержит гидрофильный домен, который взаимодействует с комплексом С5b-8, и участок, обладающий выраженной гидрофобностью, за счет которого С9 взаимодействует с липидной мембраной. Под влиянием комплекса С5b-8 происходит полимеризация нескольких молекул С9, после чего циркулирующий комплекс поли-С9 встраивается в двухслойную липидную мембрану, формируя сквозной белковый канал. Другие факторы неспецифической эффекторной системы защиты. Лизоцим (мурамилпептидаза) — фермент, расщепляющий мурамиловую кислоту в составе оболочки грамположительных микроорганизмов вплоть до лизиса микробной клетки. Лизоцим синтезиру ется гранулоцитами, моноцитами и макрофагами, и случае инфекции грамотрицательными микроорганизмами лизоцим действует совместно с системой комплемента. В норме лизоцим присутствует в достаточно высоких количествах в различных физиологических секретах и жидкостях организма. Определение его уровня в слюне, слезной жидкости и других секретах может дать важную информацию о состоянии антимикробной защиты. Необходимо отметить, что при миеломоноцитарном лейкозе возможно резкое повышение титров лизоцима. Фибронектин (холодовой нерастворимый глобулин) содержится в плазме и тканевых жидкостях, синтезируется макрофагами и отличается крайне высокой чувствительностью к действию протеаз. Рецепторы к фибронектину имеются практически на всех клетках человека. Сама же молекула фибронектина имеет участки для связывания коллагена, фибрина, C1q и некоторых бактерий (стафилококки, стрептококки). Связывание этих лигандов с «плавающим» носителем рецепторов приводит к конформационным изменениям белка, который очень быстро ферментируется. Определение фибронектина в сыворотке крови и биологических жидкостях может иметь принципиальное значение для прогноза течения инфекций. Так, развитие сепсиса сопровождается резким падением его содержания в плазме. При сепсисе заместительная терапия с помощью препаратов фибронектина дает хороший клинический результат. Этапы развития острой воспалительной реакции. На поверхности микробной клетки происходит активация С3-конвертазы, которая расщепляет большие количества С3. При этом фрагменты С3b связываются поверхностью микроорганизма, а фрагмент С3а выделяется в свободном виде. Это активирует следующий этап, в результате чего образуются С3а и МАК. В результате образования МАК микробная клетка может лизироваться, однако многие бактерии обладают устойчивостью к действию МАК. Как отмечалось выше, C3а и C3а способствуют высвобождению из тучных клеток медиаторов воспаления. Это ведет к расширению капилляров, экссудации белков плазмы, а также к концентрации в очаге воспаления полиморфноядерных лейкоцитов за счет механизма хемотаксиса. Таким образом, можно легко объяснить механизмы возникновения внешних симптомов острой реакции воспаления. Расширение капилляров приводит к гиперемии (rubor), экссудация белков плазмы и выход из кровеносного русла лейкоцитов проявляются в виде отека (tumor); все это совместно с выбросом эндогенных пирогенов приводит к местному, а часто и общему повышению температуры и болезненности (calor et dolor). 2.3.3. Взаимодействие цитотоксического лимфоцита с клеткой-мишенью Цитотоксические лимфоциты-эффекторы могут быть индуцированы либо в аллогенной системе, либо клетками, презентирующими вирусный антиген на своей поверхности. В первом случае специфичность таких клеток будет направлена против антигенов МНС класса I, а во втором — против комплекса вирусный антиген — антиген МНС класса I. Отличительной особенностью цитолитической реакции цитотоксических лимфоцитов (ЦТЛ) является ее автономность. ЦТЛ не нуждаются в помощи со стороны каких-либо других клеток или растворимых факторов. Для осуществления литической реакции необходим прямой контакт между ЦТЛ и мишенью. Первая фаза взаимодействия ЦТЛ и клетки-мишени (литический цикл) называется адгезией и осуществляется за счет связывания рецептора с антигеном. Далее происходит перестройка цитоплазмы клетки-эффектора, называемая программированием лизиса. На этой стадии в цитоплазме ЦТЛ накапливаются гранулы, содержащие растворимые медиаторы, такие как перфорин, цитолизин, гранзимы и др. Следующей фазой литического цикла является летальный удар, в ходе которого происходит экзоцитоз растворимых медиаторов с последующим образованием трансмембранных пор. Результатом этих событий является коллоидно-осмотический лизис клетки-мишени. После гибели клетки-мишени клетка-эффектор способна к повторному осуществлению цитотоксической реакции (рис. 8). Есть основания полагать, что коллоидно-осмотический шок, вызванный гранулами экзоцитоза, не единственный механизм гибели клетки-мишени. Показано, что при взаимодействии комплекса Т-клеточный рецептор — CD3 с антигенами МНС на поверхности клетки-мишени включается механизм транскрипции гена Fas-лиганда, в результате чего этот белок начинает экспрессироваться на поверхности клетки-эффектора. На мембране клеток-мишеней в норме экспрессируется белок Fas, служащий рецептором для Fas-лиганда. Активация этого рецептора приводит к включению механизма программированной гибели клетки (апоптоз).  Рис. 8. Цитотоксическая реакция. Следует обратить внимание на то, что ЦТЛ действуют автономно и не зависят от каких-либо других клеток, а также гуморальных факторов (например, антител или комплемента). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
