УЧЕБНИК Клиническая иммунология. Соколов Е.И. 1998. УЧЕБНИК Клиническая иммунология. Соколов Е.И. Содержание 1 сокращения, часто встречающиеся в тексте 2
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
|
Инфекционный синдром:
Аллергический синдром:
Аутоиммунный синдром:
Первичные иммунодефициты (у детей):
Вторичные иммунодефициты:
Лимфопролиферативный синдром:
а) гиперплазия всех групп лимфатических узлов с воспалительными процессами в них в сочетании с частыми бактериальными инфекциями другой локализации; б) спленомегалия; в) мононуклеоз в анамнезе. 7.2. ДИАГНОСТИЧЕСКИЕ ТЕСТЫ, ПРОВОДИМЫЕ НЕПОСРЕДСТВЕННО У БОЛbНОГО (ТЕСТЫ IN VIVO) Тесты этой группы включают кожные тесты (капельные уколочные и др.), провокационные пробы (эндоназальные, полоскательный тест, ингаляционные тесты) и элиминационные пробы. Наибольшее распространение получили кожные тесты. Следует помнить, что проведение тестов in vivo всегда имеет ряд противопоказаний, особенно у детей. К таким противопоказаниям прежде всего относятся: 1) обострение аллергического заболевания; 2) острые инфекции; 3) обострение или декомпенсация заболеваний эндокринного аппарата, сердечно-сосудистой системы, печени, почек; 4) злокачественные опухоли; 5) психические и неврологические заболевания; 6) длительная терапия глюкокортикостероидами или иммунодепрессантами; 7) анафилактический шок в анамнезе; 8) беременность. Следует помнить и о вероятности ложноположительных и ложноотрицательных результатов. Первые могут возникнуть при повышенной чувствительности к механическому раздражению и компонентам разводящей жидкости или при наличии перекрестных реакций. Получение ложноотрицательного результата может быть связано с нарушением техники постановки проб, отсутствием или истощением реагинов в коже, предшествующим приемом антимедиаторных препаратов, если есть аллергия другого типа. Иногда применяют холодовую пробу (прикладывание кусочков льда), тепловую пробу (прикладывание грелки с температурой 40—42°С), а также кратковременную локальную инсоляцию (при подозрении на фотодерматиты). 7.3. ОСНОВНЫЕ ТЕСТЫ ЛАБОРАТОРНОЙ ИММУНОДИАГНОСТИКИ Все существующие в настоящее время лабораторные иммунологические тесты, согласно классификации, предложенной кафедрой иммунологии Российского медицинского университета, могут быть разделены на тесты I и II уровня. Тесты I уровня (ориентирующие) включают:
После анализа результатов тестов I уровня определяют тактику дальнейшего исследования иммунного статуса. Тесты II уровня в отличие от тестов I уровня ставят избирательно в зависимости от того, какие цели преследует проводимое иммунологическое обследование. Тесты II уровня могут включать:
Особое значение имеет клиническая интерпретация получаемых результатов. К. А. Лебедев и И. Д. Понякина разработали весьма полезные общие правила, которых целесообразно придерживаться при интерпретации иммунограмм: 1) комплексный анализ иммунограммы более информативен, чем оценка каждого показателя в отдельности; 2) полноценный клинический анализ иммунограммы можно проводить лишь в комплексе с оценкой клинической картины и данных анамнеза; 3) реальную информацию об изменении иммунограммы несут лишь сильные сдвиги показателей (±20—40% от нормы и более); 4) анализ иммунограмм в динамике (особенно в сопоставлении с клинической динамикой) более информативен с точки зрения как диагностики, так и прогноза течения заболевания; 5) для диагностической и прогностической оценки иммунограммы важнейшее значение имеют индивидуальные показатели нормы у данного больного (особенно с учетом возраста и наличия сопутствующих и хронических заболеваний); 6) первостепенную практическую значимость при оценке иммунограммы имеют соотношения показателей иммунограммы, а не их абсолютное значение; 7) при оценке показателей иммунограммы следует прежде всего исключить возможность их колебаний в связи с приемом пищи, физическими нагрузками, чувством страха, временем суток. 7.4. МЕТОДЫ ИССЛЕДОВАНИЯ ЛИМФОЦИТОВ Как правило, исследование лимфоцитов в лаборатории включает этап выделения фракции мононуклеарных лейкоцитов из периферической крови. С этой целью используют метод градиентного центрифугирования. Кровь больного (кровь берут из вены в раствор гепарина) разводят в 2 раза забуференным изотоническим раствором натрия хлорида, не содержащим ионов Mg и Са, и осторожно наслаивают на раствор фикола. В последний для увеличения его плотности добавляют рентгеноконтрастный препарат для внутривенного введения (например, верографин, гипак, триозил и др.). В результате между плазмой и раствором фикола образуется ступенчатый градиент плотности. После центрифугирования эритроциты и гранулоциты проходят сквозь фикол и оседают на дно, а мононуклеары (лимфоциты и моноциты) остаются в виде кольца в интерфазе. Клетки собирают пипеткой, отмывают, переносят в культуральную среду и исследуют с помощью различных методов. Все методы исследования лимфоцитов можно разделить на изучение поверхностных маркеров и функциональные тесты. В 1983 г. Первое международное рабочее совещание по антигенам дифференцировки лейкоцитов ввело в практику клинической иммунологии термин «clusters of differentiation» (кластеры дифференцировки, сокращено CD), а в 1989 г. Четвертое совещание приняло рабочую номенклатуру (табл. 6). Таблица 6. Дифференцировочные антигены лимфоцитов человека
7.4.1. Методы, основанные на изучении поверхностных маркеров В настоящее время для идентификации поверхностных структур лимфоцитов и ряда других клеток в основном используют 3 группы методов: 1) розеткообразование; 2) методы иммунофлюоресценции; 3) иммуноферментные методы. Наиболее дешевым и в то же время достаточно точным методом определения численности популяции Т-лимфоцитов является метод розеткообразования. Метод основан на наличии сродства между рецептором CD2 и гликопротеинами мембраны эритроцита барана. При смешивании лимфоцитов с эритроцитами барана образуются фигуры, получившие название розеток. Количество таких розеткообразующих клеток (Е-РОК) соответствует количеству Т-лимфоцитов, для которых характерна экспрессия на поверхности CD2-aнтигена. Другая модификация метода розеткообразования (ЕАС-розетки) используется для идентификации В-клеток. Известно, что на поверхности В-лимфоцитов имеется рецептор для C3-компонента комплемента. Для выявления этого рецептора лимфоциты смешивают с эритроцитами быка, последовательно обработанными антиэритроцитарными антителами в субагглютинирующей концентрации и комплементом (свежезамороженной сывороткой крови мыши). Использование такого источника комплемента гарантирует защиту эритроцитов от комплементзависимого лизиса. После совместной инкубации В-клетки образуют фигуры розеток. Более прогрессивным является использование метода иммунофлюоресценции, который позволяет с помощью наборов моноклональных антител к различным CD-антигенам идентифицировать практически любые поверхностные структуры лимфоцитов. Различают метод прямой и непрямой иммунофлюоресценции. Первый состоит в использовании aнти-CD-моноклональных антител, к которым присоединена флюоресцентная метка. Чаще применяют флюоресцеин изотиоцианат (ФИТЦ), дающий в ультрафиолетовых лучах зеленоватое свечение. При наблюдении в люминесцентном микроскопе клеток, обработанных мечеными антителами, можно видеть характерные светящиеся ободки, указывающие на то, что на поверхности данной клетки экспрессированы соответствующие дифференцировочные антигены. Метод непрямой иммунофлюоресценции предполагает использование немеченых моноклональных антител. Визуализация реакции осуществляется с помо щью вторых антител (например, козьи антитела против иммуноглобулина мыши, если моноклональные антитела были получены на основе мышиной гибридомы), несущих флюоресцентную метку. Применение иммуноферментного метода, когда ко вторым проявляющимся антителам вместо ФИТЦ присоединяется пероксидазная метка, особенно удобно для небольших иммунологических лабораторий, так как не требует дорогих люминесцентных микроскопов. Цветную реакцию, возникающую при взаимодействии фермент-субстрат, можно наблюдать в обычный световой микроскоп. Универсальным методом исследования лейкоцитов является метод лазерной проточной цитофлюориметрии, который позволяет не только получить детальные характеристики клеточных субпопуляций, но производить их препаративное разделение. Прежде всего на основе анализа светорассеивания (без применения антител) в исследуемом образце можно определить содержание лимфоцитов, моноцитов и гранулоцитов. Используя метод иммунофлюоресценции (прямой или непрямой), можно определить численность различных субпопуляций лимфоцитов. Помимо регистрации свечения, возможна оценка его интенсивности. Обработка полученных данных по специальной программе позволяет определить количество сайтов связывания, т. е. вычислить плотность данного рецептора на клеточной мембране. За ограниченный отрезок времени можно произвести большое число анализов. На схеме 1 в наглядной форме представлена выявляемость различных дифференцировочных антигенов на поверхности лимфоидных клеток. Схема 1. Дифференцировочные антигены человека, определяемые с помощью моноклональных антител в системе CD 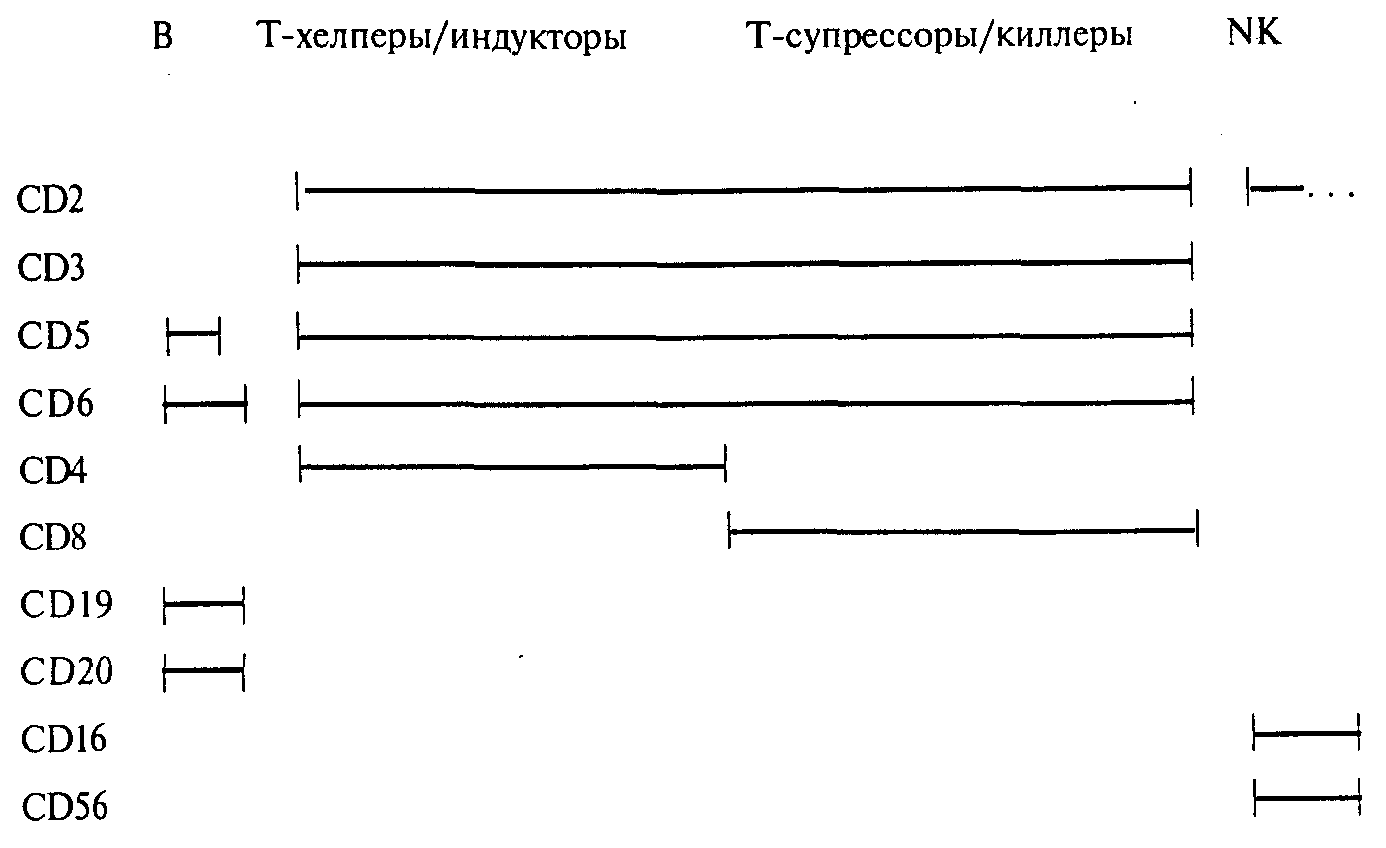 В табл. 7 и 8 представлены возрастные показатели Т- и В-клеточного звеньев иммунитета. Помимо определения численности популяций и субпопуляций, важное значение придается вычислению показателя CD4/CD8 — так называемого хелперно-супрессорного отношения (норма для Москвы 2,44±0,22). Клиническое значение этого показателя отчасти становится ясным из данных, приведенных в табл.9. Определение соотношения лимфоцитов с хелперной и супрессорной функциями допустимо производить в теофиллиновом тесте. Принцип метода заключается в том, что в присутствии теофиллина Т-лимфоциты с супрессорной функцией теряют способность к Е-розеткообразованию. Такие клетки получили название теофиллинчувствительных (ТЧ). Так называемые теофиллинрезистентные (ТР) клетки в значительном проценте случаев содержали субпопуляцию Т-лимфоцитов с хелперной активностью. Показатель ТР/ТЧ в норме составляет 2,5—3,5. Иногда для оценки численности субпопуляций лимфоцитов используют определение Т-лимфоцитов с рецепторами для Fc-фрагмента IgM (t) и с рецепторами для Fc-фрагмента IgG (Ту). А. А. Ярилин показал, что ТР-розеткообразующие клетки (РОК) на 86% представлены T-лимфоцитами и обладают хелперной активностью, а ТЧ-РОК на 91% представлены Ту-лимфоцитами и обладают преимущественно супрессорной функцией. В то же время среди Тц-клеток 69% является CD4+ и 97% — ТР-РОК. Среди T-лимфоцитов 95% клеток составляют ТЧ-РОК и только 30% из них являются CD8+ Таблица 9. Клинические примеры нарушения хелперно-супрессорного индекса (Тх/Тс)
Таким образом, не существует единого совершенного способа оценки числа лимфоцитов с супрессорной или хелперной активностью, поскольку часть СD8+-клеток является киллерами, а часть CD4+ — эффекторами. Вот почему оценку численности субпопуляций лимфоцитов желательно дополнять функциональными тестами. 7.4.2. Исследование функционального состояния лимфоцитов Существует большое число методов, позволяющих исследовать in vitro различные функции лимфоидных клеток. В частности, в клинических иммунологических лабораториях исследуют интенсивность пролиферативного ответа лимфоцитов на Т- и В-клеточные митогены, продукцию антител, а также синтез мононуклеарами периферической крови ряда цитокинов. Реакция бласттрансформации лимфоцитов (РБТЛ). Известны вещества, оказывающие на лимфоциты млекопитающих митогенное действие (табл. 10). Чаще для оценки функционального состояния Т-лимфоцитов в клинической лабораторной практике используют фитогемагглютинин (ФГА) — растительный лектин, получаемый из семян фасоли. Обычно мононуклеарные лейкоциты, выделенные из периферической крови методом градиентного центрифугирования, культивируют в присутствии ФГА в течение 72 ч. Результаты реакции можно учитывать либо морфологическим методом, либо по включению радиоактивной метки. В первом случае из клеточной культуры готовят мазки, фиксируют их в метаноле и окрашивают по Романовскому—Гимзе так же, как мазки крови. В световом микроскопе с иммерсионной системой определяют процент бластов по отношению к общему количеству лимфоцитов. Результат может быть выражен также в виде индекса стимуляции (ИС), представляющего собой отношение процента трансформированных клеток в опыте (культура с ФГА) к проценту трансформированных клеток в контроле (культура без ФГА). Т а б л и ц а 10. Некоторые неспецифические митогены лимфоцитов
Учет результатов по включению радиоактивной метки более удобен. Этот метод позволяет уменьшить количество крови для исследования, а также сократить расход питательных сред и трудозатраты. Культивирование проводят не в пробирках или флаконах, а в 96-луночных планшетах с объемом лунки около 200 мкл. В каждую лунку достаточно внести 50000 клеток, что в пересчете на цельную кровь составляет 0,05 мл. За 4—6 ч до окончания культивирования в лунки вносят 3H-тимидин. Далее с помощью специального прибора (клеточного харвестера) клетки переносят на стеклянные фильтры, избыток метки смывают большим количеством воды, фильтры высушивают и помещают во флаконы со сцинтилляционной жидкостью. Уровень включения метки оценивают на сцинтилляционном спектрофотометре. Результаты выражают в импульсах в минуту или в виде индекса стимуляции (отношение уровня включения метки в культуре с ФГА к уровню включения метки клетками, культивировавшимися без ФГА). В зависимости от качества использованных реактивов, а также от условий культивирования интенсивность стимуляции лимфоцитов может быть различной. Так, при культивировании клеток в пробирках в среде 199 интенсивность включения метки, как правило, бывает ниже, чем при культивировании в пластиковых планшетах в среде RPMI-1640. Большое значение имеет качество сыворотки, используемой в качестве добавки к питательной среде. Обычно с этой целью используют эмбриональную телячью сыворотку (ЭТС), гетерологическую сыворотку крови человека (пул от нескольких доноров) или донорскую лошадиную сыворотку. Как правило, сыворотки обладают более или менее выраженной самостоятельной митогенной активностью. В результате интенсивность пролиферации клеток в контрольных лунках также может колебаться. Наилучшими считают сывороточные препараты, обладающие минимальным митогенным действием, но вызывающим высокий уровень пролиферации при культивировании клеток в присутствии ФГА. Препараты с такими свойствами удается получить далеко не всем клиническим лабораториям. Вот почему врачу необходимо выяснить в лаборатории, в которой проводился анализ, какую интенсивность стимуляции в ответ на ФГА следует считать нормальной, а также в каких пределах может колебаться индекс стимуляции. Клиническое значение РБТЛ. При оценке результатов РБТЛ следует обращать внимание как на интенсивность пролиферативного ответа стимулированной культуры, так и на высоту ответа в контрольных лунках. Снижение пролиферативного ответа на ФГА свидетельствует о наличии иммунодефицита, однако механизмы -последнего могут быть различны. Низкий ответ в РБТЛ может коррелировать с дефицитом Т-клеток в периферической крови или с изменением показателя CD4/CD8 в пользу клеток-супрессоров. В некоторых случаях (например, в период восстановления после облучения или интенсивной химиотерапии) низкий ответ на Т-клеточные митогены может быть связан с выбросом в периферическую кровь большого количества незрелых Т-клеток. Низкий ответ в РБТЛ может быть также обусловлен нарушением продукции таких лимфокинов, как ИЛ-1 и ИЛ-2. При активации Т-клеток (в случае инфекции или наличия аутоиммунных реакций) возможно повышение спонтанной пролиферации (высоты пролиферативного ответа в контрольных лунках). Оценка интенсивности продукции цитокинов. С помощью тестов этой группы можно получить представление о продукции цитокинов мононуклеарными лейкоцитами периферической крови. Следует иметь в виду, что одни цитокины продуцируются преимущественно лимфоцитами (ИЛ-2, ИЛ-6), а другие — моноцитами (ИЛ-1, TNF); продукцию первых стимулируют Т-клеточные митогены (ФГА, Кон А), продукцию вторых — микробные липополисахариды (ЛПС). Исследование проводят по следующей схеме. Мононуклеары периферической крови, выделенные методом градиентного центрифугирования, культивируют в 24-луночных культуральных планшетах (объем лунки около 2 мл) в течение 16—18 ч в присутствии Кон А, ФГА или ЛПС. Над осадочную жидкость собирают и определяют в ней содержание цитокина. Для определения содержания цитокинов используют либо иммуноферментный анализ, либо цитокинзависимые клеточные линии. В продаже имеются иммуноферментные наборы для определения таких цитокинов, как ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, TNF, ИНФ. К сожалению, такие наборы пока довольно дороги. Существует коллекция цитокинзависимых клеточных линий, на которых также возможно определение содержания цитокинов в биологических жидкостях и культуральной среде. В большинстве случаев принцип определения основан на том, что клеточная линия способна размножаться только в присутствии определенного цитокина, например ИЛ-2 (линия CTLL-2) или ИЛ-6 (D6C8). Интенсивность пролиферации клеток линии в присутствии разных разведении исследуемого образца сравнивают с интенсивностью пролиферации клеток той же линии в присутствии различных разведении рекомбинантного цитокина с известной активностью. Математическое сравнение полученных титровочных кривых позволяет вычислить содержание цитокина в исследуемом образце. В некоторых случаях (например, при определении содержания TNF) используют не цитокинзависимую, а цитокинчувствительную клеточную линию (L929). Клетки этой линии гибнут в присутствии TNF. Таким образом, титровочная кривая будет отражать процент погибших клеток, которых будет тем больше, чем выше концентрация TNF. 7.4.3. Оценка гиперчувствительности замедленного типа Для оценки гиперчувствительности замедленного типа (ГЗТ) используют реакцию торможения миграции лейкоцитов (РТМЛ), которая по своей сути является пробирочным аналогом клеточных иммунных реакций ГЗТ. В качестве веществ, модулирующих (тормозящих или активирующих) спонтанную миграционную активность лейкоцитов, применяют те же митогены, что и при РБТЛ. Кроме того, могут быть использованы тканевые и микробные антигены, стандартные аллергены. Последние применяют при диагностике саркоидоза, туберкулеза, альвеолитов и других заболеваний, протекающих с образованием эпителиоидно-клеточных гранулем (тканевое выражение ГЗТ). Анализируемые клетки помещают в стеклянные капилляры, которые инкубируют в чашках Петри с культуральной средой с добавлением или без добавления (спонтанный уровень миграции) митогена либо антигена. Сравнение интенсивности миграции в опытной и контрольной чашках позволяет вычислить индекс миграции. 7.5. ОЦЕНКА ФУНКЦИОНАЛbНОГО СОСТОЯНИЯ ФАГОЦИТОВ Наиболее доступным объектом для оценки функционального состояния фагоцитов ^являются нейтрофилы крови. Одни тесты предполагают изучение этих клеток в цельной крови, тогда как другие (исследование рецепторов нейтрофилов, определение активных форм кислорода — АФК) требуют получения обогащенной взвеси нейтрофилов. Оценку активности Fc- и C3-рецепторов нейтрофилов можно проводить с помощью реакции розеткообразования с зимозаном, нагруженным соответственно анти-Рс-антителами или комплементом при 4°С. Этот прием позволяет определить долю нейтрофилов, способных к адгезии объекта фагоцитоза. Саму фагоцитарную активность оценивают с помощью методов, позволяющих определить долю клеток, способных формировать фагосому (частицы латекса, эритроциты, тест-культуры стафилококка или E.coli). Известен прием постановки in vitro фагоцитарной реакции с нейтрофилами больного и выделенного у него. же штаммами микроорганизмов. Этот прием наиболее адекватен для реальной оценки антимикробной активности нейтрофилов данного больного. «Переваривающую» способность нейтрофилов и их антибактериальную активность можно определить непосредственно методом фагоцитоза с перевариванием тестируемого микроорганизма. В последние годы большое распространение получили методы оценки АФК в НСТ-тесте или с помощью хемолюминесценции. НСТ-тест используют значительно чаще, так как существуют экспресс-методы, проводимые с применением цельной крови. Суть реакции состоит в том, что нитросиний тетразолий (НСТ) окрашивается в синий цвет в присутствии АФК, а в отсутствие АФК остается бесцветным. Подсчет нейтрофилов с гранулами и включениями синего цвета позволяет определить долю нейтрофилов с АФК. Миграционную активность фагоцитов оценивают в тестах РТМЛ и направленного хемотаксиса. Те же приемы можно использовать и при исследовании альвеолярных макрофагов, полученных из бронхиальных смывов. 7.6. ОСНОВНЫЕ МЕТОДЫ ВЫЯВЛЕНИЯ АНТИТЕЛ И АНТИГЕНОВ Методы определения антител и антигенов основаны на различных способах регистрации их взаимодействия. С некоторой степенью условности их можно разделить на 3 группы: — методы, основанные на реакции преципитации; — методы, основанные на реакции агглютинации; — методы, основанные на использовании меченых антител или антигенов. Методы, основанные на реакции преципитации. За счет мультивалентности антител и антигена при их смешивании образуется так называемая решетка, которая может содержать антиген и антитела в разных пропорциях. На основе реакции преципитации разработаны различные количественные методы. Двойная диффузия в агаре по Оухтерлони. В лунки, вырезанные в агаровом или агарозном геле, помещают антиген и антисыворотку, которые диффундируют навстречу друг другу. В том участке геля, где их соотношения эквивалентны, образуется видимый преципитат. Если анализу подвергается смесь антигенов, то образуется несколько линий преципитации. Если соседние лунки содержат один и тот же антиген, то линии преципитации сливаются. Если антигены разные, то образуется либо так называемая шпора, что свидетельствует о частичном родстве антигенов, либо, в случае неродственных антигенов, линии преципитации будут пересекаться. Радиальная иммунодиффузия по Манчини. Этот метод отличается более высокой чувствительностью, чем предыдущий, так как антисыворотка входит в состав агара, в который из лунки диффундирует антиген. По мере удаления от лунки концентрация антигена постепенно падает, пока не становится эквивалентной концентрации антител в агаре. При этом образуется хорошо различимое кольцо преципитации. Чем выше концентрация внесенного антигена, тем больше диаметр кольца. Если в реакции используется несколько стандартов с известной концентрацией антигена, то путем сравнения или постройки калибровочной кривой можно проводить количественное определение антигена в образцах. Метод широко используется для определения концентрации иммуноглобулинов, C3-комплемента компонента, С-реактивного белка, а-фетопротеина, трансферрина. В Москве фирмой «Реафарм» выпускаются стационарные иммунодиффузионные планшеты для определения содержания иммуноглобулинов различных классов в крови или других биологических жидкостях. В табл. 11—13 приведены нормы показателей для этого метода. Таблица 11. Концентрация иммуноглобулинов (г/л) взрослого человека в сыворотке крови в норме («Реафарм»)
Таблица 12. Концентрация иммуноглобулинов (г/л) в различных биологических жидкостях в норме («Реафарм»)
Таблица 13. Концентрация иммуноглобулинов (г/л) в сыворотке крови детей в возрасте до 14 лет («Реафарм»)
Иммуноэлектрофорез. Иммуноэлектрофорез представляет собой сочетание электрофореза с иммунопреципитацией. Существуют различные варианты иммуноэлектрофореза. Если электрофоретической разгонке подвергают антиген, то после снятия напряжения вдоль направления движения антигена в электрическом поле в геле вырезают канавку, в которую заливают антисыворотку. С помощью данного метода путем анализа образовавшейся дуги преципитации в клинической иммунологии полуколичественно определяют концентрацию иммуноглобулинов различных классов и идентифицируют миеломные белки. Для определения антигенов, мигрирующих в сторону положительно заряженного электрода, может применяться встречный Иммуноэлектрофорез. Этот метод высокочувствителен и занимает относительно мало времени. Его используют для идентификации антигенов вирусного гепатита В, антител к ДНК при СКВ, антител к Aspergillus при бронхолегочном аспергиллезе, антител к N. Meningitidis. Для количественного определения концентрации некоторых белков (альбумина, трансферрина, церулоплазмина) применяют ракетный Иммуноэлектрофорез. При этом препарат, содержащий антиген, вносят в различных разведениях в серию последовательных лунок в геле, содержащем антисыворотку. После электрофоретической разгонки образуются дуги преципитации, напоминающие по своей форме ракету. С уменьшением концентрации антигена будет соответственно уменьшаться и длина дуг. Для разделения сложной смеси антигенов используют двухмерный (перекрестный) электрофорез. Метод включает два этапа. На первом этапе белки диффундируют под влиянием электрического поля в агарозном геле, содержащем антитела. На втором этапе пластину поворачивают на 90° и подвергают повторной разгонке в направлении, перпендикулярном первому. Таким образом удается количественно охарактеризовать каждый из антигенов смеси. Этот метод, в частности, применяют для оценки степени конверсии C3 в инактивированную форму C3с в сыворотке крови больных СКВ или синовиальной жидкости больных ревматоидным артритом. Методы, основанные на реакции агглютинации. Взаимодействие антител с клетками или другими крупными частицами приводит к склеиванию (агглютинации) в хорошо различимые агломераты. Прямая агглютинация чаще используется для определения серотипов бактерий или для определения групп крови. Применяется также метод непрямой (пассивной) агглютинации, когда на основе эритроцитов готовят диагностикум. С этой целью, как правило, используют эритроциты, нагруженные антигеном после модификации их поверхности танином или хлорным хромом. Существуют и другие методы связывания поверхности эритроцитов с антигеном. Реакцию обычно проводят в пластиковых планшетах, требующих сравнительно небольших количеств реагентов. Реакцию гемагглютинации часто используют для определения в сыворотке крови титров противомикробных антител и различных аутоантител. Методы, основанные на использовании меченых реагентов. В настоящее время разработано много методов, предусматривающих применение меченых антител и антигенов. Чаще с этой целью используют радиоактивную или ферментную метку. Радиоиммунологические методы. В качестве метки чаще применяют радионуклиды йода (131I или 125I). Для определения антигенов обычно используют классический радиоиммунологический анализ (РИА). Метод основан на уменьшении связывания антителами радиоактивно меченного антигена за счет добавления немеченого антигена. Содержание последнего определяют по степени уменьшения такого связывания. Метод позволяет выявлять очень низкие концентрации антигена (до 10—12 г/мл). Метод часто используют для определения антигенов вируса гепатита, а также таких низкомолекулярных белков, как, например, гормоны. Применяют также так называемые твердофазные методы. Для определения антител антиген сорбируют на пластике (обычно в пробирках или лунках микропанели), затем, после связывания с антителами, избыток последних удаляют и добавляют радиоактивно меченные антииммуноглобулины, полученные от животного другого вида. Этот метод весьма эффективен при диагностике аллергии. Аллерген, иммобилизованный на сорбенте, инкубируют с сывороткой крови больного, после чего добавляют радиоактивно меченные анти-IgЕ-антитела. Метод иммунного окрашивания после переноса на нитроцеллюлозные мембраны (иммуноблоттинг по Вестерну). Этот метод применяется для количественного определения белков и гликопротеинов, которые после электрофоретического разделения в полиакриламидном геле переносят на микропористую нитроцеллюлозную мембрану. Неспецифически связанные с мембраной антигены обрабатывают моноклональными антителами, связывание которых проявляют с помощью радиоактивно меченных анти-Ig-антител. Визуализацию реакции осуществляют с помощью радиоавтографических отпечатков. Иммуноферментные методы. Иммуноферментные методы в силу своей безопасности и высокой чувствительности постепенно вытесняют радиоиммунологические методы. Кроме того, реагенты, к которым присоединен фермент, обычно весьма стабильны и допускают более длительное хранение (радиоактивную метку приходится возобновлять из-за распада радионуклида). Чаще используют пероксидазу и фосфатазу, которые при добавлении к реагирующим компонентам соответствующего субстрата образуют окрашенные продукты. В случае определения антител антигены иммобилизуют на поверхности лунок пластиковых панелей. К ним добавляют исследуемую сыворотку. Связывание антител с антигеном определяют на втором этапе, инкубируя образовавшийся комплекс с меченными ферментом анти-Ig-антителами (так называ емые вторые антитела). Далее, после промывки, добавляют раствор субстрата, который, вступая в реакцию с ферментом, дает окрашивание. Интенсивность окрашивания будет зависеть от количества ферментной метки (чем больше свяжется меченых антител, тем ярче окрашивание). Результаты учитывают фотометрически, В настоящее время выпускается большое количество разнообразных иммуноферментных диагностических наборов как для определения антител в сыворотке или других биологических жидкостях, так и для определения антигенов. В качестве последних могут выступать возбудители различных заболеваний (микробы, вирусы), а также различные белки, определение содержания которых в крови или секретах представляет диагностический интерес (аутоантитела, факторы неспецифической защиты, гормоны, цитокины, белки острой фазы и др.). 7.7. ОПРЕДЕЛЕНИЕ КОМПЛЕМЕНТА В клинической практике невозможно обходиться без определения содержания комплемента и его компонентов в сыворотке крови. Это касается как вариантов патологии со сниженной антивностью комплемента, так и случаев повышения его активности. Таблица 14. Заболевания, для которых характерно изменение содержания комплемента
Таблица 15. Возможные причины изменения некоторых показателей иммунограммы по Б. М. Пухлику (1992)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
