УЧЕБНИК Клиническая иммунология. Соколов Е.И. 1998. УЧЕБНИК Клиническая иммунология. Соколов Е.И. Содержание 1 сокращения, часто встречающиеся в тексте 2
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
|
ГЛАВА 4 РЕГУЛЯЦИЯ ИММУННОГО ОТВЕТА 4.1. МЕХАНИЗМЫ ОГРАНИЧЕНИЯ ИММУННОГО ОТВЕТА Система регуляции деятельности иммунной системы должна быть достаточно надежной, так как в противном случае высока вероятность развития неконтролируемой иммунной реакции, которая может привести к фатальным последствиям. О важности такого контроля косвенно свидетельствует тот факт, что в организме существует множество механизмов, ограничивающих иммунный ответ. Контроль со стороны антител по типу обратной связи. Одним из наиболее эффективных механизмов, ограничивающих синтез антител, является механизм отрицательной обратной связи, в котором продукт иммунной реакции (антитела) одновременно выступает в роли ее ингибитора. При этом речь идет не о простом снижении содержания антигена за счет его связывания антителами, поскольку целые молекулы иммуноглобулинов тормозят иммунный ответ более эффективно, чем F(ab')2-фрагменты. Полагают, что механизм такого торможения связан с образованием перекрестных связей между антигеном, молекулой IgG и Fc-рецептором В-лимфоцита. Следует отметить, что тормозящим действием обладают лишь IgG, тогда как IgM усиливают иммунный ответ. Т-супрессоры. С помощью Т-супрессоров осуществляется регуляция различных форм гуморального и клеточного иммунитета, в том числе ГЗТ, а также пролиферация ЦТЛ, Т-хелперов и В-клеток. Клетки-супрессоры могут обладать антигенной специфичностью, т. е. подавлять иммунный ответ только на определенный антиген, а могут быть и антигеннеспецифическими. Активация антигенспецифических Т-супрессоров осуществляется с помощью так называемых индукторов Т-супрессоров, имеющих такой же фенотип, как и Т-хелперы, — CD4+. Индукторы Т-супрессоров активируются при контакте с антигеном на поверхности антигенпрезентирующих клеток. Собственно механизм супрессии осуществляется с помощью растворимых факторов, способных подавлять активность как Т-хелперов, так и В-клеток или ЦТЛ. Т-супрессоры человека относятся к субпопуляции CD8+. Антигенспецифические супрессоры способны активировать антигеннеспецифические супрессоры. 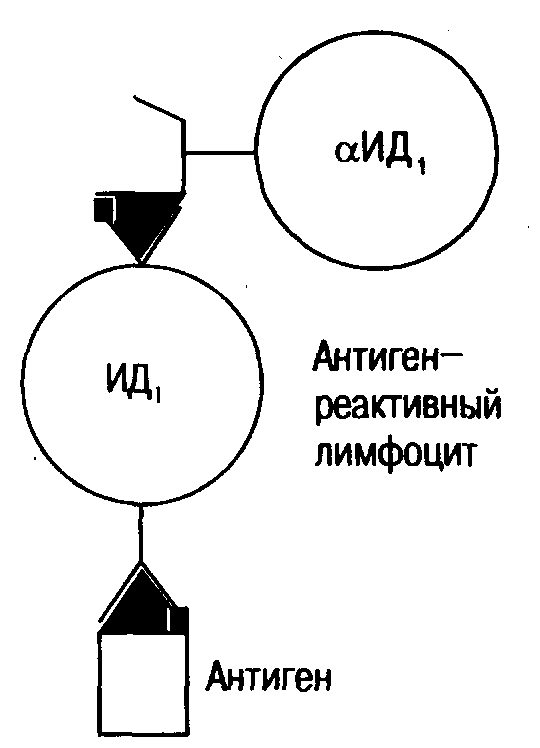 Рис. 10. Один из элементов идиотипической сети. Антигенные рецепторы одного лимфоцита распознают идиотип (ИД) рецептора другого лимфоцита. Антиидиотипические рецепторы (антитела) могут содержать «внутренний образ» антигена. Такие антиидиотипические антитела при определенных условиях могут замещать антиген. Несмотря на достаточно многочисленные исследования, показавшие, что клетки с фенотипом CD8+ могут подавлять продукцию антител посредством секреции антигенспецифического секреторного фактора, все попытки выделить устойчивую линию Т-супрессоров, а также получить биохимические и молекулярно-биологические характеристики супрессорного фактора оказались безуспешными. В связи с этим существование специальной субпопуляции Т-супрессоров сомнительно. Идиотипические сетевые взаимодействия. Гипервариабельные районы Н- и L-цепей молекулы иммуноглобулина включают участки, которые сами могут играть роль антигенных детерминант. Эти индивидуальные, характерные для антител определенной специфичности конфигурации, которые могут распознаваться соответствующими рецепторами Т- и В-лимфоцитов или антителами, получили название идиотипических детерминант. Автор гипотезы сетевого взаимодействия лауреат Нобелевской премии 1984 г. N. Jerne предположил, что лимфоциты, способные распознавать огромное число разнообразных чужеродных антигенных детерминант, должны распознавать и идиотипические детерминанты самих лимфоцитарных рецепторов. В соответствии с этим постулируется существование сетевого взаимодействия между лимфоцитами типа идиотип — антиидиотип (рис. 10). Попадание в организм чужеродного антигена неизбежно должно нарушить равновесие сетевых идиотипических взаимодействий, а стремление системы восстановить утраченное равновесие будет естественно ограничивать иммунный ответ. Антиидиотипические антитела содержат внутренний образ того антигена, к которому специфичны первые антитела. Это можно пояснить на следующем примере. Моноклональные антитела, полученные против антагониста ацетилхолина BISQ, способны стимулировать ацетилхолиновые рецепторы, выполняя в этом взаимодействии функцию ацетилхолина. Эти свойства антиидиотипических антител могут быть использованы при создании вакцинных препаратов нового поколения. 4.2. МЕХАНИЗМЫ НЕСПЕЦИФИЧЕСКОЙ РЕГУЛЯЦИИ ЗА СЧЕТ СИСТЕМЫ ЦИТОКИНОВ Классификация и общие свойства цитокинов. Цитокинами принято называть обширное семейство биологически активных пептидов, обладающих гормоноподобным действием, обеспечивающих взаимодействие клеток иммунной, кроветворной, нервной и эндокринной систем. Все цитокины объединяются следующими общими свойствами:
В зависимости от того, какие клетки преимущественно синтезируют данный цитокин, различают интерлейкины, монокины и лимфокины. Все 4 обозначения могут быть синонимами, причем термин «цитокин» играет роль объединяющего. В настоящее время 16 интерлейкинов имеют цифровые обозначения (ИЛ-1 — ИЛ-16), остальные цитокины буквенные: CSF (колониестимулирующие факторы), OSM (онкостатин М), LTF (фактор, ингибирующий лейкозные клетки), NGF (фактор роста нервов), CNTF (цилиарный нейротрофический фактор), TNF (фактор некроза опухолей). Свойствами цитокинов обладают также интерфероны. Действие цитокинов тесно связано с физиологическими и патофизиологическими реакциями организма. При этом происходит модуляция как локальных, так и системных механизмов защиты. Одной из важнейших функций системы цитокинов является обеспечение согласованного действия иммунной, эндокринной и нервной системы в ответ на стресс. 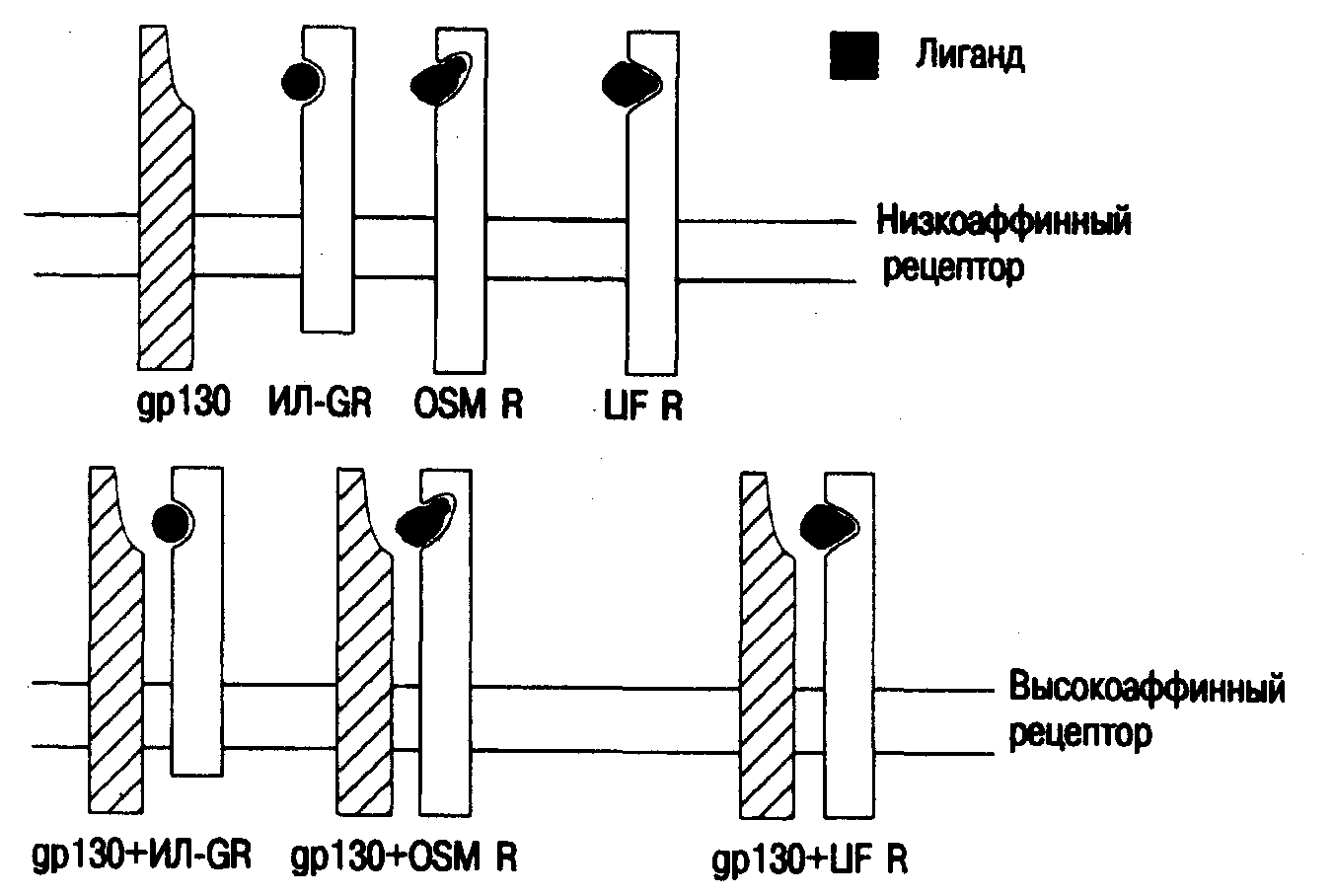 Рис. 11. Участие белка gp130 в формировании высокоаффинных рецепторов для цитокинов. Механизмы действия цитокинов. Влияние цитокина осуществляется путем его взаимодействия со специфическим мембранным рецептором клетки-мишени. В предыдущем разделе отмечалось плейотропное действие цитокинов, которое объясняется наличием специфических рецепторов на поверхности клеток различного гистогенеза. В большинстве случаев рецепторы для цитокинов представлены одной, двумя или тремя пептидными или гликопротеидными цепями, встроенными в клеточную мембрану. При этом цитокин взаимодействует с внешней, экстрацеллюлярной, частью рецептора. Сигнал о такого рода взаимодействии передается внутрь клетки интрацеллюлярной частью рецептора, которая обладает ферментативной активностью. Эффективность действия рецептора зависит от его аффинности, т. е. от того, какое минимальное келичество лиганда необходимо для образования прочного комплекса и как следствие для передачи специфического сигнала внутрь клетки. Как правило, аффинность зависит от числа белковых цепей, входящих в состав рецептора. При этом вторая цепь может быть общей у ряда рецепторов с разной специфичностью. Так, белок gp130 присутствует в качестве дополнительной цепи в рецепторах для ИЛ-6, OSM и LIF (рис. 11). В рецепторах для ИЛ-3, ИЛ-5 и GM-CSF роль дополнительной цепи выполняет белок КН-97. С этой особенностью строения большинства цитокиновых рецепторов связана, по-видимому, так называемая избыточность действия, когда разные цитокины влияют сходным образом на одну и ту же клеточную мишень (табл. 5). Таблица 5. Сравнение некоторых биологических функций цитокинов, использующих белок gpl30 для передачи сигнала внутрь клетки
Основные свойства некоторых цитокинов. ИЛ-1. Этот интерлейкин могут синтезировать различные клетки соединительной ткани, как связанные с системой кроветворения, так и не имеющие к ней никакого отношения. ИЛ-1 существует в виде двух полипептидов ИЛ-l и ИЛ-1, синтез которых кодируется различными генами. Обе эти формы образуются из соответствующих молекул-предшественников, имеющих одинаковую молекулярную массу (31 000). Предшественник ИЛ-l (про-ИЛ-l) биологически активен и способен соединяться с рецептором в форме димера. ИЛ-1 приобретает способность связываться с рецептором для ИЛ-1 только после ферментативного расщепления, в результате которого образуется конечный продукт с молекулярной массой 17 500. Этот процесс катализируется определенным ферментом — ИЛ-1-конвертирующим энзимом (ICE). Преобладающей формой ИЛ-1 является ИЛ-1 (количество соответствующей мРНК, обнаруживаемое в активированных клетках, в 10—50 раз превышает количество мРНК для ИЛ-l). Описано два вида рецептора для ИЛ-1 (ИЛ-1Р). ИЛ-1Р с молекулярной массой 80000 (рецептор I типа) выявляется на Т-лимфоцитах и фибробластах. ИЛ-1Р с молекулярной массой 68 000 (рецептор II типа) характерен для нейтрофилов, моноцитов, клеток костного мозга и В-лимфоцитов (интактных и трансформированных вирусом Эпштейна — Барр). Оба рецептора, принадлежащих к суперсемейству иммуноглобулинов, хотя и кодируются различными генами, имеют идентичную ИЛ-1-связывающую область. Биологические свойства ИЛ-1 ярко демонстрируют его полифункциональность. ИЛ-1 играет одну из центральных ролей в воспалительной реакции, в ответе на бактериальную инфекцию и тканевые повреждения, вызванные ультрафиолетовым излучением. ИЛ-1 проявляет свойства нейроэндокринного гормона, стимулируя продукцию АКТГ, простагландинов и являясь митогеном для астроцитов. ИЛ-1 стимулирует продукцию ИЛ-2 Т-лимфоцитами, а также повышает экспрессию рецептора для ИЛ-2. ИЛ-1 усиливает пролиферацию В-лимфоцитов, секрецию антител и экспрессию мембранного иммуноглобулинового рецептора. Есть данные, указывающие на участие ИЛ-1 в регенерации печени. Кроме того, ИЛ-1 стимулирует секрецию гепатоцитами сывороточных амилоидов А и Р, С-реактивного белка, гаптоглобина, a, -антитрипсина и церулоплазмина. ИЛ-1 участвует в регуляции температуры тела, а повышенная его продукция приводит к развитию лихорадки. Известны факторы, снижающие биологическую активность ИЛ-1. К ним прежде всего относятся глюкокортикоиды и простагландины. Из экзогенных факторов следует указать на циклоспорин А. В сыворотке крови лиц, которым был введен эндотоксин, в моче лихорадящих больных, а также в культуральной жидкости моноцитов, активированных in vitro, может быть обнаружен полипептид, специфически снижающий активность ИЛ-1. Из мочи больных моноцитарным лейкозом выделен фактор с молекулярной массой 23 000, идентифицированный как антагонист ИЛ-1Р. ИЛ-1Р II типа могут обнаруживаться в растворимой форме в виде мономера. Такой растворимый ИЛ-IP может связывать ИЛ-1, нейтрализуя его биологическую активность. 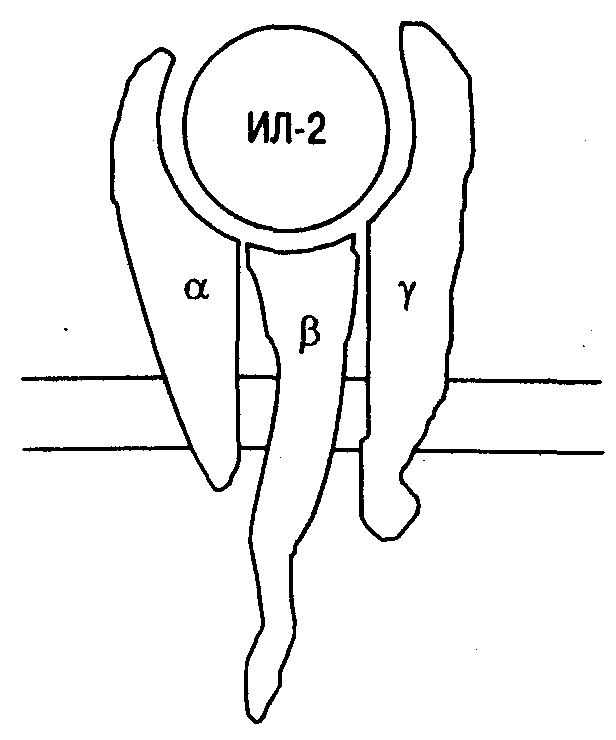 Рис. 12. Строение высокоаффинного рецептора для ИЛ-2. Для проведения сигнала требуется гетеродимеризация цитоплазматических доменов - и -цепей. ИЛ-2. Этот цитокин с молекулярной массой 15 000 (25 000 у мышей) также играет исключительно важную роль в реализации механизмов иммунного ответа. Как уже отмечалось, продуцентами ИЛ-2 являются Th1 -клетки. Помимо участия ИЛ-2 в дифференцировке и пролиферации Т-лимфоцитов, этот лимфокин принимает непосредственное участие в реализации механизмов противоопухолевой защиты. Так, ИЛ-2 повышает литическую активность NK-клеток, а также индуцирует клетки системы ЛАК (лимфокинактивированные киллеры). Кроме того, ИЛ-2 индуцирует пролиферацию ЦТЛ. Под действием ИЛ-2 усиливается секреция ИНФ Т-лимфоцитами. Рецептор для ИЛ-2 (ИЛ-2Р) состоит из трех полипептидных цепей, которые могут быть экспрессированы как вместе, так и по отдельности (рис. 12). В зависимости от того, из скольких цепей будет составлен рецептор, изменяется его аффинность. Так, при экспрессии только одной -цепи (молекулярная масса 55 000) рецептор обладает наиболее низкой аффинностью с константой диссоциации (Кd) около 10 нМ. Такой рецептор, обозначаемый иногда как ТАС-антиген, имеет очень небольшую цитоплазматическую часть и после связывания ИЛ-2 не способен проводить сигнал внутрь клетки. При изолированной экспрессии -цепи (молекулярная масса 75 000) формируется рецептор средней аффинности (Кd около 1 нМ). Такой рецептор при наличии достаточно высоких концентраций ИЛ-2 способен проводить сигнал. Есть основания полагать, что р-цепь экспрессируется вместе с -цепью (молекулярная масса 64 000), так как для проведения сигнала требуется гетеродимеризация цитоплазматических доменов - и -цепей. При совместной экспрессии всех трех цепей формируется рецептор высокой аффинности (Кd около 10 пкМ). Функция ИЛ-2Р может быть заблокирована с помощью фармакологических препаратов. Так, показано, что циклоспорин А подавляет синтез мРНК для а-цепи ИЛ-2Р. Есть данные, указывающие на то, что нецитотоксические дозы алкилирующих препаратов способны избирательно блокировать р-цепь ИЛ-2Р. ИЛ-3. Этот белок относится к семейству гемопоэтических ростовых факторов (молекулярная масса 15 000 — 28 000), является колониестимулирующим фактором гранулоцитов-макрофагов. ИЛ-3 вместе с эритропоэтином поддерживает рост и дифференцировку клеток эритроидного ростка. В то же время ИЛ-3 способен регулировать раннюю стадию дифференцировки В-лимфоцитов, поддерживает рост пре-В-клеток, а также усиливает секрецию IgG. ИЛ-4. Этот лимфокин (молекулярная масса 15000—20000) продуцируется Т-клетками (Th2) и является фактором дифференцировки для Т- и В-лимфоцитов. Кроме того, ИЛ-4 служит кофактором пролиферации покоящихся В-лимфоцитов, а также индуцирует в этих клетках синтез IgE и IgG.,. Известна способность ИЛ-4 генерировать активность ЛАК и усиливать противоопухолевую активность макрофагов. ИЛ-5. Этот димерный белок с молекулярной массой 50 000—60 000 продуцируется Т-клетками (Th2). ИЛ-5 усиливает пролиферацию активированных В-лимфоцитов, а также экспрессию на них рецептора для ИЛ-2 и синтез IgA. В нестимулированных В-клетках ИЛ-5 индуцирует секрецию IgM и IgG. ИЛ-5 является фактором дифференцировки эозинофилов, усиливает их хемотаксис. ИЛ-6. Этот мономер с молекулярной массой 19 000— 34 000 является фактором дифференцировки В-клеток, способствуя созреванию В-лимфоцитов в антителопродуцирующие клетки. ИЛ-6 индуцирует синтез белков острой фазы, в связи с чем, как и ИЛ-1, и TNF, может быть отнесен к цитокинам воспаления. Фактор некроза опухолей (TNF). Этот фактор был впервые получен в результате введения мышам бактериальных эндотоксинов. В сыворотке крови было обнаружено вещество, обладающее цитотоксической активностью по отношению к опухолевым клеткам. TNF представляет собой полипептид с молекулярной массой около 17 000. TNF продуцируют клетки моноцитарно-макрофагальной системы, которые под воздействием бактериальных эндотоксинов активируются и начинают синтезировать TNF, ИЛ-1, ИЛ-6 и вещества прокоагулянтного действия. TNF является мощным модификатором воспалительной и иммунной реакции. Он способен тормозить клеточную пролиферацию, дифференцировку и функции клеток почти всех типов, служит медиатором цитотоксичности. В результате высвобождения TNF повышается проницаемость капилляров, повреждается эндотелий сосудов, возникает внутрисосудистый тромбоз. В настоящее время признано, что TNF играет ведущую роль в патогенезе септического шока. Интерфероны. Эти белки обладают противовирусной и иммуномодулирующей активностью. В зависимости от происхождения и соответственно строения молекулы интерферона (ИФН) человека делятся на 3 типа: ИФН, продуцентами которого преимущественно являются макрофаги и В-клетки, ИФН, продуцируемый фибробластами, и ИФН, который синтезируют главным образом активированные Т-хелперы, относящиеся к субпопуляции Th1. Продукция ИФН Т-клетками происходит в результате стимуляции последних Т-клеточными митогенами, антителами против CD3, специфическими вирусными антигенами, а также аллоантигенами МНС. ИФН «придает» клеткам непермиссивность для репликации вируса, проникшего в них путем непосредственного межклеточного транспорта. Кроме того, ИФН оказывает необратимое цитотоксическое действие на трансформированные клетки, тогда как его цитостатическое влияние на нормальные клетки обратимо. ИФН усиливает цитотоксические реакции, опосредованные Т-лимфоцитами, К- и NK-клетками. Одновременно ИФН селективно повышает резистентность нормальных клеток к цитопатическим эффектам NK-клеток. За счет ИФН возможна индукция цитотоксичности у нормальных макрофагов. Активность ИФН в 10—300 раз выше, чем активность ИФН и ИФН. ИЛ-10. Этот лимфокин (молекулярная масса 17000—21000), продуцируемый Т-клетками (Th2), может рассматриваться как антагонист ряда цитокинов. Так, ИЛ-10 подавляет продукцию ИФН Th1-клетками. Кроме того, он тормозит пролиферативный ответ Т-клеток на антигены и митогены, а также подавляет секрецию активированными моноцитами ИЛ-1р, TNF и ИЛ-6. В то же время ИЛ-10 стимулирует секрецию иммуноглобулинов В-клетками. ИЛ-10 предотвращает апоптоз ИЛ-2 зависимых ЦТЛ, лишенных ИЛ-2. ИЛ-12 человека состоит из двух субъединиц с молекулярной массой 40 000 и 35 000, удерживаемых дисульфидной связью. Субъединица р40 гомологична рецептору для ИЛ-6, а субъединица р35 отдаленно напоминает ИЛ-6 и гранулоцитарный колониестимулирующий фактор. ИЛ-12 повышает литическую активность клеток системы ЛАК, а также специфическую цитотоксичность ЦТЛ. ИЛ-12 действует как ростовой фактор при активации Т- и NK-клеток. При этом он действует в качестве индуктора секреции ИФН и ингибитора синтеза IgE индуцированного ИЛ-4. 4.3. РЕГУЛЯТОРНЫЕ ИММУНОНЕЙРОЭНДОКРИННЫЕ СЕТИ Способность клеток лимфоидных органов продуцировать антитела при отсутствии каких-либо нейроэндокринных регуляторных сигналов (см. главу 1) вовсе не свидетельствует о том, что иммунная система функционирует вне интеграции с другими физиологическими системами. В настоящее время накоплена масса доказательств взаимодействия иммунной и нейроэндокринной систем. На клетках иммунной системы существуют рецепторы к таким гормонам и биологически активным веществам, как кортикостероиды, инсулин, гормон роста, тестостерон, эстрадиол, -адренергические агенты, ацетилхолин, эндорфины, энкефалины и др. Известно, что интерлейкины в центральной нервной системе могут выполнять функцию нейромедиаторов. Это хорошо показано в отношении ИЛ-1 и, по-видимому, справедливо и в отношении ИЛ-2, ИЛ-3 и ИЛ-6. Так, ИЛ-2 не только продуцируется клетками нервной ткани, но и влияет на пролиферацию и созревание элементов олигодендроглии. Принято считать, что глюкокортикоиды, андрогены, эстрогены и прогестерон подавляют иммунные реакции, а гормон роста, тироксин и инсулин их стимулируют. В то же время работами последних лет было показано, что направленность действия на иммунные реакции глюкокортикоидных гормонов может зависеть от концентрации последних: высокие концентрации оказывают иммунодепрессивное действие, а низкие — иммуностимулирующее. Усиление иммунного ответа может быть получено и в результате денервации селезенки, которая, так же как и другие органы иммунной системы, имеет автономную иннервацию и содержит чувствительные нейроны. Хорошо изучено влияние на состояние иммунной системы стресса и циркадных ритмов. Так, сильный стресс может индуцировать состояние транзиторного иммунодефицита. Такое состояние наблюдается у спортсменов-профессионалов на «пике» спортивной формы. При этом показаны снижение активности NК-клеток, уменьшение показателя CD4/CD8 и содержания IgA в слюне, снижение интенсивности пролиферативного ответа лимфоцитов на антигены и митогены и угнетение функций неспецифического иммунитета. 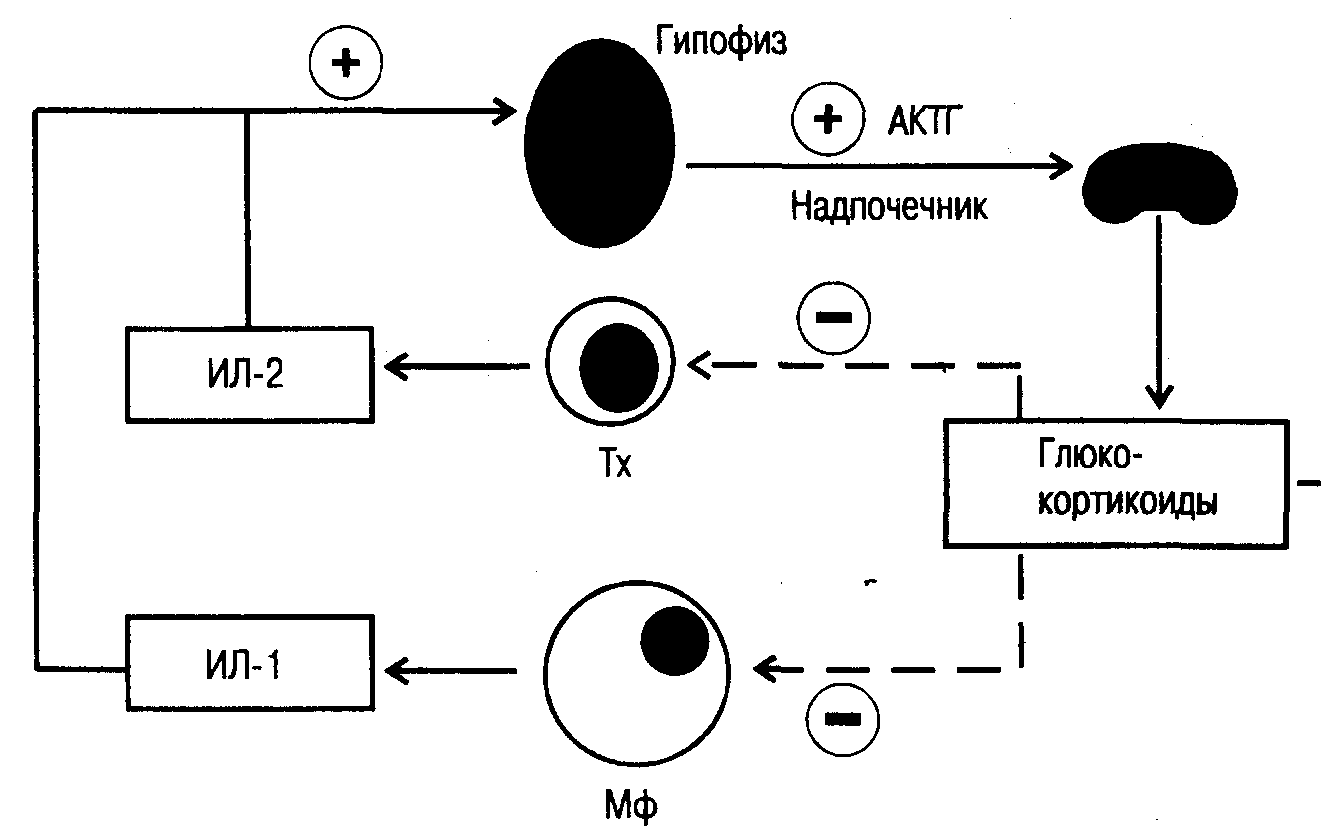 Рис. 13. Пример цепи сетевых взаимодействий между иммунной и нейроэндокринной системами. _ МФ — макрофаги, Тх — Т-хелперы. Аналогичные изменения можно наблюдать у животных в эксперименте при выраженных стрессовых нагрузках. В то же время стрессовые сигналы средней интенсивности (умеренные спортивные нагрузки) повышают резистентность организма к инфекции. Некоторые цепи сетевых взаимодействий между иммунной и нейроэндокринной системами уже достаточно хорошо изучены. Известно, например, что многие иммунные реакции находятся под контролем гипоталамо-гипофизарно-адреналовой системы. При этом показано увеличение синтеза глюкокортикоидов под действием ИЛ-1. В то же время глюкокортикоиды тормозят иммунный ответ, воздействуя, в частности, на продукцию ИЛ-1 и ИЛ-2 (рис. 13). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
