Содержание 14. А
 Скачать 3.72 Mb. Скачать 3.72 Mb.
|
ПредпосылкиПроект стал кульминацией нескольких лет работы поддержанной министерством энергетики США, в частности семинаров проводившихся в 1984-м[1] и 1986-м годах, и последовавшими действиями министерства энергетики[2]. Отчёт 1987 года чётко указывает: «Окончательной целью данного начинания является понимание человеческого генома» и «знание человеческого генома так же необходимо для прогресса медицины и других наук о здоровье, как знание анатомии было необходимо для достижения её нынешнего состояния». Поиски[3] технологий, подходящих для решения предложенной задачи, начинались ещё во второй половине 80-х годов. Начиная с 1988 года, главой Национального Центра Исследований Человеческого Генома в Национальной Организации Здравоохранения США (NIH) был Джеймс Уотсон. В 1992 его вынудили уйти в отставку, в основном из-за несогласия с позицией его руководителя, Бернадины Хили (англ.) по вопросам патентования генов (англ.). В апреле 1993 его заменил Френсис Коллинз (англ.), а в 1997 году название центра было изменено на Национальный Институт Исследований Человеческого Генома (англ.) (NHGRI). Трёхмиллиардный проект был формально запущен в 1990 году министерством энергетики США и национальным институтом здравоохранения, и ожидалось, что он продлится 15 лет. Помимо США, в международный консорциум вошли генетики Китая, Франции, Германии, Японии и Великобритании. В силу широкой международной кооперации и новых достижений в области геномики (особенно в секвенировании), а также значительных достижений в вычислительной технике, «черновик» генома был закончен в 2000 году (о чём было объявлено совместно тогдашним президентом США Биллом Клинтоном и британским премьер-министром Тони Блэром 26 июня 2000 года[4]). Продолжение секвенирования привело к объявлению в апреле 2003 года о почти полном завершении работы, на 2 года раньше, чем планировалось[5]. В мае 2006 года, была пройдена другая веха на пути к завершению проекта, когда в журнале «Nature» была опубликована последовательность последней хромосомы — Хромосомы 1[6]. 9.Организация генома человека. Международная организация по изучению генома человека (англ. The Human Genome Organisation, HUGO) — организация, созданная в рамках проекта проекта «Геном человека». HUGO была создана в 1989 году в качестве международной организации, прежде всего для стимулирования сотрудничества между генетиками во всем мире. С момента образования в HUGO вошли 220 учёных из разных стран, в том числе пять советских биологов. С самого начала работ по геномному проекту была выработана договорённость об открытости и доступности всей получаемой информации для его участников независимо от их вклада и государственной принадлежности. Все 23 хромосомы человека были поделены между странами-участницами. Советские учёные должны были исследовать структуру 3-й и 19-й хромосом. Однако, в связи с политической обстановкой в СССР и последующем его распадом финансирование этих работ было урезано, и реального участия в секвенировании отечественные учёные не принимали[1]. Программа геномных исследований в России была полностью перестроена и сконцентрирована на новой области — биоинформатике, занимающейся анализом и осмыслением уже полученных результатов. На сегодняшний день целями исследований HUGO являются[2]:
Развитие сотрудничества, распространение информации и координация деятельности в областях протеомики, биоинформатики, моделирования биологических систем, а также в области медицинских 10.Понятие о геномике и новый взгляд на эволюцию. Геномика, наука о структуре и функционировании генома. Cформировалась в конце 80-х гг. 20 в. Стремительное её развитие ( работы по физич. и генетич. картированию генома, секвенированию ДНК, анализу последовательностей нуклеотидов с помощью компъютерных технологий) было обусловлено исследованиями, проводимыми по международной программе “ Геном человека”. Геномика подразделяют на структурную, функциональную и сравнительную. Задачами структурной Г. являются изучение содержания и организации геномной информации – последовательности нуклеотидов всех молекул ДНК клетки (ядерной, митохондриальной, хлоропластной). Функциональная геномика. анализирует пути реализации информации от гена к признаку, начиная с этапа модификации нуклеотидов в молекуле ДНК (эпигеномика). Функциональную геномику часто отождествляют с транскриптомикой, исследующей структуры и количества всех матричных РНК (первичных продуктов функционирования генов) в данной клетке в данных условиях. Иногда в круг её интересов входит и познание последующих уровней реализации генетич. информации, названных (про аналогии с геномикой) протеомикой, метаболомикой (изучающей метаболиты) и целомикой (исследующей работу клеток). На уровне выше клеточного структурными и функциональными единицами являются организм, затем генетически целостная совокупность организмов, поддерживаемая в поколениях ( популяция), и, наконец, совокупность популяций разных видов, взаимодействующих в данном поколении и в их череде (биоценоз). Сравнительная геномика изучает варианты последовательностей нуклеотидов или их блоков в участках молекулы ДНК, общих по происхождению у разных организмов одного вида или у разных видов, в т. ч. отдалённых. Все эти направления Геномика вносят вклад в фундаментальную биологию, а также здравоохранение, с. х-во и биотехнологию. В медицине это ДНК-диагностика большинства инфекционных болезней человека, определение предрасположенности к наследственным болезням, генная терапия. Данные геномики используют в судебно-медицинской экспертизе при установлении отцовства, идентификации личности преступника и жертв катастроф, в т. ч. по останкам. На стыке геномики с этнографией, историей, археологией и лингвистикой возникла этногеномика, исследующая происхождение народов и их миграции по земному шару. В с. х-ве и биотехнологии понимание закономерностей функционирования геномов позволяет в короткие сроки получать растения, животных и микроорганизмы с заданными свойствами (напр., устойчивость к вредным воздействиям или эффективная продукция необходимых веществ, в т.ч. лекарственных). 11.Экспериментальные доказательства генетической роли нуклеиновых кислот. Известно, что бактерия Pneutnococcus pneumoniae имеет несколько форм. Вирулентность бактерии определяется наличием мукополисахаридной капсулы, расположенной па поверхности клетки. Эта капсула защищает бактерию от воздействий со стороны организма-хозяина. В результате, размножившиеся бактерии убивают зараженное животное. Бактерии этого штамма (S-штамм) образуют гладкие колонии. Авирулентные формы бактерий не имеют защитной капсулы и образуют шероховатые колонии (R-штамм). Микробиолог Фредерик Гриффитс в 1928 году инъецировал мышам живого пневмококка R-штамма вместе с S-штаммом, убитым высокой температурой (65°С). Спустя некоторое время ему удалось выделить из заражённых мышей живых пневмококков, обладающих капсулой. Таким образом, оказалось, что свойство убитого пневмококка - способность образовывать капсулу - перешло к живой бактерии, т.е. произошла трансформация. Поскольку признак наличия капсулы является наследственным, то следовало предположить, что какая-то часть наследственного вещества от бактерий штамма S перешла к клеткам штамма R. В 1944 году О.Т. Эвери, К.М. Маклеод и М. Маккарти показали, что такое же превращение типов пневмококков может происходить в пробирке, т.е. in vitro. Эти исследователи установили существование особой субстанции -"трансформирующего принципа", -экстракта из клеток штамма S, обогащенного ДНK. Как далее выяснилось, ДНK, выделенная из клеток S-штамма добавленная в культуру R-штамма, трансформировала часть клеток в S-форму, Клетки стойко передавали это свойство при дальнейшем размножении. Обработка "трансформирующего фактора" ДНК-азой, ферментом разрушающим ДНK, блокирована трансформацию. Эти данные впервые показали, что именно ДНК, а не белок, как полагали до тех пор, является наследственным материалом. 2. 1952г. Эксперимент Альфреда Херши и Марты Чейз. К 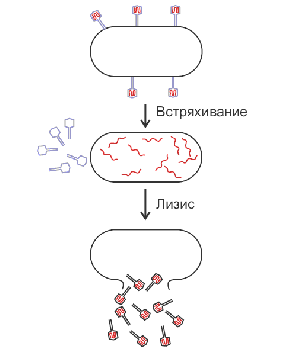 ак известно, фаг Т2 является вирусом, инфицирующим бактерию E. coli. фаговые частицы абсорбируются на наружной поверхности клетки, их материал проникает внутрь и примерно через 20 минут бактерия лизируется, освобождая большое количество фаговых частиц - потомков. В 1952 году Альфред Херши и Марта Чейз инфицировали бактерии фагами Т2, которые были мечены радиоактивными соединениями: ДНК - с помощью 32P. Белковая часть фага - 35S. После инфекции бактерии фагами, с помощью центрифугирования удалось выделить две фракции: пустые белковые оболочки фага и бактерии, инфицированных фаговой ДНК. Оказалось, что 80% метки 35S осталась в пустых фаговых оболочках, а 70% метки 32P - в инфицированных бактериях. Фаги-потомки получили только около 1% исходного белка, меченного 35S, однако они же обнаружили около 30% метки 32P. ак известно, фаг Т2 является вирусом, инфицирующим бактерию E. coli. фаговые частицы абсорбируются на наружной поверхности клетки, их материал проникает внутрь и примерно через 20 минут бактерия лизируется, освобождая большое количество фаговых частиц - потомков. В 1952 году Альфред Херши и Марта Чейз инфицировали бактерии фагами Т2, которые были мечены радиоактивными соединениями: ДНК - с помощью 32P. Белковая часть фага - 35S. После инфекции бактерии фагами, с помощью центрифугирования удалось выделить две фракции: пустые белковые оболочки фага и бактерии, инфицированных фаговой ДНК. Оказалось, что 80% метки 35S осталась в пустых фаговых оболочках, а 70% метки 32P - в инфицированных бактериях. Фаги-потомки получили только около 1% исходного белка, меченного 35S, однако они же обнаружили около 30% метки 32P.Результаты этого эксперимента прямо показали, что ДНК родительских фагов проникает в бактерии и затем становиться составляющей развившихся новых фагов частиц. 3. 1957г. Опыты Френкеля - Конрата Френкель-Конрат работал с вирусом табачной мозаики (ВТМ). В этом вирусе содержится РНК, а не ДНК. Было известно, что разные штаммы вируса вызывают разную картину поражения листьев табака. После смены белковой оболочки "переодетые" вирусы вызывали картину поражения, характерную для того штамма, чья РНК была покрыта чужим белком. Следовательно, не только ДНК, но и РНК может служить носителем генетической информации. На сегодняшний день существуют сотни тысяч доказательств генетической роли нуклеиновых кислот. Приведенные три являются классическими. 12.Химическая организация гена. Классификация генов по структуре и функциям. Структура генов Ген представляет собой последовательность нуклеотидов ДНК размером от нескольких сотен до миллиона пар нуклеотидов, в которых закодирована генетическая информация о первичной структуре белка (число и последовательность аминокислот). Для регулярного правильного считывания информации в гене должны присутствовать: кодон инициации, множество смысловых кодонов и кодон терминации. Три подряд расположенных нуклеотида представляют собой кодон, который и определяет, какая аминокислота будет располагаться в данной позиции в белке. Например, в молекуле ДНК последовательность оснований ТАС является кодоном для аминокислоты метионина, а последовательность ТТТ кодирует фенилаланин. В молекуле иРНК вместо тимина (Т) присутствует основание урацил (У). Таблица генетического кода во всех руководствах представлена именно символами иРНК. Из 64 возможных кодонов смысловыми являются 61, а три триплета — УАА, УАГ, УГА — не кодируют аминокислоты и поэтому были названы бессмысленными, однако на самом деле они представляют собой знаки терминации трансляции. Для прокариот характерна относительно простая структура генов. Так, структурный ген бактерии, фага или вируса, как правило, контролирует одну ферментативную реакцию. Специфичным для прокариот является оперонная система организации нескольких генов. Гены одного оперона (участка генетического материала, состоящего из 1, 2 и более сцепленных структурных генов, которые кодируют белки (ферменты), осуществляющие последовательные этапы биосинтеза какого-либо метаболита; в оперон эукариот входит, как правило, 1 структурный ген; оперон содержит регуляторные элементы) расположены в кольцевой хромосоме бактерии рядом и контролируют ферменты, осуществляющие последовательные или близкие реакции синтеза (лактозный, гистидиновый и др. опероны). Структура генов у бактеориофагов и вирусов в основном схожа с бактериями, но более усложнена и сопряжена с геномом хозяев. Например, у фагов и вирусов обнаружено перекрывание генов, а полная зависимость вирусов эукариот от метаболизма клетки-хозяина привела к появлению экзон-интронной структуры генов. Эукариотические гены, в отличие от бактериальных, имеют прерывистое мозаичное строение. Кодирующие последовательности (экзоны) перемежаются с некодирующими (интронами). Экзон [от англ. ex(divssi)on — выражение, выразительность] - участок гена, несущий информацию о первичной структуре белка. В гене экзоны разделены некодирующими участками — интронами. Интрон (от лат. inter — между) - участок гена, не несущий информацию о первичной структуре белка и расположенный между кодирующими участками — экзонами. В результате структурные гены эукариот имеют более длинную нуклеотидную последовательность, чем соответствующая зрелая иРНК, последовательность нуклеотидов в которой соответствует экзонам. В процессе транскрипции информация о гене списывается с ДНК на промежуточную иРНК, состоящую из экзонов и интронов. Затем специфические ферменты — рестриктазы — разрезают эту про-иРНК по границам экзон-интрон, после чего экзонные участки ферментативно соединяются вместе, образуя зрелую иРНК (так называемый сплайсинг). Количество интронов может варьировать в разных генах от нуля до многих десятков, а длина — от нескольких пар оснований до нескольких тысяч. Ген может кодировать различные РНК-продукты путем изменения инициирующих и терминирующих кодонов, а также альтернативного сплайсинга. Альтернативная экспрессия гена осуществляется и путем использования различных сочетаний экзонов в зрелой иРНК, причем полипептиды, синтезированные на таких иРНК, будут различаться как по количеству аминокислотных остатков, так и по их составу. Наряду со структурными и регуляторными генами обнаружены участки повторяющихся нуклеотидных последовательностей, функции которых изучены недостаточно, а также мигрирующие элементы (мобильные гены), способные перемещаться по геному. Найдены также так называемые псевдогены у эукариот, которые представляют собой копии известных генов, расположенные в других частях генома и лишенные интронов или инактивированные мутациями. 3. Классификация генов Накопленные знания о структуре, функциях, характере взаимодействия, экспрессии, мутабильности и других свойствах генов породили несколько вариантов классификации генов. По месту локализации генов в структурах клетки различают расположенные в хромосомах ядра ядерные гены и цитоплазматические гены, локализация которых связана с хлоропластами и митохондриями. По функциональному значению различают структурные гены, характеризующиеся уникальными последовательностями нуклеотидов, кодирующих свои белковые продукты, которые можно идентифицировать с помощью мутаций, нарушающих функцию белка, и регуляторные гены — последовательности нуклеотидов, не кодирующие специфические белки, а осуществляющие регуляцию действия гена (ингибирование, повышение активности и др.). По влиянию на физиологические процессы в клетке различают летальные, условно летальные, супервитальные гены, гены-мутаторы, гены-антимутаторы и др. Следует отметить, что любые биохимические и биологические процессы в организме находятся под генным контролем. Так, деление клеток (митоз, мейоз) контролируется несколькими десятками генов; группы генов осуществляют контроль восстановления генетических повреждений ДНК (репарация). Онкогены и гены — супрессоры опухолей участвуют в процессах нормального деления клеток. Индивидуальное развитие организма (онтогенез) контролируется многими сотнями генов. Мутации в генах приводят к измененному синтезу белковых продуктов и нарушению биохимических или физиологических процессов. Гомеозисные мутации у дрозофилы позволили открыть существование генов, нормальной функцией которых является выбор или поддержание определенного пути эмбрионального развития, по которому следуют клетки. Каждый путь развития характеризуется экспрессией определенного набора генов, действие которых приводит к появлению конечного результата: глаза, голова грудь, брюшко, крыло, ноги и т. д. Исследования генов комплекса bithorax дрозофилы американским генетиком Льюисом показали, что это гигантский кластер тесно сцепленных генов, функция которых необходима для нормальной сегментации груди (thorax) и брюшка (abdomen). Подобные гены получили название гомеобоксных. Гомеобоксные гены расположены в ДНК группами и проявляют свое действие строго последовательно. Такие гены обнаружены и у млекопитающих, и они имеют высокую гомологию (сходство). 4. Функции генов В процессе реализации наследственной информации, заключенной в гене, проявляется целый ряд его свойств. Определяя возможность развития отдельного качества, присущего данной клетке или организму, ген характеризуется дискретностью действия (от лат. discretus — разделенный, прерывистый), прерывностью (интроны и экзоны). Дискретность наследственного материала, предположение о которой высказал еще Г. Мендель, подразумевает делимость его на части, являющиеся элементарными единицами, - гены. В настоящее время ген рассматривают как единицу генетической функции. Он представляет собой минимальное количество наследственного материала, которое необходимо для синтеза тРНК, рРНК или полипептида с определенными свойствами. Ген несет ответственность за формирование и передачу по наследству отдельного признака или свойства клеток, организмов данного вида. Кроме того, изменение структуры гена, возникающее в разных его участках, в конечном итоге приводит к изменению соответствующего элементарного признака. Ввиду того что в гене заключается информация об аминокислотной последовательности определенного полипептида, его действие является специфичным. Однако в некоторых случаях одна и та же нуклеотидная последовательность может детерминировать синтез не одного, а нескольких полипептидов. Это наблюдается в случае альтернативного сплайсинга у эукариот и при перекрывании генов у фагов и прокариот. Очевидно, такую способность следует оценить как множественное, или плейотропное, действие гена (хотя традиционно под плейотропным действием гена принято понимать участие его продукта – полипептида – в разных биохимических процессах, имеющих отношение к формированию различных сложных признаков). Например, участие фермента в ускорении определенной реакции (см. рис.), которая является звеном нескольких биохимических процессов, делает зависимыми результаты этих процессов от нормального функционирования гена, кодирующего этот белок. Нарушение реакции A→B, катализируемой белком α, в результате мутации гена ведет к выключению последующих этапов формирования признаков D и E. Определяя возможность транскрибирования мРНК для синтеза конкретной полипептидной цепи, ген характеризуется дозированностью действия, т.е. количественной зависимостью результата его экспрессии от дозы соответствующего аллеля этого гена. Примером может служить зависимость степени нарушения транспортных свойств гемоглобина у человека при серповидно-клеточной анемии от дозы аллеля НЬS. Наличие в генотипе человека двойной дозы этого аллеля, приводящего к изменению структуры β-глобиновых цепей гемоглобина, сопровождается грубым нарушением формы эритроцитов и развитием клинически выраженной картины анемии вплоть до гибели. У носителей только одного аллеля НЬS при нормальном втором аллеле лишь незначительно изменяется форма эритроцитов и анемия не развивается, а организм характеризуется практически нормальной жизнеспособностью. 13.Генетический полиформизм и разнообразие геномов человека. Генетически полифомизм- это сосуществование в пределах популяции (См. Популяция) двух или нескольких различных наследственных форм, находящихся в динамическом равновесии в течение нескольких и даже многих поколений. Чаще всего Г. п. обусловливается либо варьирующими давлениями и векторами (направленностью) отбора в различных условиях (например, в разные сезоны), либо повышенной относительной жизнеспособностью гетерозигот. Один из видов Г. п. — сбалансированный Г. п. — характеризуется постоянным оптимальным соотношением полиморфных форм, отклонение от которого оказывается неблагоприятным для вида, и автоматически регулируется (устанавливается оптимальное соотношение форм). В состоянии сбалансированного Г. п. у человека и животных находится большинство генов. Различают несколько форм Г. п., анализ которых позволяет определять действие отбора в природных популяциях. 14.Новый взгляд на эволюцию Homo sapiens. Археологи сделали открытие, которое позволяет по-новому взглянуть на эволюцию предков современного человека. Как пишет журнал Science, доисторический человек освоил довольно сложный и трудоемкий процесс изготовления копий и ножей из камня, по крайней мере, на 50 тысяч лет раньше, чем предполагали ученые. Как свидетельствуют результаты исследований, наши далекие предки научились точить предметы под давлением не позднее 75 тысяч лет назад. Это мастерство позволяло им уже тогда выходить на охоту или сражаться с врагами, имея в своем арсенале довольно грозное и эффективное оружие. "Их наконечники были довольно тонкие, острые, узкие и могли намного лучше, чем ранее, убивать животных", - рассказывает один из авторов исследования Паола Вилла. Находки были обнаружены учеными, в частности, в пещере Бломбос, расположенной на юге территории современной ЮАР. Доисторический человек уже в эпоху среднего палеолита додумался, что для лучшей обработки кремневых материалов необходимо их нагревать, что позволяет легче придавать орудиям более совершенную форму. Кроме того, при этой технике наши предки в качестве точильного орудия использовали заранее обработанные каменные молотки, а позже и более мягкие деревянные и костяные отщепы, позволяющие более качественно обрабатывать на каменных наковальнях наконечники из кремния и кости. Сделанное открытие также позволяет предположить, что такой техникой заточки орудий владели и те представители Homo Sapiens, которые мигрировали из Африки 60 тысяч лет назад, сообщает ИТАР-ТАСС. 15.Биохимическая уникальность человека. Гены предрасположенности. Понятие "гены предрасположенности" в известной мере можно рассматривать как противовес существовавшему ранее представлению о том, что мутации генов, кодирующих синтез определенных белков (так называемых "структурных генов"), неминуемо приводят к тем или иным наследственным болезням.Однако по мере углубления наших знаний о структурно-функциональной организации генома человека появляется все больше данных, не укладывающихся в эту жесткую схему. Прежде всего оказалось,что далеко не всегда и не все мутации структурных генов напрямую связаны с возникновением той или иной наследственной патологии. Обнаружена большая группа наследственных болезней с поздней манифестацией, например нейродегенеративные, вызываемые особым типом так называемых динамических мутаций, эффект которых проявляется уже во взрослом состоянии. Причем в зависимости от характера мутаций их тяжесть и клиника могут меняться в широком диапазоне. Например, очень поздно манифестируют и подвержены значительным функциональным модификациям мутации пресинилиновых генов (PS1, PS2), ответственных за болезнь Альцгеймера (старческое слабоумие). Существенный вклад в клинический фенотип моногенных болезней вносят и различные трансдействующие мутации, приводящие к количественному и качественному сбою в работе индивидуальных генов. Сюда можно отнести и идентифицированные в последнее время весьма многочисленные и полиморфные по своим функциям гены-регуляторы, в частности гены факторов транскрипции. Сложность взаимоотношения генотип-фенотип нашла свое отражение в молекулярной гетерогенности наследственных болезней, cмысл которой сводится к тому, что фенотипические особенности проявления мутантных генов даже при моногенных болезнях зависят от многих факторов, в том числе от генов, мутации и полиморфизмы которых могут влиять на экспрессию главного гена7. При этом, однако, следует учитывать, что основной причиной болезни остаются мутации структурного гена, тогда как другие гены могут только усиливать и ослаблять патологический эффект его мутации. Следовательно, в случае моногенных болезней "гены предрасположенности" тождественны генам-модификаторам. Их тестирование важно для понимания взаимоотношения генотип-фенотип. Однако особую практическую ценность представляет непосредственно молекулярное тестирование самих структурных генов. Для некоторых моногенных наследственных заболеваний с поздней манифестацией уже сегодня реальна досимптоматическая диагностика. Помимо нейродегенеративных заболеваний и болезни Альцгеймера к их числу относят и рак молочной железы. По данным ВОЗ, это грозное онкологическое заболевание приводит к смерти до 12% женщин. В последние годы идентифицированы два гена (BRCA1 и BRCA2), мутации которых ответственны примерно за 5% случаев рака молочной железы. К сожалению, большие размеры этих генов и отсутствие мажорных (доминирующих по частоте) мутаций ограничивают их досимптоматическое тестирование. Но недавно в некоторых этнических группах (евреи-ашкенази) удалось выявить отдельные мажорные мутации, что позволило разработать быстрые способы их тестирования. 16.Организация генома митохондрий. Митохондриальные болезни. ДНК в митохондриях представлена циклическими молекулами, не образующими связь с гистонами, в этом отношении они напоминают бактериальные хромосомы. У человека митохондриальная ДНК содержит 16,5 тыс. н.п., она полностью расшифрована. Найдено, что митохондральная ДНК различных объектов очень однородна, отличие их заключается лишь в величине интронов и нетранскрибируемых участков. Все митохондриальные ДНК представлены множественными копиями, собранными в группы, кластеры. Так в одной митохондрии печени крысы может содержаться от 1 до 50 циклических молекул ДНК. Общее же количество митохондриальной ДНК на клетку составляет около одного процента. Синтез митохондриальных ДНК не связан с синтезом ДНК в ядре. Так же как и у бактерий митохондральная ДНК собрана в отдельную зону – нуклеоид, его размер составляет около 0, 4 мкм в диаметре. В длинных митохондриях может быть от 1 до 10 нуклеоидов. При делении длинной митохондрии от нее отделяется участок, содержащий нуклеоид (сходство с бинарным делением бактерий). Количество ДНК в отдельных нуклеоидах митохондрий может колебаться в 10 раз в зависимости от типа клеток. При слиянии митохондрий может происходить обмен их внутренними компонентами. рРНК и рибосомы митохондрий резко отличны от таковых в цитоплазме. Если в цитоплазме обнаруживаются 80s рибосомы, то рибосомы митохондрий растительных клеток принадлежат к 70s рибосомам (состоят из 30s и 50s субъединиц, содержат 16s и 23s РНК, характерные для прокариотических клеток), а в митохондриях клеток животных обнаружены более мелкие рибосомы (около 50s). В митоплазме на рибосомах идет синтез белков. Он прекращается, в отличие от синтеза на цитоплазматических рибосомах, при действии антибиотика хлорамфеникола, подавляющего синтез белка у бактерий. На митохондриальном геноме синтезируются и транспортные РНК, всего синтезируется 22 тРНК. Триплетный код митохондриальной синтетической системы отличен от такового, используемого в гиалоплазме. Несмотря на наличие казалось бы всех компонентов, необходимых для синтеза белков, небольшие молекулы митохондриальной ДНК не могут кодировать все митохондриальные белки, только лишь их небольшую часть. Так ДНК размером 15 тыс.н.п. может кодировать белки с суммарным молекулярным весом около 6х105. В это же время суммарный молекулярный вес белков частицы полного дыхательного ансамбля митохондрии достигает величины около 2х106. Интересны наблюдения за судьбой митохондрий в дрожжевых клетках. В аэробных условиях дрожжевые клетки имеют типичные митохондрии с четко выраженными кристами. При переносе клеток в анаэробные условия (например, при их пересеве или при перемещении в атмосферу азота) типичные митохондрии в их цитоплазме не обнаруживаются, и вместо них видны мелкие мембранные пузырьки. Оказалось, что в анаэробных условиях дрожжевые клетки не содержат полную дыхательную цепь (отсутствуют цитохромы b и a). При аэрации культуры наблюдается быстрая индукция биосинтеза дыхательных ферментов, резкое повышение потребления кислорода, а в цитоплазме появляются нормальные митохондрии. Расселение людей на Земле |
