Методички педфака на весенний семестр 2014. Структура и свойства белков. Методы выделения и очистки белков. Нарушения белкового состава сыворотки крови
 Скачать 1.9 Mb. Скачать 1.9 Mb.
|
|
Тема: Переваривание белков. Пути использования аминокислот в клетке. Нарушения переваривания белков. Цели занятия: Сформировать знания о процессе переваривания белков, характеристике протеолитических ферментов, работающих в желудке и тонком кишечнике, о механизме всасывания продуктов гидролиза белков, о пополнении пула аминокислот, о способах «мечения» старых белков, роли клеточных протеаз в их деградации, о путях использования аминокислот в клетке, и сформировать навыки использования полученных теоретических знаний в постановке диагноза заболеваний, в основе которых лежат нарушения переваривания белков. Хронометраж практического занятия: 1. Вводная беседа. Тестирование исходного уровня знаний— 15 мин. 2. Практическая часть 3.Собеседование по теме занятия 60 мин Просмотр и обсуждение видеофрагмента и анимации( Разбор конкретной ситуации (ситуационных задач) – 35 мин Лабораторная работа-30 мин. Контроль выполнения лабораторной работы — 15 мин. 4. Контроль усвоения темы — 15 мин. 5. Подведение итогов и задание к следующему занятию — 10 мин. Продолжительность занятия —4 часа (180 минут) Методическое и материально-техническое оснащение (таблицы, химическая посуда, биологический материал, видеофрагменты, анимации) Содержание темы: Переваривание белков. Характеристика протеолитических ферментов, работающих в желудке и тонком кишечнике. Всасывание продуктов гидролиза. Пул аминокислот в клетке. Пополнение пула аминокислот за счет эндогенного распада дефектных тканевых белков. Роль убиквитина и процессов гликозилирования . Внутриклеточные протеазы. Возможные пути использования аминокислот в клетке. Практикум: роль пепсина или трипсина в переваривании белков (есть трипсин как реактив, в аптеке можно купить пепсин уже с соляной кислотой). Приготовить раствор альбумина, сделать с ним биуретовую реакцию на белок, затем добавить пепсин и поместить в термостат после инкубации снова провести пробу на белок Базисные знания: Из курса биохимии – строение белка, пищевая ценность белков, растительные и животные белки – их роль для организма. Студент должен уметь: использовать полученные теоретические знания при постановке диагноза заболеваний, в основе которых лежат нарушения переваривания белков. Учебная карта занятия: Вводная беседа: Переваривание белков. Характеристика протеолитических ферментов, работающих в желудке и тонком кишечнике. Всасывание продуктов гидролиза. Пул аминокислот в клетке. Пополнение пула аминокислот за счет эндогенного распада дефектных тканевых белков. Роль убиквитина и процессов гликозилирования . Внутриклеточные протеазы. Возможные пути использования аминокислот в клетке. Тесты исходного уровня знаний : 1. ОБЕЗВРЕЖИВАНИЕ ПРОДУКТОВ ГНИЕНИЯ БЕЛКОВ ПРОТЕКАЕТ: 1. в печени и почках посредством микросомального окисления; 2. в печени посредством связывания с серной и глюкуроновой кислотами. 3. в печени посредством связывания с альбумином. 4. в крови, где они связываются с холестерином. Ответ: 2. 2. БАКТЕРИЦИДНЫМ ФАКТОРОМ ЖЕЛУДОЧНОГО СОКА ЯВЛЯЕТСЯ: 1. гастромукопротеид; 2. кислые соли; 3. соляная кислота; 4. серная кислота; Ответ: 3 3. ПРОЦЕССЫ ГНИЕНИЯ БЕЛКОВ В КИШЕЧНИКЕ ПРОТЕКАЮТ ПОД ВЛИЯНИЕМ: 1. протеолитических ферментов тонкого кишечника 2. ферментов микрофлоры тонкого кишечника. 3. ферментов микрофлоры попадающей в организм с пищей. 4. нормальной микрофлоры толстого кишечника. Ответ: 4 4. УКАЖИТЕ ВОЗМОЖНУЮ ПРИЧИНУ ЗАБРОСА ЖЕЛЧИ В ЖЕЛУДОК ПРИ АНАЦИДНОМ ГАСТРИТЕ: 1. открытость привратника вследствие его атрофии; 2. избыточная продукция желчи; 3. открытость привратника из-за отсутствия градиента рН между желудком и кишечником; 4. более мощная, чем в норме антиперистальтика; Ответ: 3 5. КАКОВ МЕХАНИЗМ АКТИВАЦИИ ТРИПСИНОГЕНА В ТРИПСИН? 1. активируется ионами кальция; 2. активируется путем воздействия на субъединицу фермента; 3.аллостерический механизм активации; 4. активируется по механизму ограниченного протеолиза. Ответ: 4 6. ПЕПСИН ЯВЛЯЕТСЯ ФЕРМЕНТОМ: 1. индивидуальной специфичности; 2. индивидуальной специфичности, расщепляющей связи аланин – тирозин; 3. групповой специфичности, расщепляющей связи фенилаланин – тирозин; 4. стереохимической специфичности; Ответ: 3 7. ФИЗИОЛОГИЧЕСКАЯ ПОТРЕБНОСТЬ В БЕЛКАХ У ВЗРОСЛЫХ ЛЮДЕЙ СОСТАВЛЯЕТ: 1. 100 –150 г/сут.; 2.50 –70 г/сут.; 3.30 – 40 г/ сут.; 4.400 –500 г/сут.. Ответ: 2 8. К ПРОДУКТАМ ГНИЕНИЯ БЕЛКОВ В КИШЕЧНИКЕ ОТНОСЯТСЯ СЛЕДУЮЩИЕ СОЕДИНЕНИЯ: 1.лизин; 2.орнитин; 3. кадаверин; 4.триптофан Ответ: 3 Теоретическая часть. Вопросы для собеседования 1.Переваривание белков. Характеристика протеолитических ферментов, работающих в желудке. Роль соляной кислоты в переваривании белков. 2. Характеристика протеолитических ферментов, работающих в тонком кишечнике. Схема активации протеолитических ферментов поджелудочной железы. 3.Всасывание продуктов гидролиза белка. 4. Гниение белков в кишечнике. Механизмы обезвреживания продуктов, образующихся при этом процессе. 5.Пул аминокислот в клетке. Пополнение пула аминокислот за счет эндогенного распада дефектных тканевых белков. 6.Роль убиквитина и процессов гликозилирования в «мечении» старых белков в клетке. Роль шаперонов. 7.Внутриклеточные протеазы. 8.Возможные пути использования аминокислот в клетке. Заполнить таблицу «Характеристика протеолитических ферментов желудочно-кишечного тракта»
Разбор ситуационных задач 1.У больного резко угнетена секреция желудочного сока. Что должен предпринять врач, чтобы усилить секрецию? (Введение ацедилпепсина или гистамина.Приналичии рака желудка секреция не усилится, но при ахилическом гастрите может быть получен положительный результат). 2.При обследовании грудного ребенка обнаружено, что рН желудочного сока 5,0. Имеет ли смысл попытка коррекции рН в более кислую сторону? 3.При приготовлении сыра для быстрого створаживания молока к нему добавляют очищенный желудочный сок телят. Почему? 4.При обследовании панкреатического сока обнаружено резкое снижение общей протеолитической активности. Укажите возможные причины данного явления. 5.При снижении секреторной функции желудка у больного с мочой выделяется повышенное количество индикана. Почему это происходит? 6.При составлении пищевого рациона было предложено блюдо из рыбы заменить горохом, т.к. содержание белка в них почти одинаково. Ваша точка зрения? Практическая часть (для лабораторного практикума). Практикум: роль пепсина или трипсина в переваривании белков (есть трипсин как реактив, в аптеке можно купить пепсин уже с соляной кислотой). Приготовить раствор альбумина, сделать с ним биуретовую реакцию на белок, затем добавить пепсин и поместить в термостат после инкубации снова провести пробу на белок Задание на следующее занятие в РАБОЧЕЙ ТЕТРАДИ ПО БИОХИМИИ. Практические навыки, которыми должен овладеть студент по теме занятиянавыки использования полученных теоретических знаний в постановке диагноза заболеваний, в основе которых лежат нарушения переваривания белков. Темы для реферативных сообщений Гниение белков в кишечнике. Механизмы обезвреживания продуктов, образующихся при этом процессе. Приложение Возрастные особенности переваривания белков в желудке . У детей грудного возраста в желудке находится фермент реннин (химозин) , вызывающий свёртывание молока. Основной белок молока - казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Белки успевают расщепиться под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НСl и пепсина. Защита клеток от действия протеаз Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что:
В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Однако начальные механизмы возникновения язвы ещё мало изучены. Г. Транспорт аминокислот в клетки Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь. Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Nа+-зависимых механизмов симпорта, подобно переносу глюкозы. Различная скорость проникновения аминокислот через мембраны клеток указывает на наличие транспортных систем, обеспечивающих перенос аминокислот как через внешнюю плазматическую мембрану, так и через внутриклеточные мембраны. В настоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует 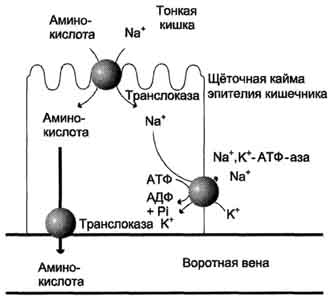 Механизм всасывания аминокислот в кишечнике. L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Nа+,К+-АТФ-азы. 466 для переноса определённой группы близких по строению аминокислот:
Причём к числу Nа+-зависимых относятся переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин). Аминокислоты конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина. Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге. Она получила название γ-глутамильного цикла (рис. 9-5). В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные - в цитозоле. Ключевую роль в транспорте аминокислоты играет мембранно-связан-ный фермент γ-глутамилтрансфераза. Этот фермент является гликопротеином и катализирует перенос γ-глутамильной группы от глутатиона (иногда другого γ-глутамильного пептида) на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Глутатион представляет собой трипептид - γ-глутамилцистеинилглицин, который находится во всех тканях животных. Реакция протекает следующим образом (см. схему А ). Аминокислота, связанная с γ-глутамильным остатком, оказывается внутри клетки. В следующей реакции происходит отщепление γ-глутамильного 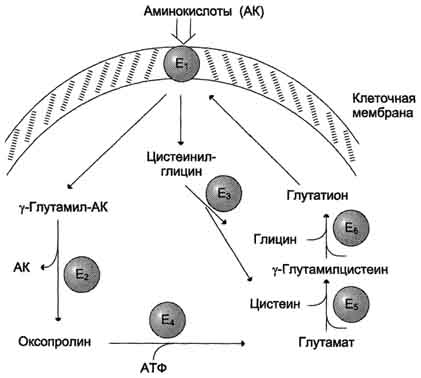 Рис. 9-5. γ-Глутамильный цикл. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. Е1 - γ-глутамилтрансфераза; Е2 - у-глутамилциклотрансфераза; Е3 - пептидаза; Е4 - оксопролиназа; Е5 - γ-глутамилцистеинсинтетаза; Е6 - глутатионсинтетаза. остатка под действием фермента γ-глутамилциклотрансферазы (см. схему Б). Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты - цис-теин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачиваются 3 молекулы АТФ. Нарушение переваривания белков и транспорта аминокислот Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей возникает иммунная реакция на приём белка, что, очевидно, связано со способностью к всасыванию таких пептидов. Продукты полностью переваренного белка (аминокислоты) лишены антигенных свойств и иммунных реакций не вызывают. У новорождённых проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь могут поступать антитела молозива (секрет молочных желёз, выделяющийся в первые дни после родов, обогащённый антителами и антитоксинами). Это усугубляется наличием в молозиве белка - ингибитора трипсина. Протеолитические ферменты в пищеварительных секретах новорождённых обладают низкой активностью. Всё это способствует всасыванию в кишечнике небольшого количества нативных белков, достаточного для обеспечения иммунной реакции. Очевидно, подобное усиление всасывающей способности кишечника является причиной наблюдаемой иногда непереносимости белков пищи (например, молока и яиц) у взрослых людей. 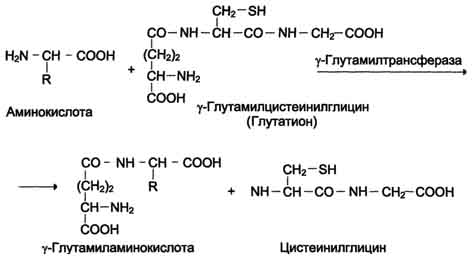 Схема А 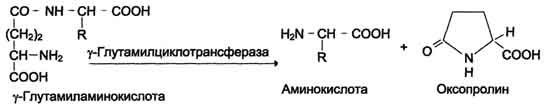 Схема Б Всё больше подтверждений получает гипотеза, согласно которой при заболевании целиакии(нетропической спру) происходит нарушение клеток слизистой оболочки кишечника, где всасываются небольшие негидролизованные пептиды. Целиакия характеризуется повышенной чувствительностью к глютену - белку клейковины зёрен злаков, употребляемых с пищей человеком. Этот белок оказывает токсическое действие на слизистую оболочку тонкой кишки, что приводит к её патологическим изменениям и нарушению всасывания. Патогенез заболевания недостаточно ясен. Такие заболевания, как цистинурия, болезнь Хартнапа и некоторые другие, возникают вследствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках. Описана врождённая патология, связанная с дефектом фермента 5-оксопролиназы (рис. 9-5, реакция 4). При этом с мочой выделяется оксопролин. У этих больных нарушены транспорт аминокислот в ткани и их метаболизм в клетках. Приложение№2 Нарушения переваривания белков в желудке При различных заболеваниях ЖКТ в желудке нарушается выделение НСl и пепсиногена, при этом переваривание белков заметно снижается. Наиболее часто встречаются патологические изменения кислотности желудочного сока. Нарушение образования пепсина отмечают реже и выявляют при более значительных поражениях желудка. Определение кислотности желудочного сока используют для диагностики различных заболеваний желудка (табл. 9-2). Повышенная кислотность желудочного сока обычно сопровождается изжогой, диареей и может быть симптомом язвы желудка и двенадцатиперстной кишки, а также гиперацидного гастрита. Пониженная кислотность бывает при некоторых видах гастритов. Полное отсутствие НСl и пепсина (желудочная ахилия) наблюдается при атрофических гастритах и часто сопровождается пернициозной анемией вследствие недостаточности выработки фактора Касла и нарушения всасывания-витамина В12 (см. раздел 3). Анацидность (рН желудочного сока >6,0) свидетельствует о значительной потере слизистой оболочкой желудка обкладочных клеток, секретирующих соляную кислоту, что часто вызывает рак желудка. Кислотность желудочного сока выражается в титрационных единицах (ТЕ) - количество 0,1 М NaOH в 1 мл, затраченное на титрование 100 мл желудочного сока по определённому индикатору. При определении кислотности желудочного сока различают: общую кислотность, связанную НСl и свободную НСl.
Таблица Компоненты желудочного сока в норме и при патологических состояниях
Значения общей кислотности в норме составляют 40-60 ТЕ.
Молочная кислота в норме в желудочном соке отсутствует. Она образуется при уменьшении содержания или отсутствии свободной соляной кислоты в результате размножения молочнокислых бактерий или при злокачественных опухолях желудка, в клетках которых глюкоза окисляется анаэробным путём. При диагностике заболеваний желудка, кроме биохимических анализов, обязательно проводят рентгенологические и эндоскопические исследования, а также биопсию. Приложение №3 Деградация белков и пептидов в цитоплазме. Селекция белков и последующий протеолиз осуществляется в цитоплазме сложной многокомпонентной системой. В этих принимают участие олигопептид убиквитин и убиквитиновая система, АТФ и полиферментный комплекс, называемый протеасомой, который кроме протеолитической активности обладает еще и АТФ-азной активностью, а также шапероны, специфические белки, контролирующие свертывание (фолдинг) полипептидных цепей, их миграцию и протеолиз. Убиктивин и убиктивиновая система протеолиза. В последнее десятилетие получены убедительные свидетельства о том, что протеолитический путь деградации многих внутриклеточных белков, найденных в цитоплазме зависит от убиквитина – пептида, состоящего из 76 аминокислотных остатков с молекулярной массой 8600 Da. Убиквитин присутствует во всех клетках эукариот, при этом его структура отличается поразительной консервативностью, что свидетельствует в пользу широкого распространения убиквитин-зависимого протеолиза. В целом роль убиквитина выглядит так. Между убиквитином и белком-субстратом образуется ковалентная связь, возникающая между ε-аминными группами остатков лизина белка и карбоксильной группой концевого остатка убиквитина. Образовавшиеся конъюгаты, которые содержат более чем одну молекулу убиквитина, могут быть деградированы протеиназами, в основном протеасомами. Узнавание белков, подлежащих протеолизу осуществляется так называемым убиктивиновым комплексом, способным взаимодействовать с отработанными или аномальными белками. АТФ расходуется как на стадии образования, так и на стадии деградации конъюгатов убиквитина с белком. Есть основания полагать, что убиквитин вызывает значительные конформационные изменения субстратного белка, что делает этот белок чувствительным к протеолизу. Связывание белка с убиквитином служит сигналом для «узнавания» этого белка протеиназами, что обеспечивает механизм избирательной деградации внутриклеточных белков. Главный вопрос заключается в том, какие особенности белковых молекул служат сигналом для их конъюгации с убиквитином и в конечном итоге для деградации. Безусловно, крайне важна генетическая основа, обеспечивающая специфическую структуру белков и позволяющая узнавать их как субстраты протеолиза. Однако, целый ряд белков может быть узнан благодаря вторичным сигналам, которые появляются в результате посттрансляционных модификаций. К основным первичным и вторичным сигналам для присоединения убиквитина могут быть отнесены следующие: конформация N-терминальной области пептида, в частности наличие «дестабилизирующей» N-концевой или другой свободной -аминогруппы («N-концевое правило») или специфически расположенный лизин субстрата; определенные короткие мотивы в последовательности аминокислотных остатков (а не трехмерная структура целой молекулы белка); нарушения вторичной структуры белка (неправильное свертывание) полипептидной цепи; повреждение боковых цепей остатков аминокислот, в том числе их окисление (например окисление остатков метионина); избыточное гликозилирование белков и пептидов. Имеются основания полагать, что убиквитин-зависимые протеиназы принимают участие в процессах деградации белков и пептидов с аномальной структурой, что является определяющим фактором адаптации клетки к изменяющимся условиям. Кроме того известно что, деградация коротко-живущих регуляторных белков через убиквитин-протеасомный путь играет важную роль в основополагающих процессах клетки. К таким белкам, например, относятся циклины, циклин-зависимые киназы и их ингибитры, супрессоры опухолей, онкобелки, активаторы транскрипции и их ингибиторы и многие другие. Весьма детально изучена деградация циклинов – регуляторных белков, которые синтезируются и затем быстро разрушаются на различных фазах клеточного цикла, контролируя тем самым прогрессию этого процесса. Итак, селекция белков для деградации может определяться первичными (конститутивными) или вторичными, (посттрансляционная модификация или ассоциирование с вспомогательными белками) сигналами. Именно эти сигналы узнаются специфическими убиквитин-белок лигазами, с которами субстратные белки связываются перед убиквитинированием. Поэтому эти лигазы являются ключевыми факторами в убиквитиновом протеолитическом каскаде: «узнают» белок для связывания, который подвергнется последующей деградации. Таким образом, катаболизм белка убиквитиновой системой осуществляется в два основных дискретных этапа: (1) ковалентное связывание множества молекул убиквитина с субстратным белком и (2) деградация меченного субстрата. Схема, отражающая последовательность событий убиквитинового пути деградации белков приведена на рис 1. Роль АТФ в действии гидролазы и интеграции протеиназы убиквитин-С терминальной гидролазой комплекса 26S остается не ясной. Недостаточно расшифрованы и другие стадии убиквитинового протеолиза, хотя главные биохимические события основных его этапов изучены и понятны. Уже очевидно, что модификация убиквитином различных регуляторных белков-мишений с последующей деградацией играет существенную роль в регуляции генной экспрессии клеточного цикла и деления клетки, в ответе клетки на стресс, в модификации рецепторов на поверхности клетки, в ДНК репарации, в апоптозе, в биогенезе митохондрий и рибосом, а также удалении аномальных и мутантных короткоживущих белков. В этом случае модифицированные множеством убиквитина белки являются мишенями для протеолиза специфическими протеиназами. Кроме того, стабильные моноубиквитиновые производные белков обнаружены во внеклеточном пространстве, например, гистоны нуклеосом. Несмотря на значительный прогресс в выяснении механизмов действия и роли убиквитиновой системы, многие проблемы остаются неразрешенными. Например, мало известно о природе структурных сигналов, которые «метят» белки для связывания и последующей деградации. Как уже было упомянуто выше, некоторые N-концевые остатки аминокислот могут служить маркерными сигналами для убиквитин-связывающего фермента. Однако, большинство клеточных белков N-α-ацелировано, а среди остальных белков со свободными N-концевыми остатками аминокислот, «дестабилизирующие» остатки крайне редки. В последние годы было показано, что N-α-ацелированные белки деградируются убиквитиновой системой и что их деградация требует специфицеских белковых факторов, которые не участвуют в деградации белков со свободной N-концевой аминокислотой. Один из таких факторов оказался идентичен фактору элонгации EF-1α синтеза белка. Идентичность этих факторов, вовлеченных в процессы как синтеза, так и деградации белка, свидетельствует об общности регуляторных механизмов между этими двумя процессами. Не решены проблемы физиологической роли убиквитиновой системы в ее возможной ассоциации с другими протеолитическими системами клетки, которые скорее всего являются весьма тесными, как это можно заключить на основании интенсивных исследований последних лет. Так, например, уже стало известно, что индуцированная стрессом лизосомная деградация клеточных белков требует убиквитин-активирующего фермента Е1. АТФ-зависимый протеолиз. Зависимость протеолиза от АТФ была обнаружена 25 лет тому назад, когда было показано, что недостаток АТФ способен оказывать тормозящее действие на внутриклеточный распад белков. Как АТФ участвует в деградации белков еще мало известно. В наибольшей степени изучены АТФ-зависимая протеолитическая активность, присущая растворимой фракции ретикулоцитов. По-видимому, она ответственна за избирательную деградацию аномальных белков в клетке, а также за утрату органелл в процессе созревания ретикулоцитов. Потеря этой активности в стареющих эритроцитах приводит к накоплению токсических окисленных и денатурированных белков, что, в свою очередь, отражается на продолжительности жизни клеток. Есть основания полагать, что использование АТФ протеиназами зависимыми от АТФ сходно с использованием этого нуклеотида другими молекулярными соединениями. Гидролиз АТФ может сопровождать: реакции рефолдирования и дефолдирования полипептидных цепей, что делает их более доступными для протеолиза; транслокацию белковых субстратов к протеолитическим активным центрам протеасом; повышение эффективности связывания белков-субстратов с протеиназами, поскольку начальное взаимодействие между субстратом и ферментом осуществляется кинетическим механизмом «пробного считывания» для отбора только подходящих для протеолиза субстратов. АТФ-зависимым, как это было видно из предыдущего раздела, является убиквитиновый путь деградации белка. АТФ вовлекается в этот путь протеолиза, по крайней мере в трех независимых процессах: ковалентное связывание убиквитина с белком-мишенью – гидролиз АТФ требуется для активации убиквитина ферментом Е1; формирование ансамбля 26S протеасомного комплекса, молекулярные механизмы которого еще до конца не известны; гидролиз связанных с убиквитином белков с участием 26S протеасом и освобождение убиквитина. Эта утилизация метаболической энергии на основных этапах деградации белков подтверждает физиологическую возможность участия протеасомной убиквитин-зависимой протеолитической системы в селективном удалении «ненужных» и отработанных короткоживущих и быстрообновляемых белков, а также аномальных белков генерируемых в клетках. Следует заметить, что расщепление белков в интактных клетках требует значительных затрат энергии. Так, например, расход АТФ при протеолизе белков митохондрий в убиквитин-зависимой протеолитической системе достигает по меньшей мере одной молекулы АТФ на каждую расщепленную пептидную связь. Выявлены АТФ-зависимые протеиназы, осуществляющие регуляцию уровня внутриклеточного протеолиза без участия убиквитина. Итак, можно заключить что, АТФ-зависимые протеиназы играют ключевую роль в процессе регуляции внутриклеточного уровня белков и пептидов. Протеасомы. Протеасомами называются мультикаталитические мультифункциональные протеиназы, присутствующие в цитоплазме всех эукариотических клеток. Протеасомы являются эндопетидазами, состоящими из множества субъединиц. Эти ферменты отличаются от других известных протеиназ и представляют особую группу протеолитических ферментов, способных катализировать три типа протеолитической активности: трипсино-подобную химотрипсино-подобную каспазо-подобную (петидилглутамин-пептидгидролазную). В основном белки в клетках деградируются 26S протеасомами, которые состоят из протеолитического кора и одного или двух регуляторных комплексов. Наиболее изученной является 26S протеасома, которая содержит 20S протеасомный кор с регуляторными 19Sкомплексами присоединенными к обоим концам кора. 26S протеасома с молекулярной массой 2000 kDa является гетерогенным комплексом, состоящим из 30 и более различных субъединиц. Центральный протеолитический сегмент – 20S протеасома имеет мол. Массу 750 kDa. Протеолитический сегмент имеет форму цилиндра, состоит из 4-х гептамерных колец 2-х типов и включает 12-15 различных полипептидов. На внутренней стороне цилиндра располагаются протеолитические центры трипсино-, химотрипсино- и каспазоподобных протеиназ. Два сегмента V-образной формы (19S) закрывают с двух сторон центральный цилиндр и отвечают за АТФ-зависимое узнавание субстрата, его дефолдирование и транслокацию в протеолитический сегмент. Таким образом, 20S протеасома может обратимо ассоциироваться с рядом других белковых компонентов, образуя необычно большой комплекс 26S, который катализирует АТФ-зависимую деградацию белков, связанных с убиквитином и\или мульти- убиквитиновой цепью. Эти дополнительные компоненты протеасомного комплекса могут регулировать протеолитические функции 20S протеасомы. Именно они обеспечивают снабжение энергией протеолиз, с участием АТФ-азы, и узнавание мульти- убиквитиновой цепи в белке-мишени для деградации. 26S протеасомные комплексы выделены и охарактеризованы из многих типов клеток. Несмотря на различия в первичной и четвертичной структурах, АТФ-зависимые протеиназы имеют ряд общих свойств и сходных механизмов действия. Они состоят из множества субъединиц, ассоциированных с мультимерной АТФ-азой, и предназначены для захвата и сканирования потенциальных белков субстратов, а также отбора из них соответствующих белков для деградации. Индуцированное нуклеотидами взаимодействие между АТФ-азными субъединицами и протеолитическим кором изменяет конформацию протеолитических активных центров, делая их более доступными для больших полипептидов или больших участков белков. Различные АТФ-азные субъединицы могут связывать и, вероятно, «выбирать» белковые субстраты, а также развертывать или перемещать белки для презентации протеолитическим активным центрам. Большой размер АТФ-азных субъединиц и ряда других белков, которые могут взаимодействовать с протеиназами, особенно, с 26S протеасомами, дает возможность воздействовать на функции множеству эффекторов. В связи с этим, активность и локализация протеиназ имеют сложную систему регуляции , включающую различные метаболиты и сигналы. Известно, что для активации протеасом требуется гидролиз АТФ. Кроме того, в последние годы получены данные о регуляции активности этих протеиназ внутриклеточным кальцием, так называемый «кальциевый сигнальный путь», который зависит от перемещения кальция, связанного с клеточным циклом. Показано, что АТФ-азные субъединицы протеасом могут быть фосфорилированы, что влияет на активность этих комплексов. Некоторые субъединицы сегмента 20S содержат структурные и регуляторные мотивы последовательности аминокислот для связывания не-субстратных белков. Так, связывание гидрофобных пептидов с этими участками ферментов стимулирует активность всех 6-и активных центров. Известно, что 26S протеасомы деградируют белки, меченные убиквитином, однако, до сих пор не ясно, как протеасомы узнают эти убиквитинированные субстраты. Нативные белки не имеют доступа к активным центрам протеасом и не подвергаются протеолизу. В цилиндрический кор протеасомы могут проникать только определенные участки денатурированных белков. При этом, химотрипсин-подобная активность может действовать как триггер, инициирующий расщепление белков в области гидрофобных остатков аминокислот, дальнейшее дефолдирование и протягивание белка через цилиндр может затем привести к расщеплению этого белка двумя другими типами протеиназ. Некоторые белки, входящие в ансамбль протеасом могут отвечать за транслокацию денатурированных цепей белка через цилиндр. В соответствии с современными представлениями, протеосомы являются физиологически важными центральными факторами, катализирующими зависимый от энергии протеолиз и играют существенную роль в нелизосомных путях катаболизма белков и процессенге антигенов. Протеасомы вовлекаясь в убиквитин-зависимый протеолиз, ответственны за элиминирование аномальных белков и короткоживущих белков, в том числе белков контролирующих прогрессию клеточного цикла, таких как циклин, антионкогенный белок р53, с-mos и другие белки. О тесной связи протеасом с апоптозом свидетельствует наличие в их составе каспазного активного центра. Каспазы – цистеиновые протеиназы, принимающие участие в проведении сигнала апоптоза, а также непосредственно отвечающие за его морфологические проявления. Ингибирование убиквитин-зависимого протеолиза приводит к гибели клетки. Хромосомная делеция в генах, кодирующих субъединицы протеасом является летальной, что указывает на необходимость протеасом для жизни клеток. Роль шаперонов в протеолизе. Совсем недавно стало известно об участии шаперонов в деградации белков. Шапероны – универсальные консервативные белки, которые связывают другие белки и стабилизируют их конформацию. Они могут исправлять недостатки фолдирования белков как после их синтеза, так и в процессе синтеза на рибосомах, включатся в мультимерные комплексы или транслоцироваться через различные клеточные мембраны. Шапероны были открыты как белки теплового шока (hsp), синтез которых увеличивается при повышении температуры. Шапероны не изменяют окончательный результат фолдирующего процесса, но предотвращают агрегацию белка перед завершением свертывания и предотвращают образование нефункционирующих или непродуктивных конформаций во время этого процесса. Они увеличивают скорость фолдирования, ограничивая тем самым число непродуктивных путей свертывания доступных для полипептидной цепи. Шапероны также нужны для рефолдинга белков после перенесения ими клеточных мембран, поскольку белки пересекают клеточные мембраны в дефолдированной конформации. Шапероны представляют собой длинную цилиндридрическую полисубъединичную четвертичную структуру, которая связывает нефолдированные белки с центральной гидрофобной полостью шаперона. Они имеют АТФ-азную активность и гидролизуют АТФ, снабжая энергией процесс свертывания полипептидной цепи. Для того, чтобы обеспечить многоступенчатый рефолдирующий процесс, комплекс шаперона с субстратом подвергается нескольким АТФ-зависимым циклам ассоциации-диссоциации. Члены семейства шаперонов молекулярной массой 70 kDa узнают гидрофобные домены белков, которые экспонируются при нарушенной (не нативной) конформации. С нативными белками шапероны не связываются. В настоящее время высказана гипотеза, в соответствии с которой шапероны, если не могут обеспечить транспорт белков, то способствуют быстрой деградации этих белков. Известно об ускорении протеолиза, индуцированного денатурирующим эффектом нагревания белка. У эукариот молекулярные шапероны вовлечены в деградацию белков, которая протекает различными путями. Так селективная и индуцированная деградация белков в лизосомах вовлекает узнавание белком теплового шока, пептидного мотива близкого к Lys-Phe-Glu-Arg-Gln в белке - субстрате. Образование комплекса между шапероном и узнающим мотивом приводит к специфическому связыванию субстратного белка с мембраной лизосомы. Внутриклеточные шапероны необходимы для импорта субстратных белков в лизосомы. Имеются данные о том, что потеря шаперонов приводит к накоплению ошибочно фолдированных белков в цитоплазме. Показано также, что деградация определенных протеолитических субстратов убиквитиновой системы требует присутствия катионов и молекулярных шаперонов. Возможно, что в зависимых от шаперонов субстратах, их Е3 узнающий участок спрятан и связывание с шапероном необходимо, чтобы его открыть. Альтернативным объяснением селективного эффекта шаперонов может быть степень нефолдированности или агрегации субстратов. Вовлечение шаперонов в протеолитический процесс требует образования комплекса с субстратом - мишенью, который может подвергаться зависимым от катионов циклам ассоциации-диссоциации. Предполагается, что связывание белков с шаперонами в отсутствии катионов приведет к тому, что протеолитический субстрат будет заперт в шапероне и не сможет быть презентирован конъюгирующему механизму. В целом нет четкого представления о механизмах действия шаперона в протеолитической системе. Обсуждается возможность такого связывания шаперона с субстратом при котором экспонируется лигаза-связывающий домен последнего, а для освобождения субстрата из шаперона и перенесения на лигазу требуется присутствие катионов. В этом случае шаперон «поддерживает» субстрат нефолдированным, однако способным связаться с Е3. Есть высокая вероятность того, что многие клеточные белки в определенной степени денатурированы. Хорошо известны и тщательно изучены функции молекулярных шаперонов в рефолдинге денатурированных белков в их нативную форму. Процесс протекает постепенно и вовлекает повторные катион-зависимые циклы ассоциации-диссоциации. Недостаточность ренатурации белков приводит к их презентации лигазе. «Решение» в предоставлении денатурированного белка протеолитической системе может основываться на скорости успешного взаимодействия между шаперон-субстратным комплексом и Е3, при этом шаперон представляет лигазе белок с экспонированным узнаваемым доменом и это приводит в результате к переносу связанного с шапероном белка на Е3. Рефолдинг белка в форму, в которой узнаваемый домен мало экспонирован, приводит к неэффективному взаимодействию и освобождению из шаперона нативного рефолдированного белка. Итак, значительная часть новосинтезированных полипептидных цепей подвергается в клетке деградации. К числу мишеней относятся белки с дефектной структурой, «неправильным» фолдингом, несвязанные субъединицы гетероолигомерных комплексов и белки, утратившие свою роль в клеточном метаболизме. В эукариотических клетках основным местом формирования белков-мишений является эндоплазматический ретикулум, в котором осуществляются различные типы ковалентной модификации полипептидов, их сворачивание и олигомеризация. Сворачивание полипептидов протекает с участием шаперонов, ответственных также за трансмембранный перенос этих цепей к поверхности эндоплазматического ретикулума, где они подвергаются убиквитинированию и связываются с протеасомами. При накоплении белков-мишеней реализуются специальные механизмы, стимулирующие их деградацию и/или выведение из клетки. Завершая обсуждение механизмов полного протеолиза и его роли, можно заключить, что процессы внутриклеточного катаболизма белков необходимы для деградации новообразованных полипептидных цепей с неправильной структурой и/или внутриклеточной компартментализацией, несзвязанных компонентов мультисубъединичных белковых комплексов, а также белков, контролирующих быстрые физиологические процессы. При этом протеолиз долгоживущих цитоплазматических белков протекает в лизосомах, а короткоживущие цитоплазматические белки деградируются преимущественно цитоплазматической системой, например, протеасомами или другими пока еще не известными системами. Итак, обмен белков является динамическим процессом, включающим одновременно синтез и деградацию белков, а изучение и понимание функций катаболизма белков также важно, как и изучение и понимание роли их синтеза Практическое занятие №17 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
