Методички педфака на весенний семестр 2014. Структура и свойства белков. Методы выделения и очистки белков. Нарушения белкового состава сыворотки крови
 Скачать 1.9 Mb. Скачать 1.9 Mb.
|
|
Тема. Ферменты: общие свойства и механизм действия. Энзимопатии. Цели занятия. Профессиональные. 1. Сформировать знания о природе, строении и функции простых и сложных ферментов. 2. Уметь объяснить роль ферментов в биологических процессах. 3. На основе знаний о строении и свойствах ферментов углубить представления об особенностях функционирования биологически активных веществ в здоровом и больном организме. 4. Знать принципы качественного определения активности ферментов в биологических жидкостях и научиться методу обнаружения в биологической жидкости фермента α-амилазы и уметь объяснить полученные результаты. Воспитательные. 1. Уметь работать в коллективе. 2. Уметь сосредоточиться и не отвлекаться, т.к. лабораторная работа требует большого внимания и аккуратности. 3. Знать, что после работы нужно привести свое рабочее место в порядок. Основное значение изучаемой темы для подготовки врача заключается в понимании процессов протекающих в организме и уметь правильно использовать возможности лабораторной диагностики в постановке диагноза. Хронометраж практического занятия: 1. Вводная беседа. Тестирование исходного уровня знаний — 20 мин. 2. Практическая часть. Обсуждение теоретического материала по теме — 60 мин 3. Разбор ситуационных задач — 20 мин 4. Лабораторная работа— 40 мин. 5. Контроль выполнения лабораторной работы — 10 мин. 6. Контроль усвоения темы — 15 мин. 7. Подведение итогов и задание к следующему занятию — 15 мин. Продолжительность занятия — 4 часа Методическое и материально-техническое оснащение (таблицы, химическая посуда, биологический материал, видеофрагменты) Содержание темы: Ферменты. Определение, классификация, структура, биологическая роль. Отличия ферментов от минеральных катализаторов. Зависимость ферментативной активности от нативной структуры белка-фермента. Активный центр. Кофакторы и коферменты. Механизм взаимодействия фермента и субстрата. Способы оценки активности ферментов в лабораторной практике. Базисные знания: разделы неорганической химии – кинетика катализа, свойства неорганических катализаторов. Разделы органической химии: строение нативной структуры белка и ее роль в функции белков-ферментов, понятие о ферментах. Сведения о витаминах. Студент должен уметь: усвоить принципы качественного определения ферментов Учебная карта занятия: Вводная беседа о роли ферментов в метаболизме. Вопросы для вводного контроля: 1. Ферменты, химическая природа ферментов, общее строение ферментов. 2. Отличие и сходство катализаторов и ферментов. 3. Специфичность действия ферментов. Виды специфичности. 4. Что такое каталитическая эффективность. 5. Общие принципы механизма действия ферментов. 6. Что такое энергетический уровень реакции и роль ферментов в его регулировании. 7. Механизм ферментативной активности 8. Структурно-функциональная организация ферментов. 9.Строение активного центра фермента. 10. Что такое аллостерический центр фермента. 11. Зависимость активности фермента от конформации белков. 12. Кофакторы ферментов. 13. Коферменты. Роль витаминов и их коферментная функция. 14. Зависимость скорости реакции от концентрации фермента. 15. Зависимость скорости реакции от концентрации субстрата. 16. Зависимость скорости реакции от температуры. Температурный оптимум. 17. Зависимость скорости реакции от рН среды. Теоретическая часть.
Особенности ферментативного состава у детей разных возрастных периодов Активность ферментов амилазы, липазы и каталазы в крови новорожденных детей первых дней жизни достаточно хорошо выражена и, по-видимому, находится в некоторой зависимости от активности ферментов матери. В период новорожденности активность указанных ферментов падает и лишь к концу этого периода, приблизительно с конца 2-й — начала 3-й недель жизни, снова начинает нарастать. У здоровых детей первых месяцев жизни, находящихся в нормальных для них условиях окружающей среды и получающих правильное питание, активность амилазы, липазы и каталазы в крови систематически нарастает с возрастом, усиление активности этих ферментов особенно отчетливо заметно в течение 1-го года жизни. Активность различных ферментов крови у отдельных детей может колебаться в довольно широких пределах. Угольная ангидраза, определяемая в периферической крови, обнаруживает низкую активность у новорожденных и с возрастом ребенка нарастает. Секреторный аппарат ж/ктракта у детей первого года жизни развит недостаточно. Состав желудочного сока у детей схож со взрослыми, но кислотная и ферментативная активность его значительно ниже. Основным действующим ферментом желудочного сока является сычужный фермент (лабфермент), который обеспечивает первую фазу пищеварения — створаживание молока. В желудке грудного ребенка выделяется крайне мало липазы. Этот недостаток восполняется наличием липазы в грудном молоке, а также панкреатическом соке ребенка. Если ребенок получает коровье молоко, жиры его в желудке не расщепляются. Ситуационные задачи. 1. Карбоксипептидаза состоит из 307 остатков аминокислот. Три каталитически группы являются главными в активном центре фермента. Это аргинин 145, тирозин 248 и глутаминовая кислота 270 (номер-положение аминокислоты в полипептидной цепи). Каким образом три аминокислоты, расположенные так далеко друг от друга, могут катализировать реакцию? Если в процессе гидролиза участвуют только эти три каталитические группы, то зачем ферменту так много аминокислотных остатков? 2. Глутаматдекарбоксилаза катализирует реакцию: В6 Глутаминовая кислота → ГАМК + СО2 а) по изменению концентрации каких веществ можно охарактеризовать активность фермента? б) как можно увеличить скорость данной реакции? 3. Фермент трипсин способен расщеплять пептидные связи белков. Почему обработка трипсином приводит к инактивации многих ферментов? (Для обоснования ответа вспомните: что такое ферменты?К какому классу ферментов относится трипсин?) 4. Оптимальными условиями действия амилазы – фермента, расщепляющего крахмал, являются рН=6,8; температура 37ºС. Как изменится активность фермента при изменении условий реакции? Укажите причину изменений. а) рН инкубационной среды =5; б) температура инкубации 70ºС; 5. Сравните специфичность действия двух групп пептидаз – пищеварительного тракта и свертывающей системы крови. В каком случае специфичность выше? (Для обоснования ответа вспомните: что такое пептидазы, к какому классу они относятся, что такое специфичность фермента?) 6. Раствор, содержащий высокомолекулярные вещества различной природы (полисахариды, белки, нуклеиновые кислоты), проявляет каталитическую активность по отношению к какой-либо определенной реакции. Природа катализатора неизвестна. Установлено, что он обладает следующими свойствами: а) снижает энергию активации; б) ускоряет прямую и обратную реакции; в) обладает высокой специфичностью; г) ускоряет момент достижения равновесия, не сдвигая его; д) прекращает каталитическое действие после добавления в раствор вещества, разрушающего пептидные связи. Какие из свойств служат прямым доказательством белковой природы катализатора? (Для обоснования ответа вспомните: что такое фермент?Чем отличаются действия органических и неорганических катализаторов) 7. Зерна в свежесобранных початках кукурузы сладкие из-за большого содержания в них глюкозы. Чем дальше от момента сбора, тем менее сладкими становится зерна в связи с превращением глюкозы в крахмал. Для сохранения сладкого вкуса початки сразу же после сбора помещают на несколько минут в кипящую воду и потом охлаждают. Как объяснить смысл такой обработки? 8. С какой целью в консервируемые продукты добавляют пищевые кислоты в концентрации 4-6%, чаще всего уксусную. 9. Известно, что в настоящее время для физического способа консервирования в промышленных условиях применяют токи УВЧ, которые в течение 30-50 сек. обеспечивают очень быструю стерилизацию. Объясните биохимический механизм такого метода. 10. Мороженая картошка имеет сладковатый привкус. Почему? (температурный оптимум амилазы картофеля –4º). 11. Почему сырое мясо нужно держать в морозильнике, а вареное – на нижней полке холодильника? 12. Объясните, почему при скисании молока оно створаживается. Практическая часть (для лабораторного практикума). 1.Специфичность действия ферментов на примере α-амилазы слюны. 2. Влияние температуры на активность фермента α-амилазы слюны. 3. Влияние рН на активность α-амилазы слюны. Студенты делятся на 3 группы. Каждая группа выполняет одну работу. Записывает результат на доске в виде схемы и объясняет. После чего все студенты в своих тетрадях заполняют протоколы. Амилаза расщепляет крахмал через стадию декстринов до редуцирующего дисахарида – мальтозы. О действии фермента можно судить по исчезновению субстрата или по образованию конечных продуктов. Принцип метода: α-амилазы катализирует гидролиз 1,4-гликозидных связей в крахмале и гликогене, что приводит к расщеплению субстрата и появлению продуктов гидролиза – декстринов и дисахарида мальтозы. Определяя убыль субстрата с помощью реакции с реактивом Люголя (раствор йода в KI), судят о наличии фермента. Крахмал определяется пробой Люголя – дает сосвободнымI2 синее окрашивание. Конечные продукты расщепления крахмала можно обнаружить с помощью редуцирующих проб, например, пробой Фелинга. Реакция основана на способности углеводов восстанавливать металлы. При нагревании голубой гидрат окиси меди восстанавливается углеводом сначала в гидрат закиси меди желтого цвета. А затем в закись меди кирпично-красного цвета. Ход работы. 1. В одну пробирку – 2 мл 0,5% раствора крахмала Во вторую пробирку – 2 мл 2% раствора сахарозы. В обе пробирки добавить по 1 мл разведенной в 10 раз слюны. Пробирки встряхнуть и поместить в термостат при 38º С на 10 минут. После этого содержимое каждой пробирки разделить на 2 части и провести в одной реакцию с реактивом Люголя, а в другой провести пробу Фелинга. Параллельно провести отдельно такие же пробы с крахмалом и сахарозой. Проба Люголя. К содержимому пробирки добавить 1 каплю раствора Люголя. Появление синего окрашивания свидетельствует о наличии крахмала. Проба Фелинга. К содержимому пробирки добавить примерно половину объема 10% раствора КОН и по каплям 1% раствора CuSO4 до образования неисчезающей мути на фоне голубой окраски раствора. Верхний слой жидкости нагреть на пламени спиртовки. Появление желтого окрашивания, переходящего в кирпично-красное, указывает на наличие редуцирующих углеводов. Сделать таблицу
2. В 4 пробирки взять по 4 мл 0,5% раствора крахмала и по 1 мл разведенной в 10 раз слюны. Одну пробирку поставить в лед, вторую в кипящую водяную баню, третью в термостат при 38º С, а четвертую оставить при комнатной температуре. Через 10 минут содержимое каждой пробирки разделить на 2 части и провести в одной реакцию с реактивом Люголя, а в другой провести пробу Фелинга. Заполнить таблицу
3. В 3 пробирки вносят по 3 мл буферных растворов с рН 2,0; 7,0; 9,0. Во все пробирки прибавляют по 2 мл 0,5% раствора крахмала и по 1 мл разведенной в 10 раз слюны. Пробирки встряхнуть и поместить в термостат при 38º С на 10 минут. После этого содержимое каждой пробирки разделить на 2 части и провести в одной реакцию с реактивом Люголя, а в другой провести пробу Фелинга. Только нужно помнить, что реакция Люголя протекает в кислой или нейтральной среде, а проба Фелинга только в щелочной среде. Заполнить таблицу
Темы для реферативных сообщений Методы определения активности ферментов, и методы выражения активности ферментов. Приложение для студентов лечебного и педиатрического факультетов Лабораторная диагностика Для исследования активности энзимов чаще всего используется плазма или сыворотка крови. В процессе свертывания крови и последующей ретракции кровяного сгустка высвобождаются биологически активные вещества тромбоцитов, под влиянием которых возрастает активность многих ферментов. Разрушение форменных элементов крови (эритроцитов) обусловливает дальнейшее повышение их активности. Поэтому, например, при исследовании лактатдегидрогеназы (ЛДГ) рекомендуется не допускать гемолиза. Хранение сыворотки сопровождается снижением функциональной способности энзимов. Для большинства из них активность не изменяется при комнатной температуре в течение 6-8 часов. Известно, что многие антикоагулянты изменяют деятельность ферментов. Установлено, что оксалаты подавляют активность ЛДГ, а салицилаты, наоборот, повышают работу аминотрансфераз. В клинико-диагностических лабораториях методы определения активности ферментов могут быть разделены на две основные группы: а) состоящие в определении конечного продукта, образовавшегося после известного периода инкубации ферментного препарата (обычно сыворотки) с субстратом в соответствующем буфере. Выполняется путём измерения опытной и контрольной проб. Для этого используется специальная химическая реакция, и учет оптической плотности может быть произведён на обычном фотоэлектроколориметре или на специальных лабораторных анализаторах. б) методы, с помощью которых в ходе ферментативной реакции непрерывно или периодически определяют потребление субстрата, кофермента или образование метаболита. Это чаще всего используется в экспериментальных лабораториях. Активность ферментов выражается количеством разрушенного субстрата или образованного в ходе реакции продукта (в моль, ммоль, мкмоль) в пересчёте на один литр сыворотки (плазмы) крови при температуре 37, 30, 25˚С (SI), либо в международных единицах (Е/л, U/l), а также в каталах (долях катала) на литр, например, мккат/л. Одна единица (U) какого-либо энзима есть то его количество, которое катализирует трансформацию 1 мкмоль субстрата за 1 мин при определенных условиях. Ферментативный состав биологических субстратов. Клетка - сложнофункциональная система, регулирующая своё жизнеобеспечение. Многообразие функций клетки обеспечивается пространственной регуляцией определённых метаболических путей. Пространственная регуляция связана со строгой локализацией определённых ферментов в различных органеллах. Так, в ядре находятся ферменты, связанные с синтезом молекул ДНК и РНК, в цитоплазме - ферменты гликолиза, в лизосомах - гидролитические ферменты, в матриксе митохондрий - ферменты ЦТК, во внутренней мембране митохондрий - ферменты цепи переноса электронов и т.д. Такая субклеточная локализация ферментов способствует упорядоченности биохимических процессов и увеличивает скорость обмена веществ. Митохондрии Внешняя мембрана митохондрий – играет разграничительную роль, в ней содержатся ферменты удлинения насыщенных жирных кислот, МАО (маркерный фермент) и др. Межмембранное пространство (ММП) – содержит аденилатциклазу и нуклеозиддифосфаткиназу). Внутренняя мембрана содержит ферменты тканевого дыхания. Маркерный фермент цитохромоксидаза. Матрикс (М) содержит ферменты ЦТК, β-окисления жирных кислот, декарбоксилирования альфа–кетокислот. Дыхательня цепь – это система ферментов и коферментов, которые принимают участие в транспорте электронов и протонов от окисляемого субстрата к кислороду. Лизосомы. Это - структуры в клетках, содержащие ферменты, способные расщеплять (т.е. лизировать — отсюда и название) белки, полисахариды, пептиды, нуклеиновые кислоты. Основная их роль — участие в процессах внутриклеточного расщепления как экзогенных, так и эндогенных биологических макромолекул. Характерной чертой лизосом является то, что они содержат около 40 гидролитических ферментов: протеазы, нуклеазы, фосфатазы, гликозидазы и др., оптимум действия которых осуществляется при рН 5. В лизосомах кислое значение среды создается из-за наличия в их мембранах протоновой «помпы», потребляющей энергию АТФ. Кроме того, в мембраны лизосом встроены белки-переносчики для транспорта из лизосомы в цитоплазму продуктов гидролиза: мономеров расщепленных молекул — аминокислот, сахаров, нуклеотидов, липидов. Чтобы не переварить самих себя, мембранные элементы лизосом защищены олигосахаридами, мешающими гидролазам взаимодействовать с ними. Функция лизосом - обеспечение внутриклеточного пищеварения, то есть расщепления как экзогенных, так и эндогенных веществ. Пероксисомы – сходны по строению с лизосомами, однако отличаются от них тем, что в их матриксе содержится каталаза - фермент, разрушающий перекись водорода, образующуюся при окислении аминокислот. Органоспецифичность. В процессе развития от оплодотворенного яйца до взрослого организма различные ферментные системы синтезируются неодновременно, поэтому с возрастом ферментный состав тканей изменяется. Возрастные изменения метаболической активности особенно выражены в период эмбрионального развития по мере дифференцировки различных тканей с их характерным набором ферментов. На самых ранних стадиях развития эмбриона (непосредственно после оплодотворения яйцеклетки) преобладают те типы ферментов.которые транслируются с материнского генетического материала. В печени выявлены 3 основные группы ферментов, появляющиеся в позднем внутриутробном периоде, в периоде новорожденности и в конце периода грудного вскармливания. Ферментный состав различных клеток неодинаков. Ферменты, выполняющие функцию жизнеобеспечения клетки, находятся во всех клетках организма. В процессе дифференцировки клеток происходит изменение ферментного состава клеток. Так, фермент аргиназа, участвующий в синтезе мочевины, находится только в клетках печени, а кислая фосфатаза, участвующая в гидролизе моноэфиров ортофосфорной кислоты - в клетках простаты. Это так называемые органоспецифичные ферменты. Если говорить об узко специализированных клетках, то ферментов, выполняющих функции в этих клетках, находится больше, чем в других клетках. Например, в клетках сердечной мышцы имеется повышенное количество ферментов креатинкиназы и аспартатаминотрансферазы, в клетках печени - аланинаминотрансферазы и аспартатаминотрансферазы, в остеобластах - щелочной фосфатазы и т.д. 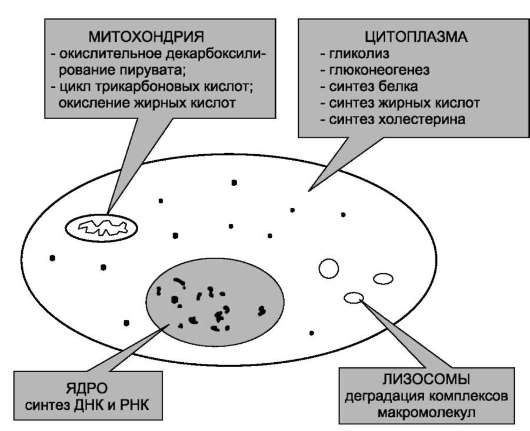 Внутриклеточная локализация ферментов. Энзимопатия - заболевания, в основе которого лежат генетические и др. изменения активности ферментов. По классификации академика Покровского энзимопатиии делятся на: 1) наследственные (генетически детерминированы - точечные мутации, хромосомные аберрации) фенилкетонурия, галактоземия, альбинизм); 2) алиментарные - связаны с пищевыми факторами: дефицит белка, микроэлементов, гипо- и авитоминозы, несбалансированное питание. Употребление недоброкачественной пищи (красители, консерванты); 3) токсические - связаны с ингибированием ферментов пестицидами, гербицидами, лекарствами, выбросами машин, заводов (например тетрациклин блокирует рибосомальный цикл гепатоцитов в печени). По современной классификации: 1) первичные (врожденные, наследственные); Точечные мутации гена, кодируюшего фермент. Наличие ингибитора или отсутствие активатора при синтезе фермента. Генетические дефекты синтеза кофермента. Нарушение процессинга белка. Патология или отсутствие матрицы ДНК и РНК 2) вторичные (приобретенные: алиментарные и токсические). Нарушения энергообеспечения (уменьшение АТФ, ГТФ - нарушение синтеза апофермента). Недостаток аминокислот (белковое голодание). Отсутствие или недостаток кофермента: витаминов, микроэлементов, нарушение ресорбции витаминов в ЖКТ. Все причины гиповитаминозов. Клеточная деструкция разного генеза. Все инфекционные болезни (вирусные, бактериальные и паразитарные) протекают с расстройством ферментных систем, это связано с выделением экзо- и эндотоксинов, блокирующих ряд ферментов. Другой причиной является гипо- и гиперфункция эндокринных желез. Также причиной может быть резкое изменение условий среды, в которой работает фермент. (Ацидоз или алколоз). Первичные энзимопатии Наследственные ферментопатии. Генетически детерминированные нарушения обмена веществ. Ферментопатии лежат в основе многих наследственных болезней. При этом может полностью отсутствовать ген, контролирующий синтез белковой молекулы фермента (апофермента), либо апофермент синтезируется, но активность фермента отсутствует или резко снижена. В результате генных мутаций может изменяться последовательность аминокислот в структуре активного центра фермента или в регионе связывания апофермента с коферментом (чаще всего витамином или металлом). Кроме того, могут синтезироваться нестабильные легко распадающиеся молекулы ферментов. Все эти изменения структуры белков-ферментов называют молекулярными болезнями, или молекулярной патологией. Известно более 150 наследственных ферментопатий, для которых установлена сущность генной мутации, определены ошибки в синтезе белковой молекулы фермента, а соответствующие мутантные гены картированы на хромосомах (т.е. установлена их локализация на одной из 22 аутосом или Х-хромосоме). Примерно 75% генных мутаций представляют собой замену оснований в молекуле ДНК, что приводит к изменению генетического кода и соответственно к замене одной аминокислоты на другую в полипептидной цепи фермента. Выпадение каталитической функции фермента создает метаболический блок соответствующей биохимической реакции. Патологические проявления блока могут быть связаны с накоплением веществ, образующихся до блока, или с дефицитом продуктов реакции, которые обычно синтезируются в результате воздействия фермента. Существует большая группа ферментопатий, получивших название болезней накопления, или тезаурисмозов, при которых вещества — предшественники реакции депонируются в клетках (например, гликоген при гликогенозах, гликопротеины, гликолипиды при ряде лизосомных болезней, мукополисахариды при мукополисахаридозах). Многие патологические состояния обусловлены дефицитом конечных продуктов реакции, приводящих к снижению биосинтеза гормонов (врожденная дисфункция коры надпочечников, гипотиреоз, гипопаратиреоз и др.). Соединения, накапливающиеся до метаболического блока,нередко становятся токсичными в результате их преобразования в обходных биохимических реакциях. Ферментопатии могут быть связаны с патологическими изменениями клеточных рецепторов. Так, наследственная недостаточность мембранных рецепторов липопротеинов низкой плотности приводит к нарушению регулирования активности ферментов синтеза холестерина и гиперхолестеринемии. Некоторые ферментопатии проявляются нарушениями активного мембранного транспорта (например, транспорта аминокислот и цистина при цистинурии, глюкозы при гликогеновой болезни, глюкуроновой кислоты при врожденной гипербилирубинемии). По принципу ведущих нарушений обмена веществ наследственные ферментопатии разделяют на следующие типы:
Первичные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов. При этом дефектные ферменты наследуются, в основном, по аутосомно-рецессивному типу. Гетерозиготы, как правило, не имеют фенотипических отклонений. Первичные энзимопатии относят к метаболическим болезням, так как происходят нарушения определенных метаболических путей. При этом развитие заболевания может протекать по одному из трех ниже перечисленных вариантов. Вторичные энзимопатии Вторичные энзимопатии являются следствием тех или иных патологических процессов, сопровождающихся нарушением активности ферментов. Они наблюдаются при многих заболеваниях. Так, например, причиной развития вторичной лактазной недостаточности могут являться: кишечные инфекции вирусной и бактериальной этиологии, паразитарные заболевания (лямблиоз и др.), синдром короткой кишки (пострезекционный), целиакия, токсическое и лекарственное поражения кишечника (на фоне лучевой и химиотерапии, антибиотикотерапии). Одним из вариантов вторичных энзимопатий являются алиментарные энзимопатии – патологические состояния, обусловленные стойкими нарушениями активности ферментов в связи с характером питания. Алиментарные энзимопатии могут быть обусловлены длительным дефицитом белка в питании (например при квашиоркоре), нарушением биосинтеза коферментов при витаминной недостаточности, угнетением синтеза металлоферментов при низком содержании в рационе соответствующих минеральных веществ. Кроме того, они могут возникать при несбалансированном питании в целом. К развитию алиментарных энзимопатий может приводить также нарушение поступления пищевых веществ из желудочно-кишечного тракта в кровь при длительных поносах, атрофии или поражении слизистой оболочки кишечника и др. К алиментарным энзимопатиям относят и так называемые токсические энзимопатии, связанные с угнетением активности или биосинтеза отдельных ферментов различными естественными компонентами пищевых продуктов (ингибиторы протеолитических ферментов, антивитамины и др.) или чужеродными веществами (например пестицидами), содержащимися в них. Клинические проявления приобретенных энзимопатий зависят от вида фермента, функция которого нарушена и характеризуется нарушениями того или иного вида обмена веществ. Разработаны методы дородовой диагностики наследственных ферментопатий (антенатальная диагностика), которая основана на определении активности ферментов в клетках хориона или амниотической жидкости, полученной при амниоцентезе на 16-й неделе беременности. Методы генно-инженерной диагностики ферментопатий охватывают все более широкий перечень заболеваний и в ближайшем будущем займут ведущее место, хотя и не исключают необходимость исследования активности ферментов биохимическими приемами. В последние годы стали известны нормальные вариации активности ферментов, участвующих в инактивации токсических продуктов как экзогенных, так и образующихся в процессе обмена веществ. Эти вариации наследуются в соответствии с законами Менделя и определяют существование в популяции фенотипов быстрых и медленных инактиваторов. Они установлены для таких ферментов, как арилуглеводород-гидроксилаза (скорость окисления полициклических углеводородов), параоксоназа (гидролиз фосфоорганических пестицидов), семейство цитохром Р-450-оксидаз (чувствительность организма к действию многих лекарственных препаратов), трансфераза глюкуроновой кислоты (гликозилирование эндогенных и экзогенных соединений) и ряда др. Такие генетически детерминированные варианты ферментативной активности изучают экогенетика и фармакогенетика человека. Практическое занятие №3. |
