Методички педфака на весенний семестр 2014. Структура и свойства белков. Методы выделения и очистки белков. Нарушения белкового состава сыворотки крови
 Скачать 1.9 Mb. Скачать 1.9 Mb.
|
2,5 г во всем объеме крови), но и внутриклеточное содержание их также невелико. Принято считать, что в норме АК составляют так называемый сбалансированный внутриклеточный пул свободных аминокислот, который характеризует интенсивность процессов поступления и |
| Проведен анализ литературы, посвященной методам определения активности аминотрансфераз. Представленные в обзоре данные указывают на то, что использование методов, приближающихся по составу к категории «оптимизированный», позволяет получать сопоставимые результаты в различных лабораториях. Приведены ситуации, в которых диагностическая значимость определения активности аминотрансфераз не вызывает сомнений. Аминотрансферазы – ферменты, катализирующие взаимное превращение аминокислот и α-кетокислот путем переноса аминогруппы, были открыты А. Е. Браунштейном и М. Г. Крицман в 1937 г. Переаминирование протекает в присутствии кофермента – фосфопиридоксаля, являющегося фосфорилированным производным витамина В6. 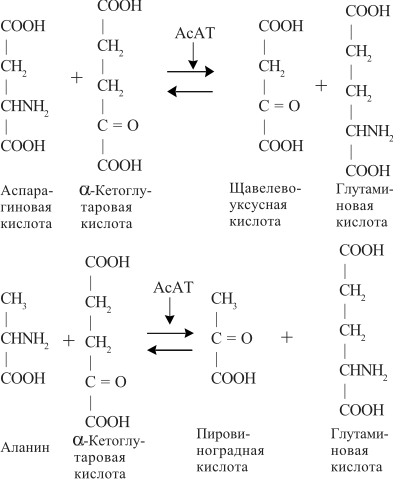 Наибольшее клинико-диагностическое значение получило определение активности двух аминотрансфераз: аспартатаминотрансферазы (КФ.2.6.1.1; L-аспатрат:2-оксоглутарат аминотрансфераза) и аланинаминотрансферазы (КФ.2.6.1.2; L-аланин:2-оксоглутарат аминотрансфераза). Для их обозначения используют сочетание трех или четырех символов – АСТ и АЛТ и АсАТ и АлАТ. В ряде случаев продолжают использовать устаревший термин «трансаминазы». Специфичность аминотрансфераз определяется аминокислотами, являющимися донорами аминогруппы: аланин – для аланинаминотрансферазы и аспарагиновая кислота – для аспартатаминотрансферазы. Реакции, катализируемые АсАТ и АлАТ, описывают следующими уравнениями: Обе реакции обратимы, равновесие сдвинуто в сторону образования аспарагиновой кислоты и аланина. Пиридоксаль-5'-фосфат (фософпиридоксаль, П-5'-Ф) в реакциях переаминирования участвует в роли кофермента. На первом этапе реакции П-5'-Ф, связанный с апоэнзимом, воспринимает аминогруппу от субстрата реакции – аспарагиновой кислоты или аланина и превращается в пиридоксамин-5'-фосфат, при этом образуются продукты реакции переаминирования кетокислоты: щавелевоуксусная кислота (ЩУК) или пировиноградная кислота (ПВК). На втором этапе аминогруппа переносится на ?-кетоглутаровую кислоту, при этом образуется другой продукт реакции – глутаминовая кислота, пиридоксамин-5'-Ф при этом превращается в П-5'-Ф. В тканевых гомогенатах обе аминотрансферазы – и АсАТ, и АлАТ – находятся в форме холоферментов, то есть связаны с коферментом. В процессе выделения аминотрансфераз из тканевых гомогенатов простетическая группа П-5'-Ф может теряться и активность фермента снижаться. От АсАТ кофермент отделяется легче, чем от АлАТ [1]. В сыворотке обе аминотрансферазы могут находиться как в виде холофермента, так и в виде апофермента. Остается неясным, теряется ли простетическая группа молекулой фермента в процессе выхода из клетки в кровоток, либо молекулы фермента высвобождаются из клетки в апоформе. Добавление П-5'-Ф в инкубационную среду способствует значительному увеличению активности аминотрансфераз в сыворотке: для АсАТ оно может составлять до 50 %, для АлАТ – до 20%. Подобного рода прирост активности аминотрансфераз наблюдается при использовании контрольных сывороток, обогащенных частично очищенными тканевыми аминотрансферазами, если измерение активности проводят в присутствии П-5'-Ф. В связи с этим для оптимизации условий определения активности аминотрансфераз экспертная группа по ферментам IFCC рекомендует добавление П-5'-Ф в среду инкубации [2]. Распределение аминотрансфераз в тканях человека. Аминотрансферазы широко распространены в тканях человека. И АсАТ, и АлАТ обнаруживают в плазме, спинномозговой жидкости, слюне, желчи. Распределение активности аминотрансфераз в тканях человека представлено в табл. 1. 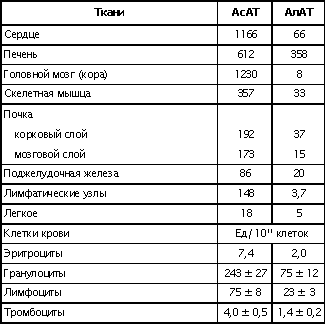 Таблица 1. Активность аминотрансфераз в тканях человека и сыворотке (Ед/г белка) [3] Как следует из представленных в табл. 1 данных, активность АлАТ, выраженная в Ед (мкмоль/мин) и отнесенная к 1 г тканевого белка, во всех изученных образцах тканей ниже, чем активность АсАТ. Активность АлАТ наиболее высокая в печени. В сердце активность АсАТ выше, чем в печени. В мышечной ткани наиболее высокая активность АсАТ обнаружена в сердце и большой грудной мышце (m. pectoralis major); гладких мышцах активность АсАТ и АлАТ низкая [4]. Внутриклеточная локализация. Из тканей человека были выделены, очищены и изучены два изофермента АсАТ – митохондральный и цитоплазматический. В сердечной мышце было обнаружено самое высокое содержание митохондриального изофермента АсАТ, в гладких мышцах – самое низкое. В эмбриональных тканях активность АсАТ обычно выше, чем в тканях взрослого организма. Низкое содержание митохондриального изофермента обнаружено в ткани поджелудочной железы (табл. 1). АлАТ – фермент, локализующийся преимущественно в цитоплазме клетки, хотя в тканях человека часть активности была найдена в митохондриях [5]. Активность аминотрансфераз в органах и тканях мужчин выше, чем у женщин, причины этих различий в активности не выяснены. Клиническое значение определения активности АсАТ и АлАТ в крови. Заболевания печени. Аминотрансферазы представляют группу ферментов печени, сывороточная активность которых изменяется при большинстве острых и хронических заболеваний печени. АсАТ и АлАТ содержатся в печени в высоких концентрациях (см. табл.1). При некрозе клеток и повышении проницаемости мембран гепатоцитов аминотрансферазы высвобождаются и их активность в сыворотке повышается. Изменение активности АлАТ в сыворотке наиболее часто отмечают при острых заболеваниях печени и желчевыводящих путей; увеличение активности АсАТ является более чувствительным тестом для диагностики хронических процессов. Разная чувствительность и специфичность АсАТ и АлАТ при диагностике заболеваний печени в ряде случаев указывает на необходимость одновременного определения активности обеих аминотрансфераз. Увеличение активности АлАТ в сыворотке крови при вирусном гепатите А может быть обнаружено в преджелтушной стадии заболевания, а при эпидемических вспышках – за 1–4 нед до клинических проявлений. Активность фермента начинает увеличиваться за неделю до появления клинических симптомов, приблизительно у 50% больных увеличение активности обнаруживают за 5 дней до появления желтухи или увеличения печени и у 90% – за 2 дня до ее развития [6]. Пик ферментативной активности выявляют приблизительно за 7–10 дней до выявления максимального уровня билирубина в крови. В этот период увеличение активности АлАТ может превышать норму в 10–100 раз, но обычно – в 20–50 раз. У 90% больных активность АлАТ выше активности АсАТ [7]. Четкой зависимости между активностью АлАТ и клинической картиной заболевания не было установлено. Быстрое снижение активности обеих аминотрансфераз может наблюдаться через несколько дней после появления желтухи, оно предшествует нормализации уровня билирубина и часто протекает параллельно клиническому улучшению. Определение активности аминотрансфераз в динамике в ряде случаев позволяет прогнозировать исход заболевания. У ряда больных с безжелтушной формой гепатита увеличение активности аминотрансфераз позволяет подтвердить диагноз. При неосложненном течении заболевания активность аминотрансфераз приближается к норме через 2–5 нед после появления желтухи, у 75% больных – к концу 8-й недели. Снижение активности АсАТ происходит быстрее, чем АлАТ. В частности, через 3 нед после начала заболевания активность АсАТ нормализовалась у 40%, тогда как активность АлАТ нормализовалась только у 10% больных [8]. У части больных активность ферментов может вновь увеличиваться после нормализации, что может свидетельствовать о рецидиве заболевания. Как правило, при остром гепатите активность АлАТ выше активности АсАТ. Это связано, скорее всего, с тем, что при сравнимой скорости высвобождения ферментов из клетки период полужизни цитоплазматического изофермента АсАТ составляет 14 ч, митохондриального изофермента – 6 ч, а АлАТ – 50 ч. Увеличение активности АсАТ связывают с высвобождением дополнительных количеств митохондриальной АсАТ при более тяжелом поражении клетки. Полагают, что длительное сохранение большей активности АлАТ, чем верхняя граница нормы, свидетельствует о хронизации процесса или развитии цирроза печени [9]. Характер изменений активности аминотрансфераз при гепатите В мало отличается от изменений активности этих ферментов при гепатите А. Как следствие более длительного инкубационного периода, активность аминотрансфераз в сыворотке может повышаться за несколько недель до появления желтухи. Склонность к хроническому течению данной формы гепатита чаще приводит к более длительному повышению активности фермента в сыворотке крови. Повышение активности аминотрансфераз у лиц, бывших в контакте с больными гепатитом, может в ряде случаев указывать на стертые или доклинические формы болезни, при этом показатель АлАТ оказывается более чувствительным признаком, чем АсАТ [10]. В ряде исследований было показано увеличение активности аминотрансфераз в сыворотке крови доноров. Гепатиты после переливания крови с увеличенной активностью аминотрансфераз встречаются в 4–20 раз чаще, чем после переливания крови с нормальным уровнем их активности [11]. Активность АсАТ и АлАТ в сыворотке крови возрастает в 80% случаев заболевания инфекционным мононуклеозом. Активность аминотрансфераз увеличивается на ранних сроках заболевания, максимального значения их активность достигает между 2-й и 3-й неделей и нормализуется на 5-й неделе, активность АлАТ обычно выше, чем АсАТ. Не было выявлено зависимости между активностью ферментов и тяжестью заболевания [12]. Заболевания сердечной мышцы. После развития инфаркта миокарда активность АсАТ в сыворотке повышается, что представляется вполне естественным из-за достаточно высокой активности АсАТ в сердечной мышце (см. табл. 1). В результате ишемического повреждения кардиомиоцитов из поврежденных участков сердечной мышцы может высвобождаться до 25% АсАТ, содержащейся в клетках. Одна треть из этого количества попадает в кровь через лимфатическую систему, большая часть – через капилляры [13]. Активность фермента в сыворотке начинает увеличиваться через 6–8 ч после появления болей в грудной клетке. Активность АсАТ достигает пика через 18–24 ч и снижается до нормы на 5-е сутки. Величина пиковых значений активности АсАТ может характеризовать размеры поврежденного участка сердечной мышцы. Активность АсАТ при инфаркте миокарда обычно повышается в 4–5 раз по сравнению с верхними значениями нормы; 10–15-кратное повышение чаще наблюдается при обширном инфаркте. В то же время, небольшое повышение активности в сыворотке не гарантирует благоприятный прогноз заболевания. Высокий уровень АсАТ выявляют в 97 % случаев инфаркта миокарда. Ввиду того, что содержание АлАТ в сердечной мышце относительно невелико, активность АлАТ может не меняться или умеренно увеличиваться при несложном инфаркте миокарда. Многие авторы сомневаются в том, что повышение ее активности в сыворотке связано с выходом фермента из миокардиоцитов. Заметное увеличение активности АлАТ принято связывать с повреждением печени. Митохондриальный изофермент АсАТ (АсАТмит) появляется в сыворотке позднее, на фоне уже повышенной общей активности АсАТ. Некоторые авторы указывают на связь между длительностью гиперферментемии и смертностью. Отдаленный прогноз при инфаркте неблагоприятен при высокой активности фермента [14]. Высокая активность обеих аминотрансфераз с большой вероятностью указывает на повреждение печени, вызванное острой сердечной недостаточностью. У большинства больных с сердечной недостаточностью активность аминотрансфераз в сыворотке может оставаться нормальной. В настоящее время при диагностике инфаркта миокарда определение АсАТ практически вытеснено определением массовой концентрации изофермента КК-МВ и сердечного тропонина в крови [15]. Заболевания скелетных мышц. При заболеваниях скелетных мышц активность аминотрансфераз меняется менее значительно, по сравнению с креатинкиназой и ее изоферментами. В частности, при алкогольной миопатии изменения активности АсАТ менее выражены по сравнению с активностью КК [16]. Увеличение активности АсАТ в сыворотке при миодистрофиях свидетельствует, скорее, о поражении печени, на что, в частности, может указывать и одновременное повышение активности АлАТ. При злокачественной гипертермии, развившейся после ингаляционной анестезии или применения миорелаксантов, активность КК, АсАТ и ряда других ферментов в крови начинает возрастать до повышения температуры тела [17]. В частности, было описано более чем 330-кратное увеличение АсАТ, по сравнению с нормой, и увеличение активности АлАТ [18]. Миопатии при эндокринных заболеваниях, например при гипер- или гипотиреозе, обычно протекают на фоне нормальной или слегка увеличенной активности АсАТ и АлАТ. Степень изменений активности аминотрансфераз при полимиозите зависит от активности и стадии заболевания. У 50% больных активность АсАТ может превышать в 30 раз значения нормы [19]. Более чем у 80% этой группы больных может увеличиваться активность АлАТ. У многих больных миопатиями и c нейромышечными заболеваниями на ранних стадиях процесса активность фермента в ткани мышцы может оставаться нормальной или даже увеличенной. При прогрессировании процесса активность фермента в мышце постепенно снижается, на этом фоне начинается постепенное падение активности ферментов в сыворотке [20]. Среди различных миопатий самую высокую активность сывороточных ферментов обнаруживают при миопатии Дюшенна. Изменения активности КК практически всегда более выражены по сравнению с изменениями активности аминотрансфераз [21]. Более чем у 50 % больных с тромбоэмболией легочной артерии активность аминотрансфераз в сыворотке крови не меняется. Повышение их активности, чаще 2–3-кратное, объясняют острой перегрузкой печени на фоне недостаточности правых отделов сердца. Вовлечение печени в патологический процесс является, как правило, причиной увеличенной активности аминотрансфераз в сыворотке при многих заболеваниях, в этих случаях определение АсАТ и АлАТ не имеет существенного диагностического значения. Спинномозговая жидкость и секрет. В спинномозговой жидкости здоровых людей нормальный диапазон активности АсАТ и АлАТ составляет около 60% от их активности в сыворотке. Зависимости между их активностью, возрастом и полом больных не было выявлено. Заметное повышение активности АсАТ было обнаружено в спинномозговой жидкости у больных после травмы головного мозга. Считают, что заметное повышение активности АсАТ и в сыворотке, и спинномозговой жидкости может указывать на массивное повреждение ткани мозга и неблагоприятный исход заболевания. Увеличение активности фермента только в спинномозговой жидкости может указывать на благоприятный исход. Злокачественные опухоли головного и спинного мозга сопровождаются в различной степени выраженном повышении активности АсАТ в спинномозговой жидкости. У больных с бактериальным менингитом обычно выявляют нормальную активность. По общему мнению, увеличение активности аминотрансфераз в спинномозговой жидкости при заболеваниях центральной нервной системы не имеет существенного диагностического значения. Активность аминотрансфераз обнаруживают в моче здорового человека. Активность АсАТ и АлАТ обычно не превышает 3–4 Ед/л. Большинство исследователей указывают на то, что определение активности аминотрансфераз в моче не имеет существенного диагностического значения. Пузырная желчь, так же как и содержимое двенадцатиперстной кишки, мало пригодна для определения активности аминотрансфераз из-за ингибирования активности ферментов желчными кислотами. Ингибирование активности АсАТ и АлАТ желчными кислотами можно предотвратить добавлением альбумина в среду инкубации. В желчи человека, полученной из печеночного протока, активность аминотрансфераз близка к активности ферментов в плазме. По другим данным, активность АлАТ в желчи ниже, чем в плазме [26]. Полагают, что инактивация ферментов происходит в желчном пузыре и ее выраженность определяется временем нахождения ферментов в желчном пузыре. В слюне человека, полученной после стимуляции, активность АсАТ выше, а активность АлАТ ниже, чем в сыворотке. Референтные интервалы активности аминотрансфераз в плазме или сыворотке человека. 1. При использовании «оптимизированных» методов верхние пределы референтных значений у мужчин выше, чем у женщин; различия для АсАТ составляют 25%, для АлАТ – 40% [28]. 2. У новорожденных и детей активность аминотрансфераз в сыворотке выше, чем у взрослых. В то же время нет единого мнения относительно возраста, при котором активность аминотрансфераз снижается до уровня активности у взрослых [29]. Противоречивы сообщения относительно референтных интервалов активности аминотрансфераз в преклонном возрасте. По одним данным, их активность повышается [30]. В то же время имеются указания на то, что у ряда обследованных в возрасте выше 100 лет активность АсАТ в сыворотке не превышает активности фермента в сыворотке 30-летних. Скорее всего, подобные разногласия вызваны наличием у обследуемых заболеваний, сопровождающихся повышением активности аминотрансфераз. 3. При наблюдении (более 1 года) за группой здоровых людей было выявлено внутрииндивидуальное постоянство активности аминотрансфераз сыворотки крови. При наблюдении за этой группой более трех лет было установлено, что у ряда испытуемых активность ферментов удерживалась на постоянном уровне, тогда как у других участников изменялась во всем диапазоне референтных значений [32]. 4. Гемолиз и, особенно, тромбоцитолизис сказываются на активности ферментов. В сыворотке активность АсАТ может превышать на 10%, а АлАТ – на 3% [33]. Вопрос о наличии зависимости между активностью аминотрансфераз и массой тела окончательно не решен. По мнению одних авторов, избыточной массе тела сопутствует более высокая активность аминотрансфераз [34], активность АлАТ при этом выше активности АсАТ, активность АсАТ выше у мужчин, чем у женщин. При биопсии печени у 62 из 72 мужчин с излишней массой и увеличенной активностью АлАТ были выявлены признаки жировой дистрофии печени, что может указывать на то, что повышение активности фермента связано, в большей мере, именно с заболеваниями печени, а не с самой избыточной массой тела. 5. Большинство исследователей не выявили сезонных и суточных колебаний активности АлАТ и АсАТ или связи между их активностью и приемом пищи. При голодании активность АсАТ может снижаться. Установлено, что тяжелая физическая нагрузка приводит к увеличению активности АсАТ в сыворотке крови. Активность аминотрансфераз в сыворотке обычно не меняется при нормально протекающей беременности. 6. Референтные значения зависят от насыщения апофермента коферментом П-5'-Ф. При адекватном питании степень активации АсАТ в сыворотке здоровых людей может составить 30–40% , у АлАТ – от 10 до 20%. Учитывая подобную зависимость, Международная федерация клинической химии рекомендует определение активности аминотрансфераз проводить в присутствии П-5'-Ф [36]. Методы определения активности аминотрансфераз. Все известные методы оценки скорости реакций переаминирования при участии АсАТ и АлАТ основаны на определении содержания кетокислот в среде инкубации. Методы с фиксированным временем инкубации (end point). Основаны на способности кетокислот вступать в реакцию с 2,4-динитрофенилгидразином (2,4-ДНФГ) и образовывать гидразоны кетокислот. Данный принцип лежит в основе хорошо известного колориметрического метода определения активности аминотрансфераз, разработанный S. Reitman и S. Frankel в 1957 г., служившего у нас в стране в качестве унифицированного. 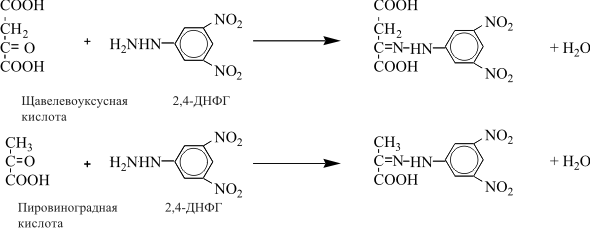 При определении активности аминотрансфераз в среде инкубации могут находиться одновременно две кетокислоты. При определении АсАТ – это α-кетоглутаровая и щавелевоуксусная кислота, при определении АлАТ – α-кетоглутаровая и пировиноградная кислота. Обе кетокислоты легко вступают в реакцию с 2,4-ДНФГ и образуют соответствующие 2,4-динитрофенилгидразоны: В начале реакции, катализируемой АсАТ, в инкубационной среде содержится только α-кетоглутаровая кислота, определяющая величину поглощения в контрольной пробе. В ходе реакции ее концентрация снижается, а содержание ЩУК возрастает. В ходе реакции, катализируемой АлАТ, в среде инкубации происходит накопление ПВК и уменьшение содержания α-кетоглутаровой кислоты. Некоторые кетокислоты, в частности пировиноградная кислота, ацетоуксусная кислота, ацетон (диметилкетон), способны к образованию фенилгидразонов. При увеличении их содержания в крови они способствуют увеличению величины поглощения инкубационной среды и контроля. Некоторые ограничения фотометрического метода определения АсАТ и АлАТ связаны с тем, что максимум поглощения фенилгидразонов щавелевоуксусной, пировиноградной и α-кетоглутаровой кислоты достаточно близки: 380 и 350 нм, соответственно. В то же время, фотометрические методы, основанные на образовании гидразонов α-кетокислот, относительно просты и обладают ограниченной, но приемлемой точностью. Наиболее удобным оказался метод, разработанный S. Reitman и S. Frankel [37]. Приведенный метод относят к категории так называемых «одноточечных методов» (end point), то есть методов с фиксированным временем инкубации. Его недостатком является невозможность определения активности фермента в широком диапазоне активности из-за ингибирования фермента – АсАТ продуктом реакции – ЩУК, накапливающейся в среде инкубации при исследовании образцов с высокой активностью. Показано, что ЩУК способна ингибировать оба изофермента АсАТ, митохондриальный изофермент ингибируется в большей степени. При высокой активности АлАТ концентрация субстрата может быстро снижаться, что приводит к отклонению от кинетики рулевого порядка. Методы непрерывной регистрации (kinetic). Контроль над скоростью реакции переаминирования можно осуществлять сочетанием аминотрансферазной реакции с реакцией, катализируемой соответствующей субстрату дегидрогеназой. Кетокислоты, образующиеся в аминотрансферазной реакции, определяют путем ферментативного превращения в соответствующие гидроксикислоты по изменению концентрации НАДН2 в среде инкубации. Например, ЩУК превращается в яблочную кислоту в присутствии малатдегидрогеназы (МДГ), а ПВК превращается в молочную кислоту при участии лактатдегидрогеназы (ЛДГ): 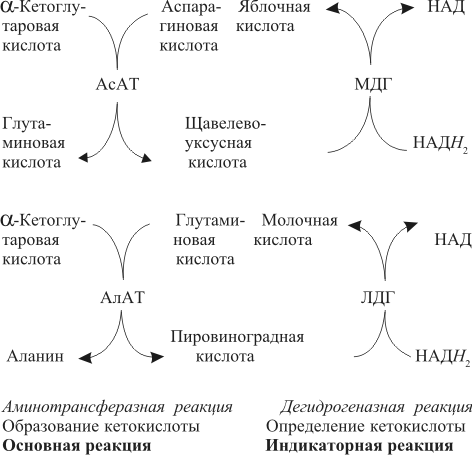 Субстраты, кофермент НАДН2 и вспомогательные ферменты МДГ и ЛДГ добавляют в среду инкубации в таких количествах, чтобы скорость реакции зависела только от активности АсАТ и АлАТ. В ходе реакции происходит превращение НАДН2 в НАД. Изменение количества НАДН2 в единицу времени в инкубационной среде контролируют либо непрерывно, либо через короткие промежутки времени по изменению поглощения при 340 нм. Изменение поглощения в минуту (ΔA/мин), обусловленное окислением НАДН2, связано с количеством субстрата, преобразованного ферментом в единицу времени. При определении активности аминотрансфераз данным методом требуется фотометр, позволяющий проводить измерения при длине волны 340 нм. Температуру инкубационной среды в кювете необходимо поддерживать на постоянном уровне. Запуск реакции проводят после окончания восстановления НАДН2 при участии эндогенных кетокислот, попадающих в инкубационную среду вместе с исследуемым образцом. После окончания лаг-фазы реакцию запускают добавлением субстрата – α-кетоглутаровой кислоты и контролируют изменение поглощения ΔA/мин. В связи с тем, что величина поглощения инкубационной среды в начале реакции составляет 1,3–1,5, для установки исходного поглощения реакционной смеси в пределах 0,7–0,9 в качестве контрольной пробы (blank) используют раствор бихромата калия [38]. Для определения активности АсАТ было предложено сочетание иных ферментативных реакций при использовании глутаматдегидрогеназы (ГлДГ) в качестве индикаторного фермента и НАД в качестве кофермента: 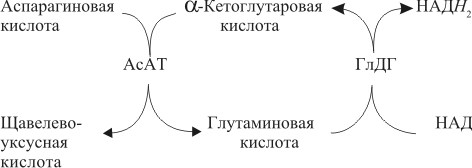 Глутаминовая кислота, образующаяся в аминотрансферазной реакции, подвергается окислительному дезаминированию при участии ГлДГ. В результате, образуется NH3 , α-кетоглутаровая кислота и происходит восстановление НАД до НАДН2. Скорость образования НАДН2 используют для расчета активности АсАТ. В настоящее время активность АсАТ и АлАТ в сыворотке в подавляющем большинстве зарубежных лабораторий определяют кинетическими методами. Наиболее популярные в настоящее время методы определения АлАТ приведены в табл. 2 . Как видно из представленных в ней данных, методы различаются по некоторым параметрам: концентрации субстрата, типу буферного раствора (трис или фосфатный) и температуре реакции. При выборе условий реакции авторы стремились подобрать оптимальные соотношения между компонентами инкубационной среды, определяющими скорость реакции. Определение аминотрансферазной активности образца рекомендуют проводить в присутствии кофермента аминотрансфераз П-5'-Ф. 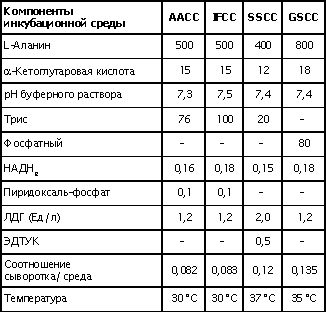 Таблица 2.Конечная концентрация реактивов (ммоль/л) в разных методах определения активности АлАТ Примечание. ААСС – Американская ассоциация клинической химии; IFCC – Международная федерация клинической химии; SSCC – Скандинавское общество клинической химии и клинической физиологии; GSCC – Немецкое общество клинической химии Определение активности АсАТ по ААСС. В данном методе в качестве буферного раствора использован трис вместо фосфатного, так как, по мнению авторов, в данном буферном растворе ассоциация кофермента П-5'-Ф с апоферментом протекает быстрее и растворы НАДН2 дольше остаются стабильными. Определение активности АсАТ проводят в присутствии кофермента П-5'-Ф. Ускорение протекания эндогенных реакций, связанных с потреблением НАДН2, и укорочение периода преинкубации достигается добавлением в среду инкубации ЛДГ. Поддержание рН среды в пределах 7,65 и температуры 37°С обеспечивает оптимальные условия для протекания аминотрансферазной и сопряженных реакций. Для разведения ферментных препаратов МДГ и ЛДГ используют растворы глицерина, а не сульфата аммония (NH4)2SO4 , чтобы избежать попадания ионов аммония и ускорения потребления НАДН2 при участии ГлДГ сыворотки крови. Конечная концентрация реактивов в среде инкубации: трис-буфер, рН 7,65 – 90 ммоль/л; аспарагиновая кислота – 175 ммоль/л; α-кетоглутаровая кислота – 15 ммоль/л; НАДН2 – 0,15 ммоль/л; МДГ – 600 Ед/л (25 °С); ЛДГ – 1200 Ед/л (25 °С ); П-5'-Ф – 0,12 ммоль/л. Соотношение объема сыворотки к общему объему инкубационной среды (разведение сыворотки) 1:15. Концентрации субстрата в данном методе отвечают требованиям Группы по ферментам AACC. Иную концентрацию субстрата рекомендует Экспертная группа по ферментам IFCC: аспарагиновая кислота – 240 ммоль/л; α-кетоглутаровая кислота – 12 ммоль/л. Несмотря на эти различия, используемая в обоих методах концентрация субстрата обеспечивает скорость реакции в пределах 96% от теоретических значений Vmax [39]. Примечание 1. У больных с заболеваниями печени в сыворотке крови может повышаться активность глутаматдегидрогеназы (ГлДГ). При увеличении содержания аммиака в сыворотке или его попадании в среду реакции в составе реактивов в виде сульфата аммония, ГлДГ способна конкурировать с АсАТ за α-кетоглутаровую кислоту и НАДН2 и приводить к ложному занижению результатов. 2. Побочные реакции на этапе преинкубации в ряде образцов сыворотки способны приводить к расходованию большей части НАДН2 и быстрому снижению величины ΔA/мин. В этих случаях следует повторить определение с более высокой исходной концентрацией НАДН2 или разведенной сывороткой. 3. При высоких значениях ΔA/мин сыворотку разводят раствором хлорида натрия (9,0 г/л), хотя более корректно для разведения использовать раствор альбумина 5 г/л. 4. В гемолизированных образцах сыворотки активность аминотрансфераз может повышаться за счет выхода ферментов из эритроцитов. 5. Замораживание и хранение сыворотки не сказывается на активности аминотрансфераз. Незначительная потеря активности может происходить при хранении сыворотки при температуре 4°С в течение 3 дней. Референтные интервалы, Ед/л при температуре 37°С [40]  Распределение активности сдвинуто в сторону высоких значений, что, вероятнее всего, связано с включением в референтные значения результатов, полученных при определении активности в гемолизированной сыворотке или сыворотке людей с бессимптомными заболеваниями печени. Определение активности аланинаминотрансферазы Используемая процедура напоминает метод определения активности АсАТ, за исключением того, что вместо аспарагиновой кислоты в качестве донора аминогруппы использован аланин, ЛДГ – в качестве индикаторного фермента. Концентрация аланина, необходимая для обеспечения оптимальных условий реакции, намного выше концентрации аспарагиновой кислоты при определении активности АсАТ. ЛДГ служит индикаторным ферментом и одновременно ускоряет протекание конкурирующих реакций. Для реакции избран рН 7,15 при 37°С, хотя оптимум значения рН для АлАТ достаточно широк. Состав реакционной среды: трис-буфер – 90 ммоль/л, рН 7,15; L-аланин – 500 ммоль/л; α-кетоглутаровая кислота – 15 ммоль/л; НАДН – 0,15 ммоль/л; ЛДГ – 2400 Ед/л; П-5-Ф – 0,12 ммоль/л. Разведение сыворотки 1:15. Концентрации субстрата соответствуют рекомендациям Группы по изучению ферментов AACC и Экспертной группы по ферментам IFCC и поддерживают скорость реакции на уровне 92% от теоретических значений Vмax. Референтные интервалы, Ед/л при 37° С [40] 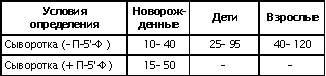 Определение активности аспартатаминотрансферазы и аланинаминотрансферазы в сыворотке крови с использованием 2,4-динитрофенилгидразина. Принцип метода: АсАТ катализирует реакцию переаминирования между аспарагиновой и α-кетоглутаровой кислотами с образованием глутаминовой и щавелевоуксусной кислот; АлАТ – реакцию переаминирования между аланином и α-кетоглутаровой кислотами с образованием глутаминовой и пировиноградной кислот. Об активности ферментов судят по приросту ЩУК и ПВК, образующих с 2,4-динитрофенилгидразином (2,4-ДНФГ) в кислой среде гидразоны соответствующих кетокислот, окрашиваемые в щелочной среде. Для получения воспроизводимых и корректных результатов при выполнении метода следует руководствоваться следующими рекомендациями. 1. Концентрацию соляной кислоты и гидроксида натрия следует четко выдерживать, поскольку образование гидразонов кетокислот проходит в кислой среде, а максимумом поглощения они обладают в щелочной среде. Время образования гидразонов кетокислот не должно быть менее 20 мин. 2. Концентрацию рабочего раствора гидроксида натрия (0,4 моль/л) следует проверять с помощью методов объемного анализа. Приготовленный раствор следует хранить в плотно закупоренной посуде. Присутствие больших количеств карбоната натрия в растворе может искажать результаты, в связи с чем рабочий раствор следует готовить из концентрированных растворов гидроксида натрия с концентрацией 400–500 г/л, «выстоявшихся» в течение 1–2 нед. 3. Калибровочный график для определения активности аминотрансфераз унифицированным методом строят с использованием дистиллированной воды вместо раствора субстрата. При корректном построении графика и использовании фотометров с невысокой степенью монохроматизации прямая зависимость между концентрацией ПВК в пробе и поглощением сохраняется до 0,25 мкмоль. При концентрации ПВК в пробе выше 0,25 мкмоль наблюдается отклонение от прямой пропорциональной зависимости. При использовании приборов с высокой степенью монохроматизации (КФК-3) или спектрофотометров (СФ-46) прямая пропорциональная зависимость соблюдается до концентрации ПВК в пробе 0,3 мкмоль. 4. В крови больных сахарным диабетом могут в избыточном количестве накапливаться кетокислоты и ацетон, способные образовывать соответствующие гидразоны в реакции с 2,4-ДНФГ и ложно завышать результаты определения, если фотометрия будет проводиться не против собственного контроля на реактивы, включающего исследуемый материал. 5. Время реакции при определении АлАТ должно составлять 30 мин, при определении АсАТ – 1 ч. Удлинение времени инкубации АлАТ до 1 ч завышает результаты по сравнению с 30-минутной инкубацией. Унифицированный метод определения активности аминотрансфераз относится к группе методов с фиксированным временем инкубации (end point), в которых отсутствует возможность наблюдать за скоростью реакции, в связи с чем часто сталкиваются с так называемым «эффектом разведения». Данный эффект характерен для сывороток крови с высокой активностью аминотрансфераз, в которых при разведении активность фермента возрастает непропорционально разведению. В основе данного феномена лежат особенности самого химического метода, где концентрация кетокислоты является недостаточной для того, чтобы обеспечить поддержание скорости ферментативной реакции. У практически здоровых людей каталитическая активность АсАТ составляет 0,028–0,125 мкмоль/с • л; АлАТ – 0,028–0,189 мкмоль/с • л. |



