Методички педфака на весенний семестр 2014. Структура и свойства белков. Методы выделения и очистки белков. Нарушения белкового состава сыворотки крови
 Скачать 1.9 Mb. Скачать 1.9 Mb.
|
                      Методички педфака на весенний семестр 2014 для педиатрического-4х часовые. Лабораторный практикум №1 Тема: Структура и свойства белков. Методы выделения и очистки белков. Нарушения белкового состава сыворотки крови. Цели занятия: Сформировать у студентов знание о структуре белков, уровнях организации белковых молекул, классификациях и биологической роли белков в организме человека. Познакомить студентов с методами анализа белков, основанными на их физико-химических свойствах, а также с методами количественного определения белков в биологических жидкостях и диагностическим значением этих методов. Сформировать у студентов навыки работы с рефрактометром и ФЭК-ом, умения анализировать протеинограммы и использовать полученные данные для диагностики заболеваний. Белки, являясь одним из основных компонентов организма, присутствуют во всех биологических жидкостях. Анализ количественного и качественного состава белков, циркулирующих в крови, позволяет оценить не только состояние обмена белков в организме, но и предположить нарушение функции отдельных органов и систем. Изменение соотношения отдельных белковых фракций плазмы крови имеет место при целом ряде физиологических и патологических состояний. Определение общего количества белка в сыворотки крови, а также оценка соотношения отдельных белковых фракций, имеет важное диагностическое значение. Хронометраж практического занятия: 1. Вводная беседа. Тестирование исходного уровня знаний— 15 мин. 2. Практическая часть – обсуждение теоретического материала, знакомство с методами анализа белка. Решение ситуационных задач – 45 мин. 4. Лабораторная работа– определение общего белка сыворотки крови по интенсивности окраски с биуретовым реактивом, анализ готовых хроматограмм аминокислот- 65 мин. 5. Контроль выполнения лабораторной работы, подведение итогов занятия — 10 мин. Продолжительность занятия — 3час(леч), 4 часа(пед) Методическое и материально-техническое оснащение (химическая посуда, биологический материал, ФЭК, рефрактометр (для демонстрации), набор разных хроматограмм аминокислот для анализа) Содержание темы:Белки – определение, роль в организме. Коротко повторить строение белков: альфа-аминокислоты, пептидная связь. Уровни организации белковой молекулы. Роль простетической группы. Конформация белка, доменное строение и их значение в функционировании белков. Физико-химические свойства белков (растворимость и осаждаемость, оптические и электрические свойства). Роль высших уровней организации белковых молекул (третичной и четвертичной структуры) в функционировании белков. Методы выделения, фракционирования очистки белков, основанные на физико-химических особенностях белковых молекул. Методы определения концентрации белка в биологических жидкостях: рефрактометрический, колориметрический. Нормальное содержание белка в сыворотке крови у детей в разные возрастные периоды и у взрослых. Электрофоретическое разделение белков сыворотки крови на бумаге и других носителях. Принципы методов. Нормы. Диагностическое значение. Базисные знания: Из курса органической химии студент должен знать и уметь писать структурные формулы протеиногенных аминокислот и пептидов; иметь представление о классификации аминокислот и белков, а также о физико-химических свойствах их (растворимость и осаждаемость, оптические и электрические свойства). Студент должен знать уровни организации белковой молекулы, характеристики связей, стабилизирующих первичную, вторичную, третичную и четвертичную структуры белков, биологическую роль аминокислот и белков. Студент должен уметь качественно обнаружить белок (биуретовая реакция) и аминокислоты (нингидриновая реакция) в растворе. Из курса физики студент должен знать устройство и принцип работы ФЭКа Учебная карта занятия: Вводная беседа. Кратко обсудить со студентами особенности структуры и уровни организации белковой молекулы в связи с физико-химическими свойствами и биологическими функциями белков. Ознакомить студентов с методами выделения, очистки и фракционирования белков, а также с методами количественного определения содержания общего белка в сыворотке крови и методом электрофоретического разделения белков сыворотки. Остановиться на диагностическом значении определения общего белка и его фракций. Познакомить студентов работой на ФЭКе и с методом построения и использованием калибровочного графика при колориметрических определениях. Дать краткую характеристику отдельных белковых фракций и индивидуальных белков, входящих в их состав. Обратить внимание на особенности нормальной протеинограммы в разные возрастные периоды у детей по сравнению со взрослыми (см. таблицу). Возрастные особенности нормальных величин белков плазмы крови
Отметить также, что резкое снижение количества белков плазмы в раннем детском возрасте – неблагоприятный симптом, который требует энергичного лечения. Продолжительная гипопротеинемия подавляет деятельность печени, нарушая обмен гликогена, процессы дезаминирования, декарбоксилирования, синтеза мочевины и других дезинтаксикационных процессов. Вопросы для собеседования.
Теоретическая часть. Разбор ситуационных задач:
4. Вам дали две пробирки с осажденным белком. Известно, что один осадок получен при действии сернокислого аммония, а второй – после добавления ТХУ. Как отличить их? В чем сходство и в чем отличие при действии этих агентов на белок? 5. Имеются пробирки с растворами: I концентрированной азотной кислоты II 10% трихлоруксусной кислоты III СuSO4 в10% NaOH Опишите, какие процессы произойдут в каждой пробирке при добавлении в них раствора белка. Какие из этих реакций находят практическое применение? 6. Белки, осуществляющие транспорт молекул или ионов через мембрану, часто классифицируются как трансмембранные белки. Такие белки имеют в своей структуре область, заключенную в липидном бислое мембраны, и области, обращенные внутрь клетки (в цитоплазму) и во внеклеточное пространство. Исходя из классификации аминокислот по полярности радикала, предположите, какие аминокислоты должны преобладать в различных участках данного трансмембранного протеина. 7. Найдите, в какой зоне рН (нейтральной, кислой или щелочной) лежит ИЭТ полипептида, состоящего из следующих аминокислотных остатков: арг-гис-глу-цис. В каком направлении будет двигаться данный пептид при разделении пептидов методом электрофореза в буферном растворе с нейтральным значением рН? Как изменится заряд и направление движения пептида в электрическом поле, если в составе пептида аргинин заменить лейцином? 8. Известно, что употребление в пищу сырых яиц может вызвать гиповитаминоз витамина Н. В составе яиц содержится белок авидин, который способен взаимодействовать с витамином Н и препятствовать его всасыванию в желудочно-кишечном тракте. Объясните, почему вареные яйца таким эффектом не обладают. 9. Больной 35 лет поступил в гастро-энтерологическое отделение. При обследовании обнаружено: общий белок сыворотки крови 59 г/л. Альбуминов – 45%, α-1 глобулины - 11%, α-2 глобулины – 10%, β-глобулины – 12%, γ-глобулинов – 22%. Оцените полученные данные. Предположите диагноз. Обоснуйте предположение. 10. Содержание общего белка в сыворотке крови ребенка 6 месяцев 72 г/л. Это норма? Если нет, как называется это состояние? Какие причины могли привести к его развитию? Почему? Практическая часть: 1.Метод количественного определения содержания белка в сыворотке крови по цветной реакции с биуретовым реактивом. Принцип метода: Ионы меди в щелочной среде при взаимодействии с пептидными связями в структуре белка дают комплексное соединение сине-фиолетового цвета. Интенсивность окраски прямопропорциональна концентрации белка в растворе. Оптическую плотность окрашенного раствора определяют на ФЭКе при зеленом светофильтре в кюветах шириной 10 мм. Ход работы: В две пробирки налить по 5 мл биуретового реактива. В первую (опытная) пробирку внести 0,1 мл исследуемой сыворотки, во вторую (контрольная) – 0,1 мл дистиллированной воды. Через 30 минут инкубации при комнатной температуре колориметрировать на ФЭКе. Концентрацию белка определить при помощи калибровочного графика. Сравнить с нормой. Сделать вывод. Для анализа должно быть подготовлено 3 пробы сыворотки крови (или имитация) – норма, гипопротеинемия и гиперпротеинемия. 2. Хроматографическое разделение смеси аминокислот(гидролизат белка). Теоретический анализ хроматограмм аминокислот (одна на пару студентов) Работа 2 . Анализ хроматограмм гидролизатов различных белков. ОБОРУДОВАНИЕ: хроматограммы различных белков, пробирки со спиртовым раствором для экстракции. ПРИНЦИП МЕТОДА. Аминокислотный состав гидролизатов белков исследуется с помощью распределительной хроматографии на бумаге. Распределительная хроматография основана на способности веществ по-разному адсорбироваться на адсорбентах и по-разному растворяться в полярных и неполярных растворителях. В качестве адсорбента в данном методе используется хроматографическая бумага. Разделение проводится смесью растворителей (бутанол + ледяная уксусная кислота + вода в соотношении 4:1:5). При этом вода удерживается бумагой, а органический растворитель движется по бумаге с определенной скоростью. Вещества (в данном случае аминокислоты), растворимые в органическом растворителе, будут двигаться по бумаге вместе с растворителем. Вещества, растворимые в воде, займут на хроматограмме промежуточное положение между линией старта и линией фронта растворителя. После окончания разделения и высушивания хроматограммы ее проявляют раствором нингидрина и вновь высушивают. После этого пятна разделенных аминокислот становятся видимыми и доступными для качественного и количественного анализа. ХОД РАБОТЫ. Студенты исследуют готовые хроматограммы различных белков. 1. Качественный анализ хроматограмм (идентификация пятен аминокислот). Производится путем расчета коэффициентов Rf для каждого пятна: 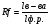 где Rf- коэффициент распределения, lв-ва- путь, пройденный веществом от линии старта, lф.р.- путь, пройденный фронтом растворителя от линии старта. Пользуясь табличными значениями Rf для каждой аминокислоты, идентифицируют аминокислоты исследуемой хроматограммы. Для расчета коэффициента измеряют расстояния от линии старта до центра каждого пятна и расстояние от линии старта до линии фронта растворителя. Рассчитанные значения коэффициентов Rf сравнивают с табличными данными и идентифицируют таким образом все пятна аминокислот на хроматограмме.
Задание на следующее занятие. Ферменты из РАБОЧЕЙ ТЕТРАДИ ПО БИОХИМИИ. Вопросы по теме для самостоятельного изучения их студентами: структура и функциональная роль шаперонов. Практические навыки, которыми должен овладеть студент по теме занятия: - написание структур пептидов из протеиногенных аминокислот - определение содержания белка в сыворотке крови, интерпретация полученного результата - анализ готовых хроматограмм, интерпретация результата Темы для реферативных сообщений – «Супервторичная и доменная структуры белка, их функциональное значение» Лабораторный практикум №2. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
