ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА И ТЕПЛОТЕХНИКА. Техническая термодинамика и теплотехника
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕССИзменение состояния рабочего тела вследствие воздействия на него внешней среды называется термодинамическим процессом (ТДП). ТДП характеризуется изменением основных параметров рабочего тела. ТДП могут быть равновесными и неравновесными. Равновесный процесс протекает так медленно, что в каждый выбранный момент времени значения параметров состояния в отдельных частях характеризуют равновесное состояние всей системы, а не отдельной ее части. Равновесные процессы можно описать графически, например, в виде изотерм. Неравновесные процессы не поддаются графическому изображению, так как рабочее тело системы, участвующее в процессе, одновременно имеет несколько разных значений параметров в различных частях. Обратимый процесс – процесс, который может происходить как в прямом, так и в обратном направлениях, причем при возвращении в первоначальное состояние (при изменении внешних условий в противоположной последовательности) система проходит все равновесные состояния прямого процесса, но в обратном порядке. Обратимые процессы – это идеализированные процессы с максимальной работой при расширении и минимальной при сжатии. Необратимый процесс – процесс, который может самопроизвольно протекать только в одном направлении. При таких процессах система не может возвратиться в исходное состояние без дополнительного внешнего воздействия. Всякий необратимый процесс изменения состояния рабочего тела является процессом неравновесным. Несколько последовательных ТДП составляющих замкнутый процесс образуют круговой процесс или цикл. Термодинамический цикл (см. рисунок 2), как и ТДП, может быть обратимым и необратимым. Обратимый цикл образуется только обратимыми процессами. 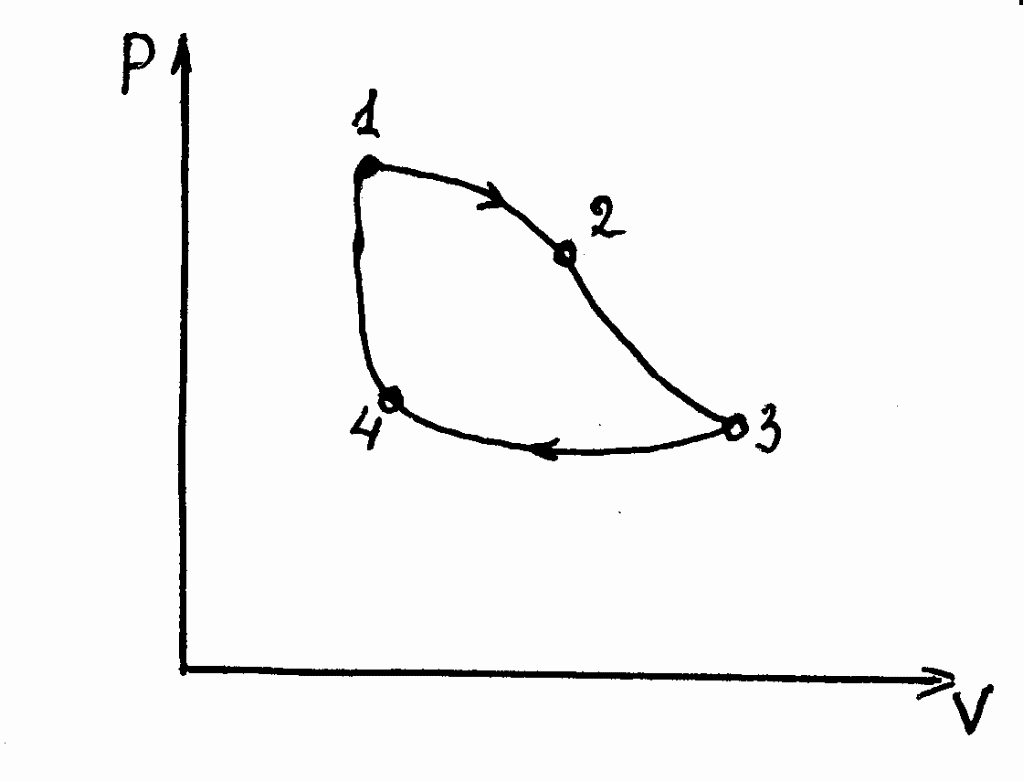 Рисунок 2 – Термодинамический цикл 7 ИДЕАЛЬНЫЕ ГАЗЫ И ИХ СМЕСИИдеальными газами (ИГ) называют такие, которые полностью подчиняются законам Бойля-Мариотта и Гей-Люссака. В ИГ отсутствуют силы взаимного притяжения и отталкивания между молекулами, а объем самих молекул пренебрежимо мал по сравнению с объемом газа. Состояние ИГ – это предельное состояние реального газа, когда давление стремится к нулю ( Введение понятия об идеальном газе позволило составить простые математические зависимости между величинами, характеризующими состояние тела, и на основе законов для ИГ создать стройную теорию ТДП. Закон Бойля – Мариотта (английский физик 1664 г. – французский химик 1676 г.) гласит: при постоянной температуре объем, занимаемый ИГ, изменяется обратно пропорционально его давлению: или при постоянной температуре Закон Гей-Люссака (французский физик 1803 г.) устанавливает зависимость между удельным объемом Совместное применение этих законов к произвольному процессу дает уравнение состояния ИГ: При умножении обеих частей уравнения (12) на массу газа (М, кг) получаем: PV=MRT(13) гдеR – удельная газовая постоянная, Уравнения (12) и (13) называются уравнениями Клапейрона. С достаточной для практики точностью их можно применять и для реальных газов, имеющих низкое давление и высокую температуру. Умножив обе части уравнения (13) на молярную массу газа ( Величина |
