ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА И ТЕПЛОТЕХНИКА. Техническая термодинамика и теплотехника
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
4Термодинамическая системаОбмен энергией в форме теплоты и в форме работы осуществляется между макроскопическими телами, которые принято называть рабочими телами. В технической термодинамике в качестве таковых рассматриваются газы и пары. Совокупность рабочих тел, обменивающихся энергией и веществом между собой называется термодинамической системой (ТДС). При этом теплообмен может происходить как внутри ТДС, так и с другими телами (внешней средой). Часть полного запаса энергии термодинамической системы, которая не связана с положением системы в поле внешних сил и движение в виде самой системы относительно внешней среды, называется внутренней энергией термодинамической системы. ТДС подразделяются на закрытые, открытые, изолированные и адиабатные при чем последние могут быть как открытыми, так и закрытыми. Открытой ТДС называют систему, которая обменивается веществом с другими системами, а в закрытой ТДС обмен веществом с другими системами отсутствует. В тех случаях, когда ТДС не обменивается ни энергией, ни веществом с другими системами, она называется изолированной. В адиабатной ТДС не происходит теплообмена с другими системами. Рабочими телами в ТДС в технической термодинамике наиболее часто служат воздух, водяной пар, аммиак, углекислый газ и многие другие. 3 ОСНОВНЫЕ ПАРАМЕТРЫ СОСТОЯНИЯПараметры состояния - физические величины, однозначно характеризующие состояние термодинамической системы и не зависящие от предыстории системы. К их числу относятся P, Tи V. Давление (Р) - физическая величина, характеризующая интенсивность нормальных сил, с которыми одно тело действует на поверхность другого. Единицей измерения давления является Паскаль (Па). Давление подразделяется на абсолютное Р, атмосферное Рa, избыточное Ри, вакуум РB (см. рисунок 1) 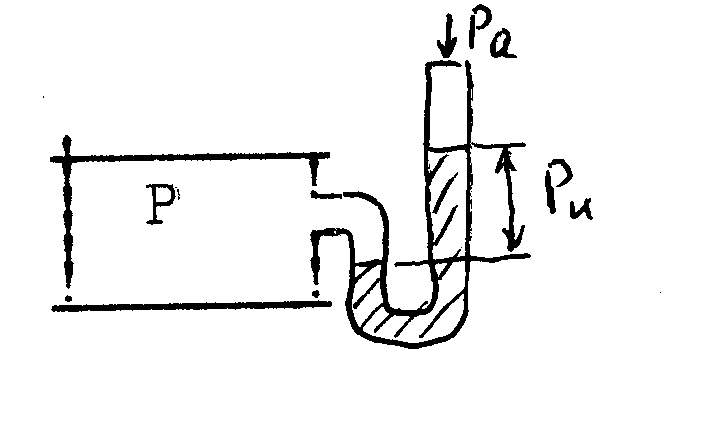 Рисунок 1 – Соотношение давлений Температура (Т) характеризует степень нагретости тела, связанную с кинетической энергией частиц рабочего тела. Чем ниже температура, тем меньше кинетическая энергия. Значения температуры определяют по температурному изменению какого-либо удобного для измерения физического свойства вещества с помощью температурной шкалы. Термодинамическая температурная шкала основана на втором начале термодинамики. Температура, при которой полностью прекращается тепловое движение молекул, принята за абсолютный нуль – начало отсчета. Другой точкой определяющей термодинамическую температурную шкалу, является температура тройной точки воды (температура равновесия между льдом, водой и паром), равная 273,16 К. За единицу измерения термодинамической температурной шкалы принят градус Кельвина (Т, К), равный Объем (V) рабочего тела в измеряется в м3. Удельным объемом называется объем Величина обратная Иногда употребляют понятие удельного веса вещества. Под удельным весом понимают вес вещества в единице его объема. В соответствии со вторым законом Ньютона плотность и удельный вес связаны соотношением: где g – ускорение свободного падения, м/с2. 5 Уравнение состояние Состояние ТДС может быть равновесным и неравновесным. Равновесное состояние изолированной ТДС характеризуется постоянством по всему объему, занимаемому системой, таких параметров, как Р (механическое равновесие) и Т (термическое равновесие). В неизолированной системе равновесное состояние однозначно определяется внешними условиями, т.е. давлением и температурой внешней среды. В равновесных ТДС отсутствуют стационарные потоки, например, теплоты и вещества. Всякая изолированная система с течением времени приходит в равновесное состояние, которое остается затем неизменным, пока система не будет выведена из него внешним воздействием. Уравнение состояние – уравнение выражающее связь между параметрами равновесного состояния ТДС. Математическая зависимость между тремя параметрами для состояния равновесия носит название термическое уравнение состояния. В общем виде оно выражается: F(V,P,T,)=0 (1) Выражая каждый из термических параметров как явную функцию двух других, уравнение (1) можно представить в виде следующей системы: 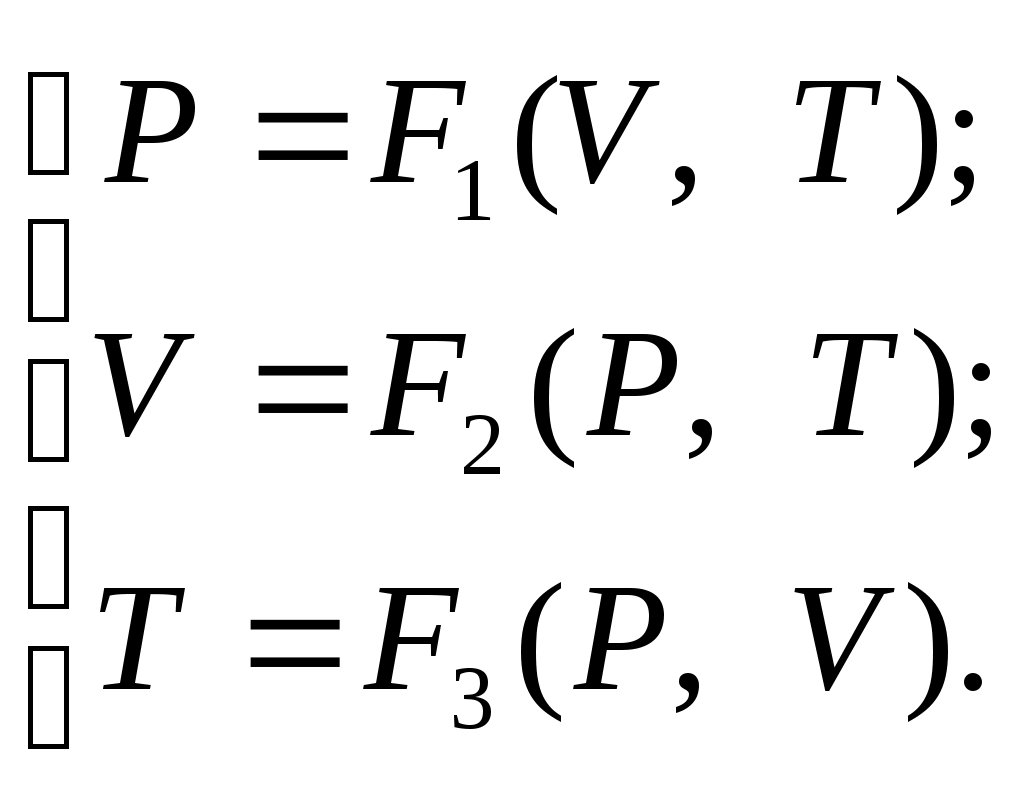 (2) (2)Продифференцировав эту систему уравнений по независимым переменным, получим приращение параметров: В индексе при частной производной указан постоянный параметр. Приняв условие dP=0, можно получить дифференциальное уравнение состояния: куда входят частные производные, имеющие определенный физический смысл – термические характеристики рабочего тела. При расчетах обычно используются значения, получаемые путем деления где Подставив выражения (5), (6), (7) в уравнение (4) получим: Так как соотношения (3-7) выведены на основе зависимостей (2), то выражение (8) справедливо для любых рабочих тел. 6 Работа газа и теплота При расширении газ совершает работу против внешней среды, передавая ей при этом энергию. При сжатии наоборот, газ воспринимает работу, совершенную внешней средой и увеличивающей его внутреннюю энергию. При этом осуществление работы возможно при наличие по меньшей мере двух движущихся тел, одно из которых оказывает силовое воздействие на другое. Из сказанного следует, что работа есть одна из форм передачи энергии от одного тела к другому. Количество работы представляет собой меру передаваемой энергии. Количество энергии, полученное телом в форме работы, называется совершенной над телом работой, а отданную энергию в форме работы – затраченной телом работой. Другой способ передачи энергии реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел либо лучистым переносом внутренней энергии излучающих тел путем электромагнитных волн, при этом энергия передается от более нагретого тела к менее нагретому. Количество энергии переданное этим способом от одного тела к другому называют количеством теплоты, а сам способ – передачей энергии в форме теплоты. Получаемая теплота называется подведенной, а отданная – отведенной теплотой. В общем случае передача энергии в форме теплоты и в форме работы может происходить одновременно. При этом необходимо отметить, что в различных термодинамических процессах в зависимости от условий их протекания количества теплоты и работы различны. Следовательно, теплота и работа характеризуют качественно и количественно две различные формы передачи движения от одних тел материального мира к другим. Работа представляет собой макрофизическую форму передачи энергии, а теплота есть совокупность микрофизических процессов, поскольку передача энергии этим способом происходит на молекулярном уровне без видимого движения тел, например изменение скоростей движения молекул и обмен энергией при их соударениях, излучение квантов света, изменения структуры самих молекул и атомов и т.д. Все эти изменения энергии, не поддающиеся непосредственному наблюдению в обычных условиях, проявляются в наших ощущениях в форме теплоты. Количество теплоты и работы являются мерами энергии, переданной телам в форме работы и в форме теплоты. Понятие «теплота и работа» возникает только в связи с протекающим термодинамическим процессом. Если нет процесса, то нет теплоты и работы. Поэтому нельзя говорить о запасе теплоты и работы в каком-либо теле. В соответствии с этим ни элементарная работа L , ни элементарная теплота Q не являются полными дифференциалами параметров состояния и их нельзя называть приращением количества теплоты и работы. Величины Q и L есть только бесконечно малые количества теплоты и работы, участвующие в элементарном процессе. Поэтому операцию интегрирования можно обозначать только следующим образом: 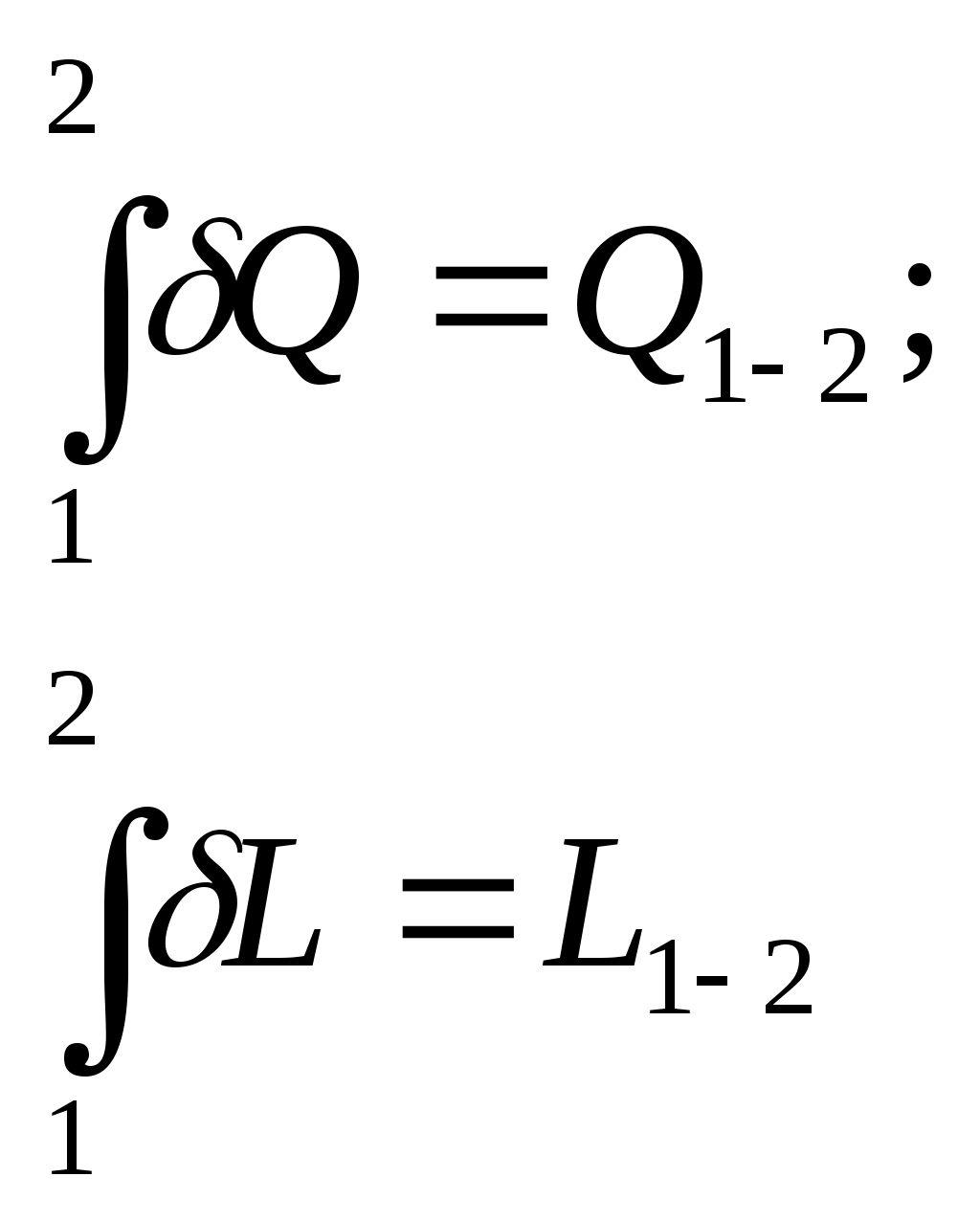 , (9) , (9)при условии, что будут заданы частные признаки между состояниями 1 и 2. |
