ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА И ТЕПЛОТЕХНИКА. Техническая термодинамика и теплотехника
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
16 Аналитическое выражение 2-го закона т-киИз выражения (63) термического КПД следует, что Но для обратимого цикла Карно термический КПД еще выражается через температуры источников теплоты: Из сравнения выражений (73) и (74) следует, что для цикла Карно Но, учитывая, что отводимая теплота отрицательна, имеем: Или Выражение (75) служит для определения приведенной теплоты. Таким образом, для каждого элементарного цикла Карно справедливо выражение (75), а для всего произвольного цикла: Уравнение (76), выведенное Клаузиусом в 1854 г., представляет собой математическое выражение второго закона термодинамики для произвольного обратимого цикла и называется первым интегралом Клаузиуса. Если сопоставить уравнение (76) и выражение (60) получим: Выражение (77) показывает, что изменение энтропии замкнутых процессов или циклов равно нолю. 17 ИЗМЕНЕНИЕ ЭНТРОПИИ В НЕОБРАТИМЫХ ПРОЦЕССАХПри прочих равных условиях работа, совершаемая необратимым процессом, меньше, чем обратимым, и, следовательно, Или, после интегрирования по замкнутому контуру: Пусть, например, в произвольном цикле, изображенном на рисунке 6, процесс 2-4-1 обратимый, а обозначенный пунктирной линией 1-3-2 необратимый. 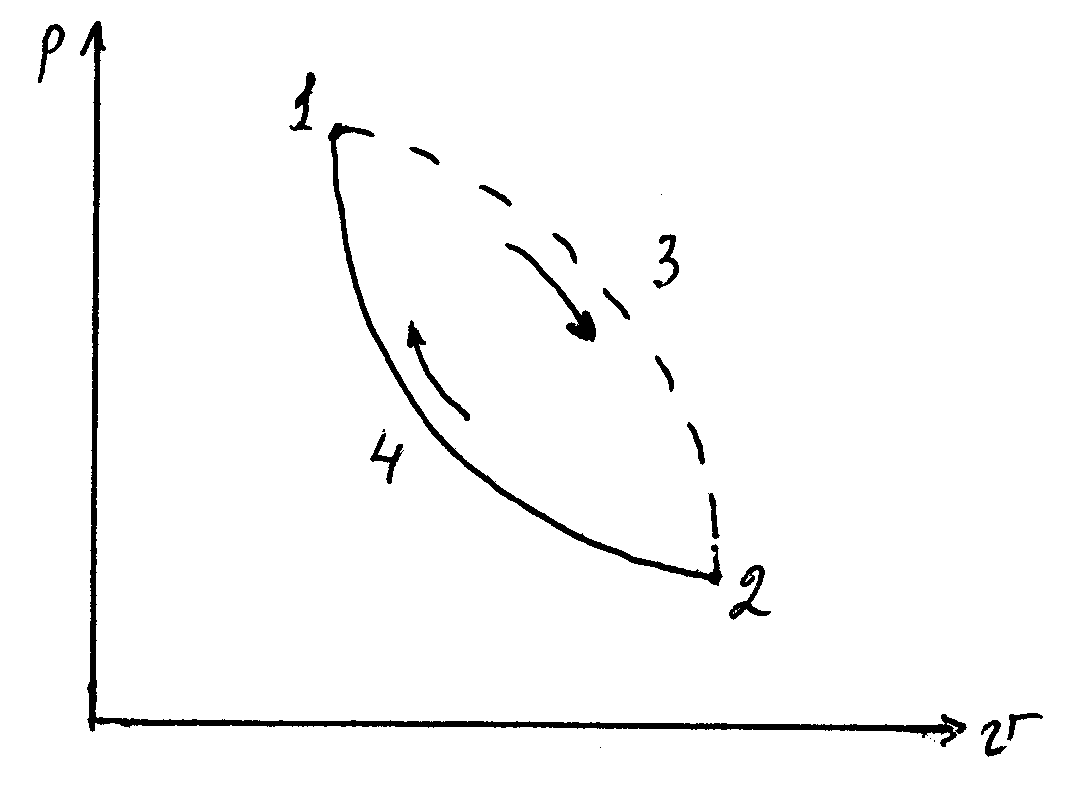 Рисунок 6 – Цикл Полученный в результате этих процессов цикл будет необратимым, поскольку один из процессов цикла необратим. Тогда интеграл (79) с учетом выражения (78) можно представить в виде суммы интегралов: Так как процесс 2-4-1 обратимый, то второй интеграл, согласно выражению (60), равен разности Или, после преобразования: Знак неравенства (82) указывает на то, что в случае необратимого процесса интеграл в правой части его уже не выражает собой разности энтропий, а меньше нее, т.е. где Таким образом, необратимость процесса 1-3-2 приводит к возрастанию энтропии. 18 ЭКСЭРГИЯ Эксэргия или техническая работоспособность – максимальная работа совершаемая рабочим телом, если в качестве холодного источника теплоты принимается внешняя среда с температурой Различают эксэргию рабочего тела в потоке, эксэргию неподвижного рабочего тела и эксэргию теплоты. Эксэргией рабочего тела, способной в той или иной мере превращаться в работу, является в случае потока энтальпия, а в случае неподвижного тела – внутренняя энергия. Рассмотрим необратимый процесс передачи тепла Qот горячего тела с температурой Знак минус указывает на то, что тепло от первого тела отводится, т.е. энтропия убывает. Тогда, энтропия второго тела возрастает: Суммарное изменение энтропии системы из двух тел: 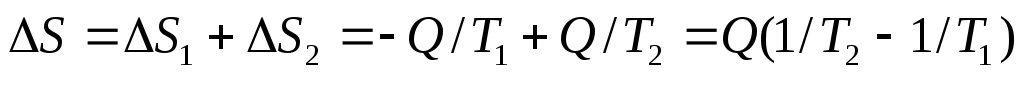 . (86) . (86)Из выражения (86) следует, что энтропия данной системы увеличивается. Максимальное количество работы за счет тепла Q может быть получено при осуществлении в заданном интервале температур цикла Карно. При этом термический КПД в интервале от Следовательно, максимальное количество работы будет равно: Максимальное количество работы, которое можно получить от тепла Qпосле необратимого перехода его второму телу, составит: В результате получается, что рассматриваемый необратимый процесс сопровождается уменьшением работоспособности системы на величину: Сравнивая полученное выражение (90) с уравнением (86) получаем выражение: Формула (91) – это уравнение французского физика Гюи-Стодола. Оно вскрывает физический смысл энтропии и показывает, что необратимые процессы перехода тепла с более высокого на более низкий температурный уровень сопровождаются потерей работоспособности, т.е. деградацией энергии той системы, в которой они происходят, а соответствующее возрастание энтропии пропорционально этой потере работоспособности. Таким образом, энтропию можно рассматривать как параметр замкнутой системы, увеличение которого является количественной мерой потери работоспособности системы, при протекании в ней необратимых процессов. Понятие об эксэргии тепла позволяет не только осуществить анализ совершенства тепловых устройств, с позиций первого закона термодинамики, но и оценить потерю работоспособности, обусловленную необратимостью происходящих в них процессов, т.е. оценить работу этих устройств и с позиций второго закона термодинамики. 19 ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ При изучении равновесных и обратимых термодинамических процессов идеальных газов должны быть выявлены: во-первых, закономерность изменения основных параметров, характеризующих состояние рабочего тела; во-вторых, особенности реализации условий первого закона термодинамики. В общем случае два любых параметра рабочего тела могут изменяться произвольно. Однако наибольший интерес представляют частные случаи. К числу частных термодинамических процессов относятся: изохорный, изобарный, изотермический, адиабатный, и политропный, который при определенных условиях может рассматриваться в качестве обобщенного по отношению ко всем выше перечисленным процессам. Политропный процесс Политропным процессом называется такой термодинамический процесс изменения состояния физической системы, при котором в течение всего процесса сохраняется постоянство теплоемкости. Пусть С – теплоемкость политропного процесса, тогда используя выражения 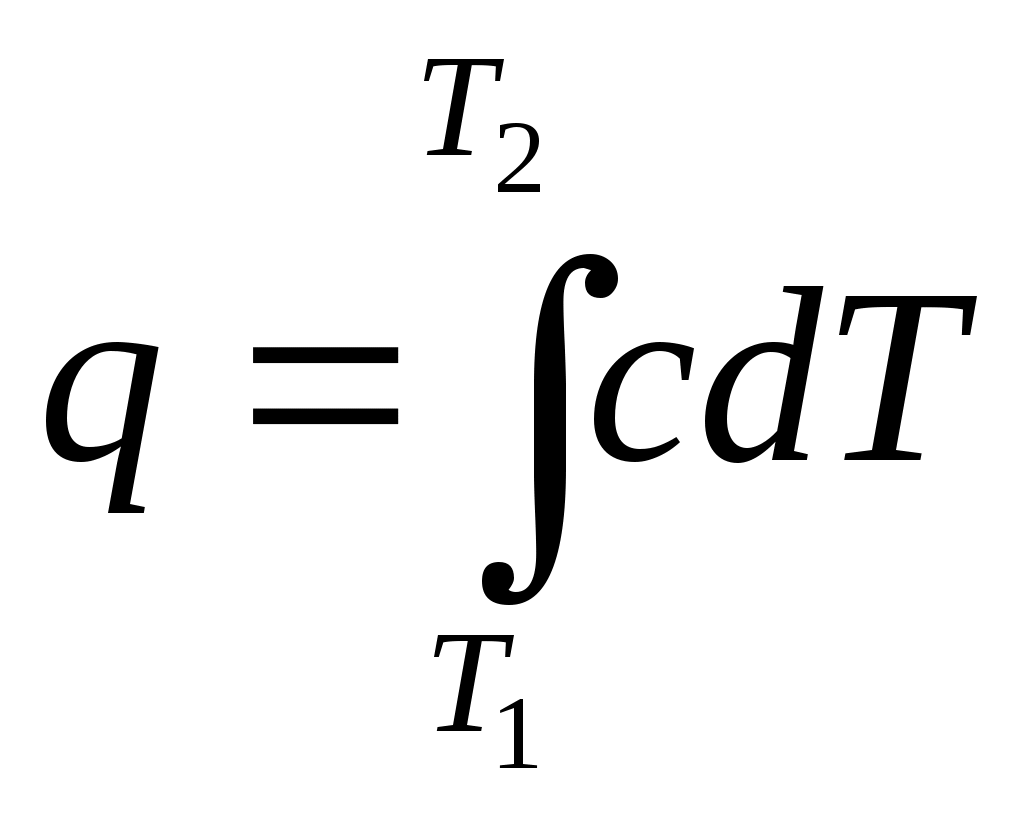 ; ; С учетом выражения откуда получим уравнение политропы: где Согласно определению политропного процесса n может быть любым, но постоянным в некотором интервале числом, которое достаточно близко воспроизводило бы разнообразные встречающиеся в практике линии индикаторных диаграмм. Очевидно, что при некоторых частных значениях n уравнение (94) должно превращаться в уравнения простейших термодинамических процессов. 20 Действительно, если в уравнении (94) n= 0, получим уравнение изобары: В этом случае (для изобарного процесса) уравнение первого закона термодинамики для изолированных систем будет совпадать с формулой (49). При поскольку величина 22 Из определения изохорного процесса очевидно, что работа в этом процессе не совершается, поскольку работа есть произведение Таким образом, подведенная к изолированной системе теплота в изохорном процессе расходуется только на изменение внутренней энергии системы. При но поскольку, согласно закону Бойля – Мариотта, если произведение давления и объема есть величина постоянная, то процесс – изотермический, тогда: 21 В изотермическом процессе не происходит изменения внутренней энергии системы, поскольку температура постоянна. Тогда уравнение первого закона термодинамики для изолированных систем(49) при изотермическом процессе примет вид: Таким образом, подведенная к изолированной системе теплота в изотермическом процессе расходуется только на совершение системой внешней работы. При 23 Показатель адиабаты для одноатомных газов (на самом деле состояние одноатомного газа не существует, оно введено для идеальных газов) для двухатомных газов (CO; О2; N2; Н2; F2; Cl2; воздух и др.) для трехатомных газов (CO2; N2O; NO2 и др.) По определению, адиабатный процесс – это процесс, протекающий без теплообмена с окружающей средой, т.е. Таким образом, в адиабатном процессе работа может совершать за счет изменения (уменьшения) внутренней энергии системы в течение некоторого времени. Таким образом политропный процесс является обобщающим по отношению к простейшим процессам. Для политропы справедливы соотношения: 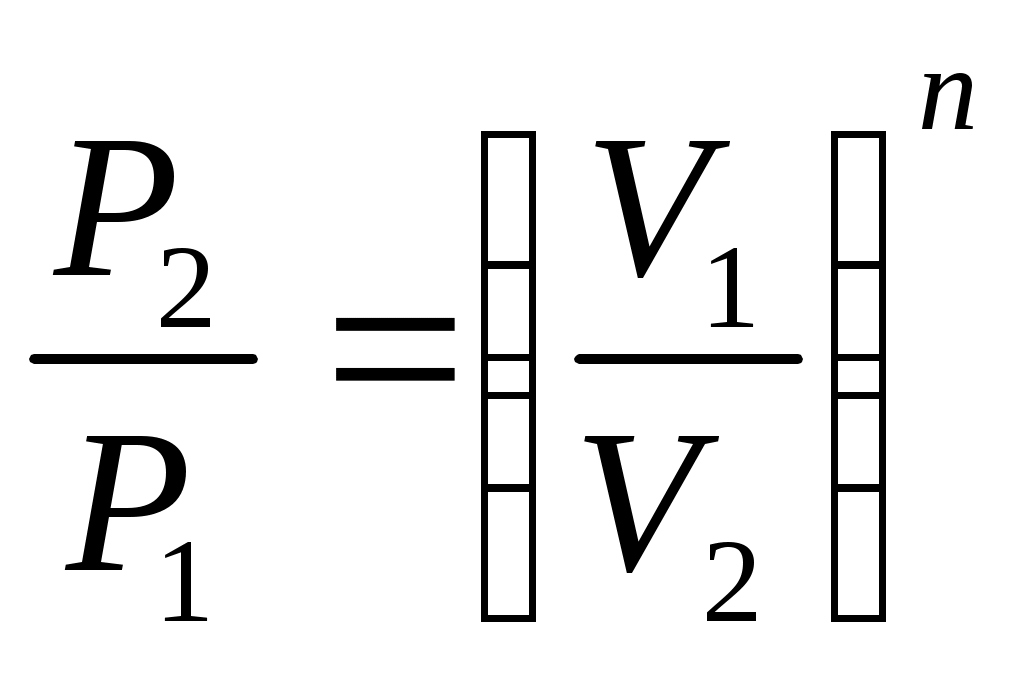 ; ; 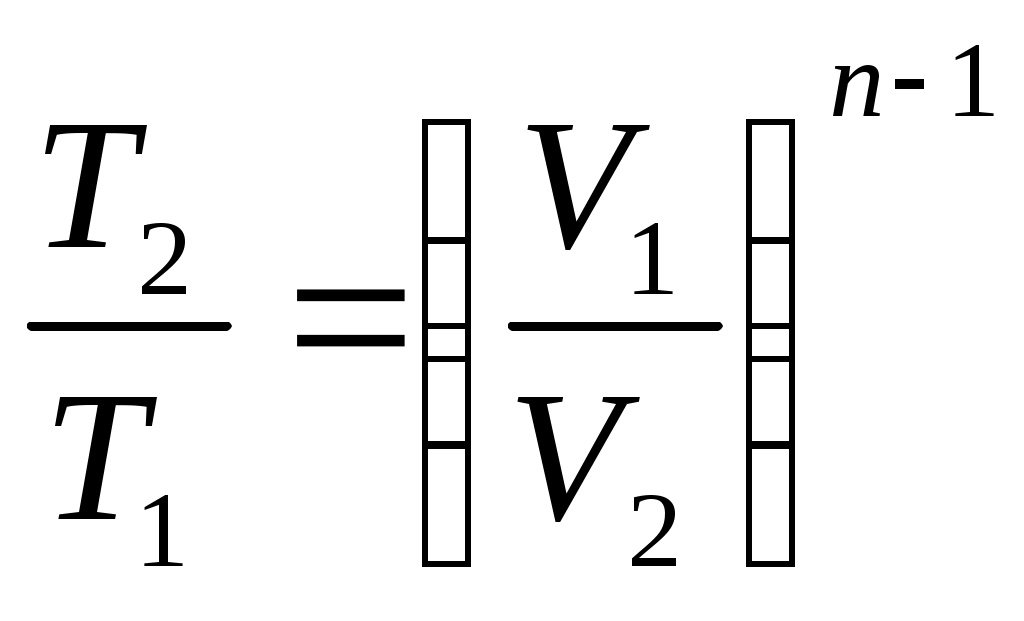 ; ; 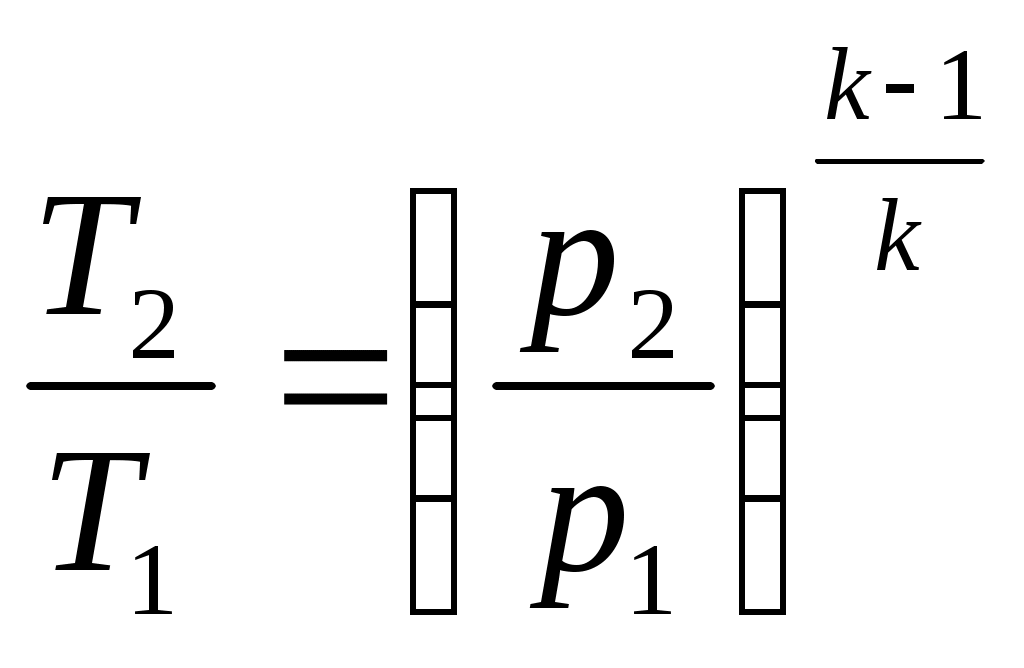 . (98) . (98)Работу политропного процесса можно определить по следующим формулам: 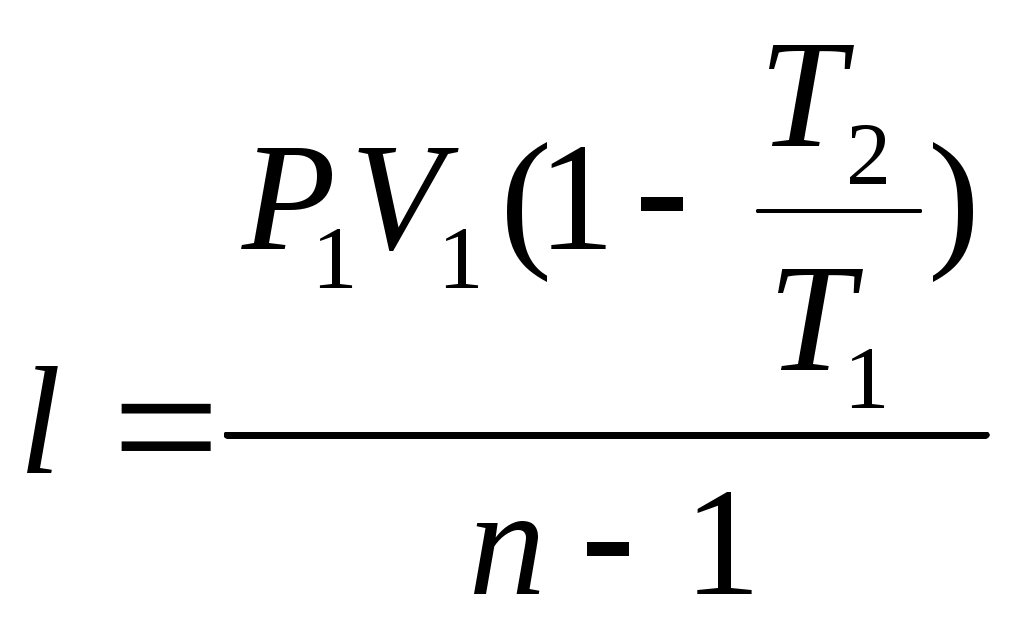 ; ;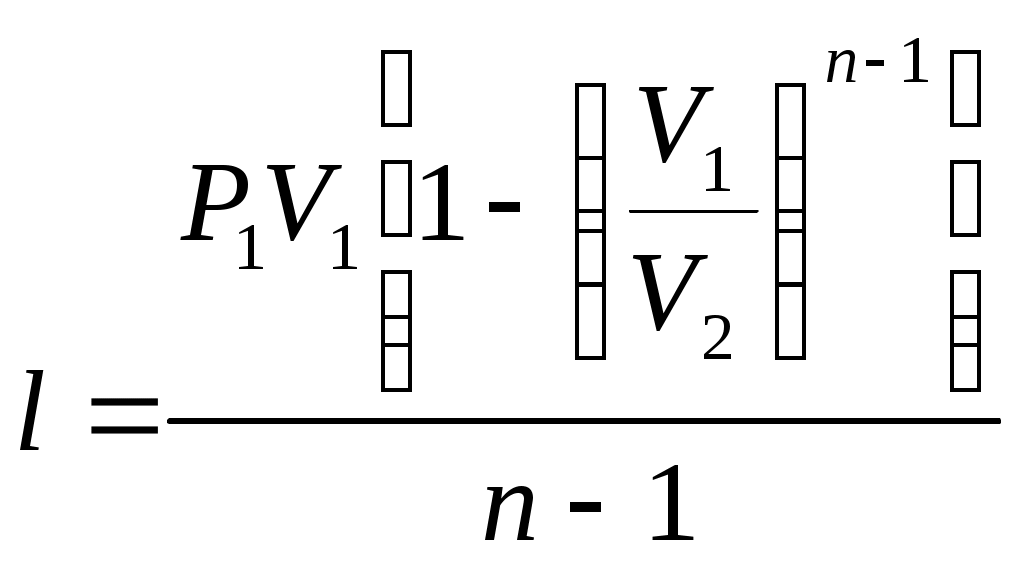 ; ; 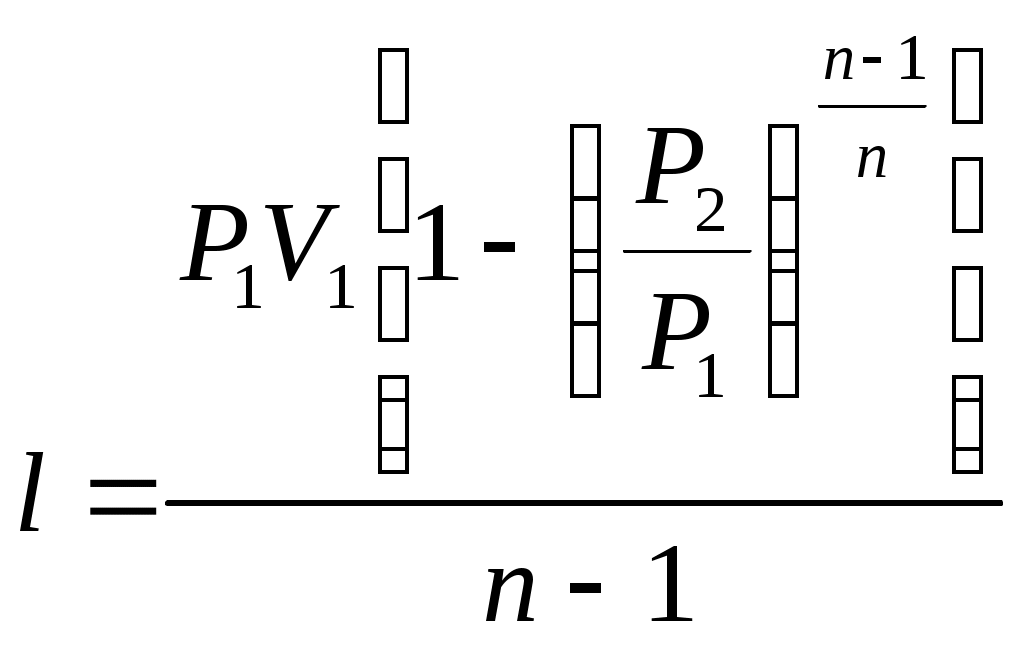 . (99) . (99)В PV-координатах работа lхарактеризуется площадью под процессом. Если Теплоемкость политропного процесса можно определить по формуле: 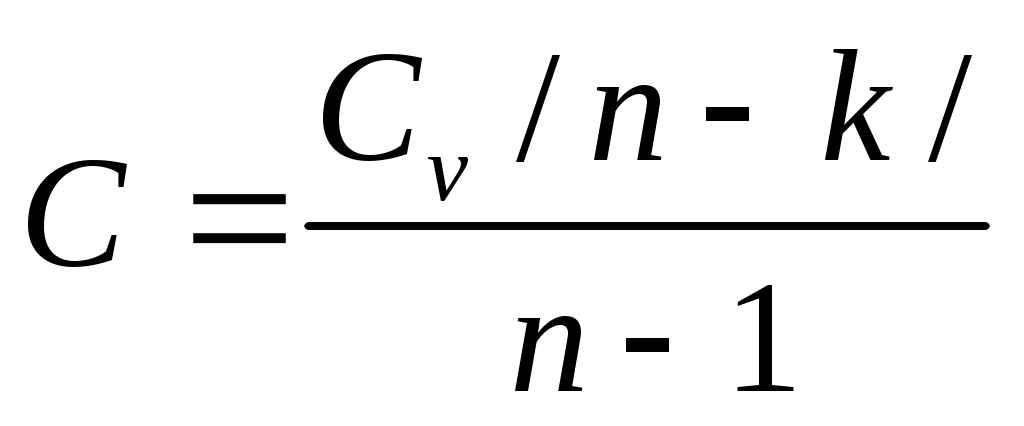 . (100) . (100)Таким образом, еще раз подтверждается, что теплоемкость идеального газа зависит от характера термодинамического процесса, что наглядно подтверждается на рисунке 7. 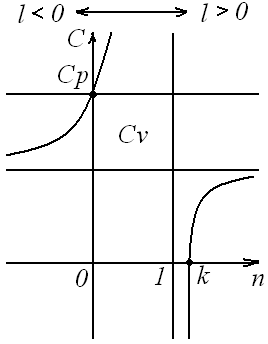 Рисунок 7 – Зависимость теплоемкости С процесса от показателя п политропы На рисунке 8 представлены совмещенные диаграммы различнох термодинамических процессов. 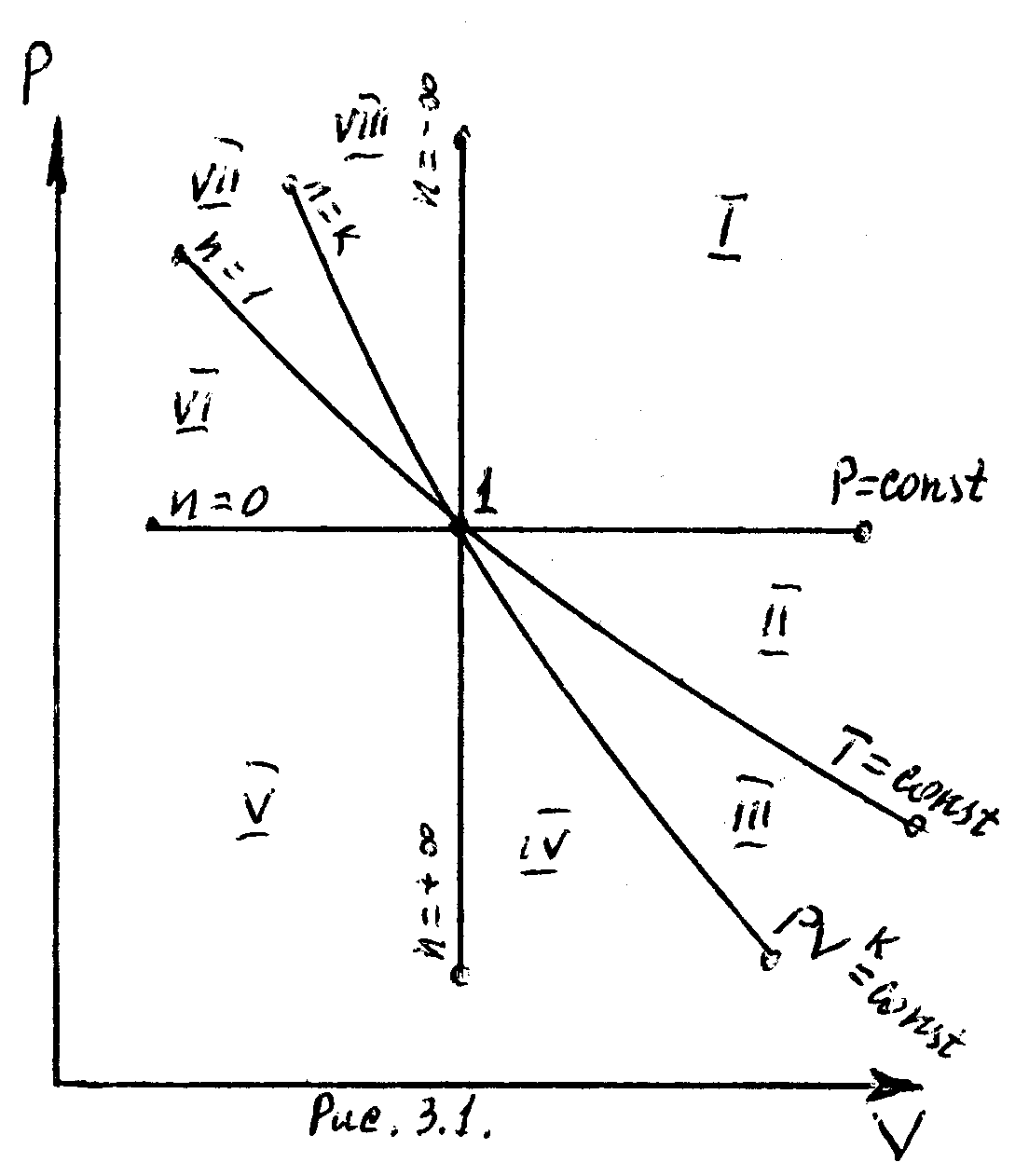 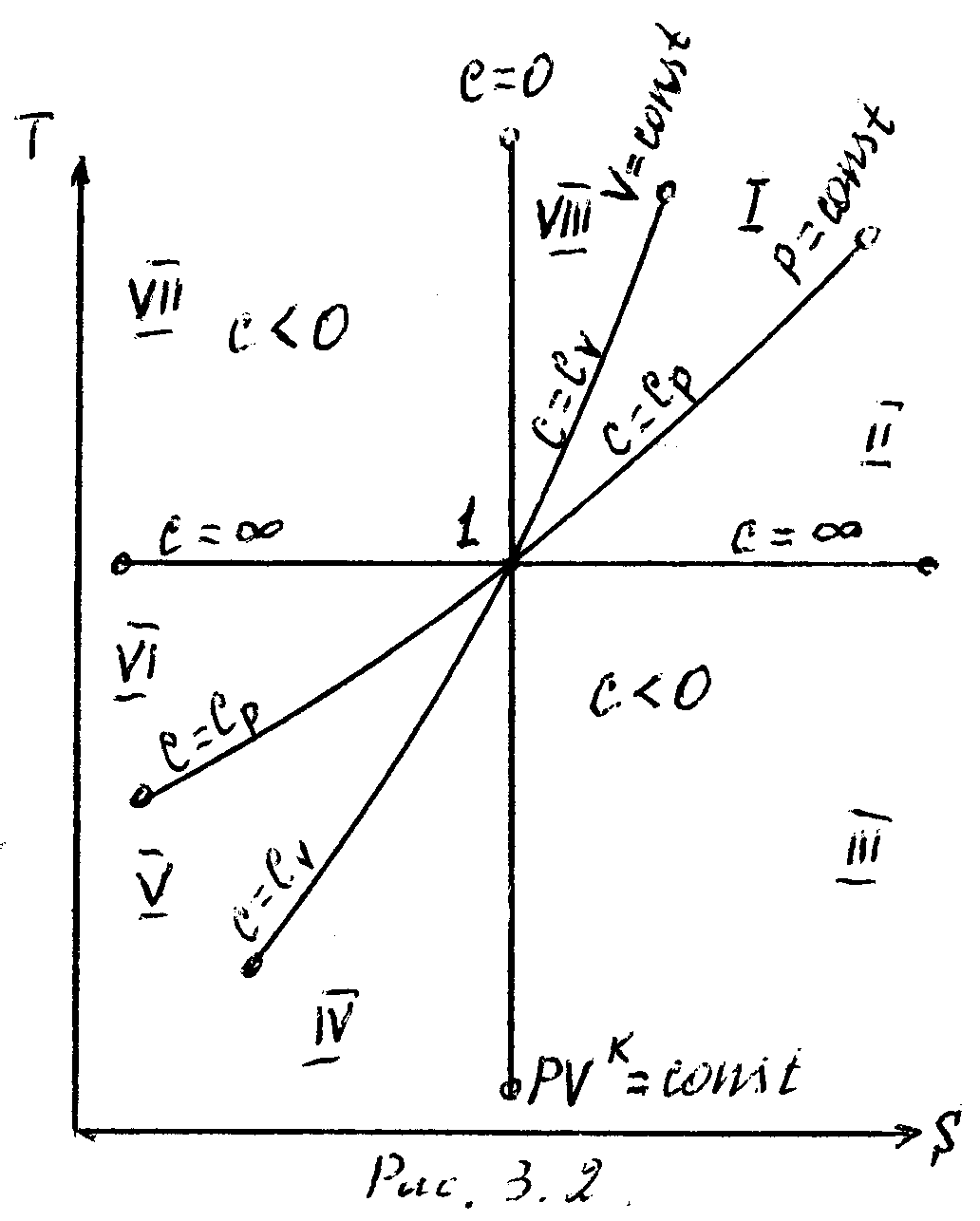 Рисунок 8 - Совмещенные диаграммы различных термодинамических процессов в PV- и TS – координатах Если в РV- и ТS – координатах выбрать некоторую произвольную точку 1 и провести из нее все рассмотренные выше термодинамические процессы, то все поле построенной таким образом диаграммы делится на 8 областей, характеризующихся определенными признаками. Так, все процессы слева от точки 1 на РV – диаграмме сопровождаются отрицательной работой. Все процессы справа от точки 1 на TS – диаграмме происходят с подводом теплоты, слева – с отводом теплоты, вверх от изотермы – с увеличением внутренней энергии и энтальпии; вниз – с уменьшением. Области, выделенные на PV – диаграмме, соответствуют процессам с подводом теплоты, а на ТS – диаграмме – процессам с положительной теплоемкостью и т.д. Для определения изменения энтропии в политропном процессе достаточно уравнение (100) подставить в выражение После интегрирования: С учетом выражений (98), можно записать: Изменения внутренней энергии и энтропии в политропном процессе определяются в ТS – координатах площадями соответственно под изохорным и изобарным процессами, происходящими в том же интервале температур |
