ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА И ТЕПЛОТЕХНИКА. Техническая термодинамика и теплотехника
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
8 Газовые смесиВ качестве рабочего тела тепловых двигателей и установок часто используются смеси различных газов. Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый компонент газовой смеси полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси. Газовая смесь ИГ подчиняется закону Дальтона – общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь: 9 Способы задания смеси газов Газовая смесь может быть задана массовыми, объемными и молярными долями. Массовой долей ( Сумма массовых долей всех газов, составляющих смесь, равна единице: Сумма масс всех газов равна массе смеси: Объемной долей ( Сумма объемных долей всех газов, составляющих смесь, равна единице: Сумма парциальных объемов газов, составляющих смесь, равна объему смеси газов: Если молярной долей назвать отношение количества вещества каждого газа ni к количеству вещества смеси газов где Из выражения (22) следует, что задание смеси молярными долями равнозначно заданию ее объемными долями. Уравнение (22) – соотношение между молярными и объемными долями. На основании закона Авогадро (при одинаковых условиях молярные объемы любых газов одинаковы) и уравнения Клапейрона – Менделеева существуют следующие зависимости: Определение кажущейся молекулярной массы и параметров состояния смеси В теорию газовых смесей введено понятие о средней (кажущейся) молекулярной массе смеси см, т.е. о молекулярной массе такого воображаемого однородного газа, который по своим свойствам аналогичен рассматриваемой смеси. Находится кажущаяся молекулярная масса следующим образом. Из определения киломоля вытекает равенство, справедливое для любого однородного газа: где n - количество вещества компонента, моль. Для смеси по аналогии можно записать: Отсюда, из равенства: следует, что: 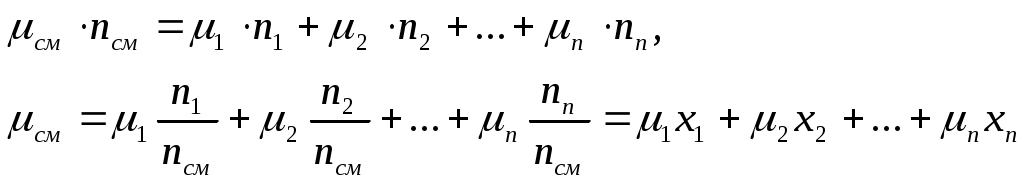 , (27) , (27)где Поскольку Если известен массовый состав смеси, то кажущуюся молекулярную массу смеси вычисляют по уравнению: 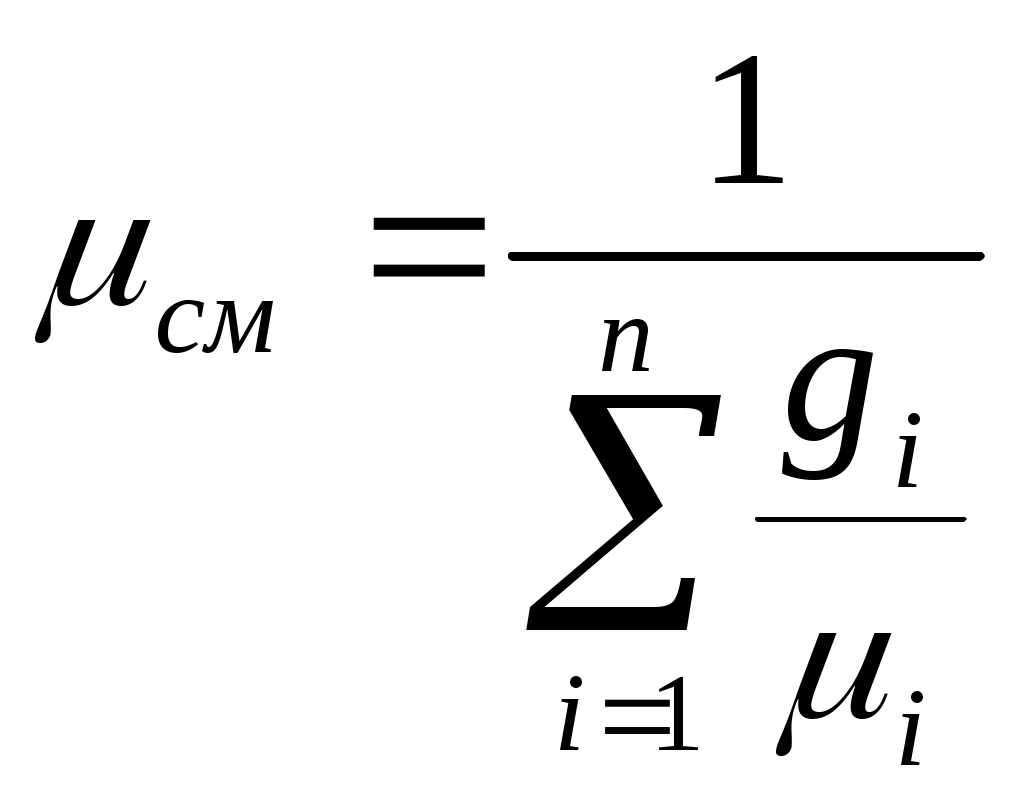 . (29) . (29)Если известен объемный состав смеси (объемная доля компонентов), то плотность смеси газов можно вычислить из соотношений: Если газовая смесь задана массовыми долями, то плотность смеси можно определить из соотношения: 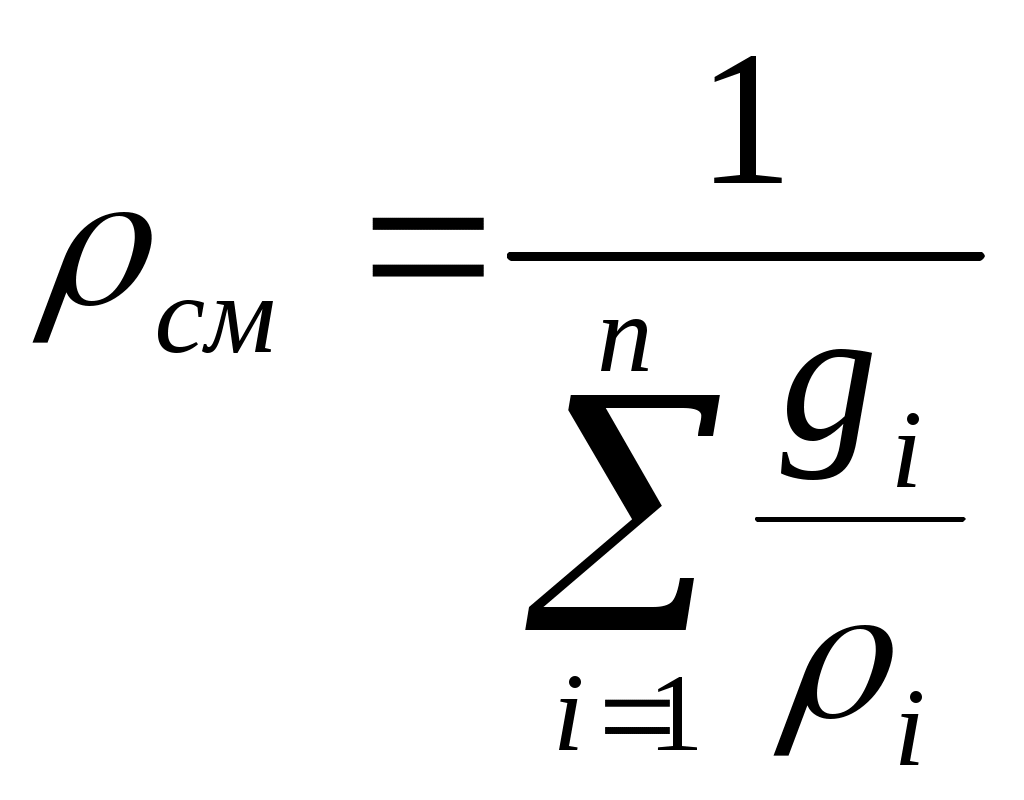 . (31) . (31)Удельный объем смеси представляет величину, обратную плотности смеси: 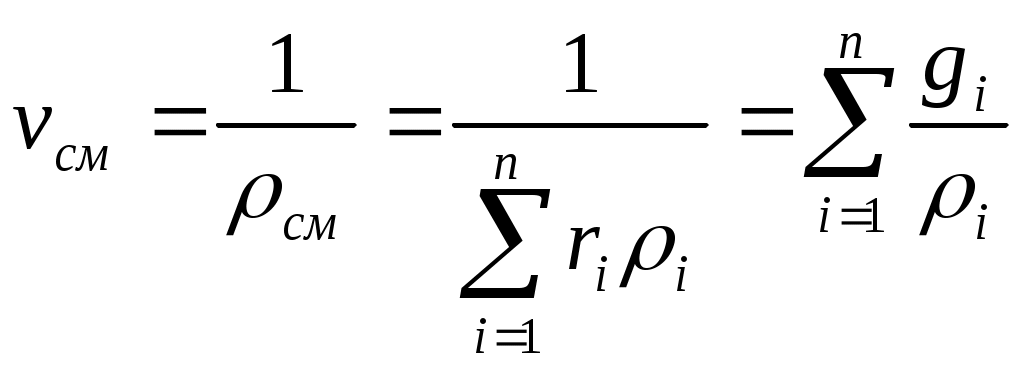 . (32) . (32)Объемные доли компонентов смеси удобно использовать для вычисления парциальных давлений ее составных частей. Из уравнения: следует, что: т.е. для любого компонента смеси можно записать: |
