Термодинамический анализ процессов в теплоэнергетических установках
 Скачать 1.55 Mb. Скачать 1.55 Mb.
|
|
1.1.3. Изображение работы изменения давления в потоке в P,v- и T,s- диаграммах для необратимых произвольных процессов расширения Изображение работы изменения давления в потоке в P,v- и T,s- диаграммах для произвольного необратимого процесса расширения осуществляется аналогично адиабатному процессу. Д 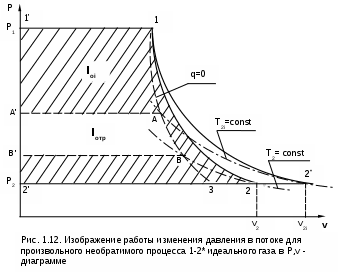 ля идеального газа (рис.1.12) в P,v- диаграмме кроме обратимого 1-2 и необратимого 1-2* процессов, проведя обратимую адиабату 1-3 и определив на ней с помощью изотерм Т2 и Т2i точки А и В, получим величину потерь работы изменения давления в потоке на трение в виде площади проекции адиабаты АВ на ось давлений loтр=ср(Т2i-Т2)= =пл.АВВ'А'А. Вычтя из площади располагаемой работы lo=пл.1'122'1' площадь loтр=пл.АВВ'А'А, получим loi=пл.1'122'В'ВАА'1' (на рис. 1.12 она заштрихована). В диаграмме Т,s- (рис.1.13) потери работы на трение для аналогичного процесса идеального газа 1-2* представляют площадь под изобарой в интервале температур Т2 и Т2i loтр=пл.22*32'2=пл.544'5'5. В результате этого, действительная работа изменения давления в потоке в Т,s- диаграмме для процесса 1-2* будет представлена п 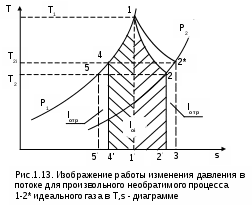 лощадью loi=пл.122'4'41 (на рис. 1.13 она заштрихована). Д 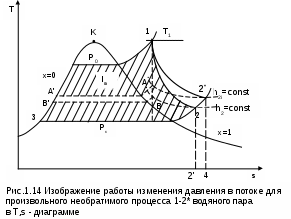 ля необратимого произвольного процесса 1-2* водяного пара в диаграмме Т,s- (рис.1.14) потеря работы на трение представляет площадь под изобарой 2-2*, а также площадь, заключенную между обратимой адиабатой АВ в интервале изоэнтальп h2=const и h2i=const и соответствующим этим точкам (А и В) изобарам, и линией х=0, т.е. loтр=пл.22*42'2=пл.АВB’А’A. Действительная работа изменения давления в потоке для процесса 1-2* водяного пара в Т,s- диаграмме будет представлена площадью loi=пл.123B’BAА’1 (на рисунке она заштрихована), поскольку эта площадь соответствует разнице располагаемой работы и работы трения loi = lo - loтр. 1.1.4. Работы изменения давления в потоке при сжатии Р 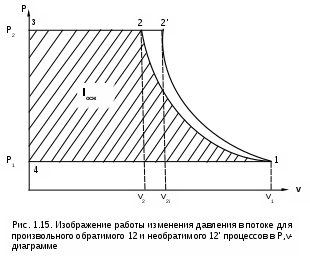 ассмотрим процесс в цилиндре сжатия ТЭУ – элемент 4 (рис.1.1). Это процесс обратный по отношению к цилиндру расширения, на его совершение требуется затратить техническую работу. Изобразим обратимый процесс сжатия рабочего тела в цилиндре 4-1-2-3 в Р,v- диаграмме (рис. 1.15). Аналогично цилиндру расширения работа изменения давления в потоке в этом случае будет определяться как сумма работы изменения объема и работ проталкивания 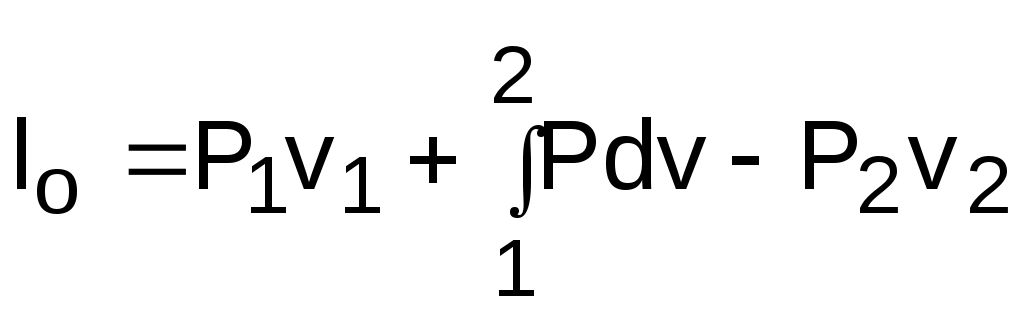 . (1.13) . (1.13)Работа изменения давления в потоке при сжатии величина отрицательная – она затрачивается. На практике её берут с обратным (положительным) знаком, а в расчетах, где это необходимо, присваивают её действительный знак (отрицательный). Поэтому её обозначают как loсж, а расчетное выражение приобретает вид Заменим в (1.14) работу изменения объема через выражение первого закона термодинамики l = q - (u2 - u1) получим: lосж = -Р1v1 - [q-(u2-u1)] + Р2v2 = h2- h1- q. (1.15) Для необратимого процесса сжатия 12* работа сжатия больше, чем для обратимого на величину работы трения: lоiсж = lосж +lотр = h2- h1- q+ h2i- h2= h2i-h1-q, (1.16) где lотр= h2i- h2 – дополнительные затраты работы на преодоление трения. Работа изменения давления в потоке при сжатии для обратимого процесса 1-2 изображается в P,v- диаграмме площадью под процессом в проекции на ось давлений lосж = пл.12341. Для необратимого процесса сжатия 1-2* площадь под процессом в проекции на ось давлений не соответствует работе изменения давления в потоке при сжатии в Р,v- диаграмме. Для изображения loiсж в Р,v- диаграмме требуются дополнительные построения, что будет подробно рассмотрено в следующем разделе. 1.1.5. Работа изменения давления в потоке для адиабатных процессов сжатия Наибольший интерес представляют адиабатные процессы сжатия, т.к. они широко распространены в ТЭУ (насосы, компрессоры). Рассмотрим адиабатный процесс сжатия и его графическое представление работы изменения давления в потоке в Р,v-, T,s- и h,s- диаграммах. Определение работы изменения давления в потоке при адиабатном сжатии идет при q=0, в результате ее расчетное выражение примет вид lосж = h2-h1 ; (1.17) lоiсж = lосж + lотр = h2 - h1 + (h2i-h2) = h2i - h1. (1.18) В P,v- диаграмме (рис. 1.16) для необратимого адиабатного процесса сжатия идеального газа 1-2* работа трения определяется как площадь под обратимой адиабатой 2-3 в интервале температур T2i и T2 в проекции на ось давлений. Здесь процессы 1-2 и 1-2* соответствуют идеальному газу. Тогда работа изменения давления в потоке при сжатии для необратимого адиабатного процесса 1-2* будет соответствовать площади 133'1'1. В 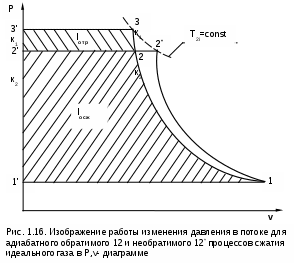 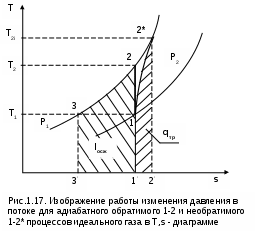 T,s- диаграмме (рис. 1.17) работа изменения давления в потоке при адиабатном сжатии идеального газа для обратимого процесса 1-2 определяется площадью lосж = пл.21'3'32, а для необратимого процесса 1-2* lоiсж = пл.2*2'3'32*. Работе трения соответствует площадь под изобарой 2-2* в проекции на ось энтропий lотр = пл.22*2'1'2. Теплота трения представляет площадь qтр = пл.12*2'1'1. Необратимость процесса адиабатного сжатия в технических устройствах характеризует адиабатный коэффициент сжатия (насоса, компрессора и т.п.), позволяющий определить действительную работу сжатия, работу трения и действительные параметры рабочего тела в конце процесса сжатия 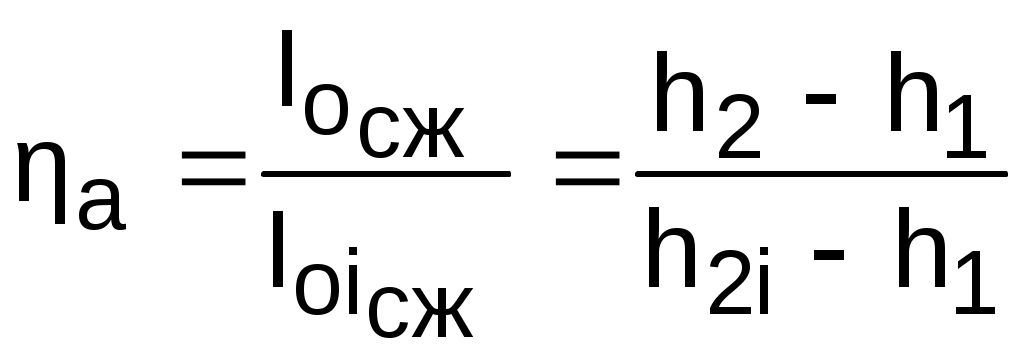 . (1.19) . (1.19)Необходимо отметить, что при сжатии работа трения больше теплоты трения, т.е. трение больше сказывается на эффективность работы машины сжатия (компрессор), чем машины расширения (турбина). С  нижения затрат работы на привод машины сжатия можно добиться совершенствованием ее проточной части, т.е. увеличением адиабатного коэффициента сжатия ηа за счет снижения потерь работы на трение и путём организации рационального термодинамического процесса сжатия. Наиболее рациональным процессом сжатия является изотермический процесс. Площадь под этим процессом в проекции на ось давлений в Р,v- диаграмме меньше площади адиабатного процесса (рис.1.18). Практическая реализация изотермического процесса сжатия технически очень сложна. На практике применяют многоступенчатое адиабатное сжатие с промежуточным изобарным охлаждением рабочего тела до начальной температуры (рис.1.19), т.е. добиваются п 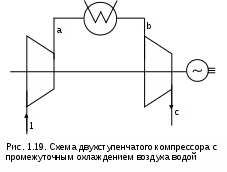 риближения процесса сжатия 1аbс к изотермическому 1-2. В схемах многоступенчатого адиабатного сжатия с промежуточным охлаждением рабочего тела до первоначальной температуры требуется оптимизация давлений между степенями компрессора. При заданных начальном Р1 и конечном Р2 давлениях оптимальная степень повышения давления в каждой ступени компрессора (опт) определяется выражением где n – число ступеней адиабатного сжатия в компрессоре. Например, для схемы рис. 1.19 величина оптимальной степени повышения давления в каждой ступени компрессора будет определяться как При изображении процесса адиабатного сжатия в h,s- диаграмме (рис. 1.20) все работы изменения давления в потоке будут представлены в виде отрезков прямых вертикальных линий, соответствующих разности энтальпий этих процессов. Здесь пример дан для водяного пара. Важно отметить, что адиабатный процесс сжатия воды в насосе в диапазоне давлений, используемых в ТЭУ, одновременно адиабатный и изохорный в виду плохой сжимаемости воды (рис. 1.21). Это позволяет рассчитать техническую работу обратимого процесса сжатия воды в насосе по формуле для изохорного процесса: 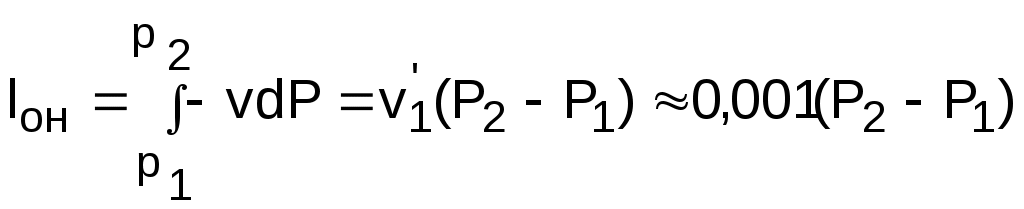 , (1.21) , (1.21)г  де v1' = 0,001 м3/кг – удельный объём воды на линии насыщения, величина практически постоянная для давлений Р1 и Р2 в ТЭУ. Для необратимого адиабатного процесса сжатия воды в насосе действительная техническая работа может быть рассчитана как 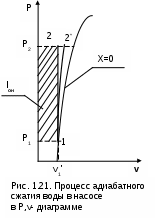 , (1.22) , (1.22)где ηн – адиабатный коэффициент сжатия в насосе. Используя выражение 1.22, легко подсчитать энтальпию в конце действительного процесса сжатия воды в насосе (h2i). Работу lоiсж необратимого адиабатного сжатия пара и воды можно показать в виде площади и в T,s- диаграмме (рис.1.22, 1.23). Для этого к площади, соответствующей работе обратимого адиабатного процесса 1-2 необходимо прибавить площадь, соответствующую работе трения lоiсж=lосж+lотр. Для пара lосж=пл.12А1, а для воды lосж=пл.21'3'32, где точка 3 находится на пересечении h1=const и Р2=const. Работа трения, как для пара, так и для воды, представляет площадь под изобарой Р2 процесса 22*, т.е. lотр=пл.22*2'1'2. 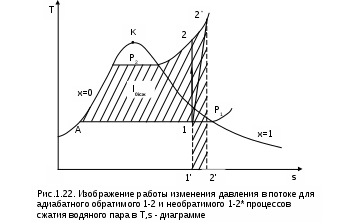 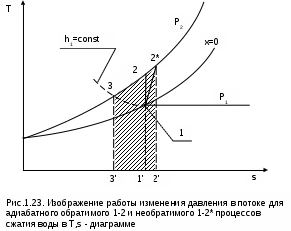 Необходимо отметить, что адиабатное сжатие жидкой фазы воды всегда наиболее предпочтительнее адиабатного сжатия ее паровой фазы. Э 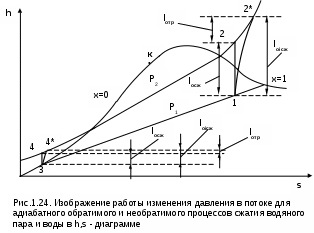 то объясняется тем, что затраты работы на сжатие жидкости в виду ее плохой сжимаемости намного меньше, чем затраты работы на сжатие пара (рис.1.24) в одном и том же интервале давлений. Кроме этого, поскольку в h,s- диаграмме процесс сжатия пара намного длиннее процесса сжатия жидкости, то и потери работы на трение для него всегда больше, чем в аналогичном процессе сжатия жидкости. то объясняется тем, что затраты работы на сжатие жидкости в виду ее плохой сжимаемости намного меньше, чем затраты работы на сжатие пара (рис.1.24) в одном и том же интервале давлений. Кроме этого, поскольку в h,s- диаграмме процесс сжатия пара намного длиннее процесса сжатия жидкости, то и потери работы на трение для него всегда больше, чем в аналогичном процессе сжатия жидкости.1.1.6. Изображение работы изменения давления в потоке в P,v- и T,s- диаграммах для необратимых произвольных процессов сжатия Работу изменения давления в потоке необратимого произвольного процесса сжатия идеального газа и водяного пара lоiсж можно также показать в P,v- и T,s- диаграммах в виде площадей. Для идеального газа величину работы трения в P,v- диаграмме (рис.1.25) можно показать в виде площади под обратимой адиабатой 2-3 в интервале температур Т2 и Т2i в проекции на ось давлений (lотр=пл. 233'2'2). Величине работы изменения давления в потоке для необратимого процесса сжатия идеального газа 1-2* в P,v- диаграмме будет соответсвовать площадь 1233’1’1. 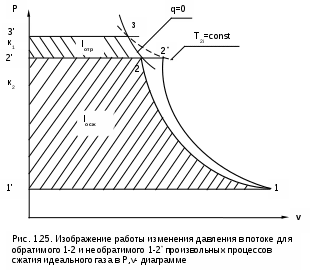 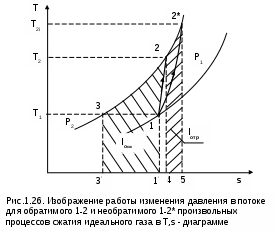 В Т,s- диаграмме (рис.1.26) величина lотр представляет площадь под изобарой в интервале температур Т2 и Т2i (lотр=пл.22*542), а величина работы обратимого адиабатного сжатия, в соответствии с выражением lосж=h2-h1-q, представляет площадь 1233'1'1. Действительная величина работы сжатия в обеих системах координат представляет сумму площадей, соответствующих работам lосж и lотр, т.к. lоiсж=lосж+lотр (на рис.1.25 и 1.26 это сумма заштрихованных площадей). Д 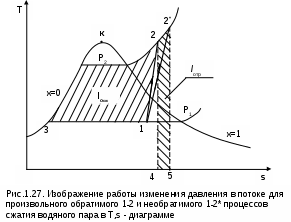 ля водяного пара (рис.1.27) величина работы обратимого процесса сжатия 1-2, в соответствии с выражением lосж=h2-h1-q, представляет в Т,s- диаграмме площадь 1231, а величине работы трения соответствует площадь под изобарой Р2 (lотр=h2i-h2=пл.22*542) в интервале энтальпий h2 и h2i (процесс 2-2*). Работа необратимого процесса сжатия 1-2* в этом случае будет представлять сумму работ сжатия обратимого процесса и работы трения и соответсвующих этим величинам в Т,s- диаграмме сумме площадей lоiсж = lосж+lотр = пл.1231 + пл.22*542. Вопросы для самоподготовки к главе 1 1. Назовите основные элементы обобщенной схемы теплоэнергетической установки. 2. Какое назначение имеет каждый из элементов теплоэнергетической установки ? 3. Каково принципиальное отличие у работы изменения давления по сранению с работой изменения объема ? 4. Напишите расчетные выражения для работы изменения давления в потоке применительно к обратимым и необратимым процессам расширения веществ. 5. Покажите величины работ изменения даления в потоке в P,v-, T,s- и h,s- диаграммах для обратимых и необратимых адиабатных процессов расширения идеальных газов. 6. Покажите величины работ изменения даления в потоке в T,s- и h,s- диаграммах для обратимых и необратимых адиабатных процессов расширения водяного пара. 7. Покажите величины работ изменения даления в потоке в P,v- и T,s- диаграммах для обратимых и необратимых произвольных процессов расширения идеальных газов. 8. Покажите величины работ изменения даления в потоке в T,s- и h,s- диаграммах для обратимых и необратимых произвольных процессов расширения водяного пара. 9. Напишите расчетные выражения для работы изменения давления в потоке применительно к обратимым и необратимым процессам сжатия веществ. 10. Покажите величины работ изменения даления в потоке в P,v-, T,s- и h,s- диаграммах для обратимых и необратимых адиабатных процессов сжатия идеальных газов. 11. Покажите величины работ изменения даления в потоке в T,s- и h,s- диаграммах для обратимых и необратимых адиабатных процессов сжатия воды и водяного пара. 12. Почему сжимать вещество в жидкой его фазе более целесообразно по сравнению со сжатием до того же давления паровой фазы того же вещества ? 13. Напишите расчетные выражения для работы изменения давления в потоке применительно к обратимому процессу сжатия жидкой фазы воды и покажите этот процесс в P,v - диаграмме. 14. Покажите величины работ изменения даления в потоке в P,v- и T,s- диаграммах для обратимых и необратимых произвольных процессов сжатия идеальных газов. 15. Покажите величины работ изменения даления в потоке в T,s- и h,s- диаграммах для обратимых и необратимых произвольных процессов сжатия воды и водяного пара. 16. Какие коэффициенты характеризуют необратимость в адиабатных процессах сжатия и расщирения газов и жидкостей в технических устройствах (турбины, сопла, компрессоры, насосы и т.д.) ? 17. Какими способами можно снизить затраты технической работы на осуществление процесса сжатия вещества до необходимого давления ? 2. ЭКСЕРГИЯ В ПОТОКЕ В части 1 «Техническая термодлинамика» [1] было введено понятие эксергии в объеме для закрытой системы. Рассмотрим эксергию вещества в открытой системе – в потоке. В этом случае вещество непрерывно движется по каналу, например, поступает в машину (цилиндр расширения ТЭУ или турбина) и, отработав в ней, выбрасывается в окружающую среду. Для вещества, находящегося в потоке, эксергии соответствует техническая работа, равная работе изменения давления в потоке при протекании в системе только обратимых процессов, т.е. располагаемой работе, при переходе вещества из начального состояния в состояние равновесия с окружающей средой. Д 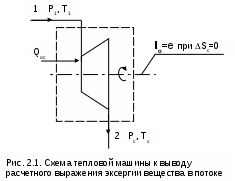 ля получения расчетного выражения эксергии в потоке рассмотрим модель обратимой тепловой машины (рис.2.1), работающей в установившемся режиме. К машине подводится рабочее тело с параметрами Р1, h1, s1; в машине рабочее тело обратимо переводится (расширяется) до состояния равновесия с окружающей средой (у него такие же температура и давление, как у окружающей среды), в результате чего параметры рабочего тела становятся равными Pс, Тс hс, sс. С вала машины снимается механическая работа lo, она же является технической работой, полученной из работы изменения давления в потоке обратимого процесса (располагаемой работы), это и есть и эксергия. Рабочее тело, выходящее из машины, находится в термодинамическом равновесии с окружающей средой, т.е. оно не способно к дальнейшему производству работы в данной системе. Таким образом, машина произвела максимально возможную полезную техническую работу lомах – эксергию. Обозначим удельную эксергию в потоке буквой е для одного килограмма рабочего тела, тогда расчетное выражение удельной эксергии в потоке можно записать как е = lомах = h1 - hc + q . (2.1) Теплота q, подведенная к рабочему телу, взята из окружающей среды и равна с обратным знаком теплоте Qос, отданной окружающей средой рабочему телу, т.е. q = -Qос. Температура окружающей среды величина постоянная, поэтому можно записать Qос = ТосSос . Поскольку в системе протекают только обратимые процессы, то изменение энтропии этой системы равно нулю, т.е. Sc = sрт + Sос = 0. Поэтому изменение энтропии рабочего тела sрт = sc - s1 равно изменению энтропии окружающей среды с обратным знаком sрт = -Sос. Используя полученные выражения, получим расчетное выражение теплоты подведенной к рабочему телу q= -ТосSос = Тосsрт = Тос(sc-s1). Подставив q в уравнение 2.1, получим расчетное выражение эксергии в потоке данного рабочего тела: е = h1-hc-Тос(s1-sс) . (2.2) Г 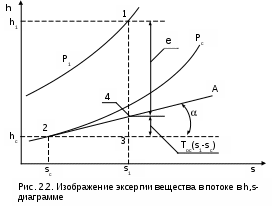 рафическое представление эксергии вещества в потоке проще всего выполняется в h,s- диаграмме (рис.2.2). Для этого в h,s,- диаграмме для данного вещества изображаются изобары Р1 и Рс и на них отмечаются точки 1 и 2, соответствующие состоянию рабочего тела при параметрах Р1, h1, s1 (точка 1) и Рс, hс, sс (точка 2). Через точку равновесного состояния рабочего тела с окружающей средой 2 проводят касательную 2А к изобаре Рс, которая получила название прямой среды. Тангенс угла наклона прямой среды к оси энтропий равен абсолютной температуре окружающей среды tg = Тос, т.к. (dh/ds)p = T. Рассмотрев прямоугольник 2-3-4, мы видим, что по законам геометрии сторона 3-4 = (2-3)tq = Тос (s1 - sс). В результате получаем, что величине эксергии в потоке в h,s- диаграмме соответствует отрезок прямой 1-4, равный расстоянию от рассматриваемой точки до прямой среды. Используя понятие эксергии вещества в потоке, можно оценить эффективность процессов в тепловых двигателях путем определения потерь эксергии за счет необратимостей в действительных процессах. В 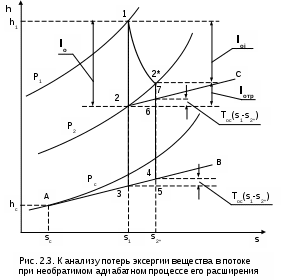 качестве примера рассмотрим адиабатный процесс расширения в тепловой машине (турбина и т.п.). Покажем идеальный 1-2 и реальный 1-2* адиабатные процессы расширения вещества в этой машины в h,s- диаграмме (рис.2.3). Для идеального процесса 1-2 техническая работа соответствует располагаемой работе lo. Для действительного необратимого процесса 1-2* техническая работа loi = lo - lотр, где lотр – потеря работы за счет трения, она соответствует отрезку 2*-6. Согласно теореме Гюи – Стодолы [1] потеря эксергии за счет любого вида необратимости определяется как -е = Тосsс. Для нашего адиабатного процесса увеличение энтропии системы равно увеличению энтропии самого тела sс=s2*-s1, т.к. теплообмена с окружающей средой нет (q=0). Используя прямоугольник 3-4-5 можно показать потерю эксергии в виде отрезка 4-5 = -е = Тосsс, т.к. 3-5 = sс = s2* - s1, а тангенс угла наклона прямой среды (АВ) равен абсолютной температуре окружающей среды tg = Тос. Если провести из точки 2 прямую параллельную прямой среды (2С), то получим отрезок 6-7 = 4-5 = -е. Кроме этого, равенство отрезков 2-3 = 7-4 =е2 (эксергия точки 2) свидетельствует о том, что эксергия точки 2* больше эксергии точки 2 на величину отрезка 2*-7 = е2* - е2. В свою очередь, отрезок 2*-6, равный потерям технической работы за счет трения, состоит из отрезка 2*-7 и 7-6, т.е. lотр включает в себя потерю эксергии (отрезок 7-6) и – увеличение эксергии в конечной точке процесса 1-2* по сравнению с конечной точкой обратимого процесса 1-2 (отрезок 2*-7): lотр = -е + (е2* - е2) . Такое графическое представление процесса в h,s- диаграмме позволяет сделать вывод о том, что из потерь технической работы lотр безвозвратно теряется только потеря эксергии -е, а другая часть lотр, обусловленная возрастанием эксергии в конце действительного процесса по сравнению с обратимым процессом (е2* - е2), имеет потенциальную возможность дальнейшего получения технической работы от вещества в этом состоянии. Этот анализ наглядно поясняет величину возврата теплоты трения lv (см. гл. 1.1.2) и имеет большое практическое значение при расчете технической работы расширения рабочего тела в многоступенчатой турбине. В многоступенчатой турбине нельзя суммировать потери технической работы в отдельных ступенях, необходимо суммировать только потери эксергии по ступеням. Таким образом, анализ эксергетических потерь необратимых процессов всегда более объективен, чем анализ потерь технической работы в этих процессах. |
