Химия. Тесты по химии для проверки уровня усвоения соответствующего учебного материала. Изложена методика решения типовых задач по химии
 Скачать 0.49 Mb. Скачать 0.49 Mb.
|
Вариант 161. От каких параметров не зависит скорость гетерогенной реакции? Ответ: 1) от давления; 2) от концентрации реагирующих веществ; 3) от концентрации твердого компонента. 2. Во сколько раз увеличится скорость реакции, если температура выросла на 40 С, а температурный коэффициент равен 2? Ответ: 1) 4; 2) 16; 3) 32. 3. Среди приведенных реакций укажите ту, для которой повышение температуры сместит равновесие в ту же сторону, что и повышение давления. Ответ: 1) 2NO+O2=2NO2 , + Q; 2) 3О2=2О3, ΔН 3) H2 + Br2 = 2HBr, +Q. Энергетика химических процессовПримеры решения задач Пример 1 Вычислите энтальпию образования N2O5(кр), если известен тепловой эффект реакции N2O5(к)+2KOH(к)=2KNO3(к)+H2O(ж); а также энтальпии образования KOH(к), KNO3(к) и H2O(ж), которые соответственно равны -425,0; -493,2 и –286,0 (кДж/моль). Решение Используя следствие из закона Гесса, запишем Подставим данные из условия и получим -380,6=(2×-493,2-286)-( Проводим арифметические вычисления: -380,6=-422,4- Отсюда Пример 2 Сколько выделится теплоты при получении 1 моль железа по реакции Fe2O3(к)+3СО(г)=2Fe(к)+3СО2(г), если энтальпии образования Fe2O3(к), СО(г) и СО2(г) соответственно равны (кДж/моль): -822,7; -110,6 и -394,0? Решение 1. Вычисляем тепловой эффект реакции (DH), используя следствие из закона Гесса. 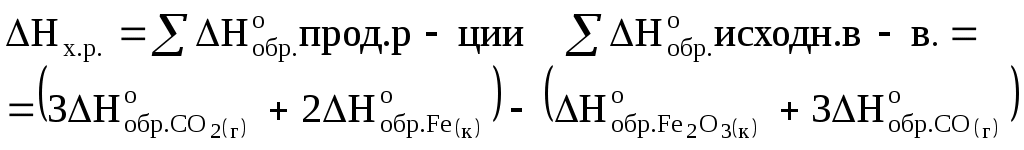 Так как энтальпия образования простого вещества принимается равной нулю то, Тогда По реакции при образовании 2 моль железа выделилось 27,2 кДж энергии, а при образовании 1 моль 27,2/ 2 = 13,6 кДж. Пример 3 При каких условиях возможно протекание реакции: 2А2(г) + В2 (г) = 2А2В(г); ∆Н °298 < 0. Решение ∆G = ∆Н – T∆S. Реакция возможна, если изменение энергии Гиббса имеет отрицательное значение. Так как реакция носит экзотермический характер и ∆Н °298 < 0, то вероятность процесса будет зависеть от второго компонента в уравнении. Поэтому необходимо, чтобы реакция протекала при невысокой температуре, тогда при любом значении изменения энтропии первый компонент будет оказывать большее влияние на значение изменения энергии Гиббса, оно примет отрицательное значение, реакция будет протекать. Задание к программированному контролю по теме «Энергетика химических процессов» Вариант 11. Пользуясь данными таблицы, вычислить стандартную энтальпию сгорания ацетилена 2С2Н2 (г) + 5О2 (г) = 4СО2 (г) + 2Н2О (г). Ответ: 1) – 863,32 кДж/моль; 2) – 798,40 кДж/моль; 3) – 1257,70 кДж/моль. 2. Не производя вычислений, установить знак ∆S° реакции: 2NH3 (г) = N2 (г) +3Н2 (г). Ответ: 1) ∆S° > 0; 2) ∆S° = 0; 3) ∆S° < 0. 3. При каких условиях возможно протекание следующей реакции: N2 (г) + 2Н2О (ж) = NH4NО2 (ж), ∆Н298 = 37,68 кДж. Ответ: 1) при стандартных условиях; 2) при высоких температурах; 3) при любой температуре. Задание к программированному контролю по теме «Энергетика химических процессов» |
