Тест. Химия(тест с +). Тесты по неорганической, физической и коллоидной химии 1516 Учение о растворах Для какого вещества фактор эквивалентности
 Скачать 426.71 Kb. Скачать 426.71 Kb.
|
|
Экзаменационные тесты по неорганической, ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ химии 15-16 Учение о растворах Для какого вещества фактор эквивалентности (fэ) равен единице? Na2SO4 NaNO3 ++ СaCl2 Na2CO3 Na3PO4 ФАКТОР ЭКВИВАЛЕНТНОСТИ (fэ) РАВЕН 1/2 ДЛЯ ВЕЩЕСТВ Ca3(PO4)2 Na3PO4 ВаSO4 ++ KNO3 CaCl2 ++ NaBr KCl 3. Для какого вещества фактор эквивалентности (fэ) равен 1/3? Na2CO3 Na3PO4 ++ NaNO3 Ca(OH)2 Al2(SO4)3 4. ФАКТОР ЭКВИВАЛЕНТНОСТИ (fэ) РАВЕН 1/6 ДЛЯ ВЕЩЕСТВ Mg(NO3)2 Ca3(PO4)2 ++ Al2(SO4)3 ++ Al(OH)3 Na3PO4 NaNO3 CaCl2 KCl Какая концентрация измеряется в моль/кг? молярная концентрация молярная концентрация эквивалента моляльная концентрация ++ массовая доля мольная доля По какому соотношению рассчитывается молярная концентрация? 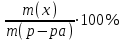 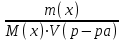 ++ ++ 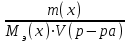 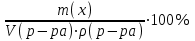 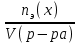 7. По какому соотношению рассчитывается молярная концентрация эквивалента? 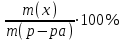 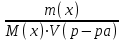 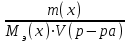 ++ ++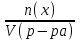 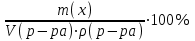 8. По какой формуле рассчитывается массовая доля раствора? 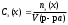 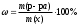 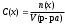 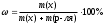 ++ ++ 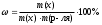 9. В 1 литре содержится 3,65 г хлороводорода. Чему равна молярная концентрация этого раствора? 1 моль/л 0,5 моль/л 0,1 моль/л ++ 0,05 моль/л 0,01 моль/л 10. В хирургии применяются гипертонические марлевые повязки, пропитанные 10%-ным водным раствором хлорида натрия. Сколько г соли и воды нужно взять для приготовления 500 г такого раствора? 5 и 495 10 и 490 25 и 475 50 и 450 ++ 75 и 425 11. В 95 г воды растворили 5 г глюкозы. Чему равна массовая доля глюкозы (%) в полученном растворе? 5,00 ++ 5,26 5,56 5,88 6,00 12. Повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя равно нулю прямо пропорционально массовой доле растворенного вещества ++ прямо пропорционально мольной доле растворенного вещества прямо пропорционально моляльности раствора не зависит от концентрации растворенного вещества 13. Что означает запись «3%-ный раствор Н2О2»? в 1 литре раствора содержится 3 г пероксида водорода в 1000 г раствора содержится 3 г пероксида водорода в 100 г раствора содержится 3 г пероксида водорода ++ в 100 г раствора содержится 3 моль пероксида водорода в 1000 г растворителя содержится 3 г пероксида водорода 14. Эбуллиоскопическая константа воды 0,52о. Чему равна температура кипения водного раствора глюкозы, моляльная концентрация которого равна 1 моль/кг? 100оС 100,52оС ++ 101,04оС 99,48оС 98,96оС 15. ГИПЕРТОНИЧНЫ ПО ОТНОШЕНИЮ К ПЛАЗМЕ КРОВИ РАСТВОРЫ 15%-ный раствор NaCl ++ 10%-ный раствор NaCl ++ 0,9%-ный раствор NaCl 0,1%-ный раствор NaCl 5%-ный раствор NaCl ++ 0,15 М раствор NaCl 0,01 М раствор NaCl 0,3 M раствор NaCl ++ 16. ИЗОТОНИЧНЫ ПО ОТНОШЕНИЮ К ПЛАЗМЕ КРОВИ РАСТВОРЫ 0,01%-ный раствор NaCl 0,9%-ный раствор NaCl ++ 10%-ный раствор NaCl 15%-ный раствор NaCl 5%-ный раствор NaCl 0,15 М раствор NaCl ++ 0,01M раствор NaCl 0,3 M раствор NaCl 1 М раствор NaCl 17. ГИПОТОНИЧНЫ ПО ОТНОШЕНИЮ К ПЛАЗМЕ КРОВИ РАСТВОРЫ 0,01%-ный раствор NaCl ++ 0,9%-ный раствор NaCl 10%-ный раствор NaCl 15%-ный раствор NaCl 5%-ный раствор NaCl 0,05 М раствор NaCl ++ 0,01M раствор NaCl ++ 0,3 M раствор NaCl 1 М раствор NaCl 18. Водный раствор какого из перечисленных ниже веществ имеет самую высокую температуру замерзания, при условии, что молярные концентрации эквивалента этих растворов одинаковы? С6Н12О6 ++ NaNO3 Ca(NO3)2 Al(NO3)3 Al2(SO4)3 19. Водный раствор какого из перечисленных ниже веществ имеет самую низкую температуру замерзания, при условии, что молярные концентрации эквивалента этих растворов одинаковы? С6Н12О6 КNO3 Mg(NO3)2 Fe(NO3)3 Al2(SO4)3 ++ 20. При одинаковой температуре растворы с молярной концентрацией 0,1 моль/л изотоничны друг другу. Для какой пары растворов будет соблюдаться это условие? фруктоза и хлорид натрия хлорид натрия и сульфат натрия сахароза и хлорид магния нитрат кальция и сульфат натрия ++ хлорид калия и сульфат калия 21. Как называется часть осмотического давления, обусловленная наличием в растворе высокомолекулярных компонентов? давление насыщенного пара над чистым растворителем давление насыщенного пара растворителя над раствором систолическое давление диастолическое давление онкотическое давление ++ 22. Как называется раствор с осмотическим давлением большим, чем в стандарте? гипотонический изотонический физиологический насыщенный гипертонический ++ 23. Какое явление наблюдается при помещении эритроцитов в 10%-ный раствор хлорида натрия? 1) гемолиз 2) плазмолиз ++ 3) деплазмолиз 4) ультрафильтрация 5) эндосмос 24. Какое явление наблюдается при помещении эритроцитов в 0,1%-ный раствор хлорида натрия? 1) гемолиз ++ 2) плазмолиз 3) диализ 4) коагуляция 5) экзосмос 25. Растворы перечисленных ниже солей имеют одинаковую молярную концентрацию 0,01 моль/л. Какая пара растворов содержит одинаковое число частиц в 1 литре раствора? 1) Na2SO4 и NaCl 2) Na2CO3 и NaBr 3) NaBr и K2SO4 4) NaCl и KBr ++ 5) NaCl и Na3PO4 26. Количество вещества эквивалента можно рассчитать как отношение молярной массы вещества к его массе массы вещества к его молярной массе молярной массы эквивалента вещества к его массе массы вещества к его молярной массе эквивалента ++ массы вещества к массе раствора 27. Какую величину можно рассчитать как произведение фактора эквивалентности и молярной массы вещества? массовую долю молярную концентрацию молярную концентрацию эквивалента молярную массу эквивалента ++ мольную долю 28. Какая величина представляет собой отношение количества растворенного вещества к объему раствора? молярная концентрация ++ молярная концентрация эквивалента массовая доля мольная доля моляльная концентрация 29. Какая величина представляет собой отношение количества растворенного вещества к массе растворителя? молярная концентрация молярная концентрация эквивалента массовая доля мольная доля моляльная концентрация ++ Буферные растворы 1. Какое утверждение верно для нейтрального раствора? [H+] = [OH-] ++ [H+] = 14 - [OH-] [H+] [OH-] [H+] [OH-] = 14 [H+] [OH-] 2. Какой компонент гидрокарбонатного буферного раствора будет реагировать при добавлении к нему небольшого количества хлороводородной кислоты? H2CO3 NaHCO3 ++ Na2CO3 CaCO3 K2CO3 3. По какому уравнению можно рассчитать концентрацию ионов водорода в ацетатном буферном растворе? 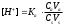 ++ ++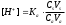 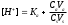 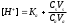 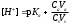 4. Какие соединения входят в состав гидрокарбонатного буферного раствора? H2CO3 и NaHCO3 ++ Na2CO3 и K2CO3 Na3PO4 и Na2HPO4 CaCO3 и H2CO3 K2CO3 и CaCO3 5. Какие соединения входят в состав фосфатного буферного раствора? Na3PO4 и H3PO4 Na2HPO4 и NaH2PO4 ++ NaH2PO4 Na3PO4 и Na2НPO4 Ca3(PO4)2 6. Какие соединения входят в состав аммиачного буферного раствора? NH4NO3 и (NH4)2SO4 (NH4)2CO3 и NH4Cl NH4Cl и NH4OH ++ (NH4)2SO4 NH4OH и HCl 7. СООТНОШЕНИЕ [H+] < [OH-] СОБЛЮДАЕТСЯ В ВОДНЫХ РАСТВОРАХ CH3COOH Са(OH)2 ++ NH4OH ++ H3PO4 NaOH ++ NaCl KCl 8. СООТНОШЕНИЕ [H+] > [OH-] СОБЛЮДАЕТСЯ В ВОДНЫХ РАСТВОРАХ Са(OH)2 NH4OH H3PO4 ++ HNO3 ++ NaOH NaCl KOH HCl ++ Чему равна концентрация ионов [H+] в чистой воде при 25°С (моль/л)? 10-14 10-7 ++ 107 101 7 Чему равна концентрация Сон-, если Сн+ = 10-4? 14 10-14 10-7 10-10 ++ 10-4 Чему равна сумма рН и рОН для разбавленных водных растворов? 10-14 10-7 1 7 14 ++ Как называется смещение реакции среды в организме в кислую сторону? осмос ацидоз ++ алколоз гидролиз нейтрализация Как называется смещение реакции среды в организме в щелочную сторону? Ацидоз алколоз ++ гидролиз гомеостаз нейтрализация Чему равна концентрация ионов водорода (моль/л) в водном растворе с рОН =11? 10-1 10-3 ++ 10-5 10-9 10-11 Какова реакция среды, если рОН = 13? кислая ++ щелочная слабощелочная слабокислая нейтральная Чему равен рН раствора гидроксида натрия с СNаОН = 0,001 моль/л? 10-2 2 9 11 ++ 10-12 17. ДЛЯ РАСТВОРА HCl С КОНЦЕНТРАЦИЕЙ 0,1 МОЛЬ/Л СПРАВЕДЛИВЫ СООТНОШЕНИЯ 1) [H+] = [OH-] 2) [H+] > [OH-] ++ 3) [H+] < [OH-] 4) [OH-] = 10-13 ++ 5) [OH-] = 10-1 6) [H+] = 10-13 7) [H+] = 10-1 ++ 8) pOH = 1 9) pH = 1 ++ 18. УСЛОВИЕ [H+] > [OH-] ВЫПОЛНЯЕТСЯ ДЛЯ ВОДНЫХ РАСТВОРОВ ВЕЩЕСТВ 1) CH3COOH ++ 2) NH4OH 3) NaOH 4) H2SO4 ++ 5) KOH 6) NaCl 7) HCl ++ 19. По какой формуле можно рассчитать концентрацию ионов водорода в растворе уксусной кислоты? [H+] = Cк-ты [H+] = Кк-ты [H+] = 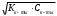 ++ ++[H+] = 14 - [OH-] [H+] = 10-14 20. По какой формуле можно рассчитать концентрацию ионов водорода в растворе гидроксида аммония? [H+] = Cосн [H+] = Cосн [H+] = 10-14 - [OH-] [H+] = 14 - [OH-] [H+] = 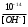 ++ ++ 21. ДЛЯ РАСТВОРА КОН С КОНЦЕНТРАЦИЕЙ 0,01 МОЛЬ/Л ВЕРНО [H+] = [OH-] [H+] [OH-] [H+] [OH-] ++ [OH-] = 10-12 [OH-] = 10-2 ++ [H+] = 10-12 ++ [H+] = 10-2 22. Чему равна константа ионизации Kb для раствора слабого однокислотного основания с концентрацией 0,1 моль/л и степенью ионизации =0,001? 10-1 10-3 10-4 10-5 10-7 ++ 23. Чему равна степень ионизации для раствора слабого однокислотного основания с концентрацией 0,1 моль/л и константой ионизации Kb равной 10-7? 0,1 0,01 0,001 ++ 10-4 10-5 Как называется объемная доля химически связанного СО2 в 100 мл плазмы крови? щелочным резервом крови, ++ водородным показателем крови, осмотическим давлением крови, буферной емкостью крови, концентрацией крови. |
