Тесты для подготорвки к экзаменам 2. Тесты по общей и неорганической химии для самоконтроля и подготовки к экзаменам
 Скачать 0.5 Mb. Скачать 0.5 Mb.
|
|
Основные закономерности протекания химических реакций. Энергетика и направление реакций. Скорость и химическое равновесие. 154. Химическая реакция обязательно сопровождается выделением или поглощением энергии, поскольку: а) для ее протекания необходима энергия, равная энергии активации; б) ее протекание требует столкновения реагирующих частиц; в) ее протекание заключается в разрыве одних и образовании других химичеc- ких связей; г) при ее протекании количество атомов до и после реакции остается постоян- ным. - 16 - 155. Первый закон термодинамики формулируется так: а) скорость реакции пропорциональна концентрации реагирующих веществ; б) тепловой эффект реакции равен сумме изменения запаса внутренней энергии и совершенной работе; в) при одинаковых условиях в равных объемах газов содержится одинаковое число молекул; г) при абсолютном нуле К энтропии веществ равны 0. 156. Внутренней энергией системы называется … а) кинетическая энергия движения молекул; б) суммарный запас всех видов энергии системы; в) потенциальная энергия системы; г) энергия притяжения электронов к ядру. 157. Стандартная теплота образования сложного вещества – это: а) количество теплоты, выделяющееся при образовании 1 моля вещества; б) тепловой эффект образования 1 моля вещества из простых веществ при стан- дартных условиях; в) количество теплоты, выделяющееся при образовании 1 моля вещества из про- стых веществ при стандартных условиях; г) количество теплоты, выделяющееся при образовании 1 моля вещества из про- стых газообразных веществ при стандартных условиях. 158. «Тепловой эффект химической реакции равен сумме теплот образования продуктов реакции минус сумма теплот образования исходных веществ». Это формулировка: а) правила Вант-Гоффа; б) закона Гесса; в) закона Генри; г) правила Гиббса. 159. В эндотермической реакции … а) скорость химической реакции мала; б) тепловой эффект химический реакции положителен (Qp 0); в) энтальпия реакционной системы увеличивается (Н 0); г) энтальпия реакционной системы уменьшается (Н 0). 160. Нfo(H S) = -21 кДж/моль. Сколько выделится или поглотится теплоты при взаимодействии 16 г серы и 11,2 л водорода? а) выделится 10,5 кДж; б) выделится 21 кДж; в) поглотится 21 кДж; г) поглотится 10,5 кДж. 161. Ho(SO ) = -143 кДж/моль. Сколько выделится или поглотится теплоты при разложении на простые вещества 44,8 л SO2? а) выделится 143 кДж; б) выделится 21 кДж; в) поглотится 286 кДж; г) поглотится 10,5 кДж. 162. Какой из отрезков на энергетической диаграмме реакции A+B=C+D соответствует изменению энтальпии реакции? - 17 - 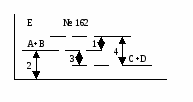 а) отрезок 1; б) отрезок 2; в) отрезок 3; г) отрезок 4. 163. Какой из отрезков на энергетической диаграмме реакции A+B=C+D с 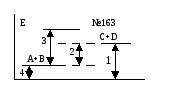 оответствует изменению энтальпии реакции? оответствует изменению энтальпии реакции?а) отрезок 1; б) отрезок 2; в) отрезок 3; г) отрезок 4. 164. Какая из приведенных реакций отвечает теплоте образования NO в стандартных условиях (Hof)? а) N(г) + O(г) = NO(г); б) 2NH3(г) + 5/2O2(г) = 2NO(г) + 3H2O(ж); в) 1/2N2(г) +1/2O2(г) = NO(г); г) N(г) + 1/2O2(г) = NO(г). 165. Какая из нижеприведенных реакций отвечает стандартной энтальпии образования SO2(г)? а) S(к) + O2(г) = SO2(г); б) H2SO3(р) = SO2(г) + H2O(ж); в) S(к) + 2/3 O3(г) = SO2(г); г) SO3(г) = SO2(г) + O(г). 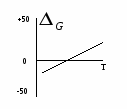 166. На рис. представлена зависимость G реакции 166. На рис. представлена зависимость G реакции от абсолютной температуры. Эта реакция возможна: а) невозможна ни при каких температурах; б) только при высоких температурах; в) только при низких температурах; г) при любых температурах. 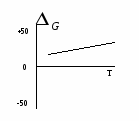 167. На рис. представлена зависимость G реакции 167. На рис. представлена зависимость G реакцииот абсолютной температуры. Эта реакция возможна: а) только при высоких температурах; б) только при низких температурах; в) при любых температурах; г) ни при каких температурах. 168. «При увеличении температуры на 10 градусов скорость большинства химических реакций увеличивается в 2-4 раза». Это формулировка: а) закона действующих масс; б) правила Вант-Гоффа; в) закона Генри; г) закона Гесса. 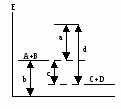 169. На рис. обозначены различные энергетические 169. На рис. обозначены различные энергетическиепараметры обратимой реакции A + В C + D. Каким отрезком обозначена на рис. энергия активации прямой реакции? а) а; б) б; в) с; г) d. - 18 - 170. Начальная концентрация одного из реагирующих веществ была равна 1,2 моль/л, а через 10 мин. стала равной 0,3 моль/л. Чему равна средняя скорость химической реакции (моль/л.мин.)? а) 0,09; б) -0,09; в) 0,9; г) -0,9. 171. Среднее значение скорости гомогенной реакции 2KBr(р) + Cl2(р) = Br2(р) + 2KCl(р) равно 0,2 моль/л.мин. при концентрациях реагирующих веществ: C(KI) = 0,4 моль/л, C(Br2) = 0,5 моль/л. Вычислить константу скорости химической реакции. а) 10; б) 1; в) 2; г) 2,5. 172. Измерили скорость реакции 2SO2 + O2 = 2SO3 при начальных концентрациях: C(SO2) = 0,2 моль/л, С(O2) = 0,1 моль/л. Повторно измерили скорость с новыми значениями концентраций: C(SO2) = 0,4 моль/л, C(O2) = …моль/л. Первоначальная и повторно измеренные скорости оказались равными. Чему равна C(O2)? а) 0,2; б) 0,05; в) 0,025; г) 0,4. 173. При повышении температуры от 18 до 28оС скорость реакции увеличилась в 2 раза. Во сколько раз она возрастет при увеличении температуры от 18 до 68оС? а) в 16 раз; б) в 32 раза; в) в 5 раз; г) в 10 раз. 174. При 20оС срок хранения раствора составляет 8 дней. Определите срок хранения растворов при температуре 40оС, если температурный коэффициент равен 2. а) 1 день; б) 5 дней; в) 2 дня; г) 10 дней. 175. На сколько градусов необходимо понизить температуру хранения лекарства с 20оС, при которой оно хранится не более 5 дней, чтобы довести срок его хранения до 45 дней. Температурный коэффициент равен 3. а) на 9о; б) на 20о; в) на 15о; г) на 45о. 176. Две химические реакции при температуре 20оС протекают с одинаковой скоростью. При повышении температуры на каждые 10о скорость первой реакции увеличивается в 2 раза, а второй – 3 раза. При какой температуре скорость второй реакции в два раза превысит скорость первой? а) 40; б) 37; в) 57; г) 47. 177. Во сколько раз нужно увеличить концентрацию азота в реакции N2 (г) + 3Н2 (г) = 3NH3 (г), чтобы при уменьшении концентрации водорода в 3 раза скорость реакции не изменилась? а) в 9 раз; б) в 27 раз; в) в 3 раза; г) в 6 раз. 178. «В момент химического равновесия отношение произведения молярных концентраций продуктов реакции к молярным концентрациям исходных веществ есть величина постоянная, называемая …» а) константой химического равновесия; б) свободной энергией Гиббса; в) степенью диссоциации; г) константой скорости реакции. - 19 - 179. Константа скорости химической реакции не зависит: а) от природы реагирующих веществ; б) от температуры; в) от катализатора; г) от концентрации реагирующих веществ. 180. Для реакции определены константы равновесия при различных температурах. При какой температуре выход продуктов реакции минимальный. а) 1200оС, К = 108; б) 900оС, К = 102; в) 600оС, К = 10-2; г) 300оС, К = 10-4. 181. В реагирующей системе, схема которой А + 2В С + 3D, исходные концентрации вещества А – 3 моль/л, вещества В – 4 моль/л, а равновесная концентрация вещества С – 1,5 моль/л. Константа равновесия в системе равна: а) 45,3; б) 48,7; в) 50,5; г) 91,1. 182. Как следует одновременно изменить температуру и давление в обратимой реакции N2O4(г)↔ 2NO2 (г) (Н прямой реакции +57,4 кДж), чтобы газовая бесцветная бурая смесь окрасилась? а) температуру и давление увеличить; б) температуру и давление уменьшить; в) температуру увеличить, давление уменьшить; г) температуру уменьшить, давление увеличить. 183. Как следует изменить концентрации, чтобы в гомогенной обратимой реакции FeCI3 + 3KCNS ↔ Fe(CNS)3 + 3KCI окраска ослабла? бесцветная бесцветная красная бесцветная а) концентрации FeCI3 и 3KCNS увеличить, КСI – уменьшить; б) концентрация FeCI3 и 3KCNS уменьшить, КСI – увеличить; в) концентрации всех веществ в системе увеличить; г) концентрации всех веществ в системе уменьшить. 184. Смещение равновесия влево в равновесной реакции CO(г) + 2Н2(г) ↔ СН3OH(г) – Q, произойдет при а) увеличении давления; б) увеличении температуры; в) уменьшении концентрации СН3ОН; г) уменьшении концентрации Н2. 185. Смещение равновесия вправо в равновесной реакции CO(г) + 2Н2(г) ↔ СO2 (г) + СН4 (г) + Q произойдет при: а) уменьшении температуры; б) увеличении концентрации СН4; в) увеличении температуры; г) введении катализатора. 186. Реакция, в которой понижение давления и повышение температуры вызовут смещение равновесия в одну сторону, - это: а) 2SO2 (г) + O2 (г) ↔ 2SO3 (г) + Q; б) СO2 (г) + 2Н2 (г) ↔ СН3ОН (г) – Q; в) FeO (к) + СO (г) ↔ Fe (к) + СО2 (г) – Q; г) СO2 (г) + Н2 (г) ↔ СO (г) + Н2О (г) + Q; - 20 - В заданиях 187-192 следует охарактеризовать нижеприведенную реакцию: 2SO3 (г) ↔ 2SO2 (г) + О2 (г); Н = + 196 кДж. а) б) в) г) 187. Станд. теп- лота образова- SO2 и SO3 O2 SO2 SO3 вания равна 0 для: 188. Энтропия уменьша- увеличи- не изме- нельзя от- в прямой реакции ется вается няется ветить без таблиц 189. Кинети- V=k.C2(SO2)+ C(O2); V=k.2C(SO2) С(О2); V=k.C2(SO3); V=k.C.2(SO3).C(O2). ческое уравнение скорости прямой реакции: 190. При увел. давл.в 2 раза увеличив. увеличив. не изменя- увеличив. конс-та скор.: в 6 раз в 8 раз ется в 4 раза 191. Константа [SO2]2[O2] [SO3]2 2[SO3] 2[SO3] равн.имеет вид: [SO3]2 [SO2]2[O2 ] 2[SO2][O2] [SO2]2[O2] 192. Равновесие уменьше- увеличении увеличении уменьшении смещ вправо при: нии т-ры т-ры давления конц. SO3 Растворы и их свойства. Концентрация растворов. Электролиты. Химические равновесия в растворах электролитов. 193. Массовая доля (%) при растворении 20 г глюкозы в 140 г воды равна: а) 6,25; б) 12,5; в) 18,75; г) 20. 194. Массовая доля (%) аскорбиновой кислоты в растворе, содержащем 10 г растворенного вещества в 190 г воды: а) 10; б) 5; в) 19; г) 5,26. 195. По какой формуле можно рассчитать массовую долю (%) вещества в водном растворе? а) mв. 100 б) mв. 100 в) mв. 100 г) mв. 100 ρ. Vp mН О Мв Vp 196. По какой формуле можно рассчитать содержание вещества (mв) в водном растворе, если известна его массовая доля (,%)? а) .100 б) .Vp в) mв. 100 г) (mв+mН О) mp 100 100 - 21 - 197. По какой формуле можно рассчитать молярную концентрацию раствора? а) б) mв в) Мв г) Vp,л Мв mв. Vp,л Vp,мл 198. Объем раствора 100 мл. Молярная концентрация соли 0,2 моль/л. Какое количество (моль) соли содержит раствор? а) 0,2.100; б) 0,2.1000; в) 100 г) 0,2.100 100 0,2.1000 1000 199. Растворы LiCI, NaCI, KCI имеют одинаковую массовую долю растворенных веществ и практически одинаковую плотность растворов. Какой из них имеет максимальную молярную концентрацию? а) р-р NaCI; б) одинакова у всех растворов; в) р-р КСI; г) р-р LiCI. 200. Растворы LiOH, NaOH, KOH имеют одинаковую массовую долю растворенных веществ и практически одинаковую плотность растворов. Какой из них имеет максимальную молярную концентрацию? а) у всех одинакова; б) р-р NaOH; в) р-р KOH; г) р-р LiOH. 201. Молярная масса эквивалента KHSO4 (М = 136 г/моль) в реакции KHSO4 + KOH = K2SO4 + H2O равна: а) 136; б) 68; в) 56; г) 72. 202. Объем раствора 250 мл. Молярная концентрация эквивалента раствора 0,1 моль/л. Молярная масса эквивалента растворенного вещества 31,6 г/моль. Сколько грамм вещества содержится в растворе? а) 0,1.31,6 б) 31,6.1000.0,1 в) 0,1.31,6.250 г) 0,1.31,6.250 250 250 1000 203. Известно, что осмотическое давление крови человека составляет 780 кПа. Какой из нижеприведенных растворов NaCI создает такое же осмотическое давление? а) 5% р-р; б) 0,1% р-р; в) 10% р-р; г) 0,9% р-р. 204. Формула P=СRT (закон Вант-Гоффа), показывающая зависимость осмотического давления от концентрации и температуры, применима … а) только к растворам неэлектролитов; б) к любым растворам; в) только к растворам электролитов; г) к растворам слабых электролитов. 205. Плазмолиз клеток будет наблюдаться при помещении их в раствор NaCI концентрации … а) 0,1%; б) 10%; в) 0,9%; г) 0%. 206. Формула P=СRT (закон Вант-Гоффа) может быть применима к растворам электролитов после введения в качестве сомножителя … а) степени диссоциации ; б) константы диссоциации Кд; в) изотонического коэффициента I; г) диэлектрической проницаемости . 207. Какой раствор изотоничен по отношению к 0,9% раствору NaCI? а) раствор любого соединения, имеющего такую же концентрацию частиц, как и 0,9% раствор NaCI; - 22 - б) раствор NaCI любой концентрации; в) раствор любого соединения, имеющего концентрацию 0,9%; 208. Определите преимущественное направление диффузии при помещении клетки в гипотонической раствор NaCI. а) NaCI диффундирует из клетки; б) вода диффундирует из клетки; в) NaCI диффундирует в клетку; г) вода диффундирует в клетку, 209. В каком ряду 0,01 М растворов СН3СOOH, NaCI, C6H12O6 происходит возрастание осмотического давления: а) NaCI – CH3COOH - C6H12O6; б) CH3COOH - NaCI - C6H12O6; в) C6H12O6 – СН3СООН – NaCI; г) C6H12O6 – NaCI – CH3COOH. 210. Молярная концентрация какого иона в насыщенном растворе гидроксида железа (Ш) наибольшая? а) Fe+3; б) FeOH2+; в) Fe(OH)2+; г) ОН-. 211. Молярная концентрация какого иона в растворе мышьяковой кислоты наименьшая? а) HAsO42-; б) Н+; в) AsO43-; г) H2AsO4-. 212. Сила кислоты определяется: а) степенью ее диссоциации в растворе; б) числом ионов водорода в ее формуле; в) растворимостью в воде; г) ее окислительно-восстановительной способностью. 213. Основность кислоты определяется: а) количеством атомов элемента, образующего кислоту; б) количеством атомов кислорода; в) наличием водородных связей; г) количеством ионов водорода. 214. «Отношение числа молекул электролитов, распавшихся на ионы, к общему числу молекул называется . . .» а) степенью гидролиза; б) степенью диссоциации; в) константой гидролиза; г) константой диссоциации. 215. Закон разбавления Оствальда, показывающий зависимость степени диссоциации от концентрации, применим: а) для любых электролитов; б) только для сильных электролитов; в) только для труднорастворимых электролитов; г) только для слабых электролитов. 216. Константа диссоциации уксусной кислоты увеличивается при: а) повышении концентрации р-ра; б) разбавлении р-ра; в) увеличении температуры; г) добавлении одноименного иона; 217. Степень диссоциации гидроксида аммония можно увеличить при: а) охлаждении; б) добавлении хлорида аммония; в) разбавлении; г) подщелачивании. - 23 - 218. Каким образом можно увеличить степень диссоциации уксусной кислоты? а) подщелачиванием раствора; б) подкислением раствора; г) разбавлением раствора; г) нагреванием раствора. 219. Для какого из нижеприведенных растворов электролитов степень диссоциации не зависит от концентрации? а) CH3COOH; б) CH3COONa; в) NH4OH; г) Н3РО4. 220. В каком ряду электролитов равной концентрации происходит уменьшение рН растворов? а) Н3ВО3 – Н2О - CH3COOH; б) Н3ВО3 - CH3COOH - Н2О; в) Н2О - Н3ВО3 - CH3COOH; г) CH3COOH - Н3ВО3 - Н2О; 221. В каком ряду электролитов равной концентрации происходит увеличение рН растворов? а) H2S – H2SO4 – H2SO3; б) H2SО4 – H2SO3 – H2S; в) H2SО3 – H2S – H2SO4; г) H2SО3 – H2SO4 – H2S; 222. В каком ряду электролитов равной концентрации происходит уменьшение рН растворов? а) H3PO4 – H2SO4 - H2S; б) H2SО4 – H3РO4 – H2S; в) H2S – H3РO4 – H2SO4; г) H2SО4 – H2S – H3РO4; 223. В каком ряду электролитов равной концентрации происходит увеличение рН растворов? а) NH4OH – Ba(OH)2 – CH3COOH; б) СН3СOOH - NH4OH – Ba(OH)2; в) Ba(OH)2 - NH4OH - CH3COOH; г) CH3COOH - Ba(OH)2 - NH4OH. 224. В каком ряду электролитов равной концентрации происходит уменьшение рН растворов? а) НСI – Ba(OH)2 – HCOOH; б) HCOOH - Ba(OH)2- НСI; в) Ba(OH)2 - HCOOH – HCI; г) HCOOH – HCI - Ba(OH)2; 225. В каком ряду электролитов равной концентрации происходит увеличение рН растворов? а) HF – HBr – HCIO; б) HBr – HF – HCIO; в) HCIO – HF – HBr; г) HCIO – HBr – HF. В заданиях 226-229 установите соответствие концентрации раствора электролита и величины рН. 226. 0,2 М НСIO ( Кд = 5.10-8) а) 1; 227. 0,05 М Ba(OH)2 б) 5; 228. 0,1 М НСI в) 4; 229. 0,01 М НСN (Кд ≈ 10-8 ) г) 13. 230. «Произведение концентраций ионов труднорастворимого электролита в его насыщенном растворе при постоянной температуре называется . . . а) ионным произведением воды; б) константой диссоциации; в) произведением растворимости; г) константой гидролиза. - 24 - 231. Какая соль наиболее растворима (в скобках дана величина ПР): а) AgI (1,5.10-16); б) AgBr (4,4.10-13); в)AgSCN (1,2.10-12); г) AgCI (1,8.10-10). 232. Наименее растворима в воде соль (в скобках – величина ПР): а) BaSO3 (1.10-7); б) CaSO4 (1.10-5); в) CaCO3 (5.10-9); г) BaC2O4 (1,1.10-7). 233. Концентрация катиона А в насыщенном растворе труднорастворимой соли типа АВ2 равна 1.10-3моль/л. Вычислить ПР этой соли. а) 1.10-6; б) 1.10-9; в) 4.10-9; г) 2.10-3; 234. . Концентрация аниона В в насыщенном растворе труднорастворимой соли типа АВ2 равна 2.10-4моль/л. Вычислить ПР этой соли. а) 8.10-12; б) 1,4.10-2; в) 4.10-12; г) 4.10-8; 235. Произведение растворимости соли типа АВ2 равно 2,7.10-15. Чему равна концентрация (моль/л) насыщенного раствора этой соли? а) 1.10-5; б) 1.10-4; в) 5,4.10-5; г) 1,35.10-9. 236. Основное условие образования осадка: а) ПИ=ПР; б) ПИ<ПР; в) ПИ>ПР; г) ПИ << ПР. 237. Основное условие растворения осадка: а) ПИ=ПР; б) ПИ<ПР; в) ПИ>ПР; г) ПИ >> ПР. 238. Основную соль (гидроксосоль) при гидролизе образует: а) Na2CO3; б) AgNO3; в) AICI3; г) К3PO4. 239. Кислую соль при гидролизе образует: а) Cr2(SO4)3; б) ZnCI2; в) Na2SO4; г) К2S. 240. Гидролизуется по катиону соль: а) МgCI2; б) Ca(NO3)2; в) CH3COOK; г) Na2CO3. 241. Гидролизуется по катиону и аниону соль: а) Na2CO3; б) (NH4)2SO4; в) (NH4)2CO3; г) CH3COONa 242. Не подвергается гидролизу соль: а) К3PO4.; б) СаСI2; в) Na2SO3; г)Na2S. 243. Гидролизуется по аниону соль: а) K2SO3; б) K2SO4; в) ZnSO4; г) NaNO3. 244. В растворе какой соли лакмус окрашен в розовый цвет, а фенолфталеин – бесцветен: а) СaCI2; б) K2SO3; в) NaNO3; г) AICI3. 245. В растворе какой соли лакмус не изменит окраску: а) СН3СOONa; б) CH3COONH4; в) Na2CO3; г) NH4CI. 246. Какую пару солей нельзя различить при помощи фенолфталеина: а) K2SO3 и K2SO4; б) Na2S и Na2CO3; в) Na2CO3 и ZnCI2; г) Na2CO3 и Na2SO4. 247. Наименее гидролизована в водном растворе и имеет наименьшую величину рН соль: а) Na2SO3; б) Na2S; в) Na2CO3; г) Na2SiO3. - 25 - 248. . Наиболее гидролизована в водном растворе и имеет наименьшую величину рН соль: а) AICI3; б) MgCI2; в) CaCI2; г) CuCI2. 249. В каком ряду растворов солей одинаковой концентрации имеет место возрастание рН? а) NH4СI – Ba(NO3)2 – NaNO2; б) NaNO2 – Ba(NO3)2 - NH4CI; в) Ba(NO3)2 - NH4CI – NaNO2; г) NaNO2 - NH4CI - Ba(NO3)2. 250. Восстановите левую часть ионного уравнения гидролиза … + … ↔ AI(OH)2+ + H+: а) AI3+ + 2HOH ↔ AI(OH)2+ + H+; б) AIOH2+ + HOH ↔ AI(OH)2+ + H+; в) AI3+ + OH- + HOH ↔ AI(OH)2+ + H+; г) AI2+ + 2HOH ↔ AI(OH)2+ + H+; 251. Константа гидролиза реакции СO32- + HOH ↔ HCO3- + OH-: а) [CO32-] б) [HCO3-]+[OH-] в) [HCO3-] [OH-] г) [CO32-]+[HOH-] [HCO3-] [OH-] [CO32-] [CO32-] [HCO3-] [OH-] 252. Константа гидролиза реакции: NH4++CH3COO-+HOH↔NH4OH+CH3COOH а) [NH4OH] [CH3COOH] б) [NH4+] [CH3COO-] [NH4+] [CH3COO-] [NH4OH] [CH3COOH в) [NH4OH] г) [CH3COOH] [NH4+] [CH3COO-] [NH4+] [CH3COO-] 253. При сливании растворов CrCI3 и K2S идет: а) первая ступень гидролиза с образованием CrOHS и KHS; б) обменная реакция с образованием Cr2S3 и KCI; в) взаимное усиление гидролиза с образованием Cr(OH)3 и H2S; г) окислительно-восстановительная реакция. 254. При сливании растворов AI2(SO4)3 и Na2CO3 идет: а) обменная реакция с образованием AI2(CO3)3 и Na2SO4; б) взаимное усиление гидролиза с образованием AI(OH)3, СO2 и Na2SO4; в) окислительно-восстановительная реакция; г) первая ступень гидролиза солей с образованием AIOHSO4 и NaHCO3. 255. Степень гидролиза Na3PO4 уменьшается при добавлении: а) HCI; б) CO2; в) NaCI; г) NaOH. 256. Степень гидролиза ацетата натрия возрастает при: а) уменьшении температуры; б) увеличении температуры; в) добавлении NaOH; г) увеличении концентрации раствора. 257. Степень гидролиза AICI3 возрастает при: а) добавлении Na2CO3; б) уменьшении температуры; в) добавлении НCI; г) увеличении концентрации раствора. 258. Определите функцию [Fe(H2O)6]3+ - иона с точки зрения протолитической теории: [Fe(H2O)6]3+ + НОН ↔ [FeOH(H2O)5]2+ + H3O+ а) основание; б) восстановитель; в) кислота; г) комплексообразователь. - 26 - 259. Определите функцию SiO32--иона с точки зрения протолитической теории: SiO32- + HOH ↔ HSiO3- + OH- а) основание; б) амфолит; в) восстановитель; г) кислота. 260. Определите функцию Н2О с точки зрения протолитической теории: HOH + HOH ↔ H3O+ + OH- а) комплексообразователь; б) основание; в) амфолит; г) кислота. |
