Учебник для студентов фармацевтических вузов и факультетов Под редакцией
 Скачать 7.13 Mb. Скачать 7.13 Mb.
|
|
Глава 17 КОЛЛОИДНЫЕ РАСТВОРЫ (SOLUTIONES COLLOIDALE) ХАРАКТЕРИСТИКА КОЛЛОИДНЫХ РАСТВОРОВ Коллоидные растворы представляют собой улып-рамикрогетерогенную систему, в которой структурной единицей является комплекс молекул, атомов и ионов, называемых мицеллами. Размер частиц дисперсной фазы коллоидных растворов (от гр. holla— клей и eidos— вид) находится в пределах от 1 до 100 нм (0,1 мкм). Ядро мицеллы образуется вследствие скопления отдельных молекул гидрофобного вещества. Двойной слой ионов, которые окружают ядро (адсорбционный и диффузный), возникает в результате или адсорбции ионов, или же вследствие диссоциации поверхностно размещенных молекул ядра под влиянием внешней среды. Соединения, из которых образуются ионы двойного слоя, называются ионогенными группами. Соответственно правилу Фаянса на поверхности ядра лиофобной мицеллы адсорбируются преимущественно те ионы, которые имеют с ядром общие химические элементы. Все эти ионы называются потенциал определяющими ионами. Электрически заряженные частицы, ограниченные адсорбционным слоем, называются гранулой. Ионы, которые нейтрализуют гранулу, образуют вокруг ядра ионную атмосферу, распределяясь между адсорбционным и диффузным слоями. Эти ионы называются противоионами. Как правило, в адсорбционном слое мицеллы размещаются потенциалопределяю-щие ионы, а в диффузном — противоионы. Таким образом, мицеллу можно рассматривать как комплекс гранулы и противоио-нов (рис. 112). Подробное строение мицелл рассматривается в курсе физколлоидной химии. В фармацевтической практике применяются, главным образом, гидрозоли, то есть дисперсные системы, где дисперсионной средой является вода. 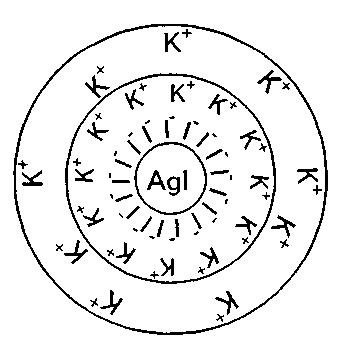 Рис. 112. Строение мицеллы В связи с большим размером частиц коллоидные растворы обладают характерными свойствами: малая диффузионная способность, низкое осмотическое давление, малая способность к диализу, способность рассеивать свет во все стороны при рассматривании растворов в отраженном свете (образуется характерный конус Тинда-ля). Мицеллы в коллоидном растворе находятся в хаотическом движении. Для них характерно броуновское движение. Коллоидные растворы являются седиментационно устойчивыми системами. Седиментация — это процесс оседания частиц под действием силы тяжести. Оседанию частиц в коллоидных растворах препятствует броуновское движение, которое распределяет частицы по всему объему. Коллоидные растворы — агрегативно и термодинамически неустойчивые системы, так как частицы обладают избыточной поверхностной энергией. В результате уменьшения поверхностной энергии может происходить коагуляция коллоидных растворов. Коагуляция — это процесс соединения между собой частиц в дисперсных системах с образованием более крупных комплексов. Укрупнение частиц в коллоидных растворах возникает под воздействием молекулярных сил сцепления и поверхностного натяжения жидкости. Силы межмолекулярного притяжения содействуют сцеплению частиц при их столкновении, а силы поверхностного натяжения жидкости — уменьшению поверхности соприкосновения жидкости с частицами. Однако, несмотря на это, типовые коллоидные растворы сохраняют свою устойчивость на протяжении определенных сроков, что можно объяснить наличием факторов, препятствующих соединению коллоидных частиц. Один из таких факторов — наличие у коллоидных частиц одноименных электрических зарядов, благодаря чему они отталкиваются, а, следовательно, не соединяются в большие агрегаты. Коллоидные растворы могут быть устойчивыми только в присутствии третьего компонента — стабилизатора, который, адсорбируясь на поверхности раздела частица-среда, предупреждает коагуляцию. Устойчивость коллоидных систем улучшается и за счет возникновения сольватных слоев из молекул растворителя. Коллоидные растворы — неравновесные системы: они не обладают свойствами обратимости (если коллоидный раствор упарить или осадить электролитом, а потом снова добавить воду, то коллоидный раствор не получится). Необходимо также иметь в виду, что при длительном хранении может происходить так называемое «старение», которое проявляется в слипании частиц, что приводит к их коагуляции. Это явление также отличает коллоидные растворы от истинных. Устойчивость коллоидных растворов нарушается за счет самопроизвольного слипания частиц, при добавлении электролитов (которые, гидратируясь, отнимают воду от мицеллы коллоидного раствора, то есть нарушается водная оболочка вокруг коллоидных частиц, в результате чего частицы укрупняются и происходит их оседание), при изменении температуры, рН среды, воздействия света. Устойчивость системы обеспечивается наличием заряда на поверхности частицы (диссоциация вещества, адсорбция одноименных ионов), сольватным слоем, оболочкой из ВМС, ПАВ вокруг частиц дисперсной фазы, препятствующей их слипанию. Механизм стабилизирующего действия ВМС и ПАВ заключается в том, что они адсорбируются на поверхности частиц и ориентируются на границе раздела фаз таким образом, что полярной частью обращены к полярной жидкости, а неполярной — к неполярным частицам, образуя на поверхности фазы мономолекулярный адсорбционный слой. Ионы ПАВ, адсорбируясь на поверхности раздела, обладают поверхностной активностью, при этом повышаются силы отталкивания между частичками и снижается их поверхностное натяжение, что способствует агрегативной устойчивости. Кроме того, вокруг пленки ПАВ, окружающей частичку, ориентируются молекулы сольватного слоя (в воде — гидратная оболочка). Такие коллоиды называются «защищенными». Поскольку размер частиц защищенных коллоидов таков, что они не проходят через физиологические мембраны, они лишены способности всасываться, а их препараты, следовательно, проявляют только местное действие. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАЩИЩЕННЫХ КОЛЛОИДОВ В фармацевтической практике применяют в основном три защищенных коллоидных препарата. Это колларгол, протаргол и ихтиол. Колларгол и протаргол применяют как вяжущие средства, антисептики, противовоспалительные средства. Их растворы используют для смазывания слизистых оболочек верхних дыхательных путей, в глазной практике, для промывания мочевого пузыря, гнойных ран и т. д. Раствор протаргола (серебро белковое) — Argentumprotei-nicum— это аморфный порошок коричнево-желтого цвета, без запаха, слабо горького и слегка вяжущего вкуса, легко растворим в воде, является защищенным коллоидным препаратом серебра, содержит 7,3—8,3 % (в среднем 8 %) серебра оксида. Роль защитного коллоида выполняют продукты гидролиза белка (альбуминаты). Препарат описан в ГФ IX, ст. 398. Rp.: Solutionis Protargoli 2 % 100 ml Da. Signa. Для промывания полости носа При приготовлении растворов протаргола используется его способность набухать благодаря содержанию большого количества (около 90 %) белка. После набухания протаргол самопроизвольно переходит в раствор. 2,0 г протаргола насыпают тонким слоем на поверхность 100 мл воды и оставляют в покое. Препарат набухает, и частички протаргола, постепенно растворяясь, опускаются на дно подставки, давая доступ следующим порциям воды к препарату. Взбалтывать раствор протаргола не рекомендуется, так как при взбалтывании порошок слипается в комки, образуется пена, которая обволакивает частицы протаргола и замедляет его пептизацию. Полученный раствор при необходимости процеживают во флакон для отпуска через рыхлый комочек ваты, промытый горячей водой. Растворы протаргола можно фильтровать через беззольную фильтровальную бумагу или стеклянные фильтры № 1 и № 2. В зольной фильтровальной бумаге содержатся ионы железа, кальция, магния, которые вызывают коагуляцию протаргола и в результате происходит потеря лекарственного препарата на фильтре. Если в составе раствора, кроме воды, прописан глицерин, то протаргол сначала растирают в ступке с глицерином и после его набухания постепенно добавляют воду. Кроме того, надо учитывать, что растворы протаргола надо отпускать в склянках из темного стекла, так как свет — это фактор, влияющий на коагуляцию коллоидных препаратов. Под действием света содержащийся в протарголе серебра оксид разрушается, окисляя продукты гидролиза белка, в результате чего протаргол превращается в металлическое серебро. Раствор протаргола не следует готовить в запас. Растворы колларгола (серебро коллоидальное) — Argentumcolloidale— это зеленовато- или синевато-черные пластинки с металлическим блеском, растворимы в воде, содержат 70 % серебра оксида и 30 % продуктов гидролиза белка (натриевые соли лизальбиновой или протальбиновой кислот), которые выполняют роль защитного коллоида. Колларгол также описан в ГФ IX. В связи с малым количеством белка (около 30 %) происходит медленное растворение препарата в воде. Поэтому для ускорения растворения можно применять два способа приготовления в зависимости от концентрации прописанного раствора. 1. В стеклянный флакон для отпуска фильтруют (можно процедить) воду очищенную, высыпают колларгол и содержимое склянки встряхивают до полного перехода колларгола в раствор. Этот метод удобен при небольших концентрациях колларгола (до 1 %). Rp.: Solutionis Collargoli 2 % 200 ml Da. Signa. Для спринцеваний 2. Если приходится готовить растворы большей концентрации, то поступают следующим образом: колларгол помещают в ступку, в данном случае 4,0 г, добавляют небольшое количество воды очищенной, смесь оставляют на 2—3 минуты для набухания, растирают, а затем понемногу при помешивании добавляют оставшееся количество воды. Стадия набухания колларгола происходит сравнительно долго, поэтому более рационально применять второй способ. В случае необходимости раствор колларгола фильтруют через стеклянный фильтр № 1 или № 2 или процеживают через рыхлый комочек ваты, промытый горячей водой. Раствор светочувствительный, поэтому отпускают во флаконе из оранжевого стекла. Растворы ихтиола (аммониевая соль сульфокислот сланцевого масла) — Ichtyolum— это почти черная или бурая сиропообразная жидкость своеобразного резкого запаха и вкуса. Растворим в воде, глицерине, спирто-эфирной смеси. Водные растворы при взбалтывании сильно пенятся. Описание препарата приведено в ГФ IX. Является природным защищенным коллоидом. Rp.: Solutionis Ichtyoli 1 % 200 ml Da. Signa. Для примочек Отвешивают 2,0 г ихтиола в старированную фарфоровую чашку (или во вместилище из пергаментной бумаги), постепенно добавляют 200 мл воды при непрерывном помешивании стеклянной палочкой, затем при необходимости процеживают во флакон для отпуска. Rp.: Solutionis Ichtyoli 2 % 100 ml Glycerini 10,0 Misce. Da. Signa. Для тампонов В тарированную подставку отвешивают 10,0 г глицерина (вязкая жидкость) и туда же отмеривают 98 мл воды очищенной, взбалтывают до однородности. 2,0 г ихтиола отвешивают в тарированную фарфоровую чашечку, потом добавляют по частям раствор глицерина в воде и растирают до полного растворения, оставив в подставке часть водно-глицеринового раствора. Полученный раствор ихтиола при необходимости процеживают через рыхлый комочек ваты во флакон для отпуска объемом 150 мл. Фарфоровую чашку ополаскивают остатком водно-глицеринового раствора и им же промывают ватный тампон. Флакон укупоривают и оформляют к отпуску. Для приготовления глицериновых растворов ихтиола флакон помещают в горячую воду для облегчения растворения ихтиола. Rp.: Solutionis Ichtyoli 10 % 100 ml Kalii iodidi 2,0 Misce. Da. Signa. По 2 столовые ложки на микроклизму В данном случае необходимо избрать оптимальный вариант технологии, чтобы избежать коагулирующего действия электролита — калия йодида. С этой целью его целесообразно добавить к ихтиолу в виде водного раствора. Взвешивают в тарированную чашку 10,0 г ихтиола и частями при помешивании добавляют 80 мл воды. Раствор процеживают во флакон для отпуска, в который отмеривают 10 мл 20 % -ного раствора калия йодида и взбалтывают до однородности. РАСТВОРЫ ПОЛУКОЛЛОИДОВ Растворы полуколлоидов — это такие системы, которые при определенных условиях являются истинными растворами, а при смене концентрации дисперсной фазы становятся золями в коллоидном состоянии. В этом случае вещество (дисперсная фаза) одновременно состоит из молекул, ионов и различных агрегатов в виде мицелл различной дисперсности. Мицеллы образуются в результате ассоциации молекул растворенного вещества. При этом повышается концентрация растворенного вещества, что способствует увеличению коллоидной фракции. С повышением температуры наоборот более трудным становится мицеллообразование, поскольку ослабляются межмолекулярные связи и усиливается молекулярно-кинетическое движение. К таким растворам, применяющимся в медицинской практике, относятся растворы танидов, мыл, некоторых органических оснований (этакридина лактат). Вследствие резко выраженной поверхностной активности полуколлоиды легко адсорбируются на неполярных поверхностях и гидроли-зуют их. Особенно проявляется способность к ассоциации молекул в растворах танидов и других дубильных веществ, которая увеличивается с повышением концентрации. Приготовление растворов полуколлоидов проводят в аптеках по общим правилам приготовления растворов, приведенных выше. Водные растворы танидов. В водных растворах танидов, которые являются производными фенола, мицеллы образуются не только вследствие слипания молекул по гидрофобным участкам, но и вследствие образования водородных связей. Rp.: Tannini 3,0 Aquae purificatae 100 ml Misce. Da. Signa. Для смачивания кожи при ожогах Раствор для наружного применения, в состав которого входит танин, относящийся к полуколлоидам (концентрация его 3 %). В подставку отмеривают 98,2 мл теплой очищенной воды и в ней растворяют 3,0г танина (КУО = 0,61). Раствор процеживают через ватный тампон во флакон и оформляют к отпуску. Водные растворы мыл. Мыла, которые являются солями жирных кислот, могут существовать в водных растворах в виде неионизированных молекул, ионов, продуктов гидролиза мыла, агрегатов (мицелл) и молекул жирной кислоты. В достаточно концентрированных растворах мицеллы имеют сферическую форму. Они состоят из молекул, которые соединены своими углеводородными группами и обращены наружу (в воду) ионогенными, сильнополярными группами. При более высоких концентрациях мыла в растворах образуются мицеллы другого состава (пластинчатые мицеллы). В спирте мыла образуют молекулярные растворы, так как спирт является растворителем как для полярной, так и для неполярной молекулы мыла. В рецептуре аптек могут встречаться жидкие лекарственные формы, представляющие сочетания растворов ВМС, коллоидных и полуколлоидных растворов. Глава 18 СУСПЕНЗИИ (SUSPENSIONES) ХАРАКТЕРИСТИКА СУСПЕНЗИЙ Суспензии — жидкая лекарственная форма, содержащая в качестве дисперсной фазы одно или несколько мелкоизмелъ-ченных порошкообразных лекарственных веществ, распределенных в жидкой дисперсионной среде. Суспензии (взвеси) представляют собой микрогетерогенные дисперсные системы, состоящие из твердой дисперсной фазы и жидкой дисперсионной среды. В зависимости от величины частиц суспензии различают: — грубые, которые называют взбалтываемыми микстурами (Mix-turaeagitandae), имеют размер частиц дисперсной фазы (то есть лекарственного вещества) более 1 мкм, при стоянии быстро оседают, поэтому их не процеживают (в случае необходимости процеживают только растворитель); — тонкие, которые называют мутными, или опалесцирующими, микстурами (Mixturaeturbidae), размер частиц от 0,1 до 1 мкм, отличаются от грубых суспензий тем, что в них осадок образуется более медленно. В зависимости от способа применения суспензии различают для внутреннего, наружного и парентерального применения. Если в форме суспензий прописываются лекарственные вещества для внутреннего применения, то их называют микстурами-суспензиями. В качестве наружных средств суспензии прописываются для смазываний, спринцеваний и др. Реже суспензии применяются для инъекций, в основном, внутримышечных (для внутривенного введения не используются). В аптечной практике наиболее часто используют суспензии, в которых дисперсионной средой являются вода, водные вытяжки из лекарственного растительного сырья, глицерин, жирные масла и др. Суспензии могут быть готовыми к применению, а также в виде порошков или гранул для суспензий, к которым перед использованием прибавляют воду или другую подходящую жидкость в количестве, указанном в частных статьях. Суспензии образуются в следующих случаях: — при назначении в составе жидких лекарств твердых ингредиентов, которые не растворимы в прописанном растворителе (например, если в качестве растворителя прописана вода, а в качестве лекарственного вещества — цинка оксид, камфора, фенилсалицилат и другие вещества); — при назначении твердых растворимых веществ в количествах, превышающих предел их растворимости (например, кислота борная имеет растворимость в холодной воде 1:25, а выписана 1:30, следовательно, нерастворившаяся часть ее будет в виде осадка); — когда в результате происходящих химических реакций образуются новые лекарственные вещества, не растворимые в прописанном растворителе (например, если смешать растворы кальция хлорида и натрия гидрокарбоната, образуется осадок кальция карбоната); — когда при смешивании двух растворителей ухудшаются условия растворимости лекарственных веществ (например, при добавлении нашатырно-анисовых капель к водным растворам солей выделяется анетол). В медицинской практике суспензии имеют определенное значение: — в суспензиях имеется возможность вводить твердые нерастворимые вещества в жидкость, где они имеют высокую степень дисперсности, в силу чего быстрее и полнее проявляют свое лечебное действие, что доказано многочисленными биофармацевтическими исследованиями; — суспензии позволяют обеспечить пролонгированное действие и регулировать его продолжительность путем изменения величины частиц лекарственного вещества. Например, суспензия аморфного цинк-инсулина с частицами около 2 мкм вызывает кратковременное понижение сахара в крови. Суспензия кристаллического препарата с частицами 10—40 мкм оказывает длительное терапевтическое действие. Смесь аморфного и кристаллического препаратов обеспечивает раннее наступление терапевтического эффекта и его длительность. Необходимо отметить, что суспензии представляют собой трудно-дозируемые лекарственные препараты. Ядовитые и сильнодействующие вещества из-за трудности дозировки в суспензиях, как правило, не отпускаются. Исключение составляет тот случай, когда их количество, выписанное в рецепте, не превышает высшую разовую дозу во всем объеме лекарственной формы. Вопрос об отпуске сильнодействующих веществ в суспензиях решается в каждом отдельном случае индивидуально. Суспензии не отпускаются и в тех случаях, когда в результате химического взаимодействия между лекарственными веществами образуются ядовитые осадки. ФАКТОРЫ, ВЛИЯЮЩИЕ НА УСТОЙЧИВОСТЬ ГЕТЕРОГЕННЫХ СИСТЕМ. ЗАКОН СТОКСА Суспензии не обладают способностью диффундировать, осмотическим давлением, у них не наблюдается самопроизвольное хаотическое движение частиц. Характерная особенность суспензий — их способность к отстаиванию. Поэтому одним из важных требований, которые предъявляются к суспензиям, является их устойчивость. Устойчивость суспензий зависит, в первую очередь, от свойств содержащихся в них лекарственных веществ, а именно: являются ли эти вещества поверхностно-гидрофильными или гидрофобными. Суспензии гидрофильных веществ более устойчивые, так как гидрофильные частички смачиваются дисперсионной средой и вокруг каждой из них образуется водная (гидратная) оболочка, которая препятствует агрегации мелких частиц в более крупные. Гидрофобные частицы не защищены такой оболочкой, так как при соприкосновении с водой они не в состоянии образовывать стабилизирующую водную оболочку, а потому легко и самопроизвольно (под действием молекулярных сил) слипаются, образуя агрегаты-хлопья (коагуляция), которые быстро оседают. Если при коагуляции суспензий образуются хлопья, плохо смачиваемые водой, то они всплывают на поверхность воды. Всплывание больших хлопьевидных агрегатов гидрофобного вещества на поверхность воды называется флокуляци-ей (от лат. flocculi— хлопья). Флокуляция усиливается при взбалтывании, так как поверхность гидрофобного вещества плохо смачивается и это способствует фиксации пузырьков воздуха к твердой фазе. Устойчивость суспензий зависит также от степени дисперсности (измельчения) частиц дисперсной фазы и их электрического заряда, что препятствует укрупнению и коагулированию частиц при их движении. Чем измельченнее вещество, тем устойчивее суспензия, тем точнее ее дозирование, эффективнее действие. Устойчивость зависит от отношения плотностей диспергированных частиц дисперсной фазы и дисперсионной среды. Если плотность дисперсной фазы больше плотности дисперсионной среды, то частицы быстро оседают. Если плотность дисперсной фазы меньше плотности дисперсионной среды, то частицы всплывают. Если плотность дисперсной фазы примерно равна плотности дисперсионной среды, тогда суспензия наиболее устойчива. Различают агрегативную и седиментационную устойчивость суспензий. Агрегативная устойчивость — это устойчивость против сцепления частиц. При седиментации суспензий могут наблюдаться два различных случая: в одном случае каждая частица оседает отдельно, не соединяясь друг с другом. Оседание при этом происходит более медленно. Такая дисперсная система называется агрегативно устойчивой. Однако, возможен и такой случай, когда твердые частицы суспензии коагулируют под действием молекулярных сил притяжения и оседают в виде целых хлопьев. Такие системы носят название агрегативно неустойчивых. Седиментационная устойчивость — это устойчивость против оседания частиц, связанных только с их размером. Во всякой суспензии твердые вещества будут седиментироваться (оседать) со скоростью, зависящей от степени дисперсности твердых частиц и некоторых других факторов. Закон Стокса. В общем виде скорость седиментации находит отражение в формуле Стокса. При радиусе частиц дисперсной фазы меньше 0,5 мкм формула Стокса не применима, так как броуновское движение препятствует их осаждению. Для шарообразных частиц диаметром от 0,5 до 100 мкм скорость оседания частиц дисперсной фазы подчиняется формуле Стокса. Скорость оседания прямо пропорционально зависит от радиуса частиц дисперсной фазы, разности плотностей дисперсной фазы и дисперсионной среды и обратно пропорциональна вязкости дисперсионной среды. V= Где: V— скорость движения (оседания), см/с; r— радиус частиц дисперсной фазы; d1 — плотность частиц дисперсной фазы, г/см3; d2— плотность дисперсионной среды, г/см3; g— ускорение силы тяжести, см/с2. При применении формулы Стокса нужно иметь в виду, что частицы дисперсной фазы должны быть строго шарообразной формы, абсолютно твердые и гладкие; кроме того, формула Стокса не отражает явлений, происходящих на границе раздела фаз, зависящих от того, являются ли вещества гидрофобными или гидрофильными. Поскольку устойчивость является величиной по своему значению обратной скорости седиментации, формулу Стокса можно преобразовать и получить: tf = I =------ У 2r2 .(d,-d,).* где U— устойчивость суспензии. Устойчивость суспензии будет тем больше, чем меньше радиус частиц дисперсной фазы, чем ближе значения плотности фазы и среды, чем больше вязкость дисперсионной среды. И поэтому, чтобы повысить устойчивость взвесей, прибегают к следующим приемам: — к повышению вязкости дисперсионной среды. Это достигается путем введения ПАВ, вязких жидкостей (глицерина, сиропов), гидрофильных коллоидов, крахмала и др.; — стараются как можно тоньше диспергировать твердые частицы дисперсной фазы. Это достигается путем тщательного измельчения вещества в ступке сначала в сухом виде, а затем в присутствии небольшого количества жидкости. При измельчении веществ в сухом виде степень дисперсности находится в пределах до 50 мкм, а если его дополнительно измельчать в присутствии воды, то размер частиц получается в пределах 0,1—5 мкм. Необходимость прибавления 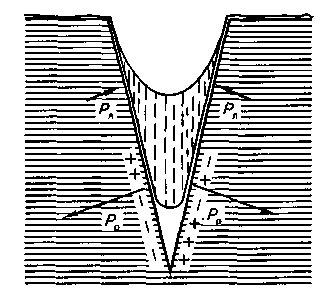 Рис. 113. Схема расклинивающего действия жидкости («эффект Ребиндера») жидкости объясняется тем (как это следует из рис. 113), что снижается твердость измельчаемого вещества и, кроме того, смачивающие жидкости проникают в мелкие трещины твердых частиц, которые образуются при растирании вещества и оказывают расклинивающее давление (Рр), которое действует противоположно стягивающему действию вогнутого мениска, так называемому Лапласовскому давлению (Р). Микротрещины расширяются, и происходит дальнейшее измельчение вещества. Это явление известно под названием «эффекта Ребиндера». Чем выше энергия смачивания, тем сильнее выражен расклинивающий эффект и будет лучше происходить расщепление вещества. Б. В. Дерягин установил, что максимальный эффект диспергирования в жидкой среде наблюдается при добавлении 0,4—0,6 мл жидкости на 1,0 г твердого вещества (40—60 %). В соответствии с этим, в технологии лекарств существует правило Дерягина: для более тонкого измельчения твердого порошкообразного вещества жидкость берут в половинном количестве от его массы. Гидрофильные вещества легче разрушаются в присутствии воды, чем в присутствии неполярных жидкостей. Для облегчения диспергирования гидрофобных веществ выгоднее использовать спирт или эфир. Стабилизация суспензий. Агрегативную устойчивость суспензии приобретают тогда, когда их частицы покрыты сольватными оболочками, состоящими из молекул дисперсионной среды. Такие оболочки препятствуют укрупнению частиц, являясь для разбавленных суспензий фактором стабилизации. С целью повышения стойкости взвесей гидрофобных веществ, которые на своей поверхности не образуют защитных гидратных слоев, их следует лиофилизировать, то есть добавлять гидрофильный коллоид (стабилизатор), тем самым сообщая им свойства смачиваемости. В качестве стабилизаторов применяют природные или синтетические высокомолекулярные вещества: камеди, белки, желатозу, растительные слизи, природные полисахаридные комплексы, метилцеллюло-зу, натрий-карбоксиметилцеллюлозу, поливинилпирролидон, поли-глюкин, твины, спены, бентониты и др. (см. главу 16). Все указанные поверхностно-активные вещества, уменьшают запас поверхностной энергии в системе. Наиболее сильно проявляют защитное действие в суспензиях ВМС. Растворы этих веществ не только сами обладают большой устойчивостью, но и передают это свойство гидрофобным частицам. Стабилизирующее действие этих веществ заключается в образовании гидратных слоев на поверхности частиц суспензии, а также в охвате этих частиц длинными цепочкообразными макромолекулами (рис. 114). Соотношение между твердой фазой суспензии и защитными ВМС зависит 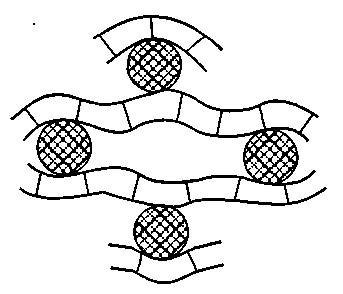 Рис. 114 Схема стабилизации суспензий высокомолекулярными веществами от степени гидро- фобности препарата и гидрофилизирующих свойств защитного вещества и устанавливается экспериментальным путем. Для определения концентрации ПАВ, необходимого для смачивания гидрофобных веществ, порошок лекарственного препарата измельчают до 40 мкм, высушивают до постоянной массы и помещают в эксикатор над высушенным кальция хлоридом. Затем 0,02 г этого вещества наносят на 1 см2 поверхности раствора, содержащего ПАВ различных концентраций в стакане вместимостью 30 мл и диаметром 45 мкм.  Таблица 18 Критическая концентрация Смачивания лекарственных Препаратов твином-80 Время погружения порошка в раствор ПАВ фиксируют секундомером. На основании полученных данных строят график зависимости времени погружения порошка от концентрации ПАВ. От точки пересечения касательных вблизи области перегиба восстанавливают перпендикуляр на ось абсцисс. Точка пересечения перпендикуляра с осью абсцисс указывает концентрацию ПАВ, необходимую для смачивания фармацевтических порошков. По результатам проведенных опытов делают вывод о целесообразной концентрации ПАВ, обеспечивающей гидрофилизацию лекарственного препарата. Это количество должно быть оптимальным. При превышении предела происходит процесс застудневания. При недостаточной добавке ВМС может возникнуть обратное явление — астабилизация, так как частиц ВМС не хватит на то, чтобы покрыть и защитить всю поверхность взвешенных частиц. В табл. 18 приведена критическая концентрация смачивания твином-80 порошков ряда лекарственных веществ, использующихся в медицине (А. И. Бондаренко, 1992). Следует учитывать, что твины и спены несовместимы с салицилатами, производными параокси-бензойной кислоты, фенолами и т. д. Частички суспензий могут быть стабилизированы и добавлением электролитов, которые создают в пограничном слое дзета-потенциал определенного знака и величины. Возникновение дзета-потенциала в суспензиях объясняется так же, как и заряжение ядра мицеллы в гидрофобном золе: адсорбция ионов из раствора и диссоциация или гидролиз поверхностного слоя твердой фазы. Следует иметь в виду, что электролиты стабилизируют суспензии только в определенных концентрациях. Если превышается концентрация электролита, то стабилизирующее действие электролита переходит в коагулирующее. СПОСОБЫ ПРИГОТОВЛЕНИЯ СУСПЕНЗИЙ Суспензии лекарственных веществ готовят двумя методами: дисперсионным и конденсационным. В основе дисперсионного метода лежит принцип получения определенной степени дисперсности путем измельчения порошкообразного лекарственного вещества. В основе конденсационного способа — соединение молекул в более крупные частицы — агрегаты, характерные для суспензий. При приготовлении суспензий дисперсионным методом получаются более крупные частицы (грубые суспензии), а при приготовлении суспензий конденсационным методом — более мелкие частицы (тонкие суспензии). Технология суспензий должна включать такие технологические приемы, которые обеспечили бы получение суспензий с тонко диспергированными частицами. Суспензии с концентрацией лекарственных веществ 3 % и более готовят по массе. Приготовление суспензий дисперсионным методом. В зависимости от того, какие вещества входят в состав суспензии (гидрофильные или гидрофобные), способ диспергирования будет различным. К гидрофильным веществам относятся магния оксид, цинка оксид, крахмал, белая глина, висмута нитрат основной и др. К гидрофобным — камфора, ментол, тимол, сера, фенилсалицилат и другие аналогичные вещества. Приготовление суспензий с гидрофильными веществами. При приготовлении суспензий из гидрофильных веществ твердое лекарственное вещество сначала растирают в ступке в сухом виде, а затем (по правилу Дерягина) с половинным количеством жидкости (от массы сухого вещества). Полученную смесь в виде кашицы (пульпы) разбавляют водой и сливают во флакон для отпуска. Rp.: Zinci oxydi 10,0 Aquae purificatae 100 ml Misce. Da. Signa. Для примочек Суспензия для наружного применения, в состав которой входит гидрофильное вещество — цинка оксид. 10,0 г цинка оксида растирают в ступке сначала в сухом виде, а затем добавляют 4—6 мл воды и тщательно растирают, чтобы обеспечить максимальное диспергирование. Затем по частям прибавляют остальное количество воды и переносят во флакон для отпуска, стараясь путем смывания со стенок ступки количественно перенести диспергированный цинка оксид. Оформляют этикетками «Наружное» и «Перед употреблением взбалтывать». ППК Дата № рецепта Zinci oxydi 10,0 Aquaepurificatae 100 ml__________ mобщ= 110,0 Приготовил: (подпись) Проверил: (подпись) Прием взмучивания. Для получения более тонких и устойчивых суспензий применяют прием взмучивания, который является разновидностью метода диспергирования. Он используется для приготовления суспензий из гидрофильных веществ, отличающихся большой плотностью. Rp.: Bismuthi subnitratis 2,0 Aquae Menthae 200 ml Misce. Da. Signa. По 1 столовой ложке 3 раза в день В этом случае 2,0 г висмута нитрата основного тщательно растирают в ступке, затем добавляют 1 мл мятной воды (по правилу Деря-гина), растирают, добавляют 5- или 10-кратное количество мятной воды (около 10 мл), перемешивают и оставляют в покое на 2—3 минуты, чтобы более крупные частицы осели, а тонкую смесь сливают во флакон для отпуска. Остаток снова растирают, добавляют 5—10-кратное количество воды, перемешивают, оставляют в покое, а затем сливают во флакон для отпуска. Эту операцию повторяют до тех пор, пока все вещество не будет переведено в тонкодиспергирован-ное состояние. После взмучивания с водой заметная седиментация наблюдается через 2—3 часа. Исходная дисперсность микстуры легко восстанавливается при взбалтывании перед употреблением. В данной микстуре один из стабилизирующих факторов — поверхностный потенциал — возникает в результате электролитической диссоциации поверхностного слоя взвешенных частиц висмута нитрата основного. Устойчивость микстур-суспензий с гидрофильными веществами значительно повышается, если в пропись будут введены вещества, увеличивающие вязкость дисперсионной среды, не будучи при этом ПАВ. В качестве таких вязких жидкостей целесообразно вводить в микстуры сахарный и другие сиропы (если они не прописаны в рецепте, можно посоветовать врачу). Тогда твердое вещество тщательно растирают в сухом виде, а затем с небольшим количеством сиропа (половинное количество по отношению к веществу), добавляют остальное количество сиропа и разбавляют водой. Сиропы повышают вязкость микстуры, вследствие чего скорость оседания взвешенных частиц лекарственного вещества уменьшается, и оно более точно дозируется. При приготовлении суспензий из гидрофильных набухающих веществ их сначала растирают в сухом виде (если прописаны другие порошки в рецепте, то смешивают с этими веществами), а затем смешивают с водой, не растирая с половинным количеством воды. Приготовление суспензий с гидрофобными веществами. Получить устойчивую суспензию из гидрофобных веществ простым растиранием с жидкостью не удается. В таких случаях гидрофобные вещества смешивают с гидрофильным коллоидом для образования на поверхности твердых частиц адсорбционных оболочек, придающих суспензии необходимую устойчивость (см. с. 308). Для веществ с нерезко выраженными гидрофобными свойствами (терпингидрат, фенилсалицилат, сульфаниламидные препараты и др.) в качестве стабилизаторов используют абрикосовую камедь, желатозу, 5 % -ный раствор метилцеллюлозы или твин-80 в количествах, указанных в табл. 19. Для веществ с резко выраженными гидрофобными свойствами (ментол, камфора и др.) количество стабилизаторов увеличивается в 2 раза (табл. 19). Гидрофилизирующие свойства указанных защитных веществ проявляются в присутствии воды. Для образования Таблица 19 Количество стабилизатора на 1,0 г гидрофобного вещества  первичной пульпы требуется количество воды, равное полусумме препарата и защитного вещества. Rp.: Therpini hydrati 2,0 Natrii hydrocarbonatis 1,0 Aquae purificatae 100 ml Misce. Da. Signa. По 1 столовой ложке 3 раза в день Микстура-суспензия с терпингидратом — веществом с нерезко выраженными гидрофобными свойствами. Поэтому суспензии с терпингидратом отличаются склонностью к флоккуляции. Это приводит к быстрому осаждению. В подставку отмеривают бюреткой 80 мл воды очищенной и 20 мл 5 %-ного раствора натрия гидрокарбоната. В ступке растирают 2,0 г терпингидрата с 10 каплями спирта (труднопорошкуемое вещество), затем добавляют 1,0 г желатозы и 1,5 мл раствора натрия гидрокарбоната. Все тщательно растирают до получения пульпы (однородной смеси). Затем добавляют (небольшими порциями) раствор натрия гидрокарбоната, сливая полученную суспензию во флакон для отпуска. ППК Дата № рецепта Aquae purificatae 80 ml Solutionis Natrii hydrocarbonatis 5 % 20 ml Therpini hydrati 2,0 Gelatosae_______________1,0 Vобщ = 100 ml Приготовил: (подпись) Проверил: (подпись) Rp.: Mentholi 0,5 Natrii hydrocarbonatis Natrii tetraboratis aa 1,5 Aquae purificatae 100 ml Misce. Da. Signa. Полоскание Суспензия для наружного применения с гидрофобным пахучим и летучим веществом ментолом, с резко выраженными гидрофобными свойствами. В подставку отмеривают 100 мл воды и растворяют натрия гидрокарбонат и натрия тетраборат (или берут 30 мл натрия гидрокарбоната в виде 5 %-ного раствора). В ступку помещают 0,5 г ментола, растирают с 5 каплями спирта (как труднопорошкуемое вещество), добавляют 1,0 г 5 %-ного раствора метилцеллюлозы и растирают до получения однородной кашицы. Затем добавляют =15 капель водного раствора солей (по правилу Дерягина), растирают и небольшими порциями прибавляют раствор солей. После перемешивания смывают содержимое ступки во флакон для отпуска. При приготовлении суспензий с гидрофобными веществами особого подхода требует приготовление суспензий серы, так как она относится к числу особых веществ с резко выраженными гидрофобными свойствами. Сера адсорбируется на поверхности воздушных пузырьков и ее частицы всплывают на поверхность в виде пенистого слоя. Применение для стабилизации суспензий серы общепринятых веществ не всегда целесообразно, так как они уменьшают ее фармакологическую активность. В качестве стабилизатора суспензий серы для наружного применения используют калийное или зеленое мыло из расчета на 1,0 г серы 0,1—0,2 г мыла. Мыло не применяют, если в суспензию входят соли тяжелых или щелочноземельных металлов, так как при этом образуются нерастворимые осадки. Следует также учитывать, что медицинское мыло несовместимо с кислотами. Rp.: Sulfuris praecipitati 2,0 Glycerini 5,0 Aquae purificatae 100 ml Misce. Da. Signa. Втирать в кожу головы Серу растирают с частью глицерина 0,8—1,2 г. Глицерин обладает высокими гидрофильными свойствами, смачивает поверхность частиц серы и способствует их измельчению. К полученной пульпе добавляют остальной глицерин и очищенную воду, смывая смесь во флакон для отпуска. В последнюю очередь добавляют 0,2 г калийного мыла и тщательно взбалтывают флакон. Rp.: Streptocidi 3,0 Camphorae 3,5 Sulfuris praecipitati Acidi salicylici aa 2,0 Glycerini 3,0 Sp. Aethylici Sol. acidi borici 3 % aa 50 ml Misce. Da. Signa. Для протирания кожи Во флакон для отпуска отвешивают 2,0 г кислоты салициловой, 1,5 г кислоты борной, 3,5 г камфоры, добавляют 50 мл этилового спирта 90 %. Флакон укупоривают и взбалтывают до растворения порошков. В подставку отмеривают 50 мл воды очищенной. В ступке измельчают 3,0 г стрептоцида с 15 каплями спирта 95 % (труднопорошкуемое вещество), добавляют 2,0 г серы, 3,0 г глицерина и растирают до однородной кашицы. Добавляют 50 мл (частями) воды очищенной, смывая суспензию во флакон для отпуска. При приготовлении суспензий объемом 1—3 л можно использовать средства механизации — смеситель СЭС-1 (см. главу 10). Приготовление суспензий конденсационным методом. В аптечной практике широкое применение при приготовлении суспензий находит конденсационный метод. При этом различают следующие случаи образования суспензий: — за счет химического взаимодействия; — за счет замены растворителя. Конденсационный метод получения суспензий основан на получении высокодисперсных частиц веществ дисперсной фазы, которые находятся в молекулярном или ионном состоянии. Процесс образования этих соединений зависит от целого ряда условий: от температуры; от концентрации растворенных веществ; от порядка смешивания. В аптечных условиях такие микстуры-суспензии получаются чаще всего в результате реакции обменного разложения, реже — за счет реакции гидролиза, окислительно-восстановительных и других реакций. Для получения тонких дисперсий необходимо, чтобы исходные вещества были в состоянии разбавленных растворов или коллоидно-дисперсных систем. Rp.: Calcii chloridi 10,0 Natrii hydrocarbonatis 4,0 Aquae purificatae 200 ml Misce. Da. Signa. По 1 столовой ложке 3 раза в день Нерастворимое вещество образуется при смешивании растворов кальция хлорида и натрия гидрокарбоната. В результате обменного разложения образуется свежеосажденный кальция карбонат: СаС12 + 2NaHC03 ------ CaC03J + Н20 + 2NaCl Для того, чтобы получить кальция карбонат в тонко диспергированном состоянии, необходимо приготовить сначала растворы кальция хлорида и натрия гидрокарбоната, а затем их слить. В результате получается тонкий осадок кальция карбоната. Лучше воспользоваться концентрированными растворами: 50%-ным кальция хлорида и 5 % -ным натрия гидрокарбоната. Тогда во флакон для отпуска отмеривают 100 мл воды очищенной, добавляют 20 мл 50 % -ного раствора кальция хлорида и 80 мл 5 % -ного раствора натрия гидрокарбоната. Rp.: Plumbi acetates Zinci sulfatis ana 1,5 Aquae purificatae 100 ml Misce. Da. Signa. Для уретральных впрыскиваний В данном случае в результате реакции обменного разложения происходит образование осадка свинца сульфата: РЬ(СН3СОО)2 + ZnS04------- PbSOj + Zn(CH3COO)2 В этом примере использовать раздельное растворение веществ нельзя, как в предыдущем примере, так как выпадут кристаллы свинца сульфата с острыми краями. При спринцевании такие кристаллы могут ранить слизистые оболочки и вызвать острый воспалительный процесс. Поэтому суспензия готовится таким образом: в ступке растирают твердые ингредиенты сначала в сухом виде, а затем добавляют воду в половинном количестве от массы сухих веществ до получения пульпы, добавляют остальное количество воды и сливают во флакон для отпуска. По методу замены растворителя получаются более тонкие суспензии, чем при механическом диспергировании. Чаще всего опа-лесцирующие и мутные микстуры образуются при добавлении к водным растворам настоек, жидких экстрактов, нашатырно-анисовых капель (см. «Приготовление жидких лекарственных форм с использованием концентрированных растворов и сухих лекарственных веществ», с. 254). В мутных микстурах осадки, как правило, образуются достаточно тонкими и хорошо растворяются в жидкой среде при взбалтывании. ОЦЕНКА КАЧЕСТВА, ХРАНЕНИЕ И СОВЕРШЕНСТВОВАНИЕ СУСПЕНЗИЙ Оценку качества суспензий проводят по следующим показателям: однородность частиц дисперсной фазы, время отстаивания, ресус-пендируемость, сухой остаток. Однородность частиц дисперсной фазы. Определяют при микроскопировании. Не должно быть неоднородных крупных частиц. Размер частиц должен соответствовать указанному в частных статьях. Время отстаивания. По величине отстоявшегося слоя при хранении судят об устойчивости суспензий. Чем меньше высота отстоявшегося слоя, тем устойчивость больше. Ресуспендируемость. При нарушении устойчивости суспензий они должны восстанавливать равномерное распределение частиц по всему объему после 24 часов хранения при взбалтывании в течение 15—20 секунд, после трех суток хранения — в течение 40—60 секунд. Сухой остаток. Определяют с целью проверки точности дозирования суспензий. Для этого отмеривают необходимое количество суспензии, высушивают и устанавливают массу сухого остатка. Отклонение в содержании действующих веществ в 1 г (мл) суспензии не должно превышать ±10 % . Все суспензии отпускают во флаконах из бесцветного стекла, чтобы можно было видеть результаты взбалтывания, с дополнительной этикеткой «Перед употреблением взбалтывать». Хранят микстуры-суспензии в прохладном месте. В настоящее время перспективным является приготовление «сухих суспензий» (в виде порошков или гранул), которые представляют смесь лекарственных веществ со стабилизатором, иногда с добавлением консерванта. Приготовляют их в заводских условиях. Сухие суспензии удобны для транспортировки, могут храниться длительное время. К основным направлениям совершенствования суспензий относятся: поиск новых стабилизаторов, консервантов; внедрение инструментальных методов оценки качества; разработка средств малой механизации. |
