ФТИЗИОПУЛЬМОНОЛОГИЯ. Учебник для вузов Рекомендуется Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебника для студентов медицинских вузов
 Скачать 3.97 Mb. Скачать 3.97 Mb.
|
|
ГЛАВА 4 ПАТОГЕНЕЗ И ПАТОМОРФОЛОГИЯ ТУБЕРКУЛЕЗА Заражение туберкулезом чаще всего возникает через дыхательные пути (аспирационный путь) при контакте с заразным больным, кото- рый выделяет во внешнюю среду содержащиеся в капельных яд- рышках и пылевых частицах. Только менее 10% этих частиц размером не больше 5 мкм попадают в альвеолы и вызывают заражение. Подав- ляющее большинство остальных, более крупных, частиц оседает на слизистой оболочке верхних дыхательных путей и удаляются оттуда благодаря функции мукоциллиарного клиренса. При энтеральном за- ражении определенное значение имеет всасывающая функция ки- шечника. Для инфицирования и развития заболевания туберкулезом основное значение имеют, во-первых, массивность инфекции, доза и длительность поступления МБТ в организм человека, во-вторых, состояние неспецифических и специфических факторов защиты в период воздействия инфекционного агента. Механизмы защиты бронхолегочной системы действуют на уровне проводящих и респираторных отделов и осуществляются за счет конденсирования воздуха, механической очистки, эндоцитоза бронхиальным эндотелием, путем клеточной неспецифической защиты. Неповрежденная слизистая оболочка полости рта, носоглотки и верхних дыхательных путей является непроницаемым барьером для МБТ. Здесь осуществляются механическая очистка воздуха за счет фильтрации и осаждения инородных частиц, удаление их вследствие чихания и кашля. Наиболее значимой частью механической очистки является мукоцилиарный клиренс на уровне бронхов и бронхиол. Клиренс обеспечивается секретом, содержащий лизоцим, протеазы, сурфактант, иммуноглобулин A (IgA), которые опсонируют МБТ, и движением ресничек бронхиального эпителия выводят их из организма. Нарушение целости слизистой оболочки полости рта и носоглотки, кариозные зубы, автозный стоматит, парадонтоз, синусит, хронический тонзиллит, а также периоды возрастной смены зубов у детей могут являться входными воротами для туберкулезной инфекции. В трахее и крупных бронхах МБТ, как правило, не задерживаются и оседают в нижних дыхательных путях и альвеолах. Некоторая часть микобактерий остается на месте проникновения, другая с током лимфы и крови переносится к месту внедрения — в региональные лимфатические узлы. В зависимости от локализации входных ворот инфекции могут поражаться подчелюстные, шейные, над- и подключичные, подмышечные внутригрудные и другие региональные лимфатические узлы. В лимфатических узлах М БТ взаимодействуют с клетками иммунной системы, вызывая целый каскад реакций, ведущих к иммунологической перестройке организма к туберкулезной инфекции и формированию специфического клеточного иммунитета. Локальные изменения в месте внедрения М БТ обусловлены прежде всего неспецифической реакцией полинуклеарных клеток (нейтрофи-лы), которые фагоцитируют возбудитель (рис. 4.1). 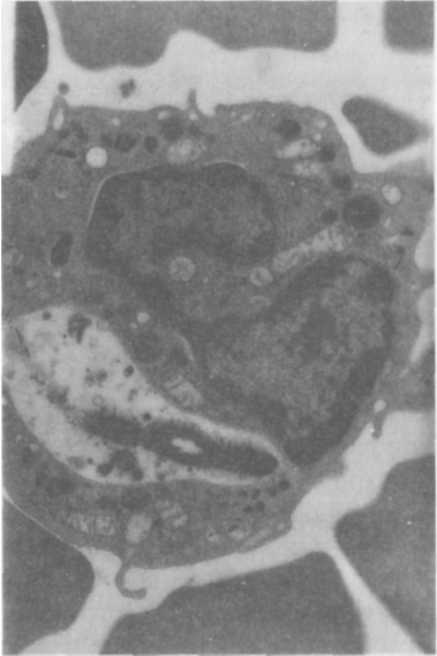 Под влиянием токсинов МВТ нейтрофилы разрушаются, вызывая воспалительную реакцию, которая сменяется более совершенной защитной реакцией с участием макрофагов, осуществляющих фагоцитоз и разрушение возбудителя. От активности фагоцитоза во многом зависит эффективность всей системы противотуберкулезной защиты организма. Макрофаги в очаге воспаления принимают форму эпите-лиоидных клеток, которые сливаются вместе, образуют гигантские клетки, однако при туберкулезе самостоятельно макрофаги уничтожить МВТ не могут. Необходимо активирующее воздействие на них сенсибилизированных цитов, в частности субпопуляции Т-хелперов (CD4+ клетки) и Т-супрессоров (CD8+ клетки). При аэрогенном заражении МВТ, достигшие альвеол, подвергаются фагоцитозу альвеолярными макрофагами. Макрофаги фиксируют микобактерии на клеточной мембране, затем погружают (инва- РиС. 4. i. Электронограмма. Ув. 20 ООО. гинируют) их в цитоплазму клетки МБТ, фагоцитированная нейтро-с образованием фагосом. Точные филом механизмы, с помощью которых эти клетки уничтожают еще не вполне расшифрованы. Тем не менее уже хорошо известны антимикобак-териальные эффекторные функции макрофагов: формирование фагосомо-лизосомных комплексов, генерация активных форм кислорода (АФК) при так называемом респираторном взрыве и образование свободнорадикаль-ных посредников, осуществляющиеся по L-аргинин зависимому цитоток-сическому пути. Первый из этих механизмов связан с неспецифической функцией макрофагов; два вторых осуществляются при воздействии сенсибилизированных Т-лимфоцитов. Образование фагосомолизосомальных комплексов происходит в результате слияния фагосомы, содержащей МБТ, с лизосомами. Лизосо-мы представляют собой весьма сложный комплекс органелл, содержащих в своих мембранах большое число ферментов, способных разрушать самые различные макромолекулы. Оптимальные условия для функционирования этих ферментных систем обеспечиваются благодаря слабой кислотности среды внутри лизосом (рН около 5); в поддержании рН важная роль принадлежит АТФ-зависимому ионному насосу. Считается общепризнанным, что МБТ, фагоцитированные макрофагами, разрушаются в фагосоме этих клеток под воздействием различных лизосомальных ферментов в результате слияния фагосомолизосомного комплекса. Однако попадая в макрофаги, могут сохраняться в фагосомах и даже продолжать размножение; при этом фагоцитоз носит незавершенный характер. Установлено, что МБТ могут продуцировать аммиак, который, с одной стороны, способен ингибировать слияние фагосомы с лизосомой, а с другой — путем защелачивания содержимого лизосомы снижать его ферментативную активность (рис. 4.2). В случаях когда процесс переваривания блокируется, макрофаги разрушаются, и возбудители выходят из поглотивших их клеток. Доказано, что это связано с токсическими веществами, освобождающимися при разрушении МБТ; это в первую очередь относится к корд-фактору (фактор вирулентности МБТ). Корд-фактор играет ключевую роль в развитии вторичного иммуно- дефицита и острого воспалительного процесса в органах и тканях орга- низма. Корд-фактор, во-первых, разрушительно действует на энергети- ческий метаболизм клеток макроорганизма, вызывая поражение митохондрий и нарушение переноса электронов по дыхательной цепи между коэнзимом Q и цитохромом С; во-вторых, тормозит синтез лизо- сомальных ферментов, что предохраняет расположен- ные МБТ от разрушения и, в-третьих, угнетает синтез CD4+ лимфоци 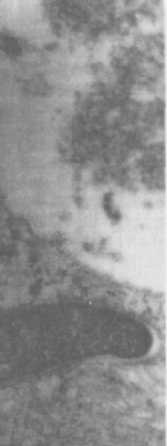 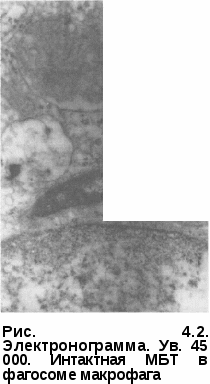 тами интерферона-у (ИНФ-у), который относится к важному фактору активации макрофагов в их способности усиливать продукцию Н202. Это оказывает токсическое действие на макрофаги при фагоцитозе тами интерферона-у (ИНФ-у), который относится к важному фактору активации макрофагов в их способности усиливать продукцию Н202. Это оказывает токсическое действие на макрофаги при фагоцитозе Повышенная вирулентность также связана с активностью каталазы/пероксидазы, которая повышает внутриклеточную выживаемость возбудителя, защищая его от механизмов лизиса в макрофаге. Важный антимикробный ме- ханизм активированных мак- рофагов, направленный против внутриклеточных возбудителей, связан с цитотоксическим дей- ствием L-аргинина. Цитотокси- ческий эффект этого механизма опосредован оксидом азота (N0) и связан с АФК, которые генериру- ются с участием и с помощью действия фактора некроза синтезируемого активированными макрофагами. Таким образом, макрофаги играют двоякую роль, обеспечивая не только защиту от туберкулеза, но и создавая благоприятные условия для выживания При этом фагоцитоз является единственным естествен- ным механизмом уничтожения МБТ в организме человека. В течении туберкулезной инфекции макрофаги играют ключевую роль в представлении Т-лимфоцитам МБТ, формировании специфического иммунитета с последующим уничтожением возбудителя. Вопрос заключается в том, насколько макрофаги в данный конкретный момент являются функционально полноценными для уничтожения фагоцитированных ими возбудителей. Организм старается локализовать инфекцию, в результате чего формируется так называемая ГЗТ, являющаяся непременным механизмом в формировании клеточного противотуберкулезного иммунитета. Именно ГЗТ опосредует развитие клеточного иммунитета, направленного на локализацию туберкулезного воспаления в инфицированном организме, и создание приобретенного иммунитета, направленного на уничтожение МБТ. При первичном инфицировании формирование иммунитета происходит параллельно размножению в клетках и тканях организма. Морфологическим эквивалентом защитных клеточных реакций организма против туберкулезной инфекции является специфическая гранулема. В гранулеме имеются три вида клеточных элементов. Центр и главную массу ее составляют эпителиоидные клетки, по периферии располагаются лимфоциты и плазматические клетки, а также нейтрофиль-ные лейкоциты. В качестве третьего элемента присутствуют гигантские многоядерные клетки Пирогова-Лангханса. Именно от состояния функциональной системы клеточного иммунитета в конечном счете зависит результат взаимодействия макро- и микроорганизма, который может закончиться формированием относительного иммунитета, или же при его несостоятельности ведет к развитию заболевания и прогресси-рованию туберкулеза. В этих случаях тканевые клеточные реакции не в состоянии отграничить и локализовать специфическое воспаление и его распространение в пораженном органе и тогда развивается заболевание. В естественных условиях заражения ГЗТ развивается через 2—3 нед. после инфицирования, а достаточно выраженный иммунитет формируется примерно через 6—8 нед. Ведущая роль в сопротивляемости организма туберкулезной инфекции отводится приобретенному клеточному иммунитету. В его основе лежит активация макрофагов и эффекторное воздействие их на Т-лимфоциты. При этом макрофаги представляют собой собственно эффекторы, а Т-лимфоциты выполняют роль индукторов ГЗТ. Точно так же как макрофаги, Т-лимфоциты являются не только необходимым компонентом противотуберкулезного иммунитета, но и являются фактором, определяющим патогенез заболевания. Координацию взаимодействия между макрофагами и Т-клетками рассматривают как центральное звено в формировании противотуберкулезного иммунитета. Формирование противотуберкулезного иммунитета обеспечивается всеми популяциями Т-лимфоцитов, но основная роль принадлежит CD4+ (Т-лимфоциты хелперы) и CD8+ клеткам (Т-лимфоциты супрессоры). CD4+ клетки способны распознавать антигены МБТ, фагоцитированных макрофагами, и играют важную роль в противотуберкулезном имму 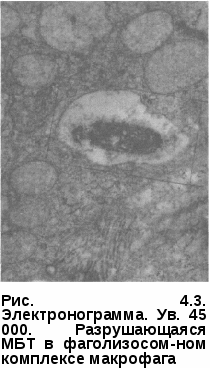 нитете. Соответственно это объясняет, почему уменьшение количества CD4+ клеток в результате ВИЧ-инфекции часто приводит к обострению туберкулеза. CD4+ лимфоциты в значительном количестве продуцируют ИНФ-у. Этот же интерферон выделяют сенсибилизированные МБТ CD8+ лимфоциты. ИФН-у является главным медиатором резистентности к туберкулезу, повышающим переваривающие способности макрофагов (рис. 4.3). Туберкулез чаще всего поража- ет легкие — орган, являющийся основными воротами инфекции. Возбудители, попавшие в аль- веолы, фагоцитируются альвео- лярными макрофагами, явно не- достаточно подготовленными к уничтожению М Вместе с мак- рофагами эти возбудители переносятся в легочную паренхиму и далее в регионарные лимфатические узлы, где и происходит их размноже- ние. Инфицированные макрофаги, фагоцитировавшие МБТ и осуще- ствляющие их переваривание, выделяют во внеклеточное пространство фрагменты разрушенных микобактерий, ферменты, медиаторы, в том числе которые активируют Т-лимфоциты, в частности CD4+клетки. Последние выделяют лимфо- кины, в частности ИЛ-2 и ИФН-у, под влиянием которых происходит миграция новых макрофагов к месту локализации возбудителя и их активация. Активированные макрофаги дополнительно секретируют фактор некроза инициирующий формирование продуктивной гранулемы, что ограничивает распространение МБТ и препятствует их размножению. Однако подобные гранулемы не в состоянии полностью устранить возбудитель. В частности, гигантские многоядерные клетки Пирогова-Лангханса становятся хранилищем МБТ и не в состоянии уничтожить своих внутриклеточных обитателей. Полное устранение возбудителя при туберкулезе не достигается даже при хорошо скоординированном взаимодействии макрофагов и Т-лимфоцитов, в результате чего организм остается инфицированным, хотя активный патологический процесс развивается далеко не во всех случаях. Любое нарушение иммунного баланса в последующие годы создает условия для реактивации сохранившейся популяции и развития клинически выраженных форм заболевания. В последующем продуктивная гранулема окружается плотной фиброзной капсулой, а ее центр некротизируется. Важную роль в инкапсуляции гранулемы и в развитии центрального ее некроза играет ФНО-а. Отграничение зоны пребывания МБТ и центральный некроз снижают Р02 и создают неблагоприятные условия для роста МБТ. При интенсивном размножении МБТ в организме человека вследствие малоэффективного фагоцитоза выделяется большое число токсичных веществ, вызывающих нарушения внутриклеточного метаболизма макрофагов и Т-лимфоцитов. Эти нарушения складываются из угнетения энергетического метаболизма, проявляющегося в глубокой депрессии активности ферментов митохондриального окисления и анаэробного гликолиза, нарушений синтеза АТФ, ДНК, РНК, аминокислот и белка. Это ведет за собой агрегацию и лабилизацию лизосом, выходу их содержимого в цитозоль и повреждению внутриклеточных структур и самой клетки; особенно эти изменения выражены в субпопуляции CD4+ клеток. При этом возникает не только их количественное уменьшение, но и снижение ими уровня синтеза ИЛ-2 и ИФН-у. Такие клетки являются маложизнеспособными и малоактивными и при активации в значительном количестве подвергаются апоптозу (запрограммированная гибель), что ведет к формированию вторичного иммунодефицита. Это способствует развитию экссудативного компонента воспаления с развитием казеозного некроза и может привести к расплавлению тканей и прорыву некротических масс в просвет бронхов или сосудов. Присутствие клеточного распада и высокие величины в этой среде создают оптимальные условия для размножения МБТ. Прорыв казеозного содержимого в просвет бронха приводит к диссеминации процесса в прилежащие участки легкого, а прорыв в сосуд — к генерализации и распространению процесса в отдаленных органах. Образуется порочный круг: токсины МБТ вызывают метаболические нарушения в макрофагах и клетках Т-клеточного звена иммунитета, которые ведут к системному мембраноповреждающему эффекту и повышенному их апоптозу. Это, в свою очередь, создает крайне отрицательное влияние на кооперацию иммунокомпетентных клеток в системе «макрофаг — CD4+ лимфоцит — макрофаг». Формируется выраженный иммунодефицит, когда иммунокомпетентные клетки не в состоянии оказывать должного сопротивления инфекции и гибнут в большом ко- личестве (апоптоз), что, в свою очередь, ведет к бурному и массивному размножению популяции и туберкулезного про- цесса. Наряду с макрофагами и Т-лимфоцитами апоптозу при туберкулезе подвержены и нейтрофилы. Следует отметить, что повышенный апоптоз, ведущий к уменьшению количества иммунокомпетентных клеток, сопровождается значительным снижением синтеза ИЛ-2 и ИНФ-у. Адекватная специфическая химиотерапия, ведущая к уничтожению популяции МБТ в пораженном органе, существенно снижает интенсивность апоптоза и ведет к увеличению синтеза ИЛ-2 и ИНФ-у. Таким образом, у больных туберкулезом легких с иммунодефицитом нарушения метаболизма с мембраноповреждающим эффектом носят системный характер и наблюдаются в клетках различных органов и систем, что в значительной степени определяет многообразие клинических проявлений при данной патологии. Эти изменения носят параспецифи-ческий токсико-аллергический характер и их морфологическим эквивалентом является нарушение функции конкретных органов и систем организма. Это накладывает существенный отпечаток на клинические проявления заболевания. У таких больных имеются относительная недостаточность функции коры надпочечников, снижение синтетической и де-токсической функции печени, дистрофические и функциональные изменения миокарда, почек, периферической и центральной нервной системы (ЦНС) и др. В развитии туберкулеза можно проследить два периода, когда клеточные реакции организма на внедрение МБТ носят четко разграниченные иммунологические, морфологические и клинические проявления. Эти периоды связаны с реакцией организма на первичное экзогенное заражение, определяемое как первичный туберкулез, и на реакцию, вызванную вторичным заражением (экзогенная суперинфекция) или реактивацией уже заживших постпервичных изменений (эндогенная инфекция), носящих название вторичный туберкулез. В зависимости от входных ворот первичного внедрения МБТ воспалительный очаг, или первичный очаг, может образоваться в легких, ротовой полости, миндалинах, кишечнике и др. Последующее размножение возбудителя происходит как в легких, так и в лимфатических узлах, и организм реагирует образованием специфической гранулемы (бугорок), т. е. образуется первичный эффект. продолжая размножаться, разносятся по организму с током крови и лимфы: возникает так называемая первичная, или облигатная, (обязательная) микобактериемия. МБТ оседают и фиксируются в тканях различных органах, где наиболее выражена микроциркуляторная капиллярная сеть — в лимфатических узлах, клубочках коркового слоя почек, эпиметафизарных отделах трубчатых костей, ампулярно-фимб-риональных отделах маточных труб, увеальном тракте глаз и др. Таким образом, с момента первичного заражения туберкулезная инфекция носит генерализованный и системный характер, дающий в последующем возможность развития внелегочных форм туберкулеза. Первичный туберкулез в результате экзогенного заражения развивается лишь у 7—10% инфицированный лиц, остальные переносят первичную туберкулезную инфекцию без клинических проявлений и спонтанно излечиваются. Наступившее заражение проявляется лишь в переходе отрицательных туберкулиновых реакций в положительные (вираж туберкулиновой чувствительности). Отсутствие клинических проявлений первичной туберкулезной инфекции может быть объяснено высоким уровнем естественной резистентности организма человека к туберкулезу, а также может быть следствием приобретенного в результате вакцинации БЦЖ искусственного иммунитета. После первичного туберкулеза может возникнуть форма туберкулезного поражения, проявляющаяся распространенной гематогенной или лимфогенной диссеминацией. Такой вид туберкулезного поражения, определяемый как диссеминированный туберкулез, генетически связан либо с прогрессированием первичной инфекции, либ с реактивацией послепервичных очагов. Первичный туберкулез может завершиться излечением с минималь- ными (малыми) или довольно выраженными изменениями, для ко- торых характерны обызвествление иликальцинация специфических изменений в легких (очаги Гона и Симона) и вггутригрудных лимфати- ческих узлах (петрификаты). У таких людей формируется приобретен- ный иммунитет. Сохранение в остаточных очагах персистирующих МБТ не только поддерживает иммунитет, но одновременно создает риск эндогенной реактивации туберкулезного процесса вследствие ре- версии измененных форм возбудителя и др.) в бактериальную форму и размножения микобактериальной популяции. В этом заклю- чается механизм эндогенной реактивации при развитии вторичного туберкулеза. Установлено, что реактивация чаще всего наблюдается у лиц при наличии факторов, снижающих иммунитет. Возможен и другой путь развития вторичного туберкулеза — экзогенный, связанный с новым (повторным) заражением (суперинфекция). Вместе с тем как для эндогенного, так и для экзогенного пути развития туберкулеза недостаточно лишь проникновения МБТ в уже инфицированный организм даже при массивной суперинфекции. Необходима совокупность ряда условий и факторов риска, снижающих иммунитет. В развитии вторичного туберкулеза необходимым условием для заболевания является снижение иммунитета, в том числе специфического, «прорыв» которого не обеспечивает достаточного контроля за размножающейся популяцией М БТ. При этом, как правило, у 90% больных развиваются клинические проявления заболевания и практически отсутствует тенденция к спонтанному излечению, что характерно для первичного туберкулеза. Применение противотуберкулезных препаратов может полностью привести к излечению от туберкулеза. Вместе с тем решающее значение принадлежит макроорганизму, состоянию его защитных механизмов, способности противостоять действию возбудителя, а также развитию полноценных репаративных процессов. В основе туберкулезного воспаления лежат три классических вида тканевых реакций: альтерация (некроз), экссудация (приток клеток и жидкостей из сосудов), пролиферация (размножение клеток в очаге воспаления). В зависимости от иммунологического состояния организма и степени патогенности МБТ преобладает та или другая реакция, на этом основано все многообразие форм туберкулеза легких и их течения. Различные сочетания патоморфологических проявлений создают предпосылки для чрезвычайно большого разнообразия туберкулезных изменений, особенно при хроническом течении заболевания со сменой периодов обострения и затихания процесса. этому необходимо добавить и различные осложнения, связанные с особенностями специфического процесса, такими, как распространение МБТ с током лимфы или крови, разрушение пораженного органа с образованием каверны, поражение сосудов с развитием кровохарканий и легочных кровотечений, нарушение обменных процессов с развитием амилоидоза внутренних органов и др. Разнообразие морфологических реакций в органах и тканях при туберкулезе зависит от патогенеза, формы, стадии, локализации и распространенности патологического процесса и в первую очередь связано с состоянием и функциональной активностью иммунной системы организма человека в момент развития специфического воспаления. Различия в морфологических реакциях специфического воспаления при первичном и вторичном туберкулезе в эксперименте показал еще Р. Кох. После первичной подкожной прививки здоровой морской свинке МБТ в этом месте через 10—14 сут возникает незаживающая язва и обязательно поражаются регионарные лимфатические узлы. Повторное введение МБТ также приводит к образованию язвы, но при этом не наблюдается поражения регионарных лимфатических узлов (феномен Коха). Общими для большинства форм туберкулеза являются специфические изменения в сочетании с неспецифическими или параспецифическими реакциями. К специфическим изменениям относится туберкулезное воспаление, которое выражается в трех основных формах воспалительных реакций: преимущественно продуктивное(с развитиемгранулем), преиму-щественноэкссудативное (с развитием экссудата) и некротическое, или творожистое (с развитием первичных некрозов ткани). Развитие продуктивного воспаления и формирование гранулемы характерно для высокого уровня неспецифической и иммунологической реактивности организма. При этом в гранулеме имеются три вида морфологических элементов. Центр представлен участком казеозного некроза, окруженного клеточными элементами, в основном эпителиоидными клетками и гигантскими многоядерными клетками Пирогова-Лангханса, по периферии располагаются лимфоциты и плазматические клетки, а также нейтрофильные лейкоциты (рис. 4.4). При этом казеозные изменения весьма ограничены и подвергаются медленному рассасыванию с последующим склерозом, фиброзом и инкапсуляцией по периферии самого некроза. В дальнейшем при специфическом лечении гранулема подвергается фиброзному превращению. Эти процессы наблюдаются при очаговом, ограниченном диссеми-нированном и инфильтративном туберкулезе легких и туберкулеме, а также при ограниченных специфических внелегочных поражениях в лимфатических узлах, головном мозге, костях, суставах и других органах. Иммунологические исследования у данной категории больных не выявляют нарушений как в количественном соотношении, так и в снижении функциональной активности иммунокомпетентных клеток. Такие формы туберкулеза, как правило, выявляются у больных при регулярных профилактических обследованиях, протекают бессимптомно или малосимптомно. 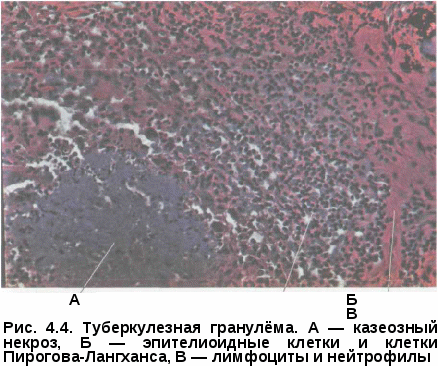 При прогрессировании процесса наблюдается увеличение казеозно-го некроза, усиливается инфильтрация грануляционной ткани макрофагами, лимфоидными клетками и нейтрофилами. Распространяется специфический процесс контактным и лимфогенным путем. В морфологическом плане экссудативное туберкулезное воспаление в легких имеет характер неспецифической пневмонии и характеризуется острым альвеолитом и очаговым или диффузным выпотом фибрина, лейкоцитов, иногда эритроцитов. При этом имеет место так называемая фаза неспецифического воспаления. Постепенно по периферии появляются специфические гранулемы, характерные для туберкулезного воспаления. Возникают участки долевой специфической пневмонии с поражением бронхов (бронходо-левые инфильтраты) и с тенденцией к слиянию и распространению процесса в пределах 1—2 сегментов, реже — доли легкого. Туберкулезные инфильтраты в легких подвергаются казеозному превращению. массы плохо рассасываются и имеют тенденцию к расплавлению и формированию каверн. Образующаяся каверна служит источником поступления в другие отделы легких и образования новых очагов, инфильтратов и каверн. Сочетание неспецифической и специфической фаз воспаления, их чередование является одной из причин полиморфизма клинико-морфо-логических проявлений туберкулеза. При заживлении массы казеозного некроза уплотняются, в последующем отмечается отложение мелких зерен солей кальция. В грануляционной ткани увеличивается количество фибробластов и фибрилл коллагена, объединяющихся в коллагеновые волокна, которые образуют соединительнотканную капсулу вокруг туберкулезного очага. В последующем специфическая грануляционная ткань все больше замещается фиброзной тканью. Эти процессы характеризуют инфильтративный туберкулез легких. В клинической картине у таких больных на первый план выходит синдром интоксикации, а при распаде легочной ткани и формировании каверн — бронхолегочные проявления. Чем больше объем поражения с экссудативно-казеозными изменениями, тем острее клинические проявления заболевания. При внелегочных локализациях нарушаются функции пораженного органа. У больных с преобладанием экссудативного компонента воспаления иммунодефицит характеризуется умеренно сниженными количественными и функциональными нарушениями в системе клеточного иммунитета. При наличии первичных творожистых некрозов отмечаются значительные функциональные нарушения, сочетающиеся с выраженным количественным дефицитом Т-клеток и макрофагов; особенно это характерно для пациентов с сочетанным течением туберкулеза и ВИЧ-инфекцией. Творожистый некроз ткани легкого характеризуется образованием обширных долевых и лобарных поражений легочной ткани, состоящих из сливающихся друг с другом очагов первичного некроза легочной ткани с очень скудной специфической клеточной реакцией эпителиоидных клеток, лимфоцитов и преобладанием нейтрофилов. Творожистый некроз наблюдается в неизмененной ткани легкого, иногда с последующим развитием вокруг участков некроза специфических гранулем. Это отличает данный вид специфического поражения от экссудативного воспаления, где экссудат, а не некроз, является доминирующим компонентом специфического воспаления. Данный вид специфического поражения легочной ткани выделен в отдельную клиническую форму — казеозную пневмонию, которая является одной из острых и злокачественных разновидностей течения болезни. При внелегочных поражениях развитие творожистого некроза приводит к полному разрушению пораженного органа. При творожистом воспалении наряду с развитием некроза имеется системное поражение микроциркуляторного русла продуктивного характера, а также тромбогеморрагические изменения, ведущие к ишемии и быстрому некрозу пораженных участков легкого или других органов. Сосудистые поражения носят универсальный характер и касаются как вен, так и артерий: в одних случаях они выражаются периваскулярной клеточной инфильтрацией мононуклеарного характера, в других воспалительная инфильтрация может захватывать все слои стенки сосуда, и тогда развивается деструктивный васкулит и наблюдаются фибрино-идные некрозы сосудов. При этом виде специфического воспаления быстро наступает творожистое перерождение жидких и клеточных элементов воспалительного экссудата с образованием вначале сухих, а затем разжиженных некротических масс. Патогистологическое исследование обнаруживает в легких картину пневмонии смешанного типа. В одних альвеолах находится масса фибрина и лейкоцитов, а в других преобладает скопление жидкого экссудата или мононуклеарных клеток. Очень быстро может наступать организация фибрина, что дает картину карнификации. В процесс обязательно вовлекается висцеральная и париетальная плевра с формированием плевральных казеозных наслоений. Нарастание творожистого некроза, который быстро, иногда в течение 2—3 нед, распространяется на все большие участки легочной ткани, нередко сопровождается секвестрацией некротизированных участков легкого. При этом образуются секвестрирующие полости неправильной формы с неровными и нечетко контурированными краями или гнойным размягчением казеозных масс с формированием каверн разнообразной величины — от мелких до гигантских. При творожистом некрозе изменения начинаются в респираторной части ацинуса, а затем очень быстро поражают весь ацинус, что вызывает образование вначале казеозных эндобронхиолитов, а затем казеозных эндобронхитов в более крупных бронхах. Остро развивающиеся и морфологически необратимые поражения легких при творожистом некрозе сопровождаются выраженным синдромом интоксикации, бронхолегочными проявлениями и приводят к развитию дыхательной недостаточности, а также к глубоким метаболическим и гемодинамическими изменениям миокарда. Заживление при творожистом некрозе идет замедленными темпами ввиду обширности морфологических повреждений легкого и большой популяции МБТ. Как один из редких исходов творожистого некроза при эффективной химиотерапии отмечается развитие цирроза, однако клиническое излечение возможно только при оперативном лечении и удалении основного очага специфического поражения легких и других органов. В сердечно-сосудистой и нервной системе, кроветворных органах, серозных оболочках и других тканях могут появляться так называемые токсико-аллергические илипараспецифические реакциикакрезультат ан-тигенемии и связывания антигенов с белками крови с образованием крупных специфических иммунных комплексов. Морфологически эти изменения проявляются очаговой или диффузной макрофагальной и лимфоцитарной инфильтрацией в результате поражения этими комплексами соответствующих органов и систем. Течение и исходы туберкулеза следует рассматривать только в условиях специфической химиотерапии, которую следует назначать всем больным активным туберкулезом легких. В процессе химиотерапии отмечается разрушающее ее влияние на возбудитель, вследствие чего резко снижается количество МБТ и создаются благоприятные условия для развития репаративных процессов. Вместе с тем при применении химиотерапии отмечается разное течение туберкулезного процесса: регрессия с последующим заживлением и клиническим излечением; стабилизация без клинического излечения с сохранением каверны или других изменений; временное стихание воспалительного процесса с последующим возникновением обострения; развитие хронического процесса или прогрес-сирование заболевания. |
