ФТИЗИОПУЛЬМОНОЛОГИЯ. Учебник для вузов Рекомендуется Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебника для студентов медицинских вузов
 Скачать 3.97 Mb. Скачать 3.97 Mb.
|
|
ИССЛЕДОВАНИЕ ПЕРИФЕРИЧЕСКОЙ КРОВИ Туберкулезная инфекция не является сильным раздражителем кроветворной системы и это обусловливает отсутствие специфической для туберкулезного заболевания картины крови, а также преимущественно малые сдвиги в гемограмме. Изменения гематологических показателей находятся в зависимости от характера процесса, тяжести течения, реактивности организма, состояния его защитных сил. При обследовании больных туберкулезом следует проводить подсчет общего количества лейкоцитов и их процентного состава в мазках крови, определение количества эритроцитов, гемоглобина и скорости оседания эритроцитов (СОЭ). Лейкоциты. Количество лейкоцитов колеблется в диапазоне 5—12x109. У больных с тяжелыми обострениями фиброзно-кавернозного туберкулеза, при которых известную роль играет вторичная флора, количество лейкоцитов может доходить до 12— 15х109. При оценке тяжести заболевания большое значение имеет определение ядерного сдвига нейтрофи-лов; влево при туберкулезе обычно бывает выражен одними палочкоя-дерными клетками. У больных инфильтративными и очаговыми формами туберкулеза без распада отмечается сдвиг нейтрофилов влево в пределах 7—10% от всех палочкоядерных. При вспышках туберкулеза и явлениях деструкции ле- гочной ткани сдвиг доходит до 10—20% г алочкоядерных. Значительное увеличение сдвига формулы влево отмечается при обострении хрони- ческого фиброзно-кавернозного туберкулеза, распространенном ин- фильтративном процессе и казеозной с явлениями распада. В этих случаях число палочкоядерных может достигать 20—30%, иногда 50% с небольшим количеством (юные) и единичными промиелоцитами (0,5—0,25%). При туберкулезе патологический процесс помимо ядерного сдвига вызывает изменения характера зернистости нейтрофилов, когда вместо обычной тонкой может появиться грубал патологическая зернистость. В норме до 6% нейтрофилов содержат патологическую зернистость. В мазках, окрашенных для выявления патологической зернистости ней-трофилов, можно одновременно подсчитывать лейкоцитарную формулу, поэтому количество нейтрофилов с патологической зернистостью подсчитывают наряду с определением ядерного сдвига по отношению к числу встретившихся нейтрофилов (а не на 100 нейтрофилов). Патологическая зернистость нейтрофилов не возрастает параллельно ядерному сдвигу, обычно она наблюдается при тяжелом течении туберкулезного процесса, при истощении нормального формирования нейтрофилов в костном мозге. У больных с тяжелыми формами туберкулеза почти все нейтрофилы (80—90%) могут содержать патологическую зернистость, которая при затихании туберкулеза обычно держится дольше всех других изменений гемограммы, свидетельствуя о неполном восстановлении функции костного мозга. Эозинофилы. Клинически выраженный туберкулез обычно протекает с нормальным числом эозинофилов в крови. Небольшая гиперэозинофилия при отсутствии сдвига нейтрофилов влево в сочетании с лимфоцитозом сопровождает благоприятно протекающие случаи туберкулеза. При обострении туберкулеза количество эозинофилов может уменьшаться (2—4%) или переставать определяться. Гипоэозинофилия и особенно анэозино-филия наблюдаются при тяжелом состоянии больных туберкулезом. Количество эозинофилов может меняться в связи с прямым действием противотуберкулезных препаратов. При лечении аминогликозидами и ПАСК содержание их может достигать 20—30%, что нередко является симптомом аллергических побочных реакций. Реже эозинофилия наблюдается при лечении изониазидом, рифампицином и циклосерином. Лимфоциты. Количество лимфоцитов повышается в период ранней туберкулезной интоксикации, в начальный период первичного туберкулеза, а также при затихании вспышки, инфильтративном и очаговом туберкулезе легких. При тяжелом течении туберкулеза число лимфоцитов снижается (нередко до 10% и ниже). Лимфопения более характерна для остропрогрессирующих форм туберкулеза типа казеозной пневмонии. Моноциты. Колебания содержания моноцитов зависят от различных агентов, вызывающих раздражение ретикулогистиоцитарной системы. Некоторую роль может ифать также непереносимость противотуберкулезных препаратов. При туберкулезе стойкое увеличение количества моноцитов бывает при свежей гематогенной диссеминации; 10—20% моноцитов определяются в ряде повторных анализов. Резкое снижение уровня моноцитов характерно для тяжелого течения первичного туберкулеза. «Красная кровь» у большинства больных туберкулезом остается в преде- лах нормы, и лишь некоторые формы туберкулеза протекают с анемией. Анемия наблюдается при первичном туберкулезе, казеозной пневмонии и при некоторых формах диссеминированного туберкулеза, протекаю- щего с поражением органов кроветворной системы; количество эритро- цитов при этом составляет Незначительная анемия наблю- дается при лечении больных циклосерином. Лейкемоидные реакции, связанные с туберкулезом, встречаются довольно редко, однако врач должен помнить о них, так как, в отличие от лейкозов, при них оказываются эффективными противотуберкулезные препараты. Выделяют типа реакций: гипопластический и гиперпластический (собственно лейкемоидный). При гиперпластическом типе количество лейкоцитов достигает 20— 30x10*. В крови появляется значительное количество (около 25%) примитивных ретикулярных клеток моноцитоидного характера, в базофильной протоплазме этих крупных клеток встречаются единичные азурофильные зерна. Наряду с моноцитоидными клетками выявляется резкий сдвиг влево нейтрофилов с появлением единичных миелоцитов. В отличие от лейкемий, характерно отсутствие базофилов и эозинофилов, наблюдается выраженная лимфопения. Быстро развивается гипохромная анемия с уменьшением числа эритроцитов до При гипопластическом типе наблюдаются стойкая выраженная лей- копения анемия эритроцитов) и тромбоци- топения (20хЮ9). Выраженная нейтропения (20—30%) сопровождается резким сдвигом влево с наличием юных и миелоцитов. Эти формы дают небольшие ремиссии, но не полное восстановление лейкоцитарной фор- мулы. При пункции грудины в костном мозге нередко обнаруживают эпителиоидные бугорки, иногда с гигантскими клетками Пирогова-Лан- гханса, и массивные участки фиброзной ткани. Это указывает на тубер- кулез и помогает исключить лейкоз. Лейкемоидные реакции при туберкулезе носят большей частью преходящий характер; иногда наблюдается цикличность в их течении, которую можно связать с волнами гематогенной диссеминации. Скорость оседания эритроцитов (СОЭ) у больных туберкулезом является чувствительным показателем обострения процесса. Высокие величины СОЭ отмечаются при остропрогрессирующих формах туберкулеза, при экссудативном характере процесса. Следует отметить, что СОЭ увеличивается при нарастании в крови уровня фибриногена и глобулинов; ускорение СОЭ вызывают и мукополисахариды. На показатели СОЭ влияет также количество эритроцитов: снижение его при анемии влечет за собой ускорение СОЭ, при эритроцитозах оседание замедленно. МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ Для обнаружения возбудителя туберкулеза в биологическом материале больных применяют следующие методы:
• бактериологический (культуральный) метод. Микроскопия препаратов патологического материала по методу Циля-Нельсена является основным методом выявления кислотоустойчивых микобактерий (КУМ). На основании микроскопического исследования можно сделать заключение только о наличии или отсутствии в препарате КУМ. Это объясняется тем, что в природе существует большое разнообразие видов микобактерий, включая и нетуберкулезные, одинаково хорошо воспринимающих окраску раствором карболового фуксина. Мазки патологического материала обрабатывают карболовым фуксином, а затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта. Докрашивают мазки 0,25% раствором метиленового синего. Окрашенные препараты просматривают в световом микроскопе с иммерсионной системой. КУМ окрашиваются в красный, а окружающий фон — в синий (рис. 5.1). При микроскопическом исследовании препарата, окрашенного по методу Циля-Нельсена, следует просматривать не менее 100 полей зрения, что обычно вполне достаточно, чтобы обнаружить в препарате единичные КУМ. В том случае, если результат исследования оказывается 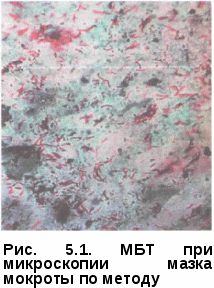 отрицательным, для подтверждения необходимо просмотреть дополнительно 200 полей зрения. Результат исследования возможно получить в течение 1 ч, но обычно его выдают через 24 ч. Значимыми преимуществами бак-териоскопического выявления КУМ в патологическом материале больных туберкулезом является доступность метода, его экономичность и быстрота получения результата. Вместе с тем метод относительно малочувствителен (необходимо, чтобы в 1 мл исследуемого материала содержалось не менее 50—100 тыс. микробных тел) и недостаточно специфичен. Люминесцентная микроскопия увеличивает разрешающую способность микроскопии по сравнению с окраской по Цилю-Нельсену на 14—30%. Для окраски используют флюорохромы — органические красители, флю- оресцирующие при освещении ультрафиолетовыми, фиолетовыми или си- ними лучами. Такими красителями являются аурамин 00 и родамин С. Препарат исследуют с помощью люминесцентного микобак- терии светятся золотисто-желтым цветом на темном фоне (рис. 5.2). Количество КУМ, обнаруживаемых 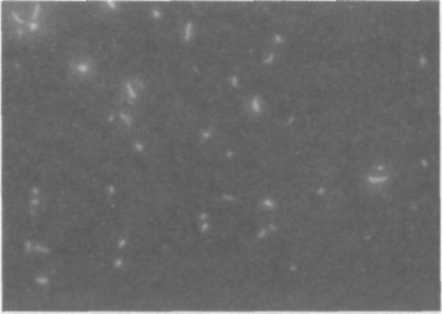 при микроскопическом исследовании, является очень важным информационным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания. Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. При использовании Рис. 5.2. МБТ при люминесцентной объектива 90х-100х и окуляра микроскопии мазка мокроты 7х— 10х(общее увеличение — 630х— ЮООх) принята следующая градация результатов световой иммерсионной микроскопии по методу Циля-Нельсена, представленная в табл. 5.1. Таблица 5.1. Градация результатов микроскопического исследования при окраске по методу Циля-Нельсена
Полимеразно-цепная реакция (ПЦР) является одним из наиболее быстрых и информативных методов выявления МБТ. Принцип метода состоит в увеличении в 106—108 раз числа копий специфического участка Д Н К М БТ, катализируемого invitroД}\ К-полимеразой в автоматическом режиме. В искусственных условиях воспроизведение процесса репликации специфического или определенного вида или рода возбудителей участка генома возможно при условии знания его нуклеотидной последовательности. Применение методов детекции продуктов репликации таких участков (ампликоны) позволяет констатировать наличие возбудителя в исследуемой пробе. К достоинствам метода ПЦР отнесятся:
Вместе с тем высокая разрешающая способность метода в ряде случаев может приводить к ложноположительным результатам, что ограничивает достоверность исследования. Бактериологический (куттуральный) метод выявления МБТ заключается в посеве мокроты и другого патологического материала на питательные среды. Для эффективного выделения культуры МБТ достаточно единичных жизнеспособных бактериальных клеток (20-100 микробных тел) в образце диагностического материала. Рост культуры регистрируют за 21—90 сут. Для посева диагностического материала используют разнообразные питательные среды, среди которых можно выделить три основные группы: плотные питательные среды на яичной основе; плотные или полужидкие питательные среды на агаровой основе; жидкие синтетические и полусинтетические питательные среды. В России наиболее широкое распространение получила плотная питательная среда Левенштейна-Йенсена. Среду Левенштейна-Йенсена применяют во всем мире в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности. Рост МБТ на этой среде проявляется в диапазоне от трех недель до трех месяцев (в среднем 1,5 мес). Вирулентные культуры обычно растут на плотных питательных средах в виде R-колоний (от англ. rough— грубый, шершавый) различ- 5.3. Рост культуры МБТ на среде Левенштейна-Йенсена через дней ной величины и вида, имеют желтоватый или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую манную крупу или цветную капусту (рис. 5.3). Интенсивность роста определяют по трехбалльной системе: «+» 1 — 20 колоний (скудное бактериовыделение); «++»21—100 колоний (умеренное бактериовыделение); «+++» более 100 колоний (обильное бак-териовыделение). Лекарственную устойчивость МБТопределяют методом абсолютных концентраций на плотной яичной питательной среде Левенштейна— Йенсена, основанной на добавлении определенных стандартных концентраций противотуберкулезных препаратов, которые принято называть критическими при расчете на мкг/мл. Культура МБТ считается чувствительной к той или иной концентра- ции противотуберкулезного препарата, которая содержится в среде, если число колоний выросших на одной пробирке с препаратом, не превышает 20, а посевная доза соответствует 107 микробных тел. Уровень устойчивости данного штамма МБТ в целом выражается той максимальной концентрацией препарата (количество мкг в 1 мл питательной среды), при которой еще наблюдается размножение МБТ. Для различных противотуберкулезных препаратов установлена определенная критическая концентрация. Она имеет клиническое значение, так как отражает воздействие препарата на МБТ в условиях макроорганизма. Для метода абсолютных концентраций появление более 20 колоний на питательной среде, содержащей противотуберкулезный препарат, в критической концентрации свидетельствует о том, что данный штамм МБТ обладает лекарственной устойчивостью. Критические концентрации противотуберкулезных препаратов при определении лекарственной устойчивости методом абсолютных кон- центраций на среде составляют для изониазида 1 мкг/мл; рифампицина — 40 мкг/мл; пиразинамида — 200 мкг/мл; этам- бутола — 2 мкг/мл; стрептомицина — 10 мкг/мл; канамицина — 30 мкг/мл; капреомицина — 30 мкг/мл; протионамида (этионамида) — 30 мкг/мл; циклосерина — 30 мкг/мл; ПАСК — 1 мкг/мл; офлоксацина — 2 мкг/мл. В большинстве случаев метод абсолютных концентраций применяется для непрямого определения лекарственной устойчивости. Вначале производят посевы мокроты на твердые питательные среды и получают чистую культуру МБТ, которую пересевают на питательные среды, содержащие определенные концентрации противотуберкулезных препаратов. Так как сроки выделения МБТ на питательных средах составляют не менее 1,5 мес, то результаты определения устойчивости указанным методом обычно получают не ранее чем через 2—2,5 мес после посева материала. Кроме описанных выше классических методов культивирования М БТ и определения лекарственной устойчивости, в России нашли свое применение следующие современные системы. держащей радиоактивный Система ВАСТЕС460 — радиометрический метод быстрого определения роста МБТ путем регистрации уровня меченного С02, образующегося в процессе утилизации субстрата с пальмитиновой кислотой, со- Для роста МБТ в данной системе используют флаконы с жидкой питательной средой, которая представляет собой обогащенную среду Middlebrook 7H9, содержащую радиоак-При размножении МБТ утилизируют С14 и выделяют С(402; тивный в этом случае учет идет по нарастанию СмОг  Система ВАСТЕСMGIT960 — индикаторные пробирки MGIT (М. Growth Indicator Tube) с той же средой Middlebrook 7Н9; содержат в придонной части флюоресцирующий индикатор (трис-4,7-дифкнил-1, Юфенантролин рутениум хлорид пентагидрат), «погашенный» высокими концентрациями Ог В процессе роста поглощают что сопровождается усилением свечения индикатора, интенсивность которого оценивают при помощи трансиллюминатора. Полностью автоматизированный комплекс позволяет одновременно исследовать лекарственную чувствительность МБТ в 960 исследуемых образцах (рис. 5.4). 5.4. Автоматизированный комплекс ВАСТЕС MGIT 960: 1 — выбор лекарства, к которому будет определятся устойчивость, чувствительность МБТ; 2 — сканирование штрихкода пробирки; 3 — загрузка пробирки в прибор Наличие роста МБТ в системе ВАСТЕС регистрируется на 4—5-й день от момента посева. В системе ВАСТЕС, где используют те же абсолютные концентрации противотуберкулезных препаратов, учет лекарственной устойчивости идет в течение 6 нед. В последние годы для быстрого определения лекарственной устойчивости используют метод микрочипов, основанный на молекулярно-генетическом анализе (ПЦР) выявления точечных мутаций в гроВ гене, ответственном за устойчивость к рифампицину, и в katGгене, ответственном за лекарственную устойчивость к изониазиду. Установлено, что более 95% устойчивых к рифампицину штаммов МБТ содержат точечные мутации (делеции и вставки в гроВ гене, коди- рующих Р-субъединицу РНК-полимеразы), и что более 70% устойчивых к изониазиду штаммов имеют делеции и вставки в katGгене, коди- рующих каталазу/пероксидазу. Результаты метода микрочипов могут быть получены на 3-4-й день исследования. |
