ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Бронхоскопия — единственный на сегодняшний день метод, позво-
ляющий визуально исследовать состояние внутренней поверхности тра-
хеи, бронхов вплоть до субсегментарных и более мелких, не-
посредственно патологические образования, их распространенность, получить содержимое для цитологического, гистологического, бактериологического, иммунологического и биохимического исследований, определить косвенные признаки поражения лимфатических узлов средостения.
Существует два типа бронхоскопий. Ригидная бронхоскопия (РБС)
проводится под наркозом полыми трубками, имеющи-
ми оснащение для и снабженными телескопами с различными угла-
ми зрения. Фибробронхоскопию (ФБС) проводят под местной анестезией
с использованием управляемого малокалиберного бронхоскопа,
в который вмонтированы биопсийный канал, световод и оптическая система. Возможно сочетанное использование обоих методов. Бронхоскопия бывает диагностической и лечебной.
Техника бронхоскопии. Подготовка больного к диагностической брон-
хоскопии заключается в беседе с ним накануне для уточнения его пси-
хического состояния и введения за 1 час до исследования транквилиза-
торов и атропина. Местную анестезию начинают с анемизации слизистой
оболочки верхних дыхательных путей эфедрином для уменьшения вса-
сывания анестетика, далее раствор лидокаина. Брон-
хоскоп проводят через нос или рот. Анестезию голосовых связок, трахеи
и бронхов выполняют под контролем зрения 2% раствором лидокаина
через канал инструмента (при РБС дают наркоз).
Введению эндоскопа и ориентировке в дыхательных путях помога-
ют анатомические образования отделов респираторного тракта: язычок
мягкого неба, надгортанник, голосовая щель, киль трахеи. Справа от него
на расстоянии 2 см между пунктами, соответствующими «1 и 3 часам»
воображаемого циферблата, находится устье верхнего долевого бронха.
Устье среднедолевого бронха расположено между точками, соответству-
ющими и 1 час», если продвинуть бронхоскоп до конца промежуточ-
ного бронха. Устье верхнего сегментарного бронха находится на-
против. Устья сегментарных бронхов нижней доли отчетливо видны при
осторожном движении бронхоскопа прямо вперед. Для осмотра левого
долевого бронха больной поворачивает голову направо. Взору открыва-
ются устья бронхов нижней доли. В таком положении на расстоянии 4—
4,5 см от киля трахеи между точками, соответствующими «8 и 10 часам»,
можно рассмотреть устье верхнего долевого бронха, а устье язычково-
го — между «1 и 2 часами» воображаемого циферблата. Отличить развет-
вления сегментарных бронхов на субсегментарные и более мелкие прак-
тически невозможно, если не фиксировать этапы продвижения
бронхоскопа. Продвигать вперед эндоскоп можно, лишь видя перед собой свободный просвет дыхательных путей. При попадании мокроты или крови на дистальную линзу и потере видимости для очистки ее нужно попросить больного покашлять (при местной анестезии), продуть канал струей кислорода или ввести через канал изотонический раствор натрия хлорида и аспирировать его.
Во время исследования следует обратить внимание на форму просвета и вид слизистой оболочки трахеи и бронхов; кровоточивость слизистой оболочки при инструментальной пальпации; эластичность стенок трахеи и бронхов; конфигурацию и подвижность шпор и устьев сегментарных и субсегментарных бронхов; наличие «плюс» или «минус» ткани и вид ее; характер секрета в просвете бронхов.
К диагностическим манипуляциям относятся цитологическое иссле-
дование мазков, взятых из бронхов, и биопсия различными методами.
Биопсию различают по принципу забора ткани: скусывание, пункция,
соскабливание (браш-биопсия), аспирация. Каждый из биоптических
приемов должен быть визуализирован бронхоскопически или в сочета-
нии с рентгеноскопией (ЭОП), резко повышающей достоверность био-
псии. Например, если наблюдается эндобронхиальное поражение при
туберкулезе бронхов, поверхностные мазки и отпечатки не имеют боль-
шого значения и лишь в редких случаях выявляются элементы туберку-
лезной гранулемы в мазках, взятых непосредственно из пораженного
туберкулезом бронха. В то же время при неспецифических эндобронхи-
тах у больных туберкулезом при цитологическом исследовании мазков
можно определить характер и степень неспецифического воспалитель-
ного процесса слизистой. При дифференциальной тубер-
кулеза бронхов с другими заболеваниями, например опухолью, мазки
имеют значение лишь при положительных результатах.
Из всех видов биопсии у больных туберкулезом для
бронхиальной патологии основное значение имеет щипцевая биопсия,
которая нередко становится при туберкулезе бронхов и лечебной про-
цедурой. Основными показаниями являются: неясные
процессы, активный туберкулез бронха, особенно гра-
нуляциями, посттуберкулезный стеноз бронхов, сопровождающийся неспецифическим воспалением, неспецифические эндобронхиты у больных туберкулезом легких с предстоящим хирургическим вмешательством.
Пункция внутригрудных лимфатических узлов через трахеи и
бронхов имеет наибольшее значение для определения генеза различных аденопатий, которые нередко приходится дифференцировать с туберкулезным бронхоаденитом (лимфогранулематоз, саркоидоз, метастазы опухоли и др.). Исследование позволяет уточнить характер и активность туберкулезных поражений, особенно при первичном туберкулезе.
Исследуя рентгенобронхоскопическую картину при периферических образованиях в легких без поражений бронхов в пределах видимости, всегда необходимо решать, какой вид биопсии наиболее приемлем и рационален. Например, если патологическое образование связано с бронхом и имеет воздушную полость, показаны катетеризация с аспирацией и браш-биопсия. Если образование расположено парабронхиально (щеточка и катетер проскальзывают мимо), лучше провести пункционную биопсию через бронх с помощью БФС. При щелевидном стенозе, ин-фильтративных изменениях, проявляющихся синдромом «мертвого устья», уместно использовать щетку или кюретку. Наоборот, при ограниченном инфильтрате или маленькой опухоли в просвете крупного бронха браш-биопсия щеткой менее эффективна из-за широкого просвета бронха. В таких случаях лучше выполнить биопсию щипцами.
Противопоказания к бронхоскопии: эпилепсия, нарушения сердечного ритма, артериальная гипертензия, туберкулез гортани.
Осложнения, связанные с обезболиванием, реакцией на местные анестетики, — головокружение, тахикардия, рвота, артериальная ги-потензия, обморок, бронхоларингоспазм. Осложнения, связанные с бронхоскопическим исследованием, — травма слизистой оболочки с кровотечением, разрыв стенки трахеи и бронха, перфорация легкого катетером — пневмоторакс, кровотечение после катетеризации, щипцовой биопсии, гипертермия, аспирационная пневмония.
Игловая трансторакальная биопсия показана при необходимости морфологического уточнения процессов в плащевой зоне, если эндоброн-хиальная бронхофиброскопическая биопсия проведена неудачно. По принципу забора тканей делится на аспирационную (обычные инъекционные иглы диаметром 0,6—0,9 мм, длиной 140— 150 мм) и трепанаци-онную (игла Виннера и модификации).
Проводят премедикацию. Место вкола иглы определяют при многоосевой рентгеноскопии. Больному в положении лежа с несколько приподнятым ножным концом (профилактика воздушной эмболии) под местной анестезией и контролем рентгеноскопии к патологическому очагу подводят иглу, с помощью которой аспирируют или срезают ткань. Осложнения — небольшой травматический пневмоторакс, кровохарканье.
Огерьпую биопсию легкого применяют при необходимости морфологического уточнения рентгенологически обнаруженного очагово- дис-семинированного процесса. Метод создает возможность большего обзора легочной поверхности, а следовательно и выбора удаляемого участка. Делают разрез размером 6—8 см. Повышая давление в наркозном аппарате, раздувают легкое, которое выпячивается в рану. Накладывают на основание скобочный шов и отсекают легочную ткань. Таким образом, сразу удается герметизировать плевральную полость и избежать пневмоторакса.
Торакоскопию применяют и как диагностический метод определения происхождения и характера диффузных и локальных плевральных процессов, и как лечебный (прижигание бронхоплевральных свищей, пережигание внутри плевральных соединительнотканных тяжей, препятствующих наложению и эффективности искусственного пневмоторакса).
Для торакоскопии используют После премеди-
кации и анестезии мягких тканей больного укладывают на бок. В пятом межреберье по средней подмышечной линии разрезают кожу и мягкие ткани до париетальной плевры, накладывают кисетный шов, прокалывают скальпелем париетальную плевру и проводят фиброскоп внутрь. Затем кисетный шов затягивают вокруг фиброскопа. Аспирируют экссудат и накладывают пневмоторакс. Осматривают париетальную и висцеральную плевру, при необходимости выполняют биопсию. Бронхо-фиброскопом не всегда просто манипулировать в большой свободной полости; в силу тяжести и гибкости он «провисает» в пустоте, поскольку управляем только его дистальный конец. Чтобы избежать этого, можно заранее ввести в биопсийный канал кусачки. Служа в качестве мандре-на, они облегчают манипуляции фиброскопом и в нужный момент готовы для биопсии. В узких щелевидных полостях фиброскопом можно управлять и без мандрена. При этом открываются широкие возможности для осмотра лакун и карманов в полости плевры, свищевых ходов.
При туберкулезном плеврите париетальная плевра мутная, покрыта фибрином; висцеральная — мелкими бугорками. Характерно развитие плотных Рубцовых струнообразных или мощных плоскостных сращений, образующих замкнутые полости. Экссудат серозный, серозно-геморра-гический, реже гнойный с хлопьями фибрина.
Медиастиноскопия позволяет уточнить характер поражения лимфатических узлов средостения, степень распространенности процесса, а также методику лечения.
Медианоскопию выполняют на операционном столе в положении больного лежа на спине, подложив ему под плечи клеенчатую подушку, чтобы создать условия, при которых увеличивается расстояние между грудиной и трахеей. Проводят манипуляцию медианоскопом Карленса или жестким бронхоскопом Фриделя со световолооконной оптикой в условиях эндотрахеального наркоза с полной мышечной релаксацией и управляемым дыханием.
Над яремной вырезкой делают поперечный разрез кожи и подкожной мышцы шеи. Далее тупым путем вслепую раздвигают мышцы, фасции и клетчатку вдоль передней поверхности трахее, формируя канал для введения медиастиноскопа. Через сделанный канал сверлящими движениями вводят медиастиноскоп до бифуркации трахеи и далее вдоль главных бронхов.
Во время медиастиноскопии производят осмотр и инструментальную пальпацию, а завершают ее биопсией — основным и заключительным этапом исследования. Лимфатические узлы следует удалять полностью. Частичная резекция кусачками нежелательна во избежание диссеминации туберкулезного процесса или кровотечения. Каждое сомнительное образование необходимо предварительно пунктировать, чтобы убедиться в том, что это не сосуд.
При туберкулезном поражении можно видеть единичные казеозно-измененные лимфатические узлы бело-серого цвета или их группы. Нередки обызвествленные узлы с перигландулярным склерозом, спаянные с сосудистой стенкой, блуждающим нервом и возвратной ветвью его.
Осложнения медиастиноскопии: подкожная эмфизема, пневмоторакс, повреждение перикарда, нервов, сосудов; возможны кровотечение, нагноение.
ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
Для диагностики и дифференциальной диагностики туберкулеза и других заболеваний легких в клинической практике широко используют цитологические методы исследования, которые состоят из двух этапов: клинического и микроскопического.
Клиническое исследование дает представление о том, каким методом и как правильно собрать материал, чтобы получить оптимальный результат в самые короткие сроки.
Существует два основных вида материала из легких, подлежащих цитологическому исследованию:
• эксфолиативный материал — мокрота, которая бывает спонтанной и редуцированной, полученной с помощью различных раздражителей (отхаркивающих средств, раздражающих ингаляций и др.);
• биопсийный материал, полученный при трансторакальной игло-вой биопсии и с помощью бронхологических методов исследования (чрезбронхиальная щипцовая биопсия легких, игловая биопсия легких и внутригрудных лимфатических узлов, браш-биопсия и соскоб слизистой бронха, эндокавитарная биопсия, аспираты, бронхоальвеолярный лаваж — БАЛ).
Цитологическое исследование проводят на основе изучения макро-, микроскопического и цитологического анализа мокроты.
При исследовании мазков, окрашенных по гематологической методике, ряд признаков, свойственных той или другой ткани, выявляется значительно ярче, чем при исследовании нативных препаратов. Это имеет существенное значение для цитологического заключения. Наиболее информативной для цитологического исследования считают мокроту, собранную утром, натощак, и которая хранится не более 2— 4 ч до начала исследования. Количество проб, необходимых для исследования при туберкулезе, — две-три, при подозрении на опухоль — пять-шесть.
У больных активным туберкулезом легких мокрота чаще всего гнойная или слизисто-гнойная. При микроскопическом исследовании препаратов слизисто-гнойной мокроты, окрашенных по гематологической методике, выявляются скопления мононуклеарных клеток, в основном альвеолярных макрофагов, лимфоцитов и эпителиоидных клеток с примесью небольшого количества нейтрофилов в стадии деструкции. При микроскопическом исследовании гнойной мокроты число нейтрофилов возрастает и становится преобладающим; иногда они располагаются на фоне казеозного некроза. У 14—32% больных активным туберкулезом легких можно обнаружить элементы эпителиоидно-клеточной гранулемы: эпителиоидные клетки и гигантские клетки Пирогова-Лангханса. Кроме этого, в мокроте часто встречаются скопления эозинофилов, появление которых чаще связано с приемом химиопрепаратов, но может быть также проявлением местных аллергических реакций на туберкулезную инфекцию.
Цитологическая картина мокроты больных туберкулезом имеет некоторые особенности. Она отличается своеобразным розовато-фиолетовым фоном, обусловленным наличием казеозного детрита, распола
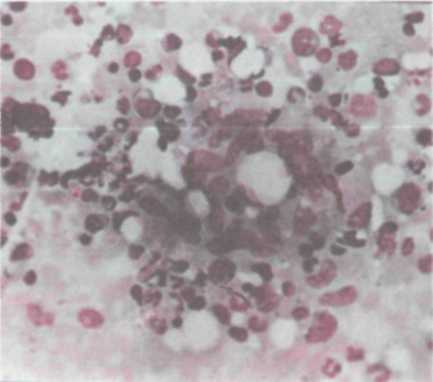
гающегося в виде аморфных масс, и нейтрофилами преимущественно в стадии полного расплавления (рис. 5.13).
Определенное диагностическое значение имеет обнаружение так называемой тетрады Эрлиха, составными элементами которой являются обызвествленные эластические волокна, кристаллы холестерина, соли аморфных фосфатов, МБТ, чаще в виде мелких осколков; иногда находят непол- Рис 5 13 Мокрота больного туберку. ную тетраду. Ее наличие указыва- лезом легких. Эпителиоидные клетки ет на обострение старых, обычно на фоне нейтрофилов обызвествленных, очагов в легких.
Указанная выше цитологическая картина мокроты характерна преимущественно для выраженных активных форм туберкулеза. При неактивном и менее выраженном туберкулезном процессе мокрота не имеет специфических цитологических черт. В этих случаях обнаруживаются только клетки плоского эпителия, альвеолярные макрофаги и нейтро-филы, что не является специфичным для туберкулеза. Подобная картина наблюдается при различных процессах в легких и верхних дыхательных путях нетуберкулезного происхождения.
Цитологическое исследование мокроты наиболее показано при дифференциальной диагностике туберкулеза и опухолей легких, грибковых поражениях, гемосидерозе, аденоматозе, средостенно-легочной формы лимфогранулематоза.
Цитологическое исследованиематериала биопсии. Наибольшеераспро-
странение в последние десятилетия получили бронхологические мето-
ды взятия биопсийного материала для цитологического исследования.
Это связано с их малой травматичностью по сравнению с другими мето-
дами (трансторакальной и открытой биопсией легких) и воз-
можностью проведения комплекса биопсий у одного больного, что по-
зволяет повысить результативность исследования.
Метод трансторакальной игловой биопсии легкого показан при отрицательных результатах цитологического исследования мокроты и материала, полученного при бронхоскопии. Наилучшие результаты цитологического исследования при использовании вышеуказанного ме
тода получают при наличии тубер-
кулем и крупноочаговых измене-
ний в легких, суб-
плеврально (рис. 5.14).
Эффективность этих методов различна при разных заболеваниях, а также зависит от квалификации бронхолога, хирурга и цитолога, правильного выбора вида биопсии.
При взятии материала с помощью трансторакальной игло-вой биопсии легкого и комплекса биопсий при бронхоскопии препараты готовит врач, выполняющий исследование, или специально обученная медицинская сестра. После высушивания их на воздухе препараты доставляют в лабораторию, где окрашивают гематологическими красителями.
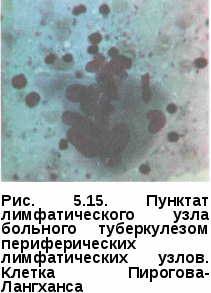 При микроскопическом исследовании туберкулезное воспаление проявляется в основном двумя морфологическими критериями: формированием эпителиоидно-клеточных гранулем и образованием, чаще в их центре, казеозного некроза, представляющего собой аморфные бесструктурные массы фиолетового цвета, которые часто содержат вкрапления солей извести.
При микроскопическом исследовании туберкулезное воспаление проявляется в основном двумя морфологическими критериями: формированием эпителиоидно-клеточных гранулем и образованием, чаще в их центре, казеозного некроза, представляющего собой аморфные бесструктурные массы фиолетового цвета, которые часто содержат вкрапления солей извести.
При туберкулезе чаще встречаются гигантские клетки Пирогова-Лангханса (рис. 5.15).
При длительно текущем туберкулезном воспалении наблюдаются наличие фиброзных изменений, кальцинация участков казеозного некроза. При разжижении казеоз-ных масс отмечается выраженная нейтрофильная инфильтрация, дистрофические изменения эпителиальных клеток (рис. 5.16).
Сложность дифференциальной диагностики туберкулеза и других гранулематозных заболеваний легких с морфологической точки
ния заключается в том, что легкое на любое длительно протекающее воспаление как специфической, так и неспецифической природы, на любой персистирующий в тканях агент органической и неорганической природы реагирует относительно мономорфной картиной, сопровождающейся в большинстве случаев образованием гранулем, которые при разных заболеваниях имеют свои морфологические особенности, не всегда, к сожалению, позволяющие дифференцировать эти заболевания.
Поэтому при проведении дифференциальной диагностики туберкулеза с другими гранулематозными и диссеминированными процессами в легких наиболее эффективным является параллельное применение чрезбронхиальной щипцовой биопсии легкого, дополненное БАЛ с использованием для их изучения комплекса цитологических методов исследования.
Цитологическое исследование жидкости бронхоальвеолярного лаважа (БАЛ-жидкость). БАЛ считается одним из наиболее безопасных методов получения диагностического материала, а возможность его многократной повторяемости является важным условием для инструментального контроля течения патологического процесса в легком.
Для цитологического исследования БАЛ-жидкости достаточно 10 мл смыва, который сразу же после получения его от больного фильтруют через четыре слоя марли или мелкую металлическую сетку в центрифужную силиконизированную пробирку. После этого определяют цитоз (количество клеток в 1 мл смыва) и процент жизнеспособности альвеолярных макрофагов в камере
Оставшуюся профильтрованную БАЛ-жидкость центрифугируют при комнатной температуре в течение не менее 10 мин со скоростью 1500 об/мин на обычной центрифуге или цитоцентрифуге. Из осадка готовят мазки, которые высушивают, фиксируют и окрашивают краской Романовского в течение 4 мин.
Эндопульмональная цитограмма определяется на основании подсчета 500 клеток; при этом учитывают альвеолярные макрофаги, лимфоциты, нейтрофилы, эозинофилы, базофилы и др. Клетки бронхиального эпи-
телия при подсчете цитограммы не учитывают.
Клеточный состав у здоровых некурящих лиц содер-
жит 93ұ5% альвеолярных макрофагов, 7ұ1% лимфоцитов и менее 1% нейтрофилов, эозинофилов, базофилов. Общее количество клеток в 1 мл смыва варьирует в среднем от 0,002 до 0,15 жизнеспособность альвеолярных макрофагов 90% и более.
При различных патологических процессах происходят изменения в соотношении клеточных элементов БАЛ-жидкости, причем эти изменения имеют определенную направленность в зависимости от этиологии и активности заболевания.
При туберкулезе наряду с лимфоцитозом (25—60%) отмечается увеличение количества нейтрофилов, в основном при вторичных формах активного специфического процесса (фиброзно-кавернозный и цирро-тический туберкулез). При первичном туберкулезе с поражением внут-ригрудных лимфатических узлов отмечается лимфоцитоз. Соотношение лимфоцитов и нейтрофилов в эндопульмональной цитограмме при туберкулезе зависит от формы, распространенности и активности специфического процесса, а также наличия сопутствующих неспецифических воспалительных заболеваний бронхов и легких. Возможно выявление типичных или их зернистых шаров
При различных формах туберкулеза в фазе стабилизации и обратного развития процесса эндопульмональная цитограмма близка к норме.
Для саркоидоза и экзогенно-аллергического альвеолита характерен
лимфоцитоз в активной фазе процесса наряду с увеличением содержания
общего количества клеток. Впрочем, при лимфоцитоз отра-
жает степень активности процесса и не зависит от формы заболевания.
При ряде заболеваний (злокачественные новообразования, гемоси-дероз, гистиоцитоз, альвеолярный протеиноз, микозы, эхинококкоз и др.) в БАЛ-жидкости обнаруживают клетки и специфические признаки, характерные для этих заболеваний, позволяющие установить диагноз, что особенно важно при наличии противопоказаний к биопсий-ным методам.
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЫХАНИЯ
Одной из основных задач клинического обследования больного является определение функционального состояния его дыхательной системы, имеющего большое значение при решении вопросов лечения, прогноза, а также оценки трудоспособности. Современные функ1циональные методы абсолютно необходимы для оценки отдельных синдромов нарушения функции внешнего дыхания (ФВД). Они позволяют определять такие характеристики респираторной функции, как бронхиальная проводимость, воз-духонаполненность, эластические свойства, диффузионная способность и респираторная мышечная функция. Функциональные пробы дают возможность выявлять ранние формы дыхательной недостаточности, многие из которых являются обратимыми. Определение характера ранних функциональных нарушений позволяет подобрать наиболее рациональные терапевтические мероприятия для их устранения. Основные методы исследования ФВД:
спирометрия;
пневмотахометрия;
исследование легочной диффузии;
измерение растяжимости легких;
непрямая калориметрия.
Первые два метода считаются скрининговыми и обязательны для использования во всех лечебных учреждениях, осуществляющих наблюдение, лечение и реабилитацию легочных больных. Такие методы, как исследование диффузионной способности и растяжимости легких являются более углубленными и дорогостоящими методами. Что же касается эргоспирометрии и непрямой калориметрии, то это также довольно сложные методы, которые применяют по индивидуальным показаниям.
Уменьшение просвета бронхиального дерева, проявляющееся ограничением воздушного потока — наиболее важное функциональное проявление легочных заболеваний. Общепринятые методы регистрации бронхиальной обструкции — спирометрия и пневмотахометрия с выполнением экспираторного маневра. Они позволяют выявить рестрик-тивные и обструктивные расстройства вентиляции, определить диффузионную способность легких, характеризовать переход газов из альвеолярного воздуха в кровь легочных капилляров. В настоящее время исследование выполняют на приборах с программным обеспечением, проводящим автоматизированные расчеты с учетом должных величин.
Жизненная емкость легких (ЖЕЛ) слагается из дыхательного, дополнительного и резервного объемов. Дышательный объем — воздух, вдыхаемый и выдыхаемый за один обычный (спокойный) дыхательный цикл. Резервный объем вдоха — дополнительный объем воздуха, который можно с усилием вдохнуть после обычного (спокойного) вдоха. Резервный объем выдоха — объем воздуха, который можно вывести из легких после обычного (спокойного) выдоха.
Определение ЖЕЛ имеет существенное значение в исследовании дыхательной функции. Общепринятой границей снижения ЖЕЛ является показатель ниже 80% от должной величины. Уменьшение ЖЕЛ может быть вызвано различными причинами — уменьшением объема функционирующей ткани вследствие воспаления, фиброзной трансформации, ателектаза, застоя, резекции ткани, деформации или травмы грудной клетки, спаечных процессов. Причиной снижения ЖЕЛ могут быть и обструктив-ные изменения при бронхиальной астме, эмфиземе, однако более выраженное снижение ЖЕЛ характерно для ограничительн^1х (рестриктивных) процессов. У здорового человека при исследовании ЖЕЛ грудная клетка после максимального вдоха, а затем выдоха возвращается к уровню функциональной остаточной емкости. У больных с обструктивными нарушениями функции легких при исследовании ЖЕЛ следует медленное ступенчатое возвращение после нескольких дыхательных циклов к уровню спокойного выдоха (симптом «воздушной ловушки»). Возникающая задержка воздуха связана со снижение эластичности легочной ткани и ухудшением бронхиальной проходимости.
Форсированная жизненная емкость (ФЖЕЛ), или объем форсированного выдоха (ОФВ), представляет собой объем воздуха, выдыхаемый как можно резче после максимального вдоха. Величина ФЖЕЛ соответствует в норме значениям ЖЕЛ при обычном дыхании. Основным критерием, позволяющим говорить о том, что у больного имеется хроническое ограничение воздушного потока (бронхиальная обструкция), является снижение ОФВ за первую секунду (ОФВ,) до уровня, составляющего менее 70% от должных величин. Обладая высокой воспроизводимостью при правильном выполнении маневра, этот показатель позволяет документально зарегистрировать у пациента наличие обструкции. По степени тяжести обструктивные нарушения функции в зависимости от ОФВ, подразделяют на легкие (при показателе 70% и более от должной), средней тяжести (при 50—60% от должной) и тяжелые (менее 50% от должной). Установлено ежегодное уменьшение ОФВ, в пределах 30 мл у здоровых лиц и более 50 мл у больных хроническими обструктивными заболеваниями легких.
Проба Тиффно — рассчитывают по отношению ОФВуФЖЕЛ и отражающих состояние проходимости дыхательных путей в целом без указания на уровень обструкции. Наиболее чувствительным и ранним признаком оценки ограничения воздушного потока служит показатель ОФВ,/ФЖЕЛ. Он является определяющим признаком хронической обструктивной болезни на всех ее стадиях. Снижение ОФВуФЖЕЛ ниже 70% свидетельствует об обструктивных нарушениях в бронхах.
Оценивают также среднюю объемную скорость воздушного потока на отрезке 25—75% кривой ФЖЕЛ и по степени ее наклона анализируют состояние проходимости преимущественно мелких бронхов.
Все шире в клинической практике используют тесты, выявляющие функциональные нарушения до появления клинических симптомов. Это кривая «поток — объем», альвеолоартериальный градиент по кислороду и закрытый объем. Очень сложна ранняя диагностика преимущественного поражения мелких бронхов диаметром менее 2—3 мм, характерного для дебюта хронической обструктивной болезни легких. Оно очень долго не выявляется при спирометрии и бодиплетизмографическом измерении сопротивления дыхательных путей.
Кривая «поток—объем» форсированного выдоха позволяет выявить уровень обструкции. Диагностика уровня нарушения бронхиальной проходимости основывается на сжатии дыхательных путей при проведении форсированного выдоха. Спадению бронхов препятствует эластичность легочной ткани. При выдохе одновременно с уменьшением объема снижается эластичность ткани, что способствует коллапсу бронхов. При уменьшении эластичности спадение бронхов происходит раньше.
При анализе кривой форсированного выдоха фиксируют мгновенную скорость на уровне пика — пиковую скорость выдоха (ПСВ), а также при выдохе 75%, 50%, 25% от выдыхаемой ЖЕЛ — максимальную скорость выдоха (МСВ 75, МСВ 50, МСВ 25). Показатели ПСВ и МСВ 75 отражают
проходимость крупных, а МСВ 50 и МСВ 25 — мелких бронхов
Другой метод, который позволяет зарегистрировать поражение мелких бронхов, — определение внутригрудного компрессионного объема Последний является той частью внутрилегочного объема воздуха, которая вследствие нарушения проводимости мелких бронхов во время форсированного экспираторного маневра подвергается компрессии. Vcomp определяется как разница между изменением легочного объема и интегрированным ротовым потоком. Эти величины следует считать важным показателем проходимости дыхательных путей. Его следует использовать для ранней диагностики хронических бронхитов, в частности у курящих, не имеющих клинических признаков хронического бронхита. Изменение этих величин может указывать на поражение мелких дыхательных путей, оно также является фактором, свидетельствующим о необходимости терапевтических и профилактических мероприятий.
Снижение ЖЕЛ, ОФВ,, MB Л в пределах 79—60% от должных величин оценивают как умеренное; 59—30% — значительное; менее 30% — резкое.
Снижение ПСВ, МСВ 75, МСВ 50 и МСВ 25 в пределах 59-40% от должных величин оценивают как умеренное; 39—20% — значительное; менее 20 — резкое.
Возникающее у больных хроническим бронхитом ограничение экспираторного воздушного потока приводит к замедлению выведения воздуха из легких во время выдоха, что сопровождается увеличением В итоге возникает динамическая гиперинфляция легких и изменение диафрагмы в виде укорочения ее длины, уплощения формы, снижения силы сокращения. В связи с гиперинфляцией легких изменяется и эластическая отдача, возникает положительное давление в конце выдоха и повышается работа дыхательных мышц.
Изучение бронхиальной проходимости с помощью фармакологических проб значительно расширяет возможности спирографии. Определение данных легочной вентиляции до и после ингаляции бронхо-литического препарата позволяет выявить скрытый бронхоспазм, дифференцировать функциональные и органические нарушения. С другой стороны, применение бронхоконстрикторов (ацетилхолин) позволяет изучить реактивность бронхиального дерева.
Для решения вопроса об обратимости обструкции применяется проба
сбронхолитическими препаратами, вводимымиингаляционно. При этом срав-
нивают преимущественно Другие показатели кривой
менее воспроизводимы, что отражается на точности результатов. Бронхо-
дилатационный ответ на препарат зависит от его фармакологической груп-
пы , пути введения и техники ингаляции. Факторами, влияющими на брон-
ходилатационный ответ, также являются назначаемая доза; время,
прошедшее после ингаляции; бронхиальная лабильность во время иссле-
дования: состояние легочной функции; воспроизводимость сравниваемых
показателей; погрешности исследования. В качестве бронходилатацион-
ных агентов при проведении тестов у взрослых рекомендуются:
32
аг°нисты короткого действия (сальбутамол — до 800 мкг, тер-буталин — до 1000 мкг) с измерением бронходилатационного ответа через 15 мин;
антихолинерггические препараты (ипратропиума бромид до 80 мкг) с измерением бронходилатационного ответа через 30—45 мин.
Возможно проведение бронходилатационных тестов с использованием
небулайзеров. При их осуществлении назначают более высокие дозы
препаратов: повторные исследования следует проводить через 15 мин
после ингаляции 2,5—5 мг сальбутамола или 5—10 мг тербуталина, или
же через 30 мин после ингаляции 500 мкг ипратропиума бромида. Во
избежание искажения результатов и для правильного выполнения брон-
ходилатационного теста необходимо отменить проводимую терапию в
соответствии с фармакокинетическими свойствами принимаемого пре-
парата (|3
2-агонисты короткого действия — за 6 ч до начала теста, дли-
тельно действующие 12 ч, теофил-
лины — за 24 ч). Результат пробы оценивают по степени прироста
показателя в процентах к исходной величине. При увеличении
на 15% и более проба считается положительной и оценивается
как обратимая. Бронхиальная обструкция считается хронической, если
она регистрируется не менее трех раз в течение 1 года, несмотря на про-
водимую терапию.
Исследованиелегочной вентиляции. Вентиляция представляет собой циклический процесс вдоха и выдоха, обеспечивающий поступление воздуха из атмосферы, содержащего около 21% и выведение из легких. Характер дыхания при заболеваниях легких может различаться. При обструктивных болезнях возникает более глубокое дыхание, при рестриктивном поражении — чаще поверхностное и учащенное. В первом случае из-за нарушения проходимости бронхов эффективна медленная скорость прохождения воздуха по воздухоносным путям, чтобы избежать турбулентности потока и спадения стенки мелких бронхов. Углубленное дыхание усиливает также эластическую отдачу. При преобладании фиброзно-воспалительных изменений, сопровождающихся снижением растяжимости легочной ткани, мышечные затраты на дыхание меньше при частом и неглубоком дыхании.
Общая вентиляция, или
минутный объем дыхания (МОД), определяет-
ся спирографически при умножении дыхательного объема (ДО) на час-
тоту дыхания. Может быть определена также и
максимальная вентиляция
легких (МВЛ), когда больной дышит часто и глубоко. Эта величина, так-
же как и отражает вентиляционную способность легких. При па-
тологии и физической нагрузке величина МОД увеличивается, что свя-
зано с необходимостью увеличения потребления При поражении
легких снижается величина МВЛ. Разница между МВД и МОД характе-
ризует резерв дыхания. По спирограмме можно рассчитать и количество
потребляемого кислорода (в норме 250 мл/мин).
Исследование альвеолярной вентиляции. Эффективность вентиляции можно оценить по величине альвеолярной вентиляции. Альвеолярная вентиляция — объем воздуха, поступающий при дыхании в альвеолы в единицу времени, обычно рассчитывают за мин. Объем альвеолярной вентиляции равен дыхательному объему с вычетом физиологически мертвого пространства. Физиологически мертвое пространство включает анатомически мертвое пространство и объем некровоснабжаемых альвеол и объем альвеол, в которых процесс вентиляции превышает объем кровотока. Величина альвеолярной вентиляции 4—4,45 л/мин, или 60— 70% от общей вентиляции. Развивающаяся при патологическом состоянии гиповентиляция приводит к гипоксемии, гиперкапнии и дыхательному ацидозу.
Гиповентиляция — альвеолярная вентиляция, недостаточная по от-
ношению к уровню метаболизма. Гиповентиляция ведет к повышению
в альвеолярном воздухе и увеличению в артериальной крови
(гиперкапния). Гиповентиляция может возникнуть при снижении ЧД и
ДО, а также при увеличении мертвого пространства. Компенсаторно
развиваются сдвиги, характерные для дыхательного ацидоза, — повы-
шаются стандартный бикарбонат (SB), буферные основания (ВВ), сни-
жается дефицит буферных оснований (BE), который становится отри-
цательным. в альвеолярной крови при гиповентиляции падает.
Наиболее частые причины гиповентиляции — нарушение проходимос-
ти и увеличение мертвого пространства дыхательных путей, нарушение
функции диафрагмы и межреберных мышц, нарушение центральной ре-
гуляции дыхания и периферической иннервации дыхательных мышц.
При неконтролируемой оксигенотерапии повышается в крови.
В результате происходит торможение рефлекторного влияния гипоксе-мии на центральную регуляцию дыхания и устранение защитного действия гипервентиляции. Возникающее состояние относительной гипо-вентиляции способствует задержке и развитию дыхательного ацидоза. Увеличение секреции в воздухоносных путях может способствовать вентиляционной недостаточности, особенно при затруднении откашливания мокроты.
Исследованиедиффузии газоввлегких. Измерениедиффузионной спо-
собности у больных легочными заболеваниями обычно выполняется
на втором этапе оценки ФВД после выполнения форсированных спи-
рометрии или пневмотахометрии и определения структуры статичес-
ких объемов. Диффузионной способностью обозначают количество
газа,
проходящее в одну минуту через мембрануиз расчета на мм разности парциального давления этого газа на обе стороны мембраны. Исследование диффузии применяется у больных для диагностики эмфиземы или фиброза легочной паренхимы. По способности обнаружения начальных патологических изменений легочной паренхимы данный метод сопоставим по чувствительности с Нарушением диффузии чаше сопровождаются легочные заболевания, однако может быть и изолированное нарушение, обозначаемое как «альвеолокапиллярный блок».
При эмфиземе показатели диффузионной способности легких (DLCO) и ее отношения к альвеолярному объему (Va) снижены, главным образом, вследствие деструкции альвеолярно-капиллярной мембраны, уменьшающей эффективную площадь газообмена. При рест-риктивных легочных заболеваниях характерно значительное снижение DLCO. Отношение DLCO/Va может быть снижено в меньшей степени из-за одновременного значительного уменьшения объема легких. Снижение диффузии обычно сочетается с нарушением вентиляции и кровотока. Диффузия может снижаться при уменьшении числа капилляров, участвующих в газообмене. С возрастом отмечается уменьшение количества легочных капилляров у больных саркоидозом, силикозом, эмфиземой, митральным стенозом, после пневмонэктомии. Характерным для больных со сниженной диффузионной способностью является снижение при нагрузке и увеличение при вдыхании На пути к гемоглобину молекулы кислорода диффундируют через альвеолы, межклеточную жидкость, эндотелий капилляров, плазму, мембрану эритроцитов, внутриэритроцитарную жидкость. При утолщении и уплотнении этих тканей, накоплении внутри и внеклеточной жидкости процесс диффузии ухудшается. обладает значительно лучшей раствори мостью, чем 0
2, а его диффузионная способность в 20 раз выше по сравнению с последним.
Исследование диффузии проводят с помощью газов, хорошо растворяющихся в крови (С0
2 и 0
2). Величина диффузионной способности для прямо пропорциональна количеству перешедшему из альвеолярного газа в кровь (мл/мин) и обратно пропорциональна разнице между средним давлением в альвеолах и капиллярах. В норме диффузионная способность колеблется от 10 до 30 мл/мин С0
2 на 1 мм рт.ст. При проведении исследования больной вдыхает смесь с низким содержанием С0
2, задерживает дыхание на 10 с, в течение которых С0
2диффундирует в кровь. При этом измеряется в альвеолярном газе до и в конце задержки дыхания. Для расчетов определяется ФОЕ.
Исследование газов крови и кислотноосновного состояния (КОС). Исследование газов крови и КОС артериальной крови является одним из основных методов определения состояния функции легких. Из показателей газового состава крови исследуют Ра0
2 и РаС0
2, из показателей КОС — рН и избыток оснований (BE). Для исследования газов крови и КОС применяют микроанализаторы крови с измерением платино-серебряным электродом Кларка и РС0
2 — стеклянно-серебряным электродом. Исследуют артериальную и артериализованную капиллярную кровь; последняя берется из пальца или мочки уха. Кровь должна свободно изливаться и не содержать пузырьков воздуха.
За норму взята величина Р0
2 от 80 мм рт.ст. и выше. Уменьшение Р0
2 до 60 мм рт.ст. расценивают как
небольшую гипоксемию; до 50—60 мм рт.ст. — умеренную, ниже 50 мм рт.ст .
—резкую.Причиной ггипоксемии могут быть следующие состояния: альвеоляр-
ная гиповентиляция, нарушение альвеолокапиллярной диффузии, ана-
томическое или паренхиматозное шунтирование, ускорение скорости
кровотока в легочных капиллярах. При снижаются ДО
или ЧД, увеличивается физиологически мертвое пространство. Возни-
кающее снижение Р0
2, как правило, сочетается с задержкой С0
2. Ги-
поксемия, имеющая место при нарушении диффузии газов, усиливает-
ся при физической нагрузке, так как увеличивается скорость кровотока
в капиллярах легких и соответственно уменьшается время контакта кро-
ви с альвеолярным газом. Гипоксемия, вызванная нарушением диффу-
зии, не сопровождается задержкой так как скорость ее диффузии
намного выше диффузии 0
2. Нередко низкое содержание С0
2 связано с
сопутствующей гипервентиляцией. Гипоксемия, веноартери-
альными шунтами, не устраняется вдыханием высоких концентраций
0
2. Альвеолоартериальная разница при этом исчезает или уменьшается
при вдыхании 14% Содержание снижается нагрузке. При нару-
шении соотношений гипоксемия исчезает
при применении оксигенотерапии. При этом может возникать задерж-
ка в связи с устранением гипервентиляции, которая имеет рефлек-
торное происхождение при наличии гипоксемии. Вдыхание в высо-
ких концентрациях приводит к исчезновению
разницы. Гипоксемия, вызванная ускоренным прохождением крови в
легочных капиллярах, имеет место при общем уменьшении кровотока в
малом круге кровообращения. Показатели при этом существенно
снижаются при физической нагрузке. ткани к недо-
статку определяется не только его показателями содержания в крови, но и состоянием кровотока. Возникновение повреждающего эффекта
ткани, как правило, связано с сочетанием гипоксемии и одновремен-
ным изменением кровотока. При хорошем кровоснабжении ткани про-
явления гипоксемии менее выражены. У больных с хронической легоч-
ной недостаточностью кровоток чаще повышен, что позволяет им
сравнительно хорошо переносить гипоксемию. При остро возникающей
дыхательной недостаточности и отсутствии усиления кровотока даже
умеренная гипоксемия может представлять угрозу жизни больного. Раз-
витие гипоксемии на фоне анемии и повышенного обмена также пред-
ставляет определенную опасность. Гипоксемия ухудшает кровоснабже-
ние жизненно важных органов, течение стенокардии, инфаркта
миокарда. Ткани имеют различную чувствительность к недостатку О
г
Так, скелетные мышцы способны извлекать его из артериальной крови
при
Р02 ниже
15—20 мм рт.ст.; клетки головного мозга и миокарда могут
повреждаться, если
Р02 снижается ниже 30 мм рт.ст. Неповрежденный
миокард
устойчив к гипоксемии, однако в ряде случаев возникают арит-
мии и явления снижения сократительной способности. Определенное
значение в развитии дыхательной недостаточности имеет состояние ве-
нозной крови: венозная гипоксемия и увеличение артериовенозной раз-
ницы по У здоровых лиц величина в венозной крови составляет
40 мм рт.ст., артериовенозная разница — 40—55 мм рт.ст. Повышение
утилизации тканями является признаком, указывающим на ухудше-
ние условий обмена и кислородного снабжения. Важным признаком
дыхательной недостаточности является также Она разви-
вается при тяжелых легочных заболеваниях: эмфиземе, бронхиальной астме, хроническом бронхите, отеке легких, обструкции дыхательных путей, заболеваниях дыхательных мышц. Гиперкапния может также возникнуть при поражениях действии на дыхательный центр наркотиков, поверхностном дыхании, когда снижается альвеолярная вентиляция нередко на фоне большой общей. Увеличению в крови способствуют неравномерная вентиляция и перфузия, увеличение физиологически мертвого пространства, интенсивная мышечная работа. Гиперкапния возникает, когда
РС02 превышает 45 мм рт.ст.; состояние гиперкапнии диагностируется при ниже 35 мм рт.ст.
Клинические признаки гиперкапнии проявляются головной болью ночью и утром, слабостью, сонливостью. При прогрессирующем увеличении появляются спутанное сознание, изменение психики, тремор. При нарастании до 70 и более мм рт.ст. возникают коматозное состояние, галлюцинации и судороги. Могут проявиться изменения
 Скачать 3.97 Mb.
Скачать 3.97 Mb.



