ФОС 8. ФОС 8 класс. Учебник Химия. 8 класс учеб. Для общеобразоват. Учреждений О. С. Габриелян. 17е изд., стереотип. М. Дрофа, 2011. 270, 2 с ил
 Скачать 366.94 Kb. Скачать 366.94 Kb.
|
|
Практическая работа № 5. Приготовление раствора сахара и расчет его массовой доли в растворе Цель: рассчитать массовую долю сахара в приготовленном растворе. Оборудование: мерный цилиндр, вода, коническая колба объемом 100 мл, сахар кусочками, весы, стеклянная палочка. Ход работы: Отмерьте мерным цилиндром 50 мл дистиллированной воды и влейте ее в коническую колбочку емкостью 100 мл. Чайную ложку сахарного песка (или два кусочка) взвесьте на лабораторных весах, затем поместите его в колбочку с водой и перемешивайте стеклянной палочкой до полного растворения. Теперь приступайте к расчетной части. Вначале рассчитайте массовую долю сахара в растворе. Необходимые данные у вас есть: масса сахара, объем воды, плотность воды примите равной 1 г/мл. 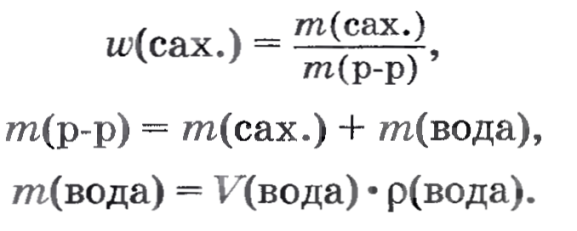 Вы также сможете рассчитать, сколько молекул сахара содержится в полученном растворе, используя известные вам соотношения: 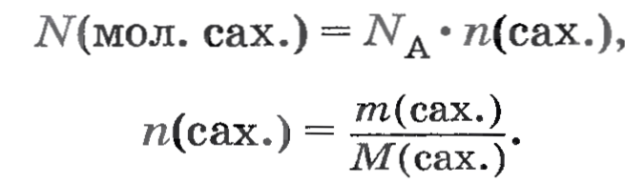  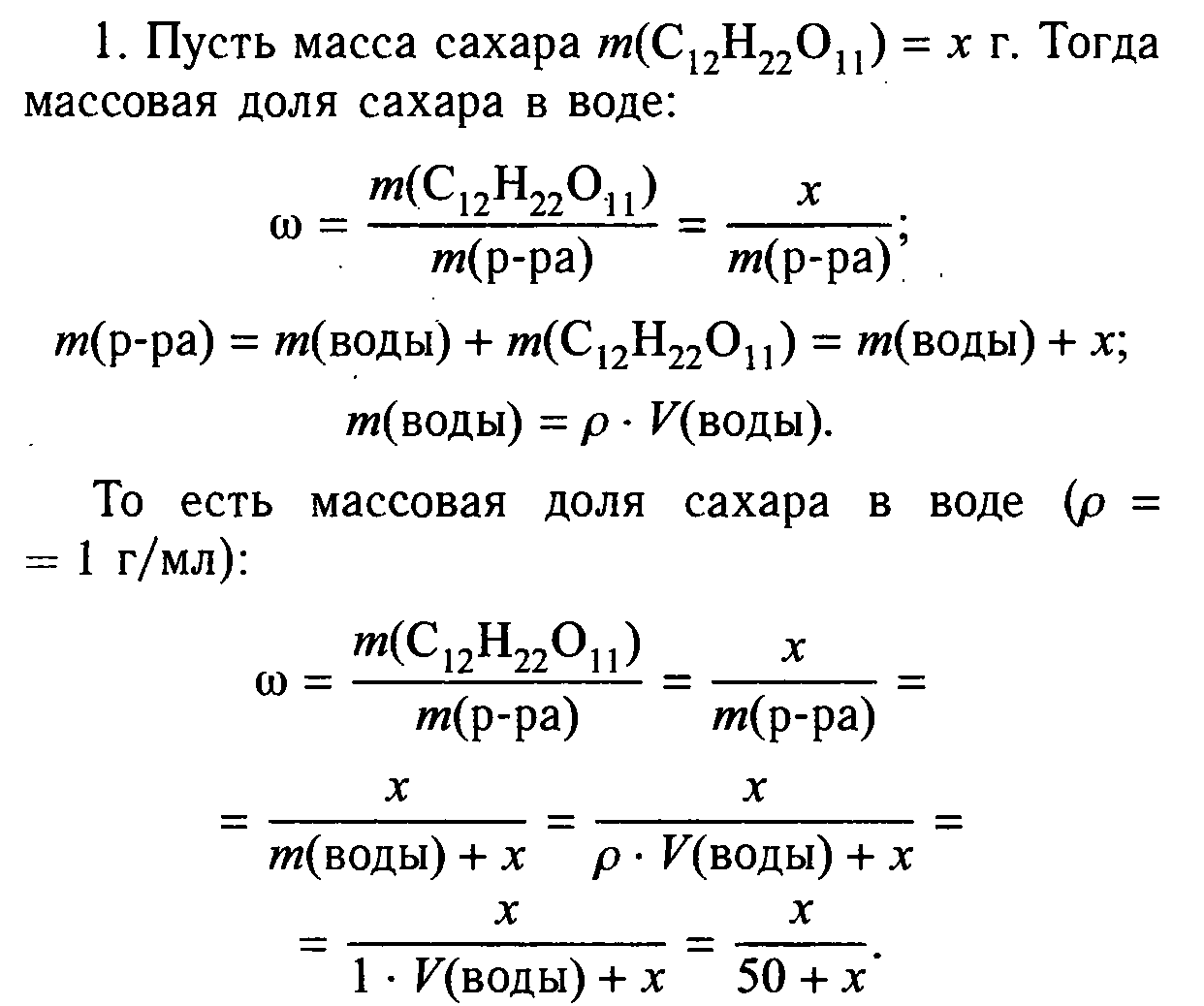 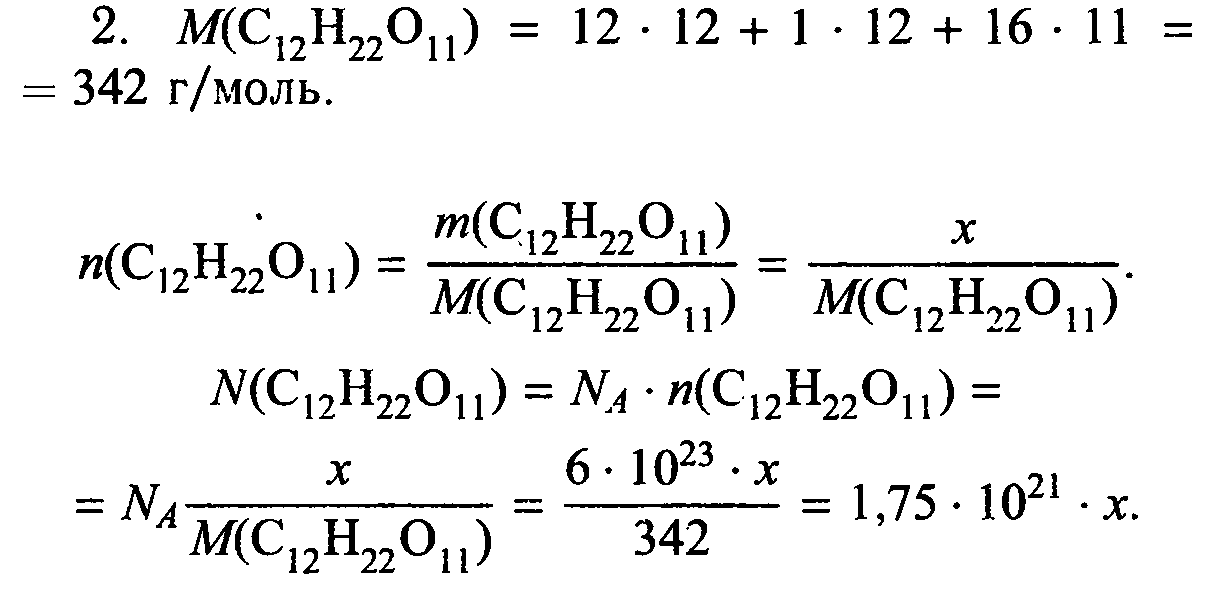 Практическая работа № 6. Ионные реакции Цель: закрепить на практике знания по решению ионных реакций. Оборудование: пробирки, таблица растворимости, реактивы. Ход работы: Опыт 1 Обнаружение сулъфат-ионов SO42- В одну пробирку налейте 1—2 мл раствора сульфата натрия, а в другую — 1—2 мл раствора сульфата калия. В обе пробирки по каплям добавьте раствор хлорида бария. Объясните наблюдаемое. Составьте уравнения электролитической диссоциации взятых солей и уравнение реакции обмена. Запишите полное и сокращенное ионные уравнения реакции. Какие соединения могут служить реактивом на ионы бария Ва2+ ? В чем сущность обнаружения ионов с помощью реактива? P.S.: Сущность обнаружения ионов с помощью реактива заключается в том, что реакции с ними обнаруживаемого иона, избирательна для данного иона. Такая реакция называется аналитической. Аналитическая реакция сопровождается выделением газа, выпадением осадка или изменением цвета раствора. Опыт 2 Обнаружение хлорид-ионов Cl По таблице растворимости выясните, какие соли, содержащие хлорид-ион Cl-, нерастворимы (малорастворимы). При помощи имеющихся у вас реактивов докажите, что в растворе хлорида натрия присутствуют хлорид-ионы. Составьте уравнения диссоциации солей, реакции обмена и полные и сокращенные ионные уравнения проведенных реакций. Опыт 3 Обнаружение сульфат-ионов SO42-и хлорид-ионов Cl- В двух пробирках содержатся растворы хлорида калия и сульфата магния. С помощью каких реакций можно доказать, что в одной пробирке находится раствор хлорида калия, а в другой — раствор сульфата магния? Раствор из первой пробирки разделите пополам и перелейте в две пробирки. Прилейте в одну пробирку раствор нитрата свинца (II), в другую — раствор хлорида бария. В какой из пробирок выпал осадок? Какая из солей — KCl или MgSO4 — содержится в первой пробирке? Раствор из второй пробирки испытайте на присутствие аниона, не обнаруженного в первой пробирке. Для этого к испытуемому раствору прилейте раствор нитрата свинца (II). Объясните наблюдаемое. Составьте уравнения реакций обмена проведенных вами реакций и полные и сокращенные ионные уравнения реакций обнаружения ионов. Опыт 4 Проделайте реакции, подтверждающие качественный состав следующих веществ: а) хлорида бария; б) сульфата магния; в) карбоната аммония. Для выполнения этого опыта используйте таблицу 12. Вывод. Практическая работа № 7. Условия протекания химических реакций между растворами электролитов до конца Цель: рассмотреть условия протекания химических реакций между растворами электролитов до конца. Оборудование: пробирки, реактивы, держатель для пробирок, пипетка. Ход работы: Опыт 1 Возьмите три пробирки и налейте в каждую по 2—3 мл раствора: в 1-ю — сульфата меди (II), во 2-ю — хлорида калия, в 3-ю — сульфата алюминия. Затем в каждую пробирку добавьте: в 1-ю немного раствора гидроксида натрия, во 2-ю — раствора фосфата натрия, а в 3-ю — раствора хлорида бария. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций. Сделайте вывод. Вывод: если выпадает осадок, то реакции идут до конца. Опыт 2 В две пробирки налейте по 2—3 мл растворов сульфита натрия и карбоната натрия соответственно. Затем прилейте в каждую из них раствор азотной кислоты. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций. Сделайте вывод. Вывод 1: если выделяется газ, то реакции идут до конца. Вывод 2: угольная и сернистая кислоты неустойчивы. Опыт 3 В одну пробирку налейте 3—4 мл раствора гидроксида натрия и добавьте две-три капли фенолфталеина. Раствор приобретает малиновый цвет. Затем прилейте соляную кислоту или раствор серной кислоты до обесцвечивания. В другую пробирку налейте примерно 2—3 мл сульфата меди (II) и добавьте немного раствора гидроксида натрия. Образуется голубой осадок гидроксида меди (II). Прилейте в пробирку серную кислоту до растворения осадка Составьте уравнения происходящих реакций в молекулярном и ионном виде. Поясните, почему в первой пробирке произошло обесцвечивание, а во второй — растворение осадка. Каким общим свойством обладают растворимые и нерастворимые основания? Осадок гидроксида меди растворился так как сульфат меди растворимое соединение. Растворимые и нерастворимые в воде основания можно растворить в растворах кислот, Происходит реакция нейтрализации. Общий вывод по лабораторной работе. Практическая работа №8 Свойства кислот, оснований, оксидов, солей Вариант 1 Цель: осуществить реакции, характеризующие свойства предложенных растворов веществ, повторить написание ионных уравнений реакций. Оборудование и реактивы: штатив с пробирками, реактивы по вариантам. Задание № 1. Осуществите реакции, характеризующие свойства раствора соляной кислоты: взаимодействие с металлом (Zn), основным оксидом (CaO), основанием (NaOH), солью (AgNO3). Составьте молекулярные и ионные уравнения реакций. Опишите признаки реакций. Задание №2 Проделайте реакции, характеризующие свойства раствора гидроксида натрия: взаимодействие с кислотой (HCl), кислотным оксидом (CO2), солью (CuSO4). Составьте молекулярные и ионные уравнения реакций. Опишите признаки реакций. Практическая работа №8 Свойства кислот, оснований, оксидов, солей Вариант 2 Цель: осуществить реакции, характеризующие свойства предложенных растворов веществ, повторить написание ионных уравнений реакций. Оборудование и реактивы: штатив с пробирками, реактивы по вариантам. Задание № 1. Осуществите реакции, характеризующие свойства раствора серной кислоты: взаимодействие с металлом (Zn) , основным оксидом (CaO), основанием (NaOH), солью (BaCl2). Составьте молекулярные и ионные уравнения реакций. Опишите признаки реакций. Задание №2 Проделайте реакции, характеризующие свойства оксида кальция: взаимодействие с кислотой (HCl), кислотным оксидом (CO2), водой. Составьте молекулярные и ионные уравнения реакций. Опишите признаки реакций. Практическая работа №8 Свойства кислот, оснований, оксидов, солей Вариант 3 Цель: осуществить реакции, характеризующие свойства предложенных растворов веществ, повторить написание ионных уравнений реакций. Оборудование и реактивы: штатив с пробирками, реактивы по вариантам. Задание № 1. Осуществите реакции, характеризующие свойства раствора соляной кислоты: взаимодействие с металлом (Zn), основным оксидом (CaO), основанием (NaOH), солью (AgNO3). Составьте молекулярные и ионные уравнения реакций. Опишите признаки реакций. Задание №2 Проделайте реакции, характеризующие свойства хлорида меди (II): взаимодействие с гидроксидом натрия (NaOH), нитратом серебра (AgNO3), железом (Fe). Составьте молекулярные и ионные уравнения реакций. Опишите признаки реакций. Практическая работа № 9 Решение экспериментальных задач Примечание. Проводится при обобщении и контроле знаний и умений обучающихся и требует от них максимальной самостоятельности. Цели: учиться экспериментальным путем различать вещества, определять их свойства, проводить химические эксперименты по плану, анализировать результаты и оформлять отчет. План работы: 1. Определить реактивы для опыта 1 и составить уравнения реакций. 2. Вспомнить химические свойства веществ и определить необходимый реактив для опыта 2. 3. Определить реактивы для опыта 3 и составить схему описанных превращений. 4. Определить правила ТБ. Оборудование и реактивы:
ТБ:аккуратно работать с химическими реактивами и лабораторным оборудованием, не пробовать и не нюхать вещества, применять правила работы со спиртовкой и правила нагревания и выпаривания веществ. Ход работы Отчет о результатах опытов заносится в таблицу, где представлены алгоритмы их проведения.
Примечание: вывод может быть и иным, например таким: «Между классами неорганических веществ существует генетическая связь, которая возможна благодаря химическим превращениям». Итоговая контрольная работа по химии 8 класс 1 вариант 1. Пользуясь периодической таблицей, дайте характеристику химическому элементу №6 по плану: а) название химического элемента, его символ; б) относительная атомная масса (округлённо до целого числа); в) заряд ядра атома; г) число протонов и нейтронов в ядре атома; д) общее число электронов; е) номер периода, группы, в котором расположен химический элемент. ж) запишите электронную формулу и электронную конфигурацию элемента. 2. Расставьте коэффициенты в окислительно – восстановительной реакции методом электронного баланса. Укажите окислитель и восстановитель. P  + Cl2 PCl5 + Cl2 PCl53.Запишите уравнения следующих реакций в молекулярном и ионном виде: а) KNO3 + HCl → б) NaOH + ZnCl2 → в) CuI2 + AgNO3 → г) Al2(SO4)3 + KBr → д) Mg(OH)2 + H2SO4 → е) MnCl2 + Ba(OH)2 → 4. Сколько молекул озона О3 содержится в 72 г его? Итоговая контрольная работа по химии 8 класс 2 вариант 1. Пользуясь периодической таблицей, дайте характеристику химическому элементу №10 по плану: а) название химического элемента, его символ; б) относительная атомная масса (округлённо до целого числа); в) заряд ядра атома; г) число протонов и нейтронов в ядре атома; д) общее число электронов; е) номер периода, группы, в котором расположен химический элемент. ж) запишите электронную формулу и электронную конфигурацию элемента. 2. Расставьте коэффициенты в окислительно – восстановительной реакции методом электронного баланса. Укажите окислитель и восстановитель. FeCl2+ Cl2 FeCl3 3. Запишите уравнения следующих реакций в молекулярном и ионном виде: а) Cu(NO3)2 + Na3PO4 → б) Li2CO3 + CaCl2 → в) FeSO4 + Mg(OH)2 → д) MnCl2 + Na2SO4 → г) Al(OH)3 + H2SO4 → е) Pb(NO3)2 + NaOH → 4. Рассчитайте массу кислорода в 12 г оксида кремния (IV). Итоговая контрольная работа по химии 8 класс 3 вариант 1. Пользуясь периодической таблицей, дайте характеристику химическому элементу №15 по плану: а) название химического элемента, его символ; б) относительная атомная масса (округлённо до целого числа); в) заряд ядра атома; г) число протонов и нейтронов в ядре атома; д) общее число электронов; е) номер периода, группы, в котором расположен химический элемент. ж) запишите электронную формулу и электронную конфигурацию элемента. |
