Учебнометодический комплекс Аналитическая, физическая и коллоидная химия
 Скачать 1.36 Mb. Скачать 1.36 Mb.
|
|
2) Реакции катиона Fe 3+ Реакция с сульфидом аммония Fe Cl3 +3(NН4)2S+ 6Н2О = Fe2S 3↓+ 6NН4Cl Осадок растворяется в кислотах и щелочах. Реакция со щелочами FeCl3 + 3NаОН = Fe(ОН) 3↓+ 3NаCl Осадок растворяется в кислотах и щелочах. FeCl3 + 3NН4ОН = Fe(ОН) 3↓+ 3NН4Cl Реакция с роданистыми солями FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl Реакция с ферроцианидом калия: FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6] Реакция с гидрофосфатом натрия. FeCl3+ Na2НРО4 = FeНРО4↓+ 2NaCl Осадок растворяется в сильных минеральных кислотах. 3) Реакции катиона Fe 2+ Реакция с сульфидом аммония FeSО4+3(NН4)2S= FeS↓+ (NН4)2SО4 Осадок растворяется в соляной кислоте. Реакция со щелочами Fe SО4+ 3NаОН = Fe(ОН) 2↓+ 3Nа2SО4 Fe(ОН) 2↓+ О2 +Н2О = 4Fe(ОН) 3↓ Осадок растворяется в кислотах и щелочах. Реакция с ферроцианидом калия: 3FeSО4+ 2K3[Fe(CN)6] = Fe3[Fe(CN)6] NаОН+ Fe3[Fe(CN)6] Реакция с карбонатами FeSО4+Nа2CО3= FeCО3+Nа2SО4 карбонаты железа на воздухе окисляется 3FeCО3+ О2 +6Н2О = 4Fe(ОН) 3↓+ 4CО2 4) Реакции катиона Мn2+ Реакция с сульфидом аммония Мn SО4+3(NН4)2S= МnS↓+ (NН4)2SО4 Осадок растворяется в соляной кислоте. Реакция со щелочами МnSО4+ 3NаОН = Мn(ОН) 2↓+ 3Nа2SО4 Осадок на воздухе окисляется Мn(ОН) 2↓+ О2 = Н2МnО3↓ Реакция с едким натром и перекисью водорода МnCl2+ NаОН +Н2О2 = Н2МnО3↓+Н2О + 2NaCl 5) Реакции катиона Zn2+ Реакция с сульфидом аммония ZnSО4+3(NН4)2S= ZnS↓+ (NН4)2SО4 Осадок разделить на две части к одной прилить соляную кислоту, к другой уксусную, написать реакции. Реакция со щелочами ZnSО4+ 3NаОН = Zn(ОН) 2↓+ 3Nа2SО4 Осадок проверить на растворимость в избытке реактива и соляной кислоте. Реакция с ферроцианидом калия: 2ZnCl2 + 2K4[Fe(CN)6] = Zn3K2[Fe(CN)6] Другие реакции ZnSО4+ 2NН4ОН = Zn (ОН) 2↓+ (NН4)2SО4 Осадок проверить на растворимость в избытке реактива и солях аммония. Zn(ОН) 2↓+ 4NН4ОН = [Zn(NН3)4 ] (ОН) 2↓+4Н2О 6) Реакции катиона Со2+ Реакция со щелочами и аммиаком СоSО4+ 3NаОН = Со(ОН) 2↓+ 3Nа2SО4 Осадок проверить на растворимость в избытке реактива. СоSО4+ 3 NН4ОН = Со(ОН) 2↓+ (NН4)2SО4 Осадок проверить на растворимость в избытке реактива. Реакция с роданидом калия СоSО4 + 2КCNS = Со(CNS)3 + 2К2SО4 Со(CNS)3 + 2КCNS = K2[Со(CNS)3 ] 7) Реакции катиона Ni2+ Реакция со щелочами и аммиаком Ni SО4+ 3NаОН = Ni (ОН) 2↓+ 3Nа2SО4 Осадок проверить на растворимость в кислотах. При избытке реактива NН4ОН образуется комплекс Ni SО4+ 3 NН4ОН = [Ni(NН3)6 ]SО4↓ +6Н2О Реакция с реактивом Чугаева ( раствор диметилглиоксима) Ni SО4+ 3 NН4ОН +2С4Н8N2О2 = Ni(С4 Н7 N2О2 ) 2 +(NН4)2SО4 +2Н2О Контрольные вопросы. 1.Какие катионы относятся к 3 группе аналитической, в чем состоит их отличие от катионов 1 и 2 групп? 2.Гидроксиды каких катионов 3 группы обладают амфотерными свойствами? 3.Подвергаются ли соли катионов 3 группы гидролизу? Что такое степень гидролиза? 4.Для каких катионов 3 аналитической группы характерны реакции окисление- восстановления? 5. При каких условиях ионы Mn2+ окисляются в ионы MnO4-? Напишите уравнения реакции. Лабораторная работа. Качественные реакции анионов 1-3 группы Выполнение работы. Проделать реакции, приведенные ниже, взяв по 1 мл каждого из компонентов реакции, отметить цвет осадка и проверить его на растворимость в указанных веществах. Реакции 1 группы анионов 1). Реакции сульфат иона. Реакция с хлоридом бария Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl осадок не растворим в минеральных кислотах даже при нагревании. Реакция с ацетатом свинца Pb(CH3COO) 2 + H2SO4 = 2CH3COOH + PbSO4↓ осадок не растворим в разбавленных минеральных кислотах, но растворяется в щелочах. PbSO4↓+4NаОН =Nа2PbO2+ Na2SO4+2Н2О 2). Реакции сульфит иона Реакция с хлоридом бария Na2SO3 + BaCl2 = BaSO3↓ + 2NaCl осадок растворяется в сильных кислотах. BaSO3↓ + 2НCl= BaCl2+ Н2О+ SO3↑ Реакция с кислотами Na2SO3 +2НCl= 2NaCl+ Н2О+ SO2↑ Реакция с иодом Na2SO3 +I2+ Н2О = Na2SO4+ 2НI прилить к полученному раствору соль бария. Реакция с перманганатом калия. 5Na2SO3 + 2КМnО4+ 3H2SO4 = 5Na2SO4+ 2МnSO4+ К2SO4+ 3Н2О 3). Реакции тиосульфат иона. Реакция с нитратом серебра Na2S2O3 +2AgNO3 =Ag2S2O3↓+2 NaNO3 осадок растворяется в избытке реактива Ag2S2O3↓+ 2Na2S2O3= Na4[Ag2S2O3] Реакция с хлоридом бария Na2S2O3 + BaCl2 = BaS2O3↓ + 2NaCl осадок нагреть до кипения. Реакция с кислотами Na2S2O3 +2НCl= 2NaCl+ Н2S2O3 Реакция с иодом. Na2S2O3 +I2+ Н2О = Na2S4O6+ 2 NaI 4). Реакции карбонат иона. Реакция с хлоридом бария Na2СO3 + BaCl2 = BaСO3↓ + 2NaCl осадок растворяется в уксусной кислоте. Реакция с кислотами Na2СO3 + 2НCl = BaСO3↓ + Н2О + СO2↑ выделяющийся СO2 можно определить по помутнению известковой воды. Са(ОН) 2 + СO2= СaСO3↓+ Н2О 5). Реакции фосфат иона Реакция с хлоридом бария Na2НРO4 + BaCl2 = BaНРO4↓ + 2NaCl осадок растворяется в соляной и азотной кислотах. Реакция с магнезиальной смесью Na2НРO4 + МgCl2 +NН4ОН = NН4МgРO4↓ + 2NaCl+ Н2О Реакция с молибденовой жидкостью Na2НРO4+12(NН4)2МоO4+23НNO3=(NН4)3РМо12O40↓+2NaNO3↓+21NН4NO3+12Н2О осадок растворяется в едких щелочах. Реакция с нитратом серебра Na2НРO4 +3AgNO3 =Ag3 РO4 ↓+2NaNO3+НNO3 осадок растворяется в НNO3 и NН4ОН. Ag3РO4 ↓+ 6NН4ОН = [Ag(NН3)2]3РO4+ 6Н2О 6). Реакции оксалат иона Реакция с хлоридом бария или кальция Na2С2O4 + BaCl2 = BaС2O4 ↓ + 2NaCl осадок растворяется в соляной и азотной кислотах. Реакция с перманганатом калия (при нагревании). 5Na2С2O4 + 2КМnО4+ 8H2SO4 = 5Na2SO4+ 2МnSO4+ К2SO4 + 8Н2О+ 10СO2↑ 7). Реакции борат иона Реакция с хлоридом бария Na2В4O7 + BaCl2 + 3Н2О = Ba(ВO2)2↓ + Н3ВO3+ 2NaCl осадок растворяется в разбавленных кислотах. Реакции 2 группы анионов 1).Реакции хлорид иона Реакция с нитратом серебра НCl + AgNO3 = AgCl AgCl [Ag(NН3)2]Cl + НNO3= AgCl 2). Реакции бромид иона Реакция с нитратом серебра NaВr + AgNO3 = AgВr Реакция с фуксинсерной кислотой. 10NaВr + 2КМnО4 + 8H2SO4 =5Вr2↑+ 2МnSO4+ 6К2SO4 + 8Н2О 3).Реакции иодид иона Реакция с нитратом серебра KI + AgNO3 = AgI Реакция с ацетатом свинца Pb(CH3COO) 2 + KI = 2CH3COOК + PbI2↓ растворяется в горячей воде. Реакция с нитритом калия 2KI + 2H2SO4+ 2КNO2= I2↓+2К2SO4+ 2Н2О+ 2NO↑ 4). Реакции роданид иона Реакция с нитратом серебра КСNS + AgNO3 = AgСNS AgСNS Реакция с хлорным железом 3КСNS + FeCl3 = FeСNS Реакция с солями кобальта СоCl2 + 4NН4СNS= (NН4) 2[Со(СNS) 4] + 2NН4Cl Реакция с солями меди 2КСNS +CuSO4= Cu(СNS) 2 5). Реакции сульфид иона (выполнять под тягой) Реакция с нитратом серебра (NН4) 2S + 2AgNO3 = Ag2S Реакция с кислотами FeS +H2SO4 = H2S↑ +Fe SO4 Pb(CH3COO) 2 + H2S= PbS Реакция с солями цинка и кадмия. (NН4) 2S +СdSO4=(NН4) 2SO4+СdS Реакции 3 группы анионов 1). Реакции нитрат иона (выполнять под тягой) Реакция с медью и серной кислотой Cu+ 4H2SO4+ 6NаNO3= Cu (NO3) 2+ 4Nа2SO4+ 4Н2О+ 2NO↑ Реакция с сульфатом железа 2NаNO3 + 6FeSO4 +4H2SO4 = Fe2(SO4) 3+ 4Nа2SO4+ 4Н2О+ 2NO↑ Реакция с алюминием или цинком. 3NаNO3 + 5NаОН +8Аl+2Н2О=8NаАlО2 +3NН3↑ 2). Реакции нитрит иона Реакция с кислотами 2NаNO2 +H2SO4 = Nа2SO4+ Н2О+ 2NO↑+ 2NO2↑ Реакция с иодидом калия 2КNO2 +2H2SO4 + 2KI = I2+2К2SO4+ 2Н2О+ 2NO↑ Реакция с перманганатом калия (при нагревании). 5 КNO2 + 2КМnО4+ 3H2SO4 = 5 КNO3 + 2МnSO4+ К2SO4 + 3Н2О 3). Реакции ацетат иона Реакция с серной кислотой CH3COONа+2H2SO4= Nа2SO4+CH3COOН слегка нагреть. Реакция с этиловым спиртом CH3COONа+ C2H5OН=CH3COO C2H5+ 3Н2О Реакция с хлорным железом 3CH3COONа + FeCl3 = Fe(CH3COONа) 3 + 3NаCl Лекции 2-3. Количественный анализ Гравиметрический метод анализа Задача количественного анализа – установить количественные соотношения составных частей данного соединения и смеси веществ. Методы количественного анализа делят на химические и физико-химические. Из химических методов количественного анализа в основном используют гравиметрический (весовой) и титриметрический (объемный) анализы. Гравиметрический анализ основан на точном измерении массы определяемого вещества в виде соединения или простого вещества определенного состава. Основным инструментом являются весы. Например, серебро осаждают в виде хлорида серебра, который высушивают и взвешивают. Расчет массовой доли вещества выполняют с помощью так называемого аналитического фактора или множителя F - отношения эквивалентов определяемого вещества ЭА и его гравиметрической формы ЭG: F =ЭА /ЭG. Например: для серебра, определяемого в виде хлорида серебра, F Ag|AgCl = 107,87/143,32=0,7526. Используя аналитический фактор можно вычислить: 1.массу вещества в анализируемой навеске, зная, что из одного эквивалента вещества в реакции осаждения образуется один эквивалент гравиметрической формы: ЭА - Э G qА - mА q= mА ЭА/ЭG = mА ∙FА|G m- масса гравиметрической формы. 2. по массе вещества затем вычисляют его массовую долю % а - 100% qА - С С= qА100/а = mА ∙FА|G /а 100% q- масса вещества или объем пробы, взятые для анализа. Гравиметрические методы подразделяются на две подгруппы: I. методы осаждения II. методы отгонки. В методах осаждения навеску анализируемого вещества переводят в раствор, после этого определяемый элемент осаждают в виде малорастворимого соединения. Выпавший осадок отделяют фильтрованием, тщательно промывают или высушивают, и точно взвешивают. По массе осадка и его формуле рассчитывают содержание определенного элемента в % по массе. В методах отгонки определяемый компонент удаляют в виде летучих продуктов, и по убыли в весе судят о содержании элемента. Требования к осадкам: Осаждаемой формой - называют то соединение, которое образуется при взаимодействии с реагентом - осадителем, а весовой формой - соединение, которое взвешивают для получения окончательного результата анализа. Например, при определении кремния в чугунах формой осаждения является кремниевая кислота H2SiO3·nH2O, а весовой формой является безводная двуокись кремния, получающаяся в результате прокаливания при температуре около 1000оС. иногда осаждаемая и весовая форма могут представлять собой одно и тоже соединение. Например, при определении серы весовым методом ее осаждают из раствора, и взвешивают в виде сульфата бария, который при прокаливании химически не изменяется. Требования к осаждаемой форме: 1)Малая растворимость осаждаемой формы соединения, содержащего определенное вещество и как более низкое содержание в ней определяющего вещества. Al → Al3+ → Al(OH)3 ∙ xH2O → Al2O3 осаждаемая форма весовая форма Требование к осаждению - малая растворимость. Произведение растворимости 2) Структура осадка должна отвечать условиям фильтрования и позволять отмывку осадков с достаточной скоростью. Мелкокристаллические осадки, могут пройти через поры фильтра. Наиболее удобны крупнокристаллические осадки, т.к. они не забивают поры фильтра, имеют слабо развитую поверхность, мало адсорбируют посторонние ионы и легко отмываются от них. Фильтруются через фильтр средней плотности, маркируемый белой лентой. Аморфные осадки, например, многие гидроксиды имеют сильно развитую поверхность, адсорбируют посторонние вещества из раствора и трудно от них отмываются. Фильтрование таких осадков проводят через неплотный фильтр, маркируемый красной лентой. Самые мелкокристаллические осадки (например, BaSO4), фильтруются через фильтр с синей лентой. Окклюзия - внедрение посторонних ионов в структуру кристаллической решетки. 3) Важно, чтобы осаждаемая форма легко переходила в весовую. Осаждаемая и весовая формы должны быть химически инертными, чтобы не приводить к количественным ошибкам. Требования к весовой форме: 1.Точное соответствие ее состава химической формуле. Если такого соответствия нет, вычисление результатов невозможно. 2.Химическая устойчивость весовой формы. 3.Содержание определяемого в весовой форме должно быть как можно меньшим, тогда погрешности определения меньше скажутся на окончательном результате анализа. Искомое процентное содержание ( Р ) рассчитывают по формуле: где b - количество весовой формы (количество полученного осадка), a – навеска исследуемого вещества, F – фактор пересчета. Фактор пересчета показывает, скольким граммам определяемого элемента соответствует 1 г весовой формы. 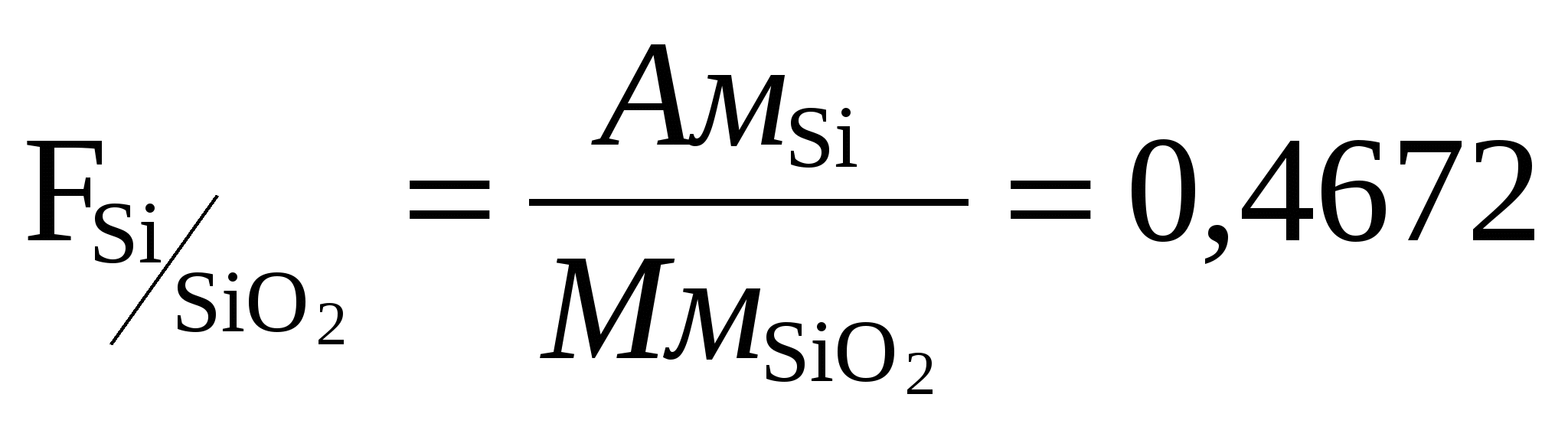 Из двух возможных гравиметрических методов определения элемента при прочих равных условиях будет более точным тот, для которого фактор пересчета будет меньше. 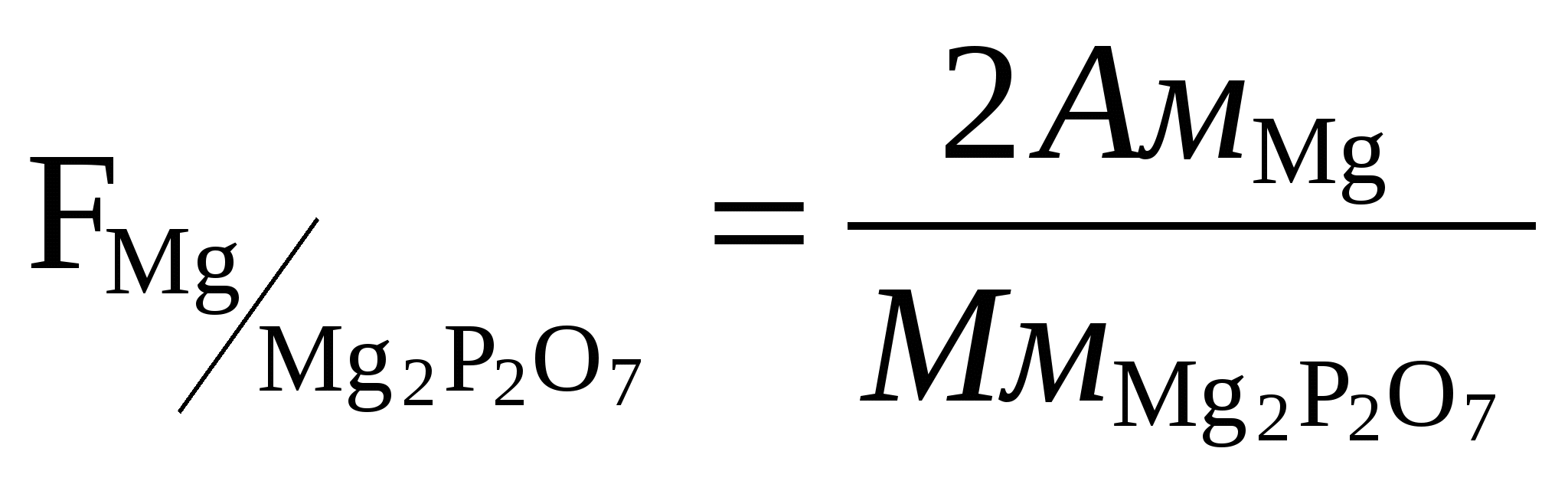 Анализ может быть: а) частным – определяется один или несколько веществ, а другие не интересуют  б) полным – на содержание всех входящих составных частей (Σ = 100%). Полный анализ проводится для того, чтобы узнать все составные части данного вещества. Титриметрические методы анализа Титриметрический анализ - метод определения количества вещества путем точного измерения объема растворов веществ, вступающих между собой в реакцию. Титр- количество г. вещества содержащегося в 1 мл. раствора или эквивалентное определяемому веществу. Например, если титр H2SO4 равен 0,0049 г/мл, это значит, что каждый мл раствора содержит 0,0049 г. серной кислоты. Раствор, титр которого известен, называется титрованным. Титрование - процесс добавления к исследуемому раствору или его аликвотной части эквивалентного количества титрованного раствора. При этом используются стандартные растворы -фиксаналы - растворы с точной концентрацией вещества (Na2CO3, HCl). Реакция титрования должна отвечать следующим требованиям:
HCl + NaOH → NaCl + H2O Главная задача титриметрического анализа - не только использовать раствор точно известной концентрации (фиксанал), но и правильно определить точку эквивалентности. Существует несколько способов зафиксировать точку эквивалентности:
Пример: Ag+ + Cl- " AgCl $ Ag+ + CrO4" Ag2CrO4$ (ярко оранжевая окраска) В колбу, где требуется определить ион хлора, добавляют небольшое количество соли K2CrO4 (свидетель). Затем из бюретки постепенно добавляют исследуемое вещество, при этом первыми в реакцию вступают ионы хлора и образуется белый осадок (AgCl), т. е. ПР AgCl << ПР Ag2Cr O4. Таким образом, лишняя капля нитрата серебра даст ярко оранжевую окраску, т. к. весь хлор уже прореагировал. III. С помощью индикаторов: например, при реакции нейтрализации используют кислотно-щелочные индикаторы: лакмус, фенолфталеин, метил оранж – органические соединения изменяющие окраску при переходе от кислой к щелочной среде. Индикаторы - органические красители, которые меняют свою окраску при изменении кислотности среды. Схематически (опуская промежуточные формы) равновесие индикатора можно представить как кислотно-основную реакцию HIn +H2O "In- + H3O+ H2O " H+ + OH- H+ + H2O " H3O+ На область перехода окраски индикатора (положение и интервал) влияют все факторы, от которых зависит константа равновесия (ионная сила, температура, посторонние вещества, растворитель), а также индикатора. Классификация методов титриметрического анализа.
AgNO3 + HCl Ag+ + Cl- " AgCl $
а) перманганатометрия (KMnO4); б) йодометрия (I2); в) броматометрия (KBrO3); г) дихроматометрия (K2Cr2O7); д) цериметрия (Ce(SO4)2); е) ванадометрия (NH4VO3); ж) титанометрия (TiCl3) и т.д. |
